Autor : Rey, DarĂo R1
1 MĂ©dico Consultor, NeumonologĂa Hospital Gral. de Agudos Dr. E. TornĂş
https://doi.org/10.56538/ramr.CVPR8593
Correspondencia : DarĂo R. Rey E-mail: darioraul.rey@gmail.com
EPID OCUP SĂŤMIL
NEUMONĂŤA CRĂ“NICA ORGANIZADA
Se
define la neumonĂa crĂłnica organizada (COP) por un patrĂłn histolĂłgico, y el
diagnĂłstico clĂnico-radiolĂłgico-patolĂłgico correspondiente, cuando no se
encuentra una causa definida, es la neumonĂa organizada criptogĂ©nica.
En
razĂłn de que se pueden hallar brotes en los bronquiolos distales, la afecciĂłn
se denominaba anteriormente «bronquiolitis obliterante con neuÂmonĂa
organizada» (BOOP) debido a que el patrĂłn patolĂłgico caracterĂstico y
preponderante era esto Ăşltimo. Actualmente, es reconocida internacionalÂmente
como COP.1
Después
de valorar las caracterĂsticas clĂnicas, tomográficas
e histopatolĂłÂgicas que llevan al diagnĂłstico de COP, se deben considerar otros
trastornos, como tumores, procesos infecciosos o padecimientos inflamatorios
del pulÂmĂłn. Si bien el patrĂłn histolĂłgico de la COP es inespecĂfico, puede
relacioÂnarse con otras afecciones, de modo que posee un valor relativo cuando
se encuentra en una muestra de ese tamaño. El comienzo, para un diagnóstico
presuntivo, puede ser la tomografĂa computarizada (TC) de tĂłrax. Cuando la COP
presenta zonas Ăşnicas o mĂşltiples de consolidaciĂłn parenquimatosa, el
diagnĂłstico diferencial incluye el carcinoma lepĂdico,
las eosinofilias pulÂmonares, el sĂndrome de Churg-Strauss, la artritis reumatoidea,
la polimioÂsitis, radioterapia o como consecuencia
del uso farmacológico de fármacos o anticuerpos monoclonales.
En
relaciĂłn con la pandemia de COVID-19, existen publicaciones de COP como
resultado de la evoluciĂłn subaguda de esta nueva enfermedad viral.2-10
Zhang
y cols. revisaron 1346 casos de COP en el perĂodo
enero 2000 - diciembre 2013 pertenecientes al Hospital de NeumonologĂa
de Shanghai. En 1170 pacientes (86,9%), se
diagnosticĂł la causa, en oposiciĂłn a su origen ignoto en 176 (13,1%). Solo en
trece observaciones, estaban relacionados con la ocupaciĂłn del individuo, que
incluĂa dos soldadores, tres obreros de lĂnea de montaje, tres operarios
textiles, cuatro obreros de fundiciones y un caso con prolongada exposiciĂłn al
polvo de vidrio.11
NEUMONĂŤA INTERSTICIAL
DE CÉLULAS GIGANTES
La
neumonĂa intersticial de cĂ©lulas gigantes (GIP) es una enfermedad pulmonar
ocupacional grave y poco comĂşn, producto de la exposiciĂłn y aspiraÂciĂłn de
metales duros con propiedades abrasivas (carburo de tungsteno y cobalto). Las
mayores exposiciones ocurren en la industria del carburo de tungsteno
cementado, los procesos de minerĂa, la fabricaciĂłn de aleaciones y en el pulido
y afilado de herramientas, con esmeriles de metales duros. Las personas con
exposiciĂłn crĂłnica pueden desarroÂllar enfermedad pulmonar intersticial y
presentar empeoramiento de la disnea, tos improductiva y pertinaz e
intolerancia al ejercicio.
En
la clasificaciĂłn inicial de Liebow y CarringÂton
figuraba como una afecciĂłn del intersticio, pero, a posteriori, al
comprobarse su relaciĂłn con los metales duros, se reclasificĂł como una neumoÂconiosis;
además, es ampliamente reconocido que la GIP se caracteriza por un patrón
patognomónico histológico de células multinucleadas.12,13
El
cobalto tiene varios usos industriales, pero no todos causan EPID OCUP.
Vinculada con el cobalÂto, sobreviene cuando los operarios están expuestos a
travĂ©s de la fabricaciĂłn o uso de herramientas creadas por el proceso de pulvimetalurgia; esta conÂsiste en un procedimiento de
fabricación de objetos metálicos que, a partir de polvos finos, después de ser
compactados, se les da una determinada forma calentándolos a una atmósfera
reconocida para obtener una herramienta. El tungsteno y el cobalto se calientan
y se combinan para formar una matriz compacta de metal.
El
operario especializado en pulvimetalurgia es un
experto en dichas tĂ©cnicas. Las piezas fabricadas presentan caracterĂsticas
especiales como lubricaciĂłn o antifricciĂłn. En la industria de herramientas de
diamante, el polvo de cobalto se utiliza como matriz para diamantes.14 En ocaÂsiones,
el paciente revelĂł haber trabajado como plomero en la industria petrolera,
desde 1982 hasta 1991, tiempo durante el cual a menudo ensamblaba tubos usando
lijadoras y amoladoras con discos de metal duro, los que, al desafilarse,
esmerilaba nuevamente solo protegido con visera. Al inicio de su
sintomatologĂa, una radiografĂa revelĂł un infiltrado pulmonar.15
En
otras oportunidades, el cuadro, como en la descripciĂłn de Carmo-Moreira,
comienza con un neumotórax espontáneo padecido por un afilador de cuchillos y
sierras, oficio realizado durante 8 años sin protección.16
En
la bibliografĂa consultada, se publican obserÂvaciones aisladas, pero se
destacan algunas por la cuantĂa de casos. Entre 1985 y 2016 Chiarchiaro
y cols. identificaron 23 pacientes con patrĂłn paÂtolĂłgico,
de los cuales el 93% presentaban “vidrio esmerilado” y el 85% de ellos, GIP en
la biopsia realizada. El tratamiento con corticoides permitiĂł obtener mejor
evoluciĂłn de estos casos.17
Naqvi y su grupo de trabajo revisaron 100
casos de estas neumoconiosis estudiadas durante 50 años. La GIP se comprobó
histolĂłgicamente en 59 y en los 41 restantes, confirmada mediante microscoÂpia
electrĂłnica de barrido y espectroscopia de rayos X. Los casos de GIP en la
industria del carburo de tungsteno cementado revelaron concentraciones elevadas
de tungsteno, aunque el cobalto se detectĂł solamente en el 6% de las
observaciones.18
Para
finalizar, como etiologĂa no laboral, existen publicaciones que relacionan la
GIP con el uso prolongado de nitrofurantoĂna.19, 20
EPID OCUP NEUMONITIS
POR HIPERSENSIBILIDAD
La
neumonitis por hipersensibilidad (NHS) se produce inmunolĂłgicamente por la
reiterada inÂhalaciĂłn de gran variedad de sustancias quĂmicas o antĂgenos
orgánicos ambientales a las que un individuo genéticamente susceptible ha sido
senÂsibilizado previamente.
Se
han propuesto definiciones alternativas de NHS, pero los expertos disienten en
cĂłmo detaÂllar la enfermedad e implementar sus criterios y orientaciĂłn
diagnĂłstica.
Quizá
una de las más completa es la de Cormier, quien
define la NHS como “Una respuesta inmune inapropiada a los antĂgenos
inhalados que causa dificultad para respirar, un defecto pulmonar resÂtrictivo,
infiltrados intersticiales observados en las imágenes pulmonares (radiografĂa
de tĂłrax y tomografĂa de alta resoluciĂłn) causados por la acumulaciĂłn de un
gran nĂşmero de linfocitos T activados en los pulmones. En ocasiones, la enÂfermedad
se caracteriza además por episodios de fiebre pocas horas después de la
exposición”.21,
22
Siguiendo
a Hirscmann y cols. desde el
punto de vista tomográfico, las NHS se pueden
clasificar en agudas cuando presentan «vidrio esmerilado», patrón centrinodular y atrapamiento aéreo, y crónicas cuando se
observa reticulaciĂłn, “panaÂlizaciĂłn”,
engrosamiento peribroncovascular y dislocaciĂłn de la
arquitectura pulmonar 23
Por
lo tanto, las posibilidades de padecer una NHS, ya sea ocupacional o no, son
sempiternas y pueden existir tantas observaciones o publicaÂciones como
probables antĂgenos ofensores. Una prueba de ello se aprecia en el consenso
sobre el tema publicado en el 2020 por la American ThoÂracic
Society, Japanese Respiratory Society y la
AsociaciĂłn Latinoamericana del TĂłrax.
La
extensa Tabla 1 expuesta en el artĂculo comprende fuentes de antĂgenos
conocidos cauÂsantes de NHS, tales como partĂculas orgánicas, levaduras, hongos
ambientales, protozoarios, bacterias, enzimas, proteĂnas animales y vegetales,
sustancias inorgánicas, agentes farmacológicos y metales.24
Yoshida y cols. realizaron
una pesquisa nacional para investigar las caracterĂsticas epidemiolĂłÂgicas y
clĂnicas de NHS en JapĂłn. Completaron un cuestionario 185 mĂ©dicos y 835 casos fueron
clasificados como tal; se observĂł NHS laboral en 115 casos (13,8%), con
predominio del “pulmón de granjero” (59%), 19 obreros, que manipulaban isocianatos, y 10 oficinistas –por contaminación
microbiológica del aire acondicionado–. Concluyen recomendando una valoración
ambiental metĂłdica y un panel de antĂgenos adaptado a las variaciones en la
exposiciĂłn, como llave diagnĂłstica.25
Moon
Bang y su grupo, informaron que hay estudios escasos
en la poblaciĂłn de EE.UU., que investigan la NHS. Los datos a nivel nacional
del NIOSH (Instituto Nacional de Seguridad y Salud Ocupacional) pueden
contribuir a comprender su epidemiologĂa. Analizaron las identificaciones de
causas de muerte para el perĂodo 1980-2002. Las tasas de mortalidad
proporcionales por industria y ocupaciĂłn se ajustaron por edad, sexo y raza, en
26 estados que informaron industria y ocupaciĂłn entre 1985-1999. Esta tasa de
mortalidad para NHS fue significativamente alta para la producciĂłn agrĂcola y
ganadera y significativamente elevada para los agricultores. Finalizan su
estudio con la conclusiĂłn de que las industrias agrĂcolas están estrechamente
asociadas con la mortalidad por NHS, por lo que es imperativo evaluar
estrategias preventivas para proteger a los trabajadores en estas industrias.26
La
revisiĂłn de la bibliografĂa permite apreciar que existe una superposiciĂłn entre
publicaciones sobre asma ocupacional (AsmOcup) y EPID
OCUP NHS. Al evaluarlas, se deduce que, en los indiviÂduos sensibilizados, la
progresiĂłn de una afecciĂłn a la otra dependerĂa tanto de la concentraciĂłn del
agente ofensor como de un perĂodo prolongado de exposiciĂłn sin resguardo o con
protecciĂłn inadeÂcuada.
Al
decir de un referente como Salvaggio en un editorial hace
50 años, las NHS (ocupacionales o no) constituyen una suerte de Caja de
Pandora, en las que la investigación podrá suministrar las respuestas adecuadas
para cada caso.27
Las
EPID OCUP NHS más citadas en la biblioÂgrafĂa son el pulmĂłn “de granjero”, el
pulmón “de panadero”, las ocasionadas por MWF e isocianatos
y las provocadas por sustancias impermeabilizantes.
PulmĂłn de granjero
Se
trata de una enfermedad eventualmente grave, resultado de la manipulaciĂłn de
materiales orÂgánicos mohosos y polvorientos. Una exposiciĂłn determinada induce
la enfermedad en ciertas perÂsonas, mientras que otras no se afectan. La
biopsia de pulmĂłn revela una neumonitis intersticial granulomatosa. La
hipersensibilidad individual a los hongos o a sus productos parece ser un
factor crucial. El tratamiento es evitar la exposiciĂłn del trabajador
sensibilizado. Los actinomicetos termĂłÂfilos, Saccharomyces
rectivirgula, Termopolyspora
polyspora o Micropolyspora
faenii, se consideran particularmente antĂgĂ©nicos importantes y resÂponsables de la mayorĂa de
los casos notificados de NHS. Campbell fue el primero en considerar la
causalidad, aunque no lo denominĂł de esta forma y Fawcitt
considerĂł que se hallaba vinculado con cereal estacionado y enmohecido.28,
29
Una
encuesta epidemiolĂłgica en agricultores realizada en China mostrĂł un 6% de
productores diagnosticados con NHS. El 19% presentaban AsÂmOcup
y EPOC, el 17%. Los factores incidentes fueron humedad elevada y la gran
capacidad y la baja altura de los depĂłsitos.30 Los factores que
contribuyen a la NHS agrĂcola en Francia fueron la alta humedad, el empaque
prieto de heno, correlacionados con una mayor concentraciĂłn de microorganismos
promotores de NHS. Como medida de prevenciĂłn, realizar empaque y secado de
forraje y, al manipular heno potencialmente mohoso, usar protecciĂłn
respiratoria.31
A
través de las décadas, se han comunicado numerosos trabajos relacionados con
esta afecciĂłn y su relaciĂłn con tareas rurales, y es esencial el de Peppys por su investigaciĂłn y confirmaciĂłn serolĂłgica al
estudiar 327 trabajadores agrĂcolas con diferentes antĂgenos, en los cuales el
89% presentaron reacciones positivas y en 205 agriÂcultores, el 87% se debiĂł a
heno contaminado por Termopolyspora polyspora.
Cuanto
más elevados eran los tĂtulos serolĂłgicos, habĂa más reacciones a otros
antĂgenos y episodios más graves y frecuentes, con predominio de paÂcientes de
sexo masculino. En 122 agricultores no expuestos y sin padecer la enfermedad,
solo el 18% presentó reactividad. Finaliza subrayando que el “pulmón de
granjero” era insidioso en el 49%; subÂclĂnico, en el 9%; y con cuadro tĂpico,
en el 32%.32-34
Esta
enfermedad ocupacional no se ve en nuesÂtro medio debido a que el ganado se
alimenta de pasturas y no de heno o cereal almacenado, lo que favorece la
contaminaciĂłn fĂşngica.
Con
respecto a este padecimiento, Cuthbert y Gordon
hicieron un seguimiento a 10 años en 29 casos. Los resultados revelaron que la
protecciĂłn respiratoria y el reemplazo del heno por pasto acopiado en silos
favorecĂan la prevenciĂłn. Para ser seguros, los respiradores deben usarse en
las ocasiones donde haya polvo agrĂcola, especialmente en ambientes cerrados.35
En
las Ăşltimas dĂ©cadas, se ha publicado la freÂcuencia con que en esta enfermedad,
aparecen bronquitis crĂłnica, enfisema no vinculado al tabaÂquismo y signos tomográficos de NHS. Depierre y
cols. investigaron, en Francia, 1763 trabajadores
rurales con serologĂa y cuestionarios, y obtuvieron respuesta en el 69%, de los
que 270 eran sospechoÂsos de la enfermedad. Hallaron relaciĂłn entre la
bronquitis crĂłnica y la afecciĂłn, lo que sugiere que el polvo fĂşngico era el
responsable de ello (un 50,6% en los afectados frenta
a un 8,6% en los controles con una p < 001). Concluyen que la
bronquitis crĂłnica del “pulmĂłn de granjero” fue independiente del taÂbaquismo y
la edad. Las anomalĂas radiolĂłgicas del intersticio pulmonar eran del 9,2% y su
prevalencia es menos comĂşn en llanuras o montañas, probableÂmente debido al
frĂo ambiental.36 Como publicaciĂłn de rareza, Soumgane
y cols. describen una mujer con “pulmón de granjero”
que presentaba una PPFE. Su evoluciĂłn fue excelente con corticoides y
seguimiento durante un año.37
Enfermedad del
intersticio pulmonar por fluidos para trabajar metales
Los
fluidos para trabajar metales (MWF) son esencialmente emulsiones de aceite en
agua con aditivos (inhibidores de corrosiĂłn, emulsionantes, antiespumantes y biocidas). Su contaminaciĂłn miÂcrobiana es casi
sistemática, ya que sus componenÂtes sirven como nutrientes para
microorganismos contaminantes. Los biocidas para MWF
son proÂductos de protecciĂłn utilizados para contrarrestar la contaminaciĂłn y
el crecimiento microbianos. Los criterios adecuados de un biocida
para MWF son los siguientes:
1.
Actividad de amplio espectro.
2.
Apto a bajas concentraciones.
3.
Compatible con la fĂłrmula y propiedades fĂsico-quĂmicas del MWF y estable en el
tiempo.
4.
Eficaz en presencia de suciedades.
5.
Sin acciĂłn corrosiva sobre los metales.
6.
No presenta peligro para personas y el medio ambiente.
7.
EconĂłmico.
El
futuro está en el desarrollo de nuevas molĂ©cuÂlas con actividad biocida que se correspondan con la optimizaciĂłn del
rendimiento de las molĂ©culas actuales y el establecimiento de diferentes estraÂtegias
que potencien la actividad de los biocidas. Con más
de 1,2 millones de trabajadores en los Estados Unidos implicados en la
manufactura de
Los
métodos de vigilancia epidemiológica son útiles para revelar causalidad, al
demostrar que el MWF es el factor más frecuente de AsmOcup,
junto con los isocianatos. En la publicaciĂłn de Bakerly, componĂan el 11% y estos Ăşltimos, el 21%; en tanto
que, en la de Rosenman y cols., los MWF constituĂan
el 11% y los isocianatos, el 14%.40, 41
PeriĂłdicamente
surgen publicaciones de series o casos de AsmOcup por
MWF, pero son más exiguas las de NHS por los mismos productos.42-45
En
1995, Bernstein y cols. publican
los seis primeros casos de NHS por MWF y con relativa frecuencia aparecen
episodios de esta enfermedad laboral.46-49
Existen
estudios metódicos que muestran que, tanto en la NHS como en la AsmOcup, no solo están implicados los fluidos, sino también
microorganisÂmos u hongos que crecen en ellos, principalmente el Mycobacterium immunogenum,
responsable de la contaminaciĂłn y de causar hipersensibilidad en animales de
experimentaciĂłn.50-52
Enfermedad de los
panaderos
El
asma de los panaderos es una de las causas más usuales de AsmOcup
y su incidencia se estima entre 1-10/1000 trabajadores de panaderĂa. Un
establecimiento panadero es un complejo hábitat con un sinnúmero de potenciales
sensibilizantes Un empleado de esta industria que
estĂ© expuesto a alergenos de panaderĂa puede padecer
la enferÂmedad, incluidos molineros, pasteleros y procesaÂdores de alimentos.
Los principales alergenos son las harinas (trigo,
centeno y cebada), las enzimas que se adicionan a la masa (como la
α-amilasa) y los parásitos y hongos que pueden contaminar la harina. Este
tipo de asma laboral es mediada por la IgE; su
titulaciĂłn es fundamental para el diagÂnĂłstico de la afecciĂłn.53, 54
Simonis y cols. estudiaron
en 433 panaderos niveles de IgE e IgE
especĂfica a las enzimas de horneado investigados en el Programa de PrevenÂciĂłn
del Asma en la InstituciĂłn Alemana de Seguro Social de Accidentes para la
Industria Alimentaria. calcularon la exposiciĂłn del
personal al polvo ambiental, incluida la concentraciĂłn del nivel de
α-amilasa en el área de trabajo.
Los
resultados y conclusiones a las que llegaron fueron los siguientes:
a.
Importante descenso (del 26% al 13%) en la sensibilizaciĂłn a la α-amilasa.
b.
La sensibilización a la glucoamilasa fue mucho más
alta que a la celulasa.
c.
Es comĂşn en los panaderos la sensibilizaciĂłn a las tres enzimas.
d.
El 30% de los panaderos están sensibilizados al menos a una de las enzimas.
e.
Ha disminuido la exposiciĂłn a α-amilasa.
f.
Con relación a 10 años atrás, el 11% menos de panaderos están expuestos a la
α-amilasa.
g.
La alta sensibilizaciĂłn a la glucoamilasa en paÂnaderos
afectados lleva a investigar los niveles de exposiciĂłn en panaderĂas y evaluar
sensibiÂlizaciones en el contexto de las enfermedades profesionales.55
Las
investigaciones de Diederichs y Lubers
revelaban hace 60 años una incidencia de sensiÂbilizaciĂłn cercana al 54% entre
los panaderos. La expectativa prevista de presentaciĂłn de signos y sĂntomas se
estimaba en 12,7 años para la rinitis laboral y de 15,3 años para el AsmOcup.56
En 1980, Thiel y Ulmer publicaron
un exhaustivo estudio en el que informaron que, en Alemania, desde 1961, era
una enfermedad laboral reconocida. Ya en la Roma antigua, se conocĂa el padecer
de los esclavos que hacĂan pan y la primera referencia cientĂfica fue debida a Ramazzini, circa 1700. Sin embargo, la NHS por
harinas, parásitos, hongos o enzimas es excepcional. La publicación de Gerfaud y cols. sobre NHS en un
panadero expuso buena evoluciĂłn con corticoides y micofenolato,
pero la serologĂa fue positiva para maĂz, avena, Aspergillus fumigatus y ácaros, como el Glyciphagus
destructor o el SitoÂphilus granarius, lo que muestra la complejidad de los
estudios diagnĂłsticos que se requieren al testear en el caso 26 antĂgenos.57,
58
Se
ha publicado una NHS provocada por paráÂsitos de la harina, pero la más
interesante es la de Van Heemst y cols. sobre una NHS inducida por fitasa
en un obrero que trabajĂł 20 años sin proÂtecciĂłn elaborando alimentos para
pollos. La fitasa cataliza la hidrĂłlisis del fitato, que es un modo de almacenar fosfato existente en la
soja y cereales. Las aves y cerdos utilizan parcialmente este fĂłsfoÂro, por lo
que, para incrementar su disponibilidad, se añade la enzima al alimento.59,
60
Para
finalizar, Brant y cols. efectuaron
una enÂcuesta y serologĂa en 239 panaderos de distintos supermercados
británicos. Los resultados mosÂtraron que el 15% presentaban signos y sĂntomas
respiratorios, el 11% poseĂa serologĂa positiva para harinas y un 4%, para la
α-amilasa. Esta poblaÂciĂłn de panaderos, a pesar de los bajos niveles de
exposiciĂłn al polvo, acusaba niveles importantes de sensibilizaciĂłn y sĂntomas
respiratorios afines con el trabajo. Permutas en el sitio laboral y moÂdificaciones
en el proceso de fabricaciĂłn del pan han provocado un cambio en la distribuciĂłn
del AsmOcup y la NHS de los panaderos en el Reino
Unido.61
PulmĂłn de los
criadores de aves
El
criador de aves está expuesto a una enfermedad pulmonar inmunológica debido a
la exposiciĂłn reÂpetida de antĂgenos aviarios transmitidos por aire. Es un tipo
de NHS desencadenada por la excreta de proteĂnas aviarias sumamente antigĂ©nicas
o proteĂnas cĂ©reas que cubren las plumas de una variedad de aves, lo que
provoca una reacción de hipersensibilidad en un huésped susceptible.62
La
enfermedad puede ser más consecuencia de una actividad recreacional que
laboral. Esta afecciĂłn, que en su gran mayorĂa se expresa como AsmOcup, está asociada con una variedad de haÂllazgos
anormales, pruebas cutáneas, alteraciones radiográficas, serologĂa y
perturbaciones en la funÂciĂłn pulmonar. Desafortunadamente, ninguno de ellos
son diagnĂłsticos; la enfermedad se identifica mejor mediante criterios
clĂnicos.63
Morel
y cols. estudiaron con este fin 86 paÂcientes con NHS
entre 1977-2003 y 1/5 padecĂa la forma crĂłnica. Todos fueron estudiados con
serologĂa, radiografĂa y TC de tĂłrax, pruebas cuÂtáneas, FBC con BAL o BTB. El
82% padecĂa tos y el 98% presentaba disnea, con un 25% en clase funcional III o
IV y un 18%, opresiĂłn torácica. En el BAL, poseĂa linfocitosis el 83% y, en la
TC, hallaron el 79% de patrón intersticial y el 68% de “vidrio esmerilado”. La
serologĂa fue positiva en el 92% de la serie.64
La
serologĂa es de gran valor para colaborar en la sospecha diagnĂłstica. El mĂ©todo
ELISA utiliÂzado indicĂł ser Ăştil para evaluar las respuestas de IgG especĂficos. En un metaanálisis
efectuado por Shiroshita y cols., el ELISA mostrĂł
elevada sensibilidad y el método Ouchterlony expuso
una alta especificidad.65, 66
El
estudio de McSharry en 50 afectados, para validar un
procedimiento de detecciĂłn de antiÂcuerpos automatizado fluorimĂ©trico,
proporciona un método para la estandarización internacional de la NHS, que
mejora el control de calidad y perfecciona su idoneidad como complemento
diagnĂłstico.67
Existen
relativamente pocas publicaciones de NHS por antĂgenos aviarios; la mayorĂa son
por actividad colombĂłfila, pero vale destacar el caso de Chopra
en el que la exposición a aves fue muy cercana durante 35 años; o la de Cooper,
cuya observaciĂłn era sobre un trabajador de limpieza en un restaurante que
recolectaba plumas de patos y gansos, y las colocĂł en un jarrĂłn en su hogar
durante los Ăşltimos 6 meses. Fuera de su domicilio no habĂa pájaros. A veces,
se presenta con disnea inexplicable o como la exteriorizaciĂłn de una COP.62,
68, 69
InducciĂłn por isocianatos
En
muchas naciones, los isocianatos (ICN) consÂtituyen
una causa muy periĂłdica de AsmOcup. Si bien esta
referencia es muy importante y la NHS se ha notificado ocasionalmente, puede
ser un resultado más frecuente de lo que primeramente se creĂa por la
exposiciĂłn a ICN.
Los
ICN se usan en la fabricaciĂłn de una amplia variedad de productos, en especial
en la producciĂłn de espuma de uretano flexible, lacas, barnices, pinturas, y en
modificadores del caucho. Su toxicidad se conoce desde hace décadas: citados
por Blake y cols., la primera descripciĂłn fue en 1951 de Fuchs.
Schurman y Rein, informaron
dos casos en los que los pacientes fallecieron por mal asmático en 1955.70
Poco
se conoce acerca de los inevitables niveÂles laborales para la inducciĂłn de NHS
por ICN. Efectuando un adecuado monitoreo ambiental y un control médico-laboral
estricto, la exposiciĂłn a ICN se asocia a baja sensibilizaciĂłn y a una mĂnima
exposiciĂłn a la noxa.71 La exposiciĂłn sin protecciĂłn puede ocasionar
dermatitis, conjuntivitis, rinitis, bronquitis “industrial”, AsmOcup (que es lo más cotidiano hallar en la bibliografĂa)
o más ocasioÂnalmente NHS.72 Baur informĂł
14 casos de NHS por ICN al investigar 1780 obreros que usaban el material, lo
que representaba el 1% de la fuerza laboral, en tanto que Vandenplas
hallĂł un 4,7% en su investigaciĂłn. La diferencia resultarĂa en las diferentes
condiciones de trabajo.73, 74
La
susceptibilidad particular juega un papel imÂportante, como en el caso de NHS
por ICN en una secretaria de una empresa que ingresaba varias veces al dĂa en
el local donde se usaba esta noxa para teñir botas.75 El tratamiento
con esteroides puede dar excelentes resultados, y, en la biblioÂgrafĂa
japonesa, hay una publicaciĂłn sobre NHS por ICN pintando un auto como
esparcimiento recreativo.76, 77
Los
lĂmites ambientales permitidos de ICN en Estados Unidos han ido descendiendo de
0,1 ppm en 1956 hasta 0,005 ppm/8 h de trabajo o 0,02 ppm por 4 perĂodos de 15
min/d en 1980.78 Minimizar o prevenir la exposiciĂłn es fundamental
en Medicina Laboral e Higiene y Seguridad. Es imprescindible efectuar charlas
educativas y la supervisiĂłn mĂ©Âdica debe ser realizada mediante espirometrĂas periĂłdicas en el plantel de trabajo para
detectar cambios funcionales. En las áreas donde la conÂcentraciĂłn de ICN es
mayor, Nakashima y cols. aconsejan
realizar, además, controles serológicos de IgE
especĂfica para poder lograr una detecciĂłn precoz y proceder en consecuencia.79
NHS por
impermeabilizantes
Los
impermeabilizantes se utilizan para recuÂbrir cueros, tejidos o superficies
sĂłlidas a fin de certificar la resistencia a la suciedad y al agua.
Habitualmente están constituidos por tres compoÂnentes: un compuesto activo
(repelente de agua), un solvente y un propelente
(propano, butano) si viene enlatado. El repelente de agua es una mezcla de siloxanos o polĂmeros de acrilato, que contienen fluorocarbono o hidrofluorcarbono.
Hoy en dĂa, las mezclas acuosas de glicoles y glicol Ă©teres se utilizan a
menudo como disolventes.80
Durante
los últimos 20 años, se han descrito diferentes efectos en la salud por el uso
de agentes impermeabilizantes en aproximadamente veinte informes que involucran
la exposición de más de doscientas personas.
Asiduamente,
aparecen casos aislados relacioÂnados con los impermeabilizantes y, en la gran
mayorĂa de estos, los compuestos orgánicos voláÂtiles (COV) desempeñan un papel
importante.81-83
Scheepers y cols. publican la afectaciĂłn de 10 trabajadores expuestos a un
impermeabilizante con bajo porcentaje de COV y nanopartĂculas.
Abreviando, un obrero que habĂa fumado antes de ingresar al trabajo fue
hospitalizado con lesiones extendidas en ambos pulmones, y otros nueve
padecieron sĂntomas respiratorios al ingresar al ambiente laboral en las
siguientes 24 h.
Luego
de los estudios pertinentes, la conclusiĂłn de los autores fue que, en el
operario hospitalizado, los cigarrillos estaban contaminados con el lĂquido. La
sintomatologĂa de los restantes se debiĂł a material en suspensiĂłn que aĂşn estaba
presente en el ambiente. Los compuestos volátiles podrĂan haber operado si la
edificaciĂłn era completamente cerrada.84
ObservaciĂłn
muy interesante es la de Tan y cols., que publicaron 11 casos, con 5 de distrés respiratorio y 1 deceso. La investigación reveló
que una fábrica vecina –a 35 m del taller afectado–haÂbĂa liberado los residuos
de fluoro carbono, pero habĂa omitido impensadamente
rociar agua en los desechos y provocado, asĂ, el accidente.85
En
Suiza, entre octubre de 2002 y marzo de 2003, se produjo un brote agudo tras la
exposiciĂłn a impermeabilizantes. Se notificaron 180 casos (preÂviamente se
habĂan registrado menos de 10 casos/ año). Los casos notificados involucraron 3
marcas de aerosoles que habĂan cambiado su fĂłrmula previamente al incidente. Se
realizó un análisis retrospectivo para aclarar circunstancias y causas de los
efectos observados. Los resultados obteniÂdos revelaron una alta variabilidad
de respuesta individual, lo que sugiere que, en la incidencia de la afecciĂłn,
predomina algĂşn mecanismo indirecto. Los hallazgos sugieren que la mejora en
las conÂdiciones de exposiciĂłn ambiental no es suficiente para prevenir futuros
brotes tĂłxicos por aspersiĂłn del impermeabilizante. Sugieren medidas preventiÂvas
más eficaces antes de comercializar y distribuir nuevos productos
impermeabilizantes.86
La
exposición sin protección reiterada a la noxa durante 4 años puede originar la
evoluciĂłn a una NHS crĂłnica, como en una publicaciĂłn del 2017, considerada como
el 1er. caso conocido hasta ese momento.87
EPID OCUP por té
verde
En
la elaboración del té verde, se descarga un polvo fino a la atmósfera de la
fábrica llamado “pelusa de té”. La inhalaciĂłn puede provocar ataque respiraÂtorio
en relativamente poco tiempo. La tos crónica en las fábricas de té y la
enfermedad del catador de té son dos afecciones profesionales asociadas con la
industria del producto.88 El primer caso publicado correspondiĂł a un
AsmOcup por polvo del té y fue confirmado por
intradermorreacciĂłn cutánea y desafĂo bronquial especĂfico, aunque este autor
cita observaciones de Castellani en Ceylan hacia 1919.
Cartier
y Malo informan de tres casos similares estudiados por ellos y, en la
bibliografĂa japonesa, se suceden divulgaciones de NHS por tĂ© verde entre las
que se destaca la de Tanaka y cols. por la gran concentraciĂłn ambiental de la noxa actuante en
el establecimiento fabril.89-93
El
té verde tiene un 8% de epigalocatequina en oposición
al té negro que posee 1%, y es la principal responsable de AsmOcup
y NHS. Shirai y cols. observaron
tanto una correlaciĂłn significaÂtiva entre el porcentaje máximo de liberaciĂłn
de histamina y la concentraciĂłn de epigalocatequina
en las reacciones intradĂ©rmicas especĂficas como resultados positivos al
realizar desafĂo bronquial con polvo de tĂ© verde.94, 95
Miscelánea
Como
se explicĂł oportunamente, la inhalaciĂłn de partĂculas orgánicas (proteĂnas
animales, hongos o bacterias) o el material laboral maniobrado inducen la
apariciĂłn de NHS en sujetos sensibilizados. La bibliografĂa se actualiza en
forma constante con casos relacionados con antĂgenos imprevistos y la susceptiÂbilidad
individual que dio origen a la publicación, lo que hace quimérico dominarla por
completo.
De
ella se rescatan por lo interesante algunas observaciones, como la de los
trabajadores del corcho (suberosis), los “lavadores
de quesos”, en la que el antĂgeno responsable es el Penicillium
Casei o Roqueforti,
las NHS por contaminaciĂłn de aire acondicionado, las NHS en la elaboraciĂłn de
champiñones, o un caso excepcional, como el de Marchisio
y cols. por contaminaciĂłn de fiambre con Penicillium Camemberti en
una fábrica de embutidos.96-108
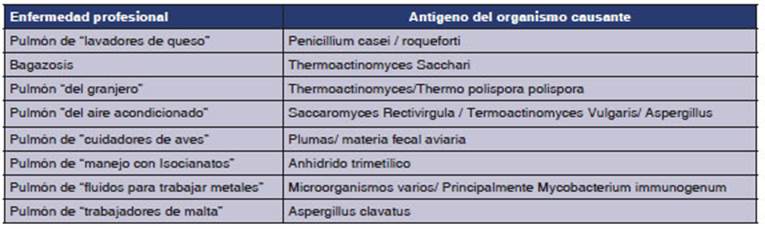
Para
finalizar, adjuntamos una tabla muy conÂcisa de algunas de las enfermedades
profesionales pulmonares que pueden provocar la apariciĂłn de NHS y sus causas
habituales (Tabla):
EPID OCUP EMERGENTE (ÂżNUEVA ENFERMEDAD
PROFESIONAL?)
Cummings
y cols. publicaron un profundo estudio realizado en
áreas de producción de una fábrica de máquinas industriales, donde, entre 1995
y 2012, trabajaron cinco hombres no fumadores sanos preÂviamente que
desarrollaron sĂntomas respiratorios.
Todos
presentaron un comienzo larvado de tos, sibilancias y disnea de esfuerzo con un
descenso promedio del 44% del FEV1 y un 53% de la DLCO (53%) previstos. La TC
de tĂłrax mostraba enfisema centrolobulillar.
Los
cinco tenĂan disnea crĂłnica, con deterioro funcional progresivo en tres, y uno
fue sometido a trasplante pulmonar. La histologĂa pulmonar mosÂtrĂł
bronquiolitis y ductitis alveolar con células B,
folĂculos carentes de centros germinales y enfisema significativo. A este
patrĂłn lo denominaron BADE (Bronchiolitis
Alveolar Ductitis Emphysema).
Los pacientes no notificaron exposiciones previas ocupacionales anormales.
No
se identificaron casos entre trabajadores de otras áreas o en la comunidad. Las
concentraciones de endotoxinas se elevaron en dos muestras. Las exposiciones
estuvieron por debajo de los lĂmites ocupacionales. El aire fluĂa de áreas donde
el mecaÂnizado ocurriĂł en otras áreas de producciĂłn. El MWF usado desarrollĂł Pseudomonas pseudoalcaligenes
y carecĂan de ADN micobacteriano, pero el
análisis 16S revelĂł más grupos bacterianos. HabĂa una relaciĂłn con el lugar de
trabajo, ya que los cinco pacientes se ocupaban especialmente en las áreas de
producciĂłn. Además, habĂa correspondencia con el empleo, ya que estos hombres
previamente sanos experimentaron una apariciĂłn insidiosa de sĂntomas
respiratorios durante la labor. Cuatro estaban sintomáticos fuera del empleo, y
presentaban exacerbaciĂłn de sĂntomas en el trabajo. Un paciente tuvo varios
meses una meÂjora funcional fuera del área, seguido de una pĂ©rdida funcional al
regresar a sus tareas iniciales.
La
conclusiĂłn de los investigadores indicarĂa una enfermedad pulmonar intersticial
ocupacional no reconocida previamente.109
Para
finalizar, hay que destacar el trabajo de Petnak y Moua, en el que efectúan un cuidadoso análisis de las
causas favorecedoras de NHS y coÂmentan lo difĂcil que es establecer la
relaciĂłn causa/ efecto ante un caso problema. Para ello, formulan un
cuestionario dirigido a detectar presuntas exÂposiciones en aquellos que
presentan enfermedad compatible con NHS basado en cuatro Ătems:
1.-
ExposiciĂłn a pájaros, aves o artĂculos con contenido de plumas o plumĂłn.
2.-
ExteriorizaciĂłn de sĂntomas en el hogar o ambiente de trabajo.
3.-
Utilización de bañera de hidromasaje, jacuzzi o concurrencia a una sauna.
4.-
Anamnesis vinculada a hobbies u ocupacioÂnes, pasadas o actuales.
El
interrogatorio propuesto por los autores sigÂnificarĂa un respaldo cuando la
serologĂa u otros elementos clĂnicos y radiolĂłgicos no son irrefutaÂbles o
están irresueltos.110
CONCLUSIONES
1.
La contingencia de padecer una enfermedad laboral u ocupacional existe en
prácticamente todas las tareas realizadas por la poblaciĂłn laÂboral.
2.
Los cambios en las prácticas de manufactura y la incorporación de materiales
novedosos han hecho que los especialistas en Medicina Laboral continĂşen
descubriendo asociaciĂłn entre nuevas exposiciones y formas agudas o crĂłnicas de
enfermedad pulmonar parenquiÂmatosa difusa.
3.
El horizonte etiológico, tanto de causas médicas como ocupacionales de la
patologĂa del interstiÂcio pulmonar, es muy amplio y se acrecienta en forma
permanente con nuevos aportes biblioÂgráficos.
4.
El complejo mecanismo de reparaciĂłn del parĂ©nÂquima pulmonar se manifiesta en
el intersticio con variadas respuestas, tanto ante causas médicas como noxas
laborales, e, incluso, puede ser diferente ante una misma etiologĂa.
5.
Para comprender el vĂnculo entre exposiciĂłn y enfermedad, los mĂ©dicos
especializados en Medicina Laboral y los profesionales dedicados a la Higiene y
Seguridad deben observar un elevado Ăndice de sospecha acerca de la potencial
toxicidad de las manifestaciones ocupacionales y ambientales.
BIBLIOGRAFĂŤA
1. Cordier
J. Cryptogenic organizing pneumonia Clin Chest Med.
2004;25:727-38.
https://doi.org/10.1016/j.ccm.2004.06.003
2. Lazor
R. Organizing Pneumonias. En: Cottin V et al. (eds.),
Orphan Lung Diseases: A Clinical Guide to Rare Lung Disease. 2015;363. https://doi.org/10.1007/978-1- 4471-2401-6_24
3.
Okada H, Kurasawa K, Yamazaki R, y col. Clinical features of organizing pneumonia associated with rheumatoid
arthritis. Mod Rheumatol. 2016;26:863-8.
https://doi.org/10.3109/14397595.2016.1153217
4. Ben Saad
A, Joobeur S, Rouetb N. Pneumonie organisĂ©e rĂ©vĂ©Âlatrice d’une polymyosite Pan African Med. J 2014;19:116. https://doi.org/10.11604/pamj.2014.19.116.4939
5.
Ochiai S, Nomoto Y, Yamashita Y, y col. Radiation-induced organizing pneumonia after stereotactic body
radiotheraÂpy for lung tumor. J Radiat Res. 2015;56:904-11. https://doi.org/10.1093/jrr/rrv049
6. Huang P, Kuo
C, Lin C, y col. Mesalazine-related lung disease in a
patient with ulcerative colitis Medicine (Baltimore). 2018;97:e13242. https://doi.org/10.1097/MD.0000000000013242
7.
Barjaktarevic I, Qadir N,
Suri A, y col. Organizing pneuÂmonia as a side
effect of ipilimumab treatment of melaÂnoma. Chest. 2013;143:858-61.
https://doi.org/10.1378/chest.12-1467
8. Watanabe C, Miyata J, Esak K, y col. Pazopanib-induced
organizing pneumonia in a patient with leiomyosarcoma:
A case report. Resp Med Case Rep. 2020;30: 101112. https://doi.org/10.1016/j.rmcr.2020.101112
9. Johar
B, Fatmawati R, Kadir A, y
col. Radiological progresÂsion of COVID-19 organizing pneumonia. Resp Case Rep. 2021;9: e00764
https://doi.org/10.1002/rcr2.764
10. Funk G, Nell C, Pokieser W y col. Organizing pneumoÂnia following Covid19
pneumonia Wien Klin Wochenschr.
2021;133:979-82. https://doi.org/10.1007/s00508-021-01852-9
11.
Zhang Y, Li N, Li Q, y col. Analysis of the
clinical charÂacteristics of 176 patients with pathologically confirmed
cryptogenic organizing pneumonia Ann Transl Med. 2020;763. https://doi.org/10.21037/atm-20-4490
12.
Moriyama H, Kobayashi M, Takada T, y col. Two-dimensionÂal
analysis of elements and mononuclear cells in hard metal lung disease. Am J Respir Crit Care Med. 2007;176:70-7. https://doi.org/10.1164/rccm.200601-134OC
13. Liebow
A, Carrington C. The interstitial pneumonias. In:
Simon M, Potchen EJ, Lemay E, eds. Frontiers in pulmoÂnary
radiology. New York Grune & Stratton,
1969:102-41.
14.
Adams T, Butt Y, Batra K, y
col. Cobalt related interstiÂtial lung disease. Resp Med.
2017;129:91-7.
https://doi.org/10.1016/j.rmed.2017.06.008
15.
Nunes-Bezerra P, Alves-Vasconcelos A, Albuquerque- Cavalcante L y col. Hard metal lung disease in an oil industry worker. J Bras
Pneumol. 2009;35:1254-8.
https://doi.org/10.1590/S1806-37132009001200015
16.
Carmo-Moreira M, da Rocha Oliveira-Cardoso A, Schuwartz-Tannus D y col. Hard metal pneumocoÂniosis with spontaneous bilateral pneumothorax J
Bras Pneumol. 2010;36:148-15.
https://doi.org/10.1016/j. rmed.2017.06.008
17. Chiarchiaro
J, Tomsica L, Strock S, y
col. A case series describing common radiographic and
pathologic patterns of hard metal pneumoconiosis Respiratory. Med Case
Rep. 2018;25:124-8. https://doi.org/10.1016/j.rmcr.2018.08.006
18. Naqvi
A, Hunt A, Burnett B, y col. Pathologic Spectrum and Lung Dust Burden in Giant
Cell Interstitial PneumoÂnia (Hard Metal Disease/Cobalt Pneumonitis): Review of
100 Cases. Arch Environ & Occup Health. 2008,63:51-70. https://doi.org/10.3200/AEOH.63.2.51-70
19. Hargett
C, Sporn T, Roggli V y col.
giant cell interstiÂtial pneumonia asocciated with nitrofurantoin. Lung. 2006;184:147-9. https://doi.org/10.1007/s00408-005-2574-z
20.
Lee B, Balavenkataraman A, Sanghavi
D, y col. Recurrent nitrofurantoin-induced
giant cell interstitial pneumonia: Case report and literature review. Resp Med Case Rep. 2015;14:49-52.
https://doi.org/10.1016/j.rmcr.2015.01.002
21.
Fernández Pérez E, Swigris J, Forssen
A, y col. IdentiÂfying an inciting antigen is associated with
improved survival in patients with chronic hypersensitivity pneuÂmonitis. Chest. 2013;144:1644-51.
https://doi.org/10.1378/chest.12-2685
22. Cormier Y, Schuyler M.
Hypersensitivity pneumonitis and organic dust toxic syndromes. In: Bernstein L,
Chan- Yeung M, Malo J-L,
Bernstein D (eds) Asthma and the workplace, 3rd edn. Marcel Dekker, New York, 2005 p 635-656.
23. Hirschmann
J, Sudhakar N, Pipavath, J,
y col. HypersenÂsitivity Pneumonitis: A Historical, Clinical, and RadioÂlogic
Review. RadioGraphics. 2009;29:1921-38.
https://doi.org/10.1148/rg.297095707
24. Raghu G, Remy-Jardin M, Ryerson C, y col. Diagnosis of Hypersensitivity
Pneumonitis in Adults An Official ATS/JRS/ALAT Clinical Practice Guideline. Am
J Resp Crit Care Med. 2020;202:e36-e69. https://doi.org/10.1164/rccm.202005-2032ST
25.
Yoshida K, Suga M, Nishiura Y, y col. Occupational hyperÂsensitivity pneumonitis in Japan: data on a
nationwide epidemiological study. Occup Environ Med.
1995;52:570-4. https://doi.org/10.1136/oem.52.9.570
26. Moon Bang K, Weissman D, Pinheiro G, y col.
Twenty- Three Years of Hypersensitivity Pneumonitis MortalÂity Surveillance in
the United States American. Am J Ind Med. 2006;49:997-1004. https://doi.org/10.1002/ajim.20405
27. Salvaggio
J. Hypersensitivity Pneumonitis: Pandora ’s Box. New Engl J Med. 1970;283:514-5.
https://doi.org/10.1056/NEJM197008062830610
28. Campbell J. Acute Symptoms
Following Work with Hay. Brit Med J. 1932;2:1143-4.
29. Fawcitt R. Occupational diseases of lungs in agriculÂtural
workers.Brit J Radiol. 1938;11:378-92.
https://doi.org/10.1259/0007-1285-11-126-378
30. Liu S, Chen D, Fu S, y col.
Prevalence and risk factors for farmer’s lung in greenhouse farmers: an
epidemiological study of 5,880 farmers from Northeast China. Cell
BioÂchem Biophys.
2015;71:1051-7.
https://doi.org/10.1007/s12013-014-0308-7
31. Gbaguidi-Haore
H, Roussel S, Reboux G, y
col. MultiÂlevel analysis of the impact of environmental factors and
agricultural practices on the concentration in hay of microorganisms
responsible for farmer’s lung disease. Ann Agric
Environ Med. 2009;16:219-225.
32. Dickie
H, Rankin J. Farmer’s lung an acute granulomaÂtous interstitial pneumonitis
occurring in agricultural workers JAMA. 1958;167:1069-78.
https://doi.org/10.1001/jama.1958.02990260011004
33. Peppys
J, Jenkins P. Precipitin (F.L.H.) Test in Farmer’s Lung Thorax. 1965;20:21-36. https://doi.org/10.1136/thx.20.1.21
34.
Hapke E, Seal M, Thomas G y
col. Farmer’s lung A cliniÂcal, radiographic, functional,
and serological correlation of acute and chronic stages Thorax. 1968;23:451-69. https://doi.org/10.1136/thx.23.5.451
35. Cuthbert O, Gordon M. Ten
year follow up of farmers with farmer’s lung. Br J Ind
Med. 1983;40:173-6.
https://doi.org/10.1136/oem.40.2.173
36. Depierre
A, Dalphin J, Pernet D y
col. Epidemiological study of farmer’s lung in five districts of the French
Doubs province. Thorax. 1988;43:429-35.
https://doi.org/10.1136/thx.43.6.429
37. Soumagne
T, Pana-Katatali H, Degano
B, y col. Combined pulmonary fibrosis and emphysema in hypersensitivity
pneumonitis BMJ Case Rep. 2015. https://doi.org/10.1136/bcr-2015-211560
38. Di Martino P.
Ways to improve biocides for metalworkÂing fluid. AIMS Microbiol. 2021;7:13-27.
https://doi.org/10.3934/microbiol.2021002
39. Gupta A, Rosenman
K. Hypersensitivity Pneumonitis Due to Metal Working Fluids: Sporadic or Under
Reported? Am J Ind Med. 2006;49:423-33.
https://doi.org/10.1002/ajim.20312
40. Bakerly
N, Moore V, Vellore A, y col. Fifteen-year trends in occupational asthma: data
from the shield surveillance scheme. Occup Med (Lond). 2008;58:169-74. https://doi.org/10.1093/occmed/kqn007
41. Rosenman
K, Reilly M, Kalinowski D. Annual report on
work-related asthma in Michigan. East Lansing, Michigan (11/13/07); 2006
http://www.oem.msu.edu/asthma/06WRA_all.pdf (accessed 10/29/2008)
42. Hendy M, Beattie B, Burge P.
Occupational asthma due to an emulsified oil mist. Br J Ind
Med. 1985;42:51-4. https://doi.org/10.1136/oem.42.1.5164
43. Robertson A, Weir D, Burge P.
Occupational asthma due to oil mists. Thorax. 1988;43:200-5. https://doi.org/10.1136/ thx.43.3.200
44. Massin
N, Bohadana A, Wild P, y col. Airway responÂsiveness,
respiratory symptoms, and exposures to soluble oil mist in mechanical workers. Occup EnÂviron Med. 1996;53:748-52.
https://doi.org/10.1136/oem.53.11.748
45. Greaves I, Eisen E, Smith T, y col. Respiratory Health of Automobile
Workers Exposed to Metal-Working FluÂid Aerosols: Respiratory Symptoms Am J Ind Med. 1997;32:450-9.
https://doi.org/10.1002/(SICI)1097-0274(199711)32:5<450::AID-AJIM4>3.0.CO;2-W
46. Bernstein D, Lummus Z, Santilli G, y col. Machine opÂerator’s lung a hypersensitivity
pneumonitis disorder associated with exposure to metalworking fluids aeroÂsols.
Chest. 1995; 1008:636-41.
https://doi.org/10.1378/chest.108.3.636
47. Hodgson M, Bracker A, Yang C, y col. Hypersensitivity pneumonitis in a
metalworking environment. Am J Ind Med. 2001;39:616-8. https://doi.org/10.1002/ajim.1061
48. Fox J, Anderson H, Moen T, y
col. Metalworking fluid-associated hypersensitivity pneumonitis: an outbreak
investigation and case–control study. Am J Ind Med.
1999;35:58-67. https://doi.org/10.1002/(SICI)1097-0274(199901)35:1<58::AID-AJIM8>3.0.CO;2-5
49. Bracker
A, Storey E, Yang C et al. An outbreak of hyÂpersensitivity
pneumonitis at a metalworking plant: a longitudinal assessment of intervention
effectiveness. Appl Occup
Environ Hyg. 2003;18:96-108.
https://doi.org/10.1080/10473220301436
50. Gordon T, Nadziejko
C, Galdanes K, y col. Mycobacterium immunogenum causes hypersensitivity pneumonitis-like
pathology in mice. Inhal Toxicol. 2006;18:449-56.
https://doi.org/10.1080/08958370600563904
51. Weiss L, Lewis R, Rossmoore H y col. Respiratory illness in workers exposed
to Metalworking fluid contaminated with nontuberculous
mycobacteria: Ohio, 2001. MMWR 2002;51:349-52.
52. Shelton B, Flanders D, Morris
G. Mycobacterium sp. as a possible cause of hypersensitivity pneumonitis in maÂchine
workers. Emerg Infect Dis. 1999;5:270-3.
https://doi.org/10.3201/eid0502.990213
53. Cullinan
P, Lowson D, Nieuwenhuijsen
M, y col. Work related symptoms, sensitisation, and
estimated expoÂsure in workers not previously exposed to flour. Occup Environ Med. 1994;51:579-83.
https://doi.org/10.1136/oem.51.9.579
54. Brant A. Baker’s asthma. Curr Opin Allergy Clin Immunol. 2007;7:152-5.
https://doi.org/10.1097/ACI.0b013e328042ba77
55. Simonis
B, Hölzel C, Stark U. Glucoamylase:
a current allergen in the baking industry Allergo J
Int. 2014;23:269- 73.
https://doi.org/10.1007/s40629-014-0034-0
56. Diederichs
W, Lubbers P. [Flour asthma as an occupational disease] (German). Zentralbl Arbeitsmed 1955;5:189-97.
57. Thiel H, Ulmer W. Bakers’
Asthma: Development and Possibility for Treatment Chest. 1980;78:400-6.
https://doi.org/10.1378/chest.78.2_Supplement.400
58. Gerfaud-Valentin
M, Reboux G, Traclet J, y
col. OccuÂpational Hypersensitivity Pneumonitis in a Baker. Chest.
2014;14:856-8. https://doi.org/10.1378/chest.13-1734
59. Lunn
J, Hughes T. Pulmonary Hypersensitivity to the Grain Weevil. Br J Ind Med. 1967;24:158-61.
https://doi.org/10.1136/oem.24.2.158
60. van Heemst
R, Sander I, Rooyackers J, y col. HypersenÂsitivity
pneumonitis caused by occupational exposure to phytase.
Eur Respir J. 2009;33:1507-9. https://doi.org/10.1183/09031936.00035408
61. Brant A, Berriman
J, Sharp C, y col. The changing distriÂbution of occupational asthma: a survey
of supermarket bakery workers. Eur Respir J. 2005;25:303-8.
https://doi.org/10.1183/09031936.05.00054004
62. Sullivan A, Shrestha P, Lanham T, y col. Bird Fancier’s lung: An
underdiagnosed etiology of dyspnea. Respir Med Case
Rep. 2020;31: 101288
https://doi.org/10.1016/j.rmcr.2020.101288
63. Christensen L, Duwayne Schmidt C, Robbins L. PiÂgeon breeders’ disease: a
prevalence study and reÂview. Clin Allergy. 1975;5:417-30.
https://doi.org/10.1111/j.1365-2222.1975.tb01881.x
64. Morell
F, Roger A, Reyes L, y col. Bird Fancier’s Lung A Series of 86 Patients
Medicine. 2008;87:110-30. https://doi.org/10.1097/MD.0b013e31816d1dda
65.
Rodrigo M, Benavent M, Cruz M, y col. Detection of speÂcific antibodies to pigeon serum and bloom antigens by
enzyme linked immunosorbent assay in pigeon breeder’s
disease. Occup Environ Med. 2000;57:159-64.
https://doi.org/10.1136/oem.57.3.159
66.
Shiroshita A, Tanaka Y, Nakashima K, y col. Diagnostic accuracy of specific IgG antibodies
for bird fancier’s lung: a systematic review and meta-analysis Ann Transl Med. 2019;7:655. https://doi.org/10.21037/atm.2019.10.65
67. McSharry
C, Dye G, Ismail T, y col. Quantifying serum antibody in bird fanciers’
hypersensitivity pneumonitis. BMC Pulm Med. 2006;6:16 https://doi.org/10.1186/1471-2466-6-16
68. Chopra V, Lal
Joshi J, Mrigpuri P, y col. Pigeon fancier’s lung –
An under-diagnosed cause of severely debilitatÂing and chronic breathlessness
Egyptian J Dis Tuberc. 2017;66:557-9.
https://doi.org/10.1016/j.ejcdt.2016.08.002
69. Cooper C, Teleb
M, Elhanaf S, y col. Bird fanciers’ lung induced by
exposure to duck and goose feathers. Am J Case Rep. 2014;15:155-8.
https://doi.org/10.12659/AJCR.890184
70. Blake B, Mc
Kay J, Rainey H, y col. Pulmonary Opacities Resulting from Di-isocyanate Exposure. J Coll Radiol Aust. 1965;9:45-8.
https://doi.org/10.1111/j.1440-1673.1965.tb00974.x
71. Bernstein D, Korbee L, Staude T, y col. The
low prevaÂlence of occupational asthma and antibody-dependent sensitization to diphenylmethane diisocyanate in a
plant engineered for minimal exposure to disocyanates.
J Allergy Clin Immunol.
1993;92:387-96. https://doi.org/10.1016/0091-6749(93)90117-X
72. Musk A, Peters J, Wegman D. lsocyanates and
Respiratory Disease: Current Status. Am J Ind Med
1988;13:331-49.
https://doi.org/10.1002/ajim.4700130304
73. Baur
X. Hypersensitivity pneumonitis (extrinsic allergic alveolitis)
induced by isocyanates. J Allergy
Clin ImÂmunol. 1995;95:1005-10. https://doi.org/10.1016/S0091-6749(95)70101-X
74.
Vandenplas O, Malo JL, Dugas
M, y col. HypersensiÂtivity pneumonitis-like reaction among
workers exÂposed to diphenylmethane diisocyanate (MDI). Am Rev Respir
Dis. 1993;147:338-46.
https://doi.org/10.1164/ajrccm/147.2.338
75. Schreiber J, Knolle J, Sennekamp J, y col.
Sub-acute ocÂcupational hypersensitivity pneumonitis due to low-level exposure
to diisocyanates in a secretary. Eur Respir
J. 2008;32:807-11.
https://doi.org/10.1183/09031936.00060507
76.
Suzuki N, Matsuzaki G, Arai
Y, y col. A case of hyperÂsensitivity pneumonitis in which serum
specific antiÂbodies for three species of isocyanate
molecules were demonstrated. Nihon Kyobu Shikkan Gakkai Zasshi. 1992;30:478-84.
77. Tabata
H, Mochizuki Y, Nakahara Y, y col. lHypersensiÂtivity
pneumonitis caused by isocyanate exposure during
recreational painting. Nihon Kokyuki Gakkai Zasshi. 2009;47:1002-7.
78. Musk W, Peters J, Wegman D. Isocyanates and
Respiratory Disease: Current Status. Am J Ind Med
1988;13:331-49.
https://doi.org/10.1002/ajim.4700130304
79. Nakashima K, Takeshita T, Morimoto K. Diagnosis and Prevention of
Diseases Induced by Isocyanate. Environ Health Prev Med 2002;7:40-6.
https://doi.org/10.1007/ BF02897329
80. Smilkstein
M, J, Burton B; T, Keene W y col. Acute respiratory illness linked to use of
aerosol leather condiÂtioner, Oregon, 1992. JAMA. 1993;269:568-9.
https://doi.org/10.1001/jama.1993.03500050028008
81.
Testud F, Gabrielle L, Paquin
M y col. Alvéolite aiguë après utilisation d’un aérosol imperméabilisant : À propos de deux observations. Rev Méd Inteme. 1998;19:262-4. https://doi.org/10.1016/S0248-8663(97)89328-9
82. Burkhart K, Britt A, Petrini G, y col. Pulmonary ToxÂicity Following Exposure to
an Aerosolized Leather Protector. Clin Toxicol.1996;34:21-4. https://doi.org/10.3109/15563659609020228
83. Wallace G, Brown P. Horse rug
lung: toxic pneumonitis due to fluorocarbon inhalation. Occup
Environ Med. 2005;62:414-16.
https://doi.org/10.1136/oem.2004.015784
84. Scheepers
P, Masen-Poos L, van Rooy
F, y col. Pulmonary injury associated with spray of a
water-based nano-sized waterproofing product: a case
study. J Occup Med Toxicol
2017;12:33. https://doi.org/10.1186/s12995-017-0180-7
85. Tan D, Wang C, Ling J, y col.
Acute respiratory disÂtress syndrome after accidental inhalation of fluoÂrocarbon
monomers and pyrolysis products. Occup Environ Med.
2016;73:287-8.
https://doi.org/10.1136/oemed-2015-103185
86. Vernez
D, Bruzzi R, Kupferschmidt
H, y col. Acute ReÂspiratory Syndrome After Inhalation
of Waterproofing Sprays: A Posteriori Exposure-Response Assessment in 102
Cases. J Occup Environ Hyg.
2006;3:250-61.
https://doi.org/10.1080/15459620600628845
87. Walters G, Trotter S, Sinha B, y col. Biopsy-proven hypersensitivity pneumonitis
caused by a fluorocarbon waterproofing spray Occupational Medicine 2017;
67:308- 310. https://doi.org/10.1093/occmed/kqx039
88. Shirai
T, Sato A, Hara Y. Epigallocatechin gallate. The major causative agent of
green tea-induced asthma. Chest. 1994;106:1801-5. https://doi.org/10.1378/chest.106.6.1801
89. Uragoda
C. Tea maker’s asthma. Brit J Industr Med. 1970;27:181-2. https://doi.org/10.1136/oem.27.2.181
90. Cartier A, Malo JL. Occupational asthma due to tea
dust. Thorax 1990;45:203-6.
https://doi.org/10.1136/thx.45.3.203
91.
Sano T, Gemma H, Satou M y
col. A case of hypersensitivÂity pneumonitis in a tea bag
manufacturer employee (in Japanese). Nihon Kyobu Rinsho 2004;63:393-398.
92. Otera
H, Tada K, Sakurai T, y col. Hypersensitivity pneumonitis associated with
inhalation of catechin-rich green tea extracts.
Respiration 2011;82:388-92.
https://doi.org/10.1159/000324450
93. Tanaka Y, Shirai
T, Enomoto N y col. Occupational hypersenÂsitivity
pneumonitis in a green tea manufacturer. Respirol
Case Rep. 2016;4:e00152.
https://doi.org/10.1002/rcr2.152
94. Shirai
T, Sato A, Hara Y. Epigallocatechin gallate. The major causative agent of
green tea-induced asthÂma. Chest. 1994;106:1801-5. https://doi.org/10.1378/chest.106.6.1801
95. Shirai
T, Sato A, Chida K, y col. Epigallocatechin
gallate-induced histamine release in patients with
green tea-inÂduced asthma. Ann Allergy Asthma Immunol. 1997;79:65- 9.
https://doi.org/10.1016/S1081-1206(10)63087-6
96. Avila R, Villar
T. Suberosis: respiratory disease in cork workers. Lancet. 1968;1:620-1. https://doi.org/10.1016/S0140-6736(68)91239-7
97.
Ruiz Manzano J, Valdés M, León M, y col. Suberosis:
alveolitis alĂ©rgica extrĂnseca en un trabajador del corcho. Med
Clin (Barc). 1984;82:265-26.
98.
Campbell J, Kryda M, Treuhaft
M, y col. Cheese Worker’s Hypersensitivity Pneumonitis. Am Rev Respir Dis. 1983;127:495-6.
https://doi.org/10.1164/arrd.1983.127.4.495
99. Galland
C, Reynaud R, De Haller B, y col. Cheese-washer’s disease. A
current stable form of extrinsic allergic alveoÂlitis
in a rural setting. Rev Mal Respir. 1991;8:381-6.
100. Bringgold
W, Halliday S. The cheese whiz lung: hypersenÂsitivity
pneumonitis in an imitation cheese factory worker.
https://doi.org/10.1016/j.chest.2020.08.1578
101. Banaszak
E, Thiede W, Fink J. Hypersensitivity pneuÂmonitis
due to contamination of an air conditioner. New Engl
J Med 1970;283:271-6.
https://doi.org/10.1056/NEJM197008062830601
102. Hodgson M, Morey P, Simon J,
y col. an outbreak of recurÂrent acute and chronic hypersensitivity pneumonitis
in office workers. Amer J Epidemiol
1987;125:631-8.
https://doi.org/10.1093/oxfordjournals.aje.a114576
103. Nakazawa
T, Tochigi T. Hypersensitivity pneumonitis due to Mushroom (Pholiota
nameko) spores. Chest. 1989;95:1149-51. https://doi.org/10.1378/chest.95.5.1149
104. Saikai
T, Tanaka H, Fuji M, y col. Hypersensitivity pneuÂmonitis due by the spore of Pleurotus eryngii. Intern Med
2002;41:571-3.
105. Moore J, Convery
R, Milla C, y col. Hypersensitivity Pneumonitis
Associated with Mushroom Worker’s Lung: An Update on the Clinical Significance
of the Importation of Exotic Mushroom Varieties. Int
Arch Allergy Immunol 2005;136:98-102.
https://doi.org/10.1159/000083298
106. Yoshikawa S, Tsushima K,
Koizumi T, y col. HypersensitivÂity Pneumonitis Induced by Spores of Penicillium citrinum in a Worker
Cultivating Enoki Mushroom.
https://doi.org/10.2169/internalmedicine.45.1646
107.
Ampere A, Delhaes L, Soots
J, y col. Hypersensitivity pneumonitis induced by Shiitake
mushroom spores. Med Mycol. 2012;50:654-7.
https://doi.org/10.3109/13693786.2012.658091
108. Marchisio
V, Sulotto G, Botta A, y
col. Aerobiological analysis in a salami factory: a possible case of extrinÂsic
allergic alveolitis by Penicillium
camembertii. Med Mycol 1999;37:285-9. https://doi.org/10.1080/j.1365- 280X.1999.00231.x
109. Cummings K, Stanton M, Nett R, y col. Severe lung disÂease
characterized by lymphocytic bronchiolitis, alveolar ductitis,
and emphysema (BADE) in industrial machine manufacturing workers. Am J Ind Med. 2019;62:927-37.
https://doi.org/10.1002/ajim.23038
110. Petnak
T, Moua T. Exposure assessment in hypersensitivÂity
pneumonitis: a comprehensive review and proposed screening questionnaire ERJ
Open Res 2020;6:00230- 2020.
https://doi.org/10.1183/23120541.00230-2020