Autor : Barimboim Enrique1, MorĂłn Graciela1, Luna Melisa1, Mangione Ramiro1, De la Torre Bertha1
1 Servicios de NeumonologĂa y ClĂnica MĂ©dica del Hospital Central de Mendoza. Argentina
Correspondencia : Dr. Enrique Barimboim. Email: enriquembarim@gmail.com
Resumen
Se
presenta una paciente con Enfermedad de Graves Basedow
que desarrolla signos clínicos de hipertiroidismo, trastornos de coaÂgulación,
hepáticos e hipertensión pulmonar que mejora con el tratamiento
de la enfermedad. Se revisan los potenciales mecanismos fisiopatológicos
implicados.
Palabras
claves: Enfermedad
de Graves; Hipertensión pulmonar; Tromboembolismo
pulmonar
Abstract
Patient with Graves-Basedow disease who develops clinical
signs of hyperthyroidism, coagulation and liver disorders, and pulmonary hypertension. The patient gets better
with the treatment for this
disease. Review of potential physiopathological mechanisms involved.
Key
words: Graves disease; Pulmonary hypertension; Pulmonary thromboembolism
Introducción
En
la última reunión de expertos realizada en Niza1 se sugirió como
recomendación retirar a las enÂfermedades tiroideas de la
clasificación de hipertensión arterial pulmonar (HAP) y, por lo
tanto, no considerar a las mismas como parte del grupo 5 (misceláneas)2. Sin embargo, se reconoció
durante la presentación, que hay razones fisiopatológicas que se
podrían aplicar a esta relación, tales como autoinÂmunidad,
disfunción de ventrículo izquierdo, alto o bajo gasto
cardíaco y angio-proliferación, entre
otros mecanismos potencialmente involucrados. Por lo tanto, se planteó
en tono de pregunta, si estaríamos en presencia de un factor de riesgo,
una comorbilidad frecuente o realmente sería una entidad
patológica propia. Propusieron alcanzar siempre, la meta de
normalización de la función tiroidea en este grupo de pacientes y
la reevaluación posterior a la misma. Presentamos un caso asistido en
nuestro hospital con una breve revisión de la literatura.
Caso clínico
Se
trata de una paciente de género femenino de 36 años sin
antecedentes patológicos previos conocidos, que consultó diarreas
de 6 meses de evolución, asociada a pérdida de 5 kg de peso.
Antecedentes médicos: Neumonía e infección urinaria, 6
meses antes. La paciente se encontraba lúcida y orientada en tiempo y
espacio. Sus signos vitales iniciales fueron: TA 110/70 mm Hg; FC 112/m; FR
20/m; SatO2 94%; T 36,2 °C. La glándula
tiroides se encontró aumentada de tamaño, con superficie
irregular y levemente dolorosa. Piel fina y caliente con placas eritematosas,
nodulares y dolorosas, en la cara anterior de la tibia. No presentó
exoftalmos. Los tonos cardíacos fueron hiperfonéticos
y se detectó un soplo holosisÂtólico
mitral con irradiación a axila y cuello. Tenía buena
mecánica respiratoria, sin ruidos agregados. El abdomen era excavado,
blando, depresible e indoloro, con aumento en los
ruidos hidroaéreos. No se detectó hepato-esplenomegalia. La exploración
neurológica demostró asinergia óculo-palpebral y un
temblor fino distal. El examen osteomioarticular fue
normal.
Exámenes
complementarios
Analítica: Hto
24% Hb 7.3 g/dl; Leucocitos 3400/mm3
(N 58; L 30; M10; EO 1; BA 1); Glucemia, uremia y creatininemia, normales. VSG 50 mm; PCR 52 mg/l;
Dímero D 208 ng/ml; TP 70%; Colesterol total
103 mg; Bilirrubina total 33.35 mg, directa 31.39 mg; Indirecta 1.96 mg; GOT 65
UI/l, GPT 39 UI/. PxE: hipergamaglobulinemia
(22.86 g/l).
TSH
<0.005 uUI/l; T3 4.18 ng/l
(vn 2); T4 22.96 ug/l (vn 14.1); T4 libre 3.59 ng/l (vn 1.70); TRAb (anti-receptor de
TSH) 37 ug/l (vn 1.7); Anti
TPO 385.4 (vn 35); CH50 91 UCH; C3 y C4 normales. ANA
+ patrón moteado y nucleolar. Ac Anti DNA –;
Ac Anti músculo liso +; Ac Anti LKM –, Ac Anti mitocondriales –; ANCA –;
IgA aumentada; Anti gliadina
IgA +; IgG –; Anti transglutaminasa –
Serologías
para HIV, hepatitis B y C negativas.
ECG: sinusal,
95/m. Trastorno de repolarización inespecífico.
Ecografía
de tiroides:
glándula aumentada de tamaño, heterogénea con marcado
aumento de la vascularización. No se observaron nódulos.
Centellograma de tiroides: aumento difuso de la
captación
Ecocardiograma
doppler: dilatación biauricular. AD 26 cm2; AI 30 cm2;
FE 75%. VD 44 mm; TAPÂSE 19 mm. CIA tipo ostium secundum. VI de dimensiones y motilidad global normales.
Movimiento paradojal del septum. Insuficiencia mitral y tricuspídea
moderada. Presión sistólica pulmonar 62 mm Hg. VCI dilatada con
disminución del colapso inspiratorio.
Ecocardiograma
transesofágico: CIA con shunt izquierda a derecha. Qp/Qs 0.9
Ecografía
de abdomen y ecodoppler de eje espleno-portal: normal.
VEDA:
reflujo
biliar. Gastropatía no erosiva
RMN
de abdomen:
leve aumento de tamaño hepático. Patrón arrosariado de vía biliar intrahepática
por colangitis. Resto dentro de límites normales.
Estudio
de coagulación: ausencia de Factor V Leiden; Fibrinógeno normal;
Aumento del Factor Von Willebrand; Aumento del Factor
VIII.
AngioTC de tórax: no se observaron
imágenes compatibles con TEP.
Centellograma pulmonar: trastornos de
perfusión periféricos compatibles con micro embolias o trombosis
“in situ”.
Cateterismo
pulmonar derecho (al
mes de tratamiento): PAP 35/14(23) mmHg; PCP 14 mmHg; PAD 9 mmHg; PFDVI 13 mmHg; GC 4.4 l/min; IC 2.9 l/min/m2;
RVP 2 uW. Qp/Qs 1.04. Prueba de sobrecarga de volumen: PSP 49/15(31);
PFDVI 18 mmHg Compatible con HTP poscapilar.
No se deÂtectaron lesiones en le angiograma. No se objetivó shunt. No se observó resalto oximétrico.
Arterias coronarias normales.
Diagnóstico:
Enfermedad
de Graves Basedow (GB). HAP asociada a
hipertiroidismo y trombosis pulmonar “in situ”.
Tratamiento
realizado:
Carbonato de litio 300 mg cada 8 hrs; Propanolol 20
mg cada 8 hrs; Enoxaparina
0,6 cada 12 hrs; Radio-iodo 12 milicuries.
Evolución: Seguimiento
ambulatorio. Refirió mejoría en su estado general,
desaparición de sus síntomas y se constató
normalización de las alteraciones bioquímicas mencionadas
previamente y norÂmalización de la presión pulmonar por
ecocardiograma. No se pudo medir nuevamente el Anti TRAb.
Discusión
Se
trata de una paciente joven con síntomas y signos clínicos de
hipertiroidismo por Graves Basedow. En la
evaluación ecocardiográfica, se
detectó hipertensión pulmonar con sutiles signos de insuficiencia
cardíaca. Se pensó en el hipertiroidismo, las alteraciones
cardiovasculares del GB, una CIA por ostium secundum,
la injuria hepática y en un TEP de vasos pequeños o trombosis
pulmonar “in situ” como mecanismos para explicar la HAP
La
enfermedad de GB3 representa el 60% al 80% de las
causas de hipertiroidismo.Su
incidencia anual se estima en 20 a 50 casos por 100000 habitantes. Aparece entre
los 20 a 50 años y predomina en muÂjeres. Es una enfermedad autoinmune
en la cual el receptor de TSH (TSHR) actúa como autoantígeno.
Su estimulación por anticuerpos TRAb causan
secreción excesiva de hormona tiroidea y síntomas de
hipertiroidismo, estimulando a su vez el aumento de tamaño de la
glándula tiroides y su vascularización. La activación de
los mecanismos de respuesta celular contra el mismo antígeno causa las
manifestacioÂnes tales como la orbitopatía, la
dermopatía y las acropaquias.
La
presentación clínica dependerá de la severidad de la
tirotoxicosis, duración de la enfermedad, susceptibilidad individual y
edad del paciente. La manifestación cardiovascular más
común es la taquiÂcardia sinusal. El aumento
del gasto cardíaco se traduce en signos clínicos. Pueden aparecer
arritmias como la taquicardia supraventricular y la
fibrilación auricular. La HAP es la complicación cardíaca
más común. La prevalencia por ecocardiografía es del 36%
al 65%. La mayoría son casos leves o sus síntomas se confunden.
En
la publicación original del registro REVEAL (EE.UU)4
el 21.6% de los pacientes confirmados con HAP de todos los
grupos, tenían enfermedades de tiroides asociadas. El aumento o la
disminución de las hormonas tiroideas tendrían implicancias
pronosticas5 en pacientes con HAP,
HAP idiopática y post TEP. Incluso la falta de tratamiento con terapia
de reemplazo hormonal sería un factor independiente de riesgo de muerte.
Un análisis del registro Alemán sobre
1756 pacientes, determinó que el hipo o hipertiroidismo no tratado y
medido por los niveles de TSH, fue predictor de mortalidad5.
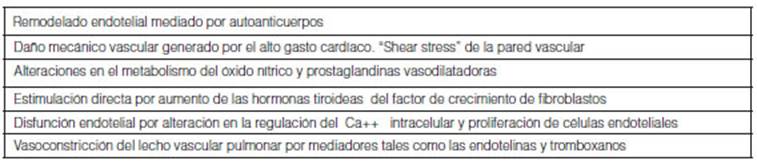
Las alteraÂciones fisiopatológicas descriptas6 a nivel cardiovascular son
variables (Tabla 1).

El
6% de pacientes pueden desarrollar signos de insuficiencia cardíaca,
pero solo el 1% llegará a desaÂrrollar una cardiopatía dilatada.
Los enfermos que desarrollan HAP, pueden debutar con insuficiencia
cardíaca derecha o ser asintomáticos. El 80% de los pacientes
normalizan la presión pulmonar luego de lograr el estado eutiroideo. El tiempo que demora en suceder esto es
variable. Se ha reportado entre 1 a 14 meses después de haber comenzado
el tratamiento.
Hasta
qué punto, la HAP se debe a los cambios hemodinámicos producidos
por las alteraciones en la función del ventrículo izquierdo, o al
estado hiperdinámico o al remodelado de los
vasos pulmonares, es una pregunta difícil de responder.
Varias
teorías tratan de explicar estas relaciones. En el siguiente cuadro se
resumen algunos de los potenciales mecanismos postulados7.
Un
probable mecanismo causal sería de tipo autoinmune. Se ha encontrado
relación lineal entre los anticuerpos estimulantes del receptor de
hormona tiroidea (TRAb) y la presión pulmonar5
lo que induÂciría en forma indirecta un daño inmunomediado
en la pared vascular. La activación de linfocitos T en la pared vascular
como mecanismo inflamatorio llevaría a la activación de
citoquinas, que funcionarían como señales para que los linfocitos
B estimulados, produzcan autoanticuerpos que juegan
en un proceso de daño-reparación y remodelado vascular. Otra
hipótesis, posiblemente complementaria, se refiere al estrés
hemodinámico producido por el hipertiroidismo que incrementa el “shear stress” de los vasos pulmonares llevando a
disfunción endotelial. Las hormonas tiroideas podrían estimular
el musculo liso vascular, su proliferación y alteración de la
funcionalidad endotelial. El tejido tiroideo, tiene receptores de alta y baja
afinidad para prostaciclinas. Potencialmente,
podría inducir proliferación en el musculo liso arterial
(angiogénesis)6. Nuestra paciente presentó por
ecocardiograma, HAP moderada con signos incipientes de fallo cardíaco
(dilatación de VCI con disminución del colapso inspiratorio). Se
descartó que la CIA fuese significativa por ecodoppler
transesofágico y luego por cateterismo. El
descenso de la HAP con el tratamiento del GB confirma este supuesto. El mismo,
que se realizó luego de un mes de tratamiento, confirmó un leve
aumento de la presión pulmonar (PAPm 23 mmHg), resistencia vascular pulmonar normal con
presión de enclavamiento de 14 mmHg., por lo
que se midió la presión de fin de diástole del VI y se
realizó una prueba de sobrecarga hídrica. Ambas fueron
compatibles con disfunción diastólica de VI. Es decir que
confirmamos una HAP de mecanismo poscapilar.
Si
bien las alteraciones del laboratorio hepático podrían ser
secundarias a tirotoxicosis, no son espeÂrables valores tan elevados de
transaminasas, lo que llevó a considerar otro mecanismo
fisiopatológico más allá del hipermetabolismo,
como responsable de la afección hepática8. Surge
así la sospecha de un daño autoinmune compartido. El
hígado y la glándula tiroides pueden ser órganos de choque
de la acÂtividad inmunológica. La afectación hepática no
fue considerada en nuestra paciente como causa de la HAP. La misma ha sido
asociada a las distintas patologías hepáticas: cirrosis
(más común), atresia biliar, obstrucción de vena porta extrahepática, fibrosis portal no cirrótica,
hipertensión portal no cirrótica, Lupus Eritematoso
Sistémico. En su génesis también juegan un papel los
mediadores endoteliales que, en este caso, producen vasoconstricción.
Esta paciente no presentó hipertensión portal ni aumento en la
resistencia vascular pulmonar en el cateterismo realizado. Consideramos como
muy posible, la hiperbilirrubinemia en contexto de
tirotoxicosis, ya que el panel inmunológico de la paciente no fue
concluyente para hepatitis autoinmune, dejando dudas la presencia de una
alteración estructural de la vía biliar, del tipo de la
colangitis biliar primaria.
Se
ha comunicado9-11 que el hipertiroidismo se asocia a un estado de hipercoagulación que favorecería la
formación de trombos y por la tanto incrementaría el riesgo de
enfermedad tromboembólica. Junto al aumento en
los niveles de T4 libre, se ha demostrado un incremento en los niveles de
factor Von Willibrand, inhibidor-1 del activador de plasminógeno tisular y de antitrombina III y
disminución en los niveles del activador de plasminógeno
tisular, acortamiento del tiempo de tromboplastina parcial activada, incremento
en el recambio de factores de coagulación II, VII, IX y X, e incremento
en los niÂveles de homocisteína y
fibrinógeno en plasma. La actividad del factor VIII se encuentra muy
elevada, lo cual tendría correlación directa con el aumento de
las catecolaminas circulantes. Un estudio de base poblacional pudo demostrar
que los pacientes con hipertiroidismo tienen 2.31 veces más riesgo en un
período de 5 años de presentar enfermedad tromboembólica.
La Sociedad Internacional de Hemostasia y Trombosis, lo considera un factor de
riesgo transitorio que incrementa la posibilidad de tromboemÂbolismo
entre 3 a 10 veces. Nuestra paciente tuvo cambios confirmados en sus factores
de coagulación y se pudo demostrar por centellograma
de pulmón la presencia de trombos subsegmentarios,
situación que agravó la HAP y que mejoró al normalizar la
función tiroidea y prevenir la recurrencia del cuadro con la
anticoagulación.
Conclusiones
Las
enfermedades de tiroides son muy comunes en la población general. Hasta
que se puedan definir mecanismos propios, los expertos mundiales en HAP
reunidos en Niza, en la última revisión de 2018, han recomendado
considerar estas entidades como comórbidas o
factores agravantes que no se deben incluir dentro de la clasificación
internacional de HAP.
Presentamos
y discutimos una paciente joven, con hipertensión pulmonar, que
podría ser atribuida al efecto de las hormonas tiroideas aumentadas por
la enfermedad de Graves, un tromboembolismo de
pulmón de vasos pequeños confirmado por centellograma
pulmonar, sumado a una disfunción diastólica cardíaca como
lo destacó el cateterismo derecho realizado.
Sugerimos
prestar especial atención a la asociación de los trastornos
tiroideos con afecciones hepáÂticas, de la vía biliar y
alteraciones laboratoriales inespecíficas que
obedecen a múltiples mecanismos fisiopatológicos.
Consideramos
que la evolución de la hipertensión pulmonar en esta paciente con
mejoría luego de normalizar la función tiroidea, apoyaría
la postura de que se trata de un factor de riesgo y una comorÂbilidad tratable
más que una entidad nosológica propia.
Conflicto
de intereses: Los
autores declaran no presentar conflictos de interés.
Bibliografía
1.
Simonneau G, Montani D, Celermajer
DS, et al. Haemodynamic definitions
and updated clinical classification of pulmonary hypertension. Eur Respir J 2019; 53: 1801913.
2.
Li JH, Safford RE, Aduen
JF, Heckman MG, Crook JE,
Burger CD. Pulmonary hypertension
and thyroid disease. Chest 2007;132(3):793–7.
3.
Smith TJ, Hegedüs L. Graves’ Disease.
N Engl J Med 2016; 375:
1552-65.
4.
Badesch D, Raskob G, Elliott CG, Krichman A, et al.
Pulmonary arterial hypertension. Baseline
Characteristics From the REVEAL Registry. Chest 2010; 137(2): 376-87.
5.
Richter M, Sommer N, Schermuly
R, Grimminger B, Seeger W,
Tello K, Ghofrani H,Gall H. The prognostic impact of thyroid function in pulmonary hypertension J Heart Lung Transplant
2016; 35: 1427-34.
6.
Sugiura T, Yamanaka S, Takeuchi H, Morimoto N,Kamioka M,Matsumura
Y. Autoimmunity and pulmonary
hypertension in patients with Graves’disease. Heart Vessel 2015;30:642–46
7.
Scicchitano P, Dentamaro I,
Tunzi F, Ricci G, Carbonara S, Devito
F, Zito A, Ciampolillo A, Ciccone M. Pulmonary hypertenÂsion in thyroid disease. Endocrine 2016; 54:
578-87
8.
Parodi R y col. Asociación entre hipertiroidismo y patología
hepática. GlándTirParatir 2008; 17:
28-33.
9.
Stuijver DJ, van Zaane B, Romualdi E, Brandjes DP, Gerdes VE, Squizzato A. The effect of hyperthyroidism
on procoagulant, anticoagulant and fibrinolytic factors: a systematic review and meta-analysis. Thromb Haemost 2012; 108:
1077-88.
10.
Elbers LPB, Fliers E, Cannegieter SC. The influence of thyroid function on the
coagulation system and its clinical conseÂquences.
J Thromb Haemost 2018; 16:
1-12.
11.
Lin HC, Yang LY, Kang JH. Increased risk
of pulmonary embolism among patients with hyperthyroidism: A five-year follow-up study. J Thromb Haemost 2010; 8: 2176-81.