Autor : Dra. Nadia M. Figueroa1 Dr. Alberto A. Marangoni1
1 Sanatorio Allende. Servicio de Diagnóstico por Imágenes. Córdoba. Argentina
Correspondencia :finami15@gmail.com. Nadia M. Figueroa
Resumen
IntroducciĂłn: Inspirado en el sistema BI-RADS
(Breast Imaging Reporting), el American College of Radiology (ACR) desarrollĂł
el sistema Lung-RADS, con la intenciĂłn de realizar informes estandarizados
sobre los nĂłdulos pulmonares detectados en el En Argentina y en muchos lugares
del mundo, no se realiza el Lung Cancer Screening (LCS) debido a los altos
costos; sin embargo, en las TC de tĂłrax los hallazgos incidentales de nĂłdulos
pulmonares, es frecuente. Para evaluarlos, existen diversos sistemas basados en
caracteÂrĂsticas que permiten establecer un seguimiento. Entre ellos, GuĂa
Fleischner, British Thoracic Society Guidelines y Lung-RADS, siendo este Ăşltimo
el Ăşnico que posee una categorizaciĂłn numĂ©rica. En este artĂculo se estudia la
utilidad del Lung-RADS, como método de diagnóstico y seguimiento en la clasificación
de los nĂłdulos pulmonares.
Objetivo: EvaluaciĂłn del nĂłdulo pulmonar diagnosticado
en la TC de TĂłrax, mediante el uso del Lung-RADS para determinar su valor
clĂnico, comparando la correlaciĂłn entre esta clasificaciĂłn y la malignidad o
benignidad en el examen histopatolĂłgico.
Material y MĂ©todo:
Estudio descriptivo,
estadĂstico, observacional, retrospectivo y prospectivo.Se estudiaron un total
de 100 pacientes adultos, de ambos sexos, con diagnĂłstico de nĂłdulo pulmonar,
comprendidos entre Enero del año 2017 hasta Diciembre del 2019, de los cuales se
excluyeron aquellos que no tuvieron un seguimiento. Estudio tomográfico
realizado en tomĂłgrafo de 128 hileras de detectores. Las variables estudiadas
incluyeron: sexo y edad de los pacientes, tamaño y densidad del nódulo,
malignidad de la lesiĂłn en el estudio anatomopatolĂłgico, categorĂa del
Lung-RADS y terapéutica realizada y sugerida. Para el análisis descriptivo, se
utilizaron frecuencias relativas (porcentajes) y absolutas (nĂşmero de casos)
para las variables cualitativas; y para las variables cuantitativas se utilizĂł
media y desvĂo estándar, y rango de valores mĂnimomáximo. Para las pruebas de
hipĂłtesis, se realizaron pruebas de Chi cuadrado para las variables
cualitativas. Para las variables cuantitativas se realizaron, en primer lugar,
pruebas de Shapiro Wilks y de Kolmogorov.
Resultados: En 100 pacientes en los que se aplicĂł
el Lung-RADS para determinar seguimiento y tratamiento, se identificaron
diferentes tipos de escenarios tanto en el comportamiento como en el
seguimiento de los mismos, algunos con necesidad de recategorizaciĂłn y cambios
en conducta diagnĂłstica y tratamiento. En cuanto al análisis estadĂstico se
analizĂł la asociaciĂłn entre la ClasificaciĂłn Lung- RADS obtenida y la presencia
o ausencia de malignidad en el examen anatomopatolĂłgico obteniendo resultados
estadĂsticamente significativos (p-valor <0,0001) para esta asociaciĂłn.
DiscusiĂłn: Actualmente se utiliza en sistema
Lung-RADS y las guĂas de recomendaciones de los nĂłdulos pulmonares de la
Sociedad Fleischner. Ambas tienen criterios similares y se basan en la sospecha
morfolĂłgica de malignidad, que incluye la densidad del nĂłdulo (sĂłlido,
parcialmente sólido o en vidrio esmerilado), tamaño y, cuando está disponible,
el crecimiento o evoluciĂłn, que se aplican en distintos grupos de pacientes. La
determinaciĂłn del puntaje Lung-RADS ha demostrado su utilidad en este estudio,
dada la correlaciĂłn patolĂłgica del nĂłdulo, con resultado estadĂsticamente
aceptable y buena correlaciĂłn con la decisiĂłn de seguimiento y tratamiento.
ConclusiĂłn: La aplicaciĂłn del sistema Lung-RADS en
serie ha demostrado un buen manejo de seguimiento de los mismos posibilitando,
en algunos casos, la realizaciĂłn de resecciones quirĂşrgicas y, en otros, una
conducta expectante con cierta seguridad evitando, en muchas oportunidades, la
adopciĂłn de tratamientos agresivos innecesarios.
Palabras clave:
NĂłdulo, Lung-RADS, TC, Conducta
Recibido: 13/01/2021
Aceptado: 09/07/2021
IntroducciĂłn
Precisamente,
en Argentina, aún no se realiza el SCP, pero está al alcance de los pacientes y
del profesional de salud la realizaciĂłn de CT de tĂłrax, con hallazgos
frecuentes de nĂłdulos pulmonares de manera incidental. Para estos casos se
utilizan varias guĂas como las de la Fleischner Society y las de la British
Thoracic Society, que comparten criterios de seguimiento y tratamiento con el
Lung-RADS, siendo esta última la única con una escala numérica de
clasificaciĂłn.
Teniendo
en cuenta las guĂas disponibles, en este estudio se evalĂşa la utilidad del
sistema Lung- RADS (Figura N° 1) utilizándolo como método de seguimiento
(teniendo en cuenta que aporta el valor numérico en base a los hallazgos en las
imágenes), para la clasificaciĂłn de los nĂłdulos pulmonares y para poder asĂ
aplicar un esquema de seguimiento para los pacientes con estos nĂłdulos.
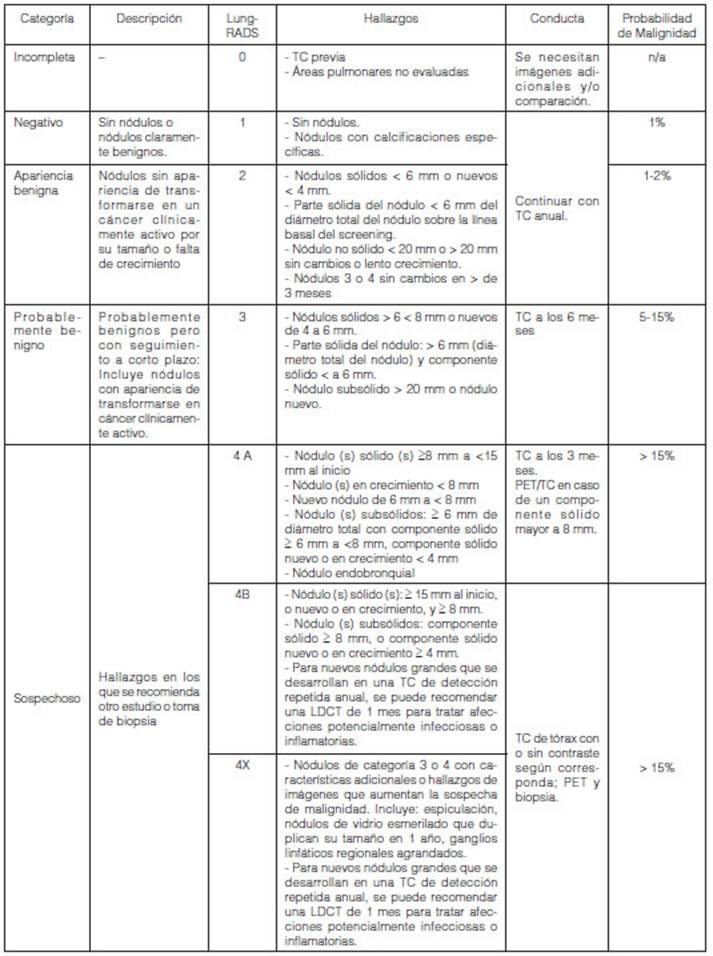
En
base a este Sistema y a las recomendaciones de la literatura en general, se
evalĂşan en este trabajo en forma retrospectiva y prospectiva, a los pacientes
con hallazgo de nĂłdulo pulmonar solitario (NPS) aplicando el sistema Lung-RADS,
para determinar si esta forma de clasificaciĂłn del nĂłdulo puede deÂterminar una
conducta especĂfica, expectante o quirĂşrgica, para considerar su valor real.
Objetivo
HipĂłtesis de trabajo
El
uso del sistema Lung-RADS aplicado al análisis de un nódulo pulmonar, determina
la probabilidad de malignidad de la lesiĂłn, aportando datos para tomar
conductas expectantes, de vigilancia activa y/o terapéuticas.
Materiales y métodos
Estudio
descriptivo, estadĂstico, observacional, retrospectivo y prospectivo.
La
American College of Radiology (ACR) desarrollĂł el Lung-RADS utilizando la
TomografĂa ComÂputada (TC) para el tamizaje del Cáncer de PulmĂłn (SCP), cuyos
criterios establecidos dependen de diferentes organizaciones, entre ellas: ACS
(American Cancer Society), ACCP (American College of Chest Physicians), ALA
(American Lung Association), ASCO (American Society of Clinical Oncology), ATS
(American Thoracic Society) y Centers for Medicare and Medicaid Services,
teniendo como factor común la edad (mayor o igual a 55 años) y el antecedente
de tabaquismo (si es actual, mayor o igual a 30 paquetes/años, o que hubiesen
dejado el hábito 15 años antes o menos).
Criterios
de inclusiĂłn: Se seleccionaron 100 pacientes adultos con diagnĂłstico de nĂłdulo
pulmonar solitario, detectados mediante TC de tĂłrax, a partir de la base de
datos del Servicio de Diagnóstico por Imágenes.
Criterios
de exclusiĂłn: pacientes pediátricos, pacientes con Lung-RADS 0 y 1, como asĂ
también los pacientes con neoplasias ya conocidas.
Para el estudio tomográfico torácico,
se utilizó un tomógrafo multicorte de 128 filas de detectores, GE®, modelo Optima 660. El
examen fue realizado con o sin inyecciĂłn de contraste en forma indistinta,
utilizando adquisición volumétrica multicorte y reconstrucción de 0,63 mm de
espesor, cada 5 mm en planos axial, sagital y coronal para el sistema de alta resoluciĂłn,
en apnea inspiratoria y completando con cortes no continuos en espiraciĂłn
sostenida y, para la adquisiciĂłn convencional, un espesor de 3,75/4 mm, cada 4
mm. También se efectuaron y analizaron las reconstrucciones MIP (Máxima
Intensidad de ProyecciĂłn) y MInip (MĂnima Intensidad de ProyecciĂłn)
densitométrica. Los parámetros de los estudios de TC, fueron: exploración
helicoidal; tiempo de rotaciĂłn del tubo de 0,6 seg.; longitud de exploraciĂłn
full; con 120 Kv; de 100 a 500 mAs determinado automáticamente; 1,375:1 de
pitch; 40 mm de cobertura del detector; un porcentaje de reducción automática y
variable de dosis, en un promedio de 20% y con un DLP (Producto Dosis-Longitud)
promedio de 900 a 1300 mGy (dependiendo del espesor y altura del paciente -por la
dosificación automática del equipo-), con un tiempo de barrido de 9 segundos
para la secuencia. Para los estudios de baja dosis, se aplicaron 120 Kv y de 18
a 200 mAs (porcentaje de reÂducciĂłn de dosis de entre 40 y 50%), con un tiempo
de barrido de 7 segundos y determinando un DLP promedio de 500 a 700 mGy. (DLP:
[mGy ∗cm]
= CTDIvol [mGy] ∗ Largo escáner [14 cm]).
Para el Estudio HistopatolĂłgico, se
realizaron tinciones con hematoxilina y eosina para el anáÂlisis. En los casos
en los que se necesitĂł InmunomarcaciĂłn se utilizaron anticuerpos especĂficos
para cada estirpe tumoral, dependiendo del resultado obtenido en el estudio
histopatolĂłgico realizado en primera instancia.
Las cirugĂas indicadas para
el tratamiento fueron en su mayorĂa lobectomĂas y la tĂ©cnica quirĂşrgica
utilizada fue convencional o videoasistida, dependiendo del requerimiento de
cada caso en particular.
Procedimiento diagnĂłstico:
Los datos fueron obtenidos de los registros de pacientes que se realiÂzaron TC
de tórax desde el año 2017. Se realizó una revisión de las TC de Tórax y se
evaluaron aquellas con nĂłdulos pulmonares, realizando la mediciĂłn de los
diámetros de los mismos en la ventana pulmonar (siguiendo a las recomendaciones
vigentes de las GuĂas Fleischner), obteniendo un diámetro promedio entre el eje
largo y el eje corto del mismo, incluyendo decimales, midiéndose en caso de
múltiples nódulos, solo el más sospechoso. El aumento de tamaño se consideró
con un aumento mayor o igual a 1,5 mm.
Se excluyeron los pacientes con Lung-RADS 1 (que abarca a los
granulomas y a los hamartomas) como asà también los pacientes con procesos
neoplásicos ya conocidos.
Las variables estudiadas incluyeron: sexo y edad de los pacientes,
tamaño y densidad del nódulo, la malignidad de la lesión en el estudio
anatomopatolĂłgico, la categorĂa del Lung-RADS y la terapĂ©utica realizada y
sugerida, conducta expectante o quirĂşrgica y determinando si la enfermedad
estaba avanzada o no al momento del diagnĂłstico. Se considerĂł un estadio
avanzado cuando se identificĂł infiltraciĂłn local, de estructuras vecinas
(pleura, pericardio, bronquios centrales), corazĂłn y/o grandes vasos, Ăłseo; y/o
extensión a distancia (metástasis en órganos extrapulmonares o en el pulmón
contralateral).
Se obtuvieron datos de los pacientes en forma retrospectiva para
favorecer un estudio más preciso y efectivo, además de los pacientes que se
evaluaron en forma prospectiva en aquellos pacientes que se examinaron a partir
de enero del año 2018. Destacamos en este punto que en la Argentina no se
realiza el LCS. Por lo tanto, los nĂłdulos pulmonares categorizados fueron
analizados en base a los hallazgos obtenidos en la imágenes en razón de un
hallazgo incidental o por estudio pulmonar por sĂntomas clĂÂnicos y no mediante
el cribado, por lo tanto no se tuvo en cuenta el tabaquismo como variable,
debido que el objetivo es valorar puramente el score, sin datos adicionales.
Los pacientes que fueron evaluados en forma prospectiva, en
algunos casos, necesitaron de una recaÂtegorizaciĂłn del Lung RADS en los
controles de seguimiento. Para el análisis estadĂstico fue utilizada esta
última recategorización. La descripción de éstos se especifica más adelante.
Por otro lado, los pacientes que luego de controles periĂłdicos se
mantuvieron estables fueron reÂcategorizados a Lung-RADS 2, por lo que se
continuĂł el seguimiento anual, sin signos de malignidad hasta la fecha.
Los nĂłdulos pulmonares categorizados fueron analizados en base a
los hallazgos visualizados en la TC de tĂłrax en todos los pacientes adultos,
sin discriminaciĂłn entre tabaquistas y no tabaquistas, ni de sexo ni de edad,
pero comprendiendo a pacientes mayores de 18 años. Se utilizó el sistema
Lung-RADS para el análisis, la categorización y la decisión de conductas de
seguimiento de los pacientes con nĂłdulos pulmonares detectados mediante TC.
Análisis EstadĂstico: Para
el análisis descriptivo se utilizaron frecuencias relativas (porcentuaÂles) y
absolutas (nĂşmero de casos) para las variables cualitativas; y para las
variables cuantitativas se utilizĂł media y desvĂo estándar, y rango de valores
mĂnimo-máximo. Para las pruebas de hipĂłtesis, se realizaron pruebas de Chi
Cuadrado para las variables cualitativas. Para las variables cuantitativas se
realizaron, en primer lugar, pruebas de Shapiro Wilks y de Kolmogorov para
analizar la distribuciĂłn de las variables. Luego, se realizaron pruebas de
Wilcoxon para observar las diferencias entre grupos. El valor P < 0,05 fue
considerado estadĂsticamente significativo.
Se utilizaron Excel e Infostat profesional versiĂłn 2019, como
software para el análisis de los datos.
Resultados
El tamaño promedio de los nódulos fue de 23,97 ± 16,61 mm, con un
diámetro mĂnimo de 5 mm y máximo de 80 mm.
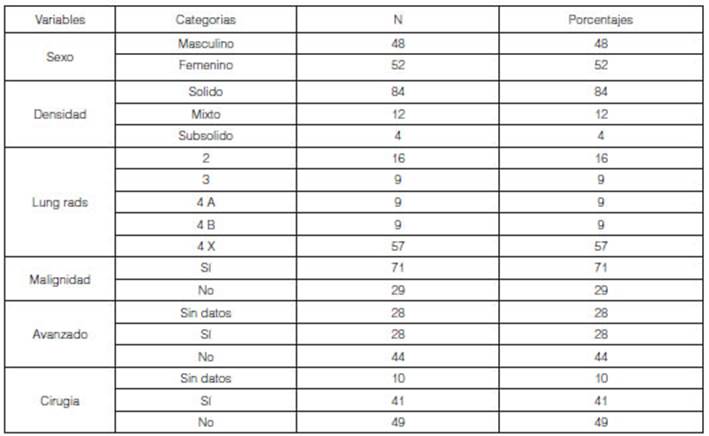
En el total de casos estudiados (n = 100) se encontraron 84 casos
(84%) en donde los pacientes presenÂtaron tumores sĂłlidos. El 57% del total de
pacientes (n = 57) tuvieron una clasificaciĂłn de Lung-RADS 4X; y el 71% de la
poblaciĂłn estudiada presentĂł tumores malignos (n = 71). Con respecto al estado
de avance de los tumores, el 44% del total de pacientes no presentaban un
estado avanzado (n = 44). Recurrieron a cirugĂa 41 pacientes.
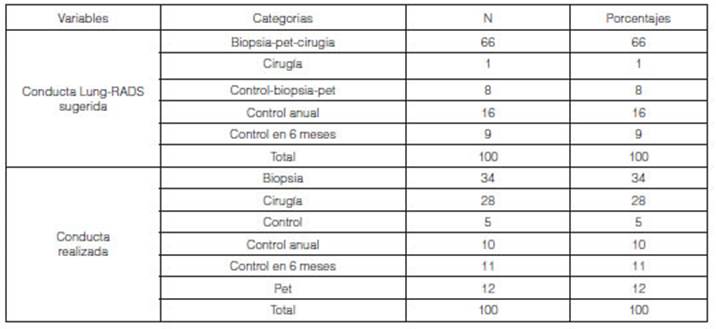
El análisis entre la conducta sugerida por el Lung-RADS y la conducta
final adoptada para el diagÂnĂłstico y/o tratamiento, analizando el total de la
muestra (n = 100) ha demostrado que en el 66% de los casos (n = 66) la conducta
Lung-RADS indicĂł la realizaciĂłn de una biopsia, o efectuar un estudio PET, o
indicar cirugĂa; mientras que en el 16% de los casos (n = 16), sugiriĂł un
control anual. Al analizar la conducta realizada, abarcando a todos los
pacientes, en el 34% de los casos (n = 34) se solicitĂł biopsia y en el 28% de
los casos (n = 28) se solicitĂł cirugĂa.
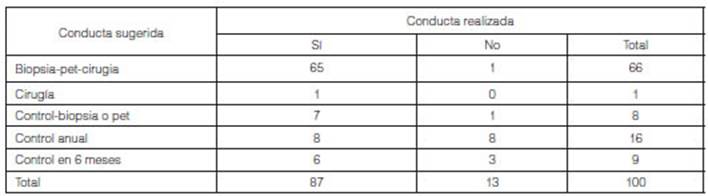
En base a las conductas adoptadas, se analizĂł si esta tuvo
concordancia con la conducta sugerida por el Lung-RADS (Tabla 3). De los
100 pacientes, en 87 la conducta realizada fue acorde al Lung-RADS sugerido
(87%). Los resultados fueron estadĂsticamente significativos (p-valor
<0,001).
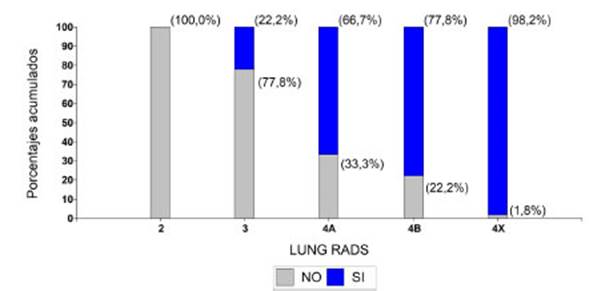
Luego, se analizĂł la asociaciĂłn entre la ClasificaciĂłn Lung-RADS
obtenida y la presencia o ausencia de malignidad en el examen anatomo-patolĂłgico
(Gráfico 1). El 100% de los casos clasificados como Lung-RADS 2 no
presentaron malignidad y este porcentaje fue disminuyendo a medida que la
graduaciĂłn de la ClasificaciĂłn de Lung-RADS aumentaba. En Lung-RADS 3, solo el
22,2% presentĂł malignidad; en Lung-RADS 4A, este porcentaje aumentĂł al 66,7%; y
ascendiĂł al 77,8% en los pacientes con Lung-RADS 4B. En los pacientes con
Lung-RADS 4X, el 98,2% de los casos presentaron malignidad. Los resultados de
esta asociaciĂłn, fueron estadĂsticamente significativos (p-valor < 0,0001).
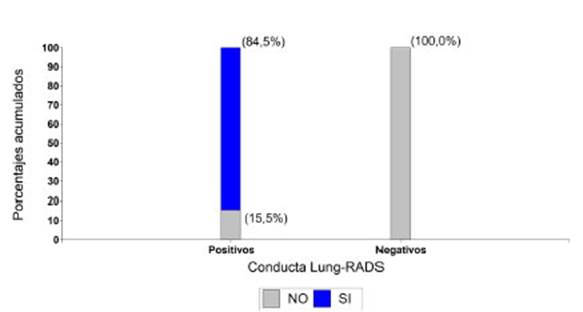
Para un mejor análisis estadĂstico, la clasificaciĂłn de Lung-RADS
se redujo a dos grupos: casos poÂsitivos y casos negativos. Los casos
considerados como negativos fueron los pacientes con Lung-RADS 2 (n = 16); y
los casos positivos fueron pacientes con Lung-RADS 3 y 4 (n = 84). Con esta
forma de agruparlos, se analizó la asociación con la malignidad del tumor (Gráfico
2) y se observĂł que ninguno de los pacientes que tuvieron Lung-RADS
negativos presentaron tumores con malignidad en la histopaÂtologĂa. En los
pacientes que tuvieron Lung-RADS positivos, hubo un 15,5% (n = 13) de casos en
los que los tumores no fueron malignos. Esta asociaciĂłn fue estadĂsticamente
significativa (p-valor < 0,0001).
A partir de este análisis, se calcularon los valores predictivos
del estudio realizado y la sensibilidad/ especificidad del mismo. El valor
predictivo positivo (VPP) de la poblaciĂłn estudiada fue de 100%, es decir que
todas las personas que tuvieron un resultado maligno en el estudio
histopatolĂłgico fueron categorizados como Lung-RADS 3 o 4.
El valor predictivo negativo (VPN) de la poblaciĂłn estudiada fue
de 55,2%, es decir que de todos los pacientes que tuvieron resultado
histopatolĂłgico benigno (100%: n = 29) , el 55,2% (n = 16) fueron categorizados
como Lung-RADS 2.
La sensibilidad del estudio fue del 84,6%, y la especificidad fue
del 100%. Es decir que, realizando estos estudios, la probabilidad de que un
nĂłdulo Lung-RADS 3 Ăł 4 tenga un resultado positivo (tumor maligno) es de un
84,6%; mientras que la posibilidad de que nĂłdulo Lung-RADS 2 tenga un resultado
negativo (tumor benigno) fue del 100%.
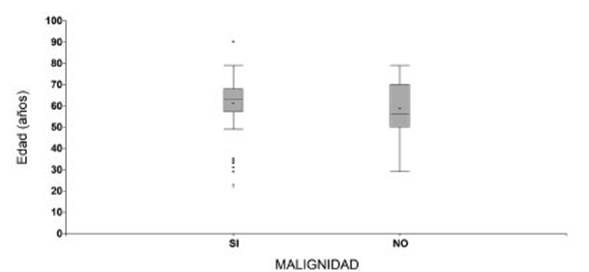
Se analizó también si la edad de los pacientes se asociaba con la
malignidad del tumor (Gráfico 3). En este caso, la edad promedio
observada en cada grupo fue similar y las diferencias no fueron estadĂsÂticamente
significativas (p-valor: 0,1963). En el grupo de pacientes con malignidad, la
edad promedio fue de 61 ± 14 años, mientras que en el grupo que no presentaron
malignidad este promedio fue de 59 ± 13 años.
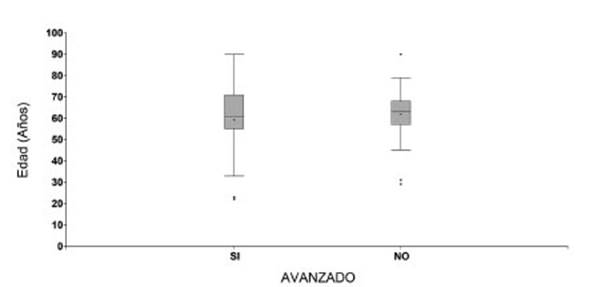
El mismo análisis se realizĂł para observar si existĂa relaciĂłn con
el estado avanzado o no que preÂsentaban los pacientes y su edad. Los pacientes
con estado avanzado tuvieron un promedio de edad de 59 ± 17 años, mientras que
los que no tuvieron estado avanzado tenĂan en promedio 62 ± 12 años. Las diferencias
observadas no fueron estadĂsticamente significativas (p-valor: 0,7374) (Gráfico
4).
En los pacientes que tuvieron tumores con malignidad, se observĂł
si existĂa asociaciĂłn entre el hecho que estuviese avanzado o no y la
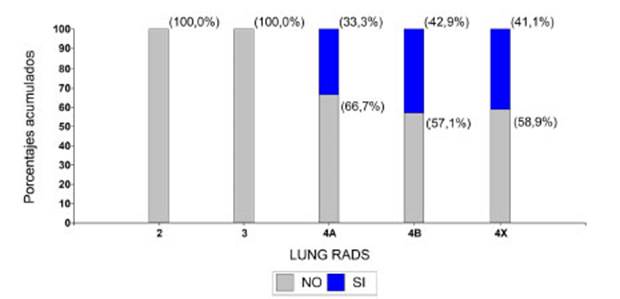
clasificación obtenida de Lung-RADS (Gráfico 5). En los pacientes con
clasificaciĂłn Lung-RADS 3 no hubo casos avanzados. En los pacientes con
Lung-RADS 4A se observaron dos casos (que representĂł un 33,3% de los pacientes
de ese grupo). En los pacientes con Lung-RADS 4B y 4X los porcentajes de casos
avanzados fueron similares: 42,9% y 41,1% respectivamente. Los resultados no
fueron estadĂsticamente significativos (p-valor: 0,7090).
Por Ăşltimo, se analizĂł si existĂa asociaciĂłn entre el hecho que
estuviese avanzado o no y la clasificaÂciĂłn obtenida de Lung-RADS en pacientes
con tumores malignos; según cuál fue la densidad obtenida en los estudios. En
los pacientes con tumores malignos solo se observaron casos de densidad sĂłlida
y mixta (Tabla 4).
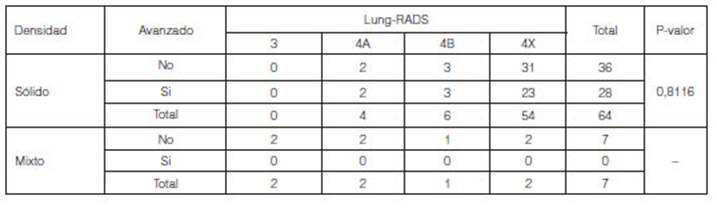
En los pacientes con densidad sĂłlida las diferencias observadas no
fueron estadĂsticamente signifiÂcativas entre casos avanzados y casos no
avanzados (p-valor: 0,8116).
Los pacientes con Lung-RADS 4A con tumores avanzados representaron
el 50% de ese grupo (n = 2), mientras que en los pacientes con Lung-RADS 4B y
4X este porcentaje fue de 50% (n = 3) y 42,6% (n = 23) respectivamente.
En el estudio descriptivo, se observaron casos en los que, tras
realizar controles, fue necesaria la recategorizaciĂłn del Lung RADS, y con ello
el cambio de conducta diagnóstica/terapéutica al respecto.
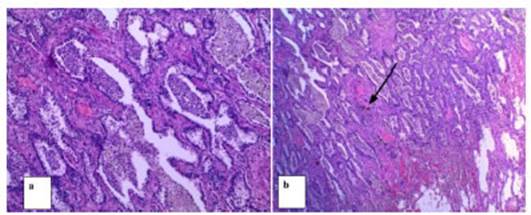
Entre ellos, uno de los pacientes de categorĂa Lung RADS 2,
presentó recategorización a 4A, por aumento de tamaño y cambio de la densidad
de la lesiĂłn, con posterior cirugĂa y diagnĂłstico de adenoÂcarcinoma pulmonar.
Se continuaron los seguimientos con estudios tomográficos anuales.
Otro paciente con nódulo pulmonar, también categorizado como Lung
RADS 2 en primera instanÂcia, presentĂł un nĂłdulo sub-sĂłlido que se mantuvo
estable durante 4 años (en este caso se realizó una revisión de los estudios
tomográficos previos), identificándose un crecimiento transcurrido ese tiempo.
Fue tratado con cirugĂa y el diagnĂłstico definitivo fue Adenocarcinoma de
Crecimiento LepĂdico.
Por otro lado, también algunos pacientes fueron categorizados en
primera instancia como Lung-RADS 3, con necesidad de recategorizaciĂłn a
Lung-RADS 4 por su crecimiento, observado en 2 pacientes, con posterior cirugĂa
y diagnóstico de cáncer de pulmón en ambos.
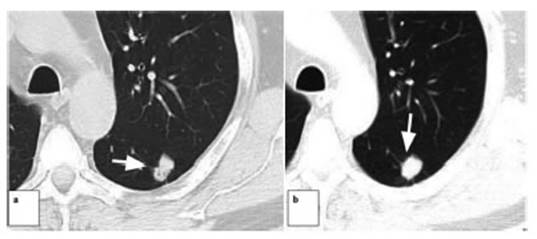
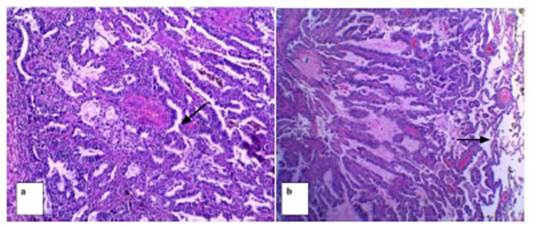
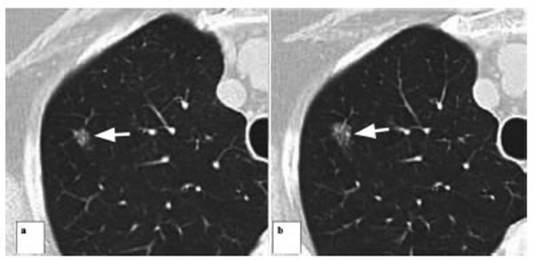
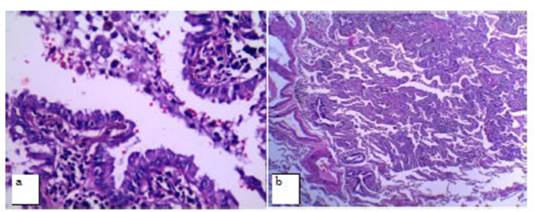
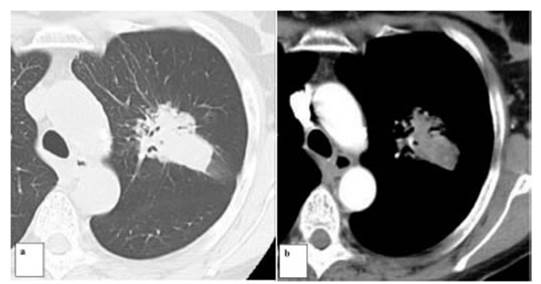
A uno de los pacientes, que presentĂł un nĂłdulo sub-sĂłlido con un
componente sólido central menor de 6 mm de diámetro, categorizado como Lung
RADS 4A, se le efectuĂł una biopsia percutánea bajo guĂa tomográfica, con
diagnĂłstico histopatolĂłgico de HAA (Hiperplasia Adenomatosa AtĂpica). Se
realizĂł control a los 6 meses con estabilidad de la lesiĂłn, por lo que se
mantiene en controles periĂłdicos por TCy fue recategorizado como Lung RADS 3.
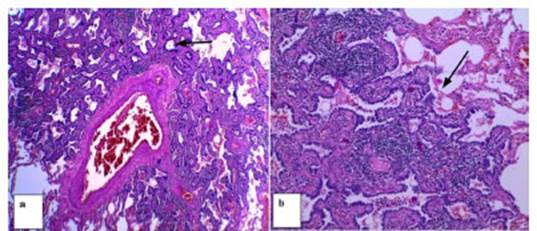
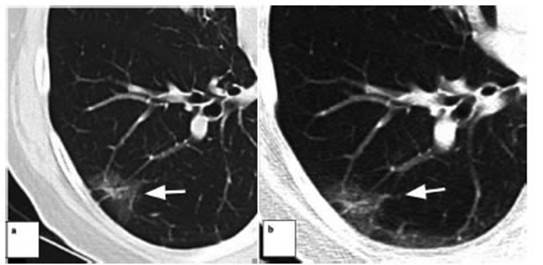
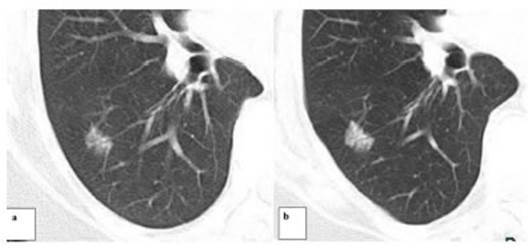
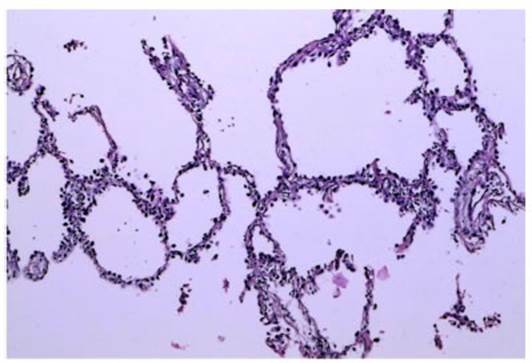
A otro de los pacientes categorizados como Lung RADS 4X se le
realizĂł biopsia percutánea con guĂa tomográfica, que tuvo un diagnĂłstico de
Alveolitis Granulomatosa por Hipersensibilidad.
DiscusiĂłn
La evaluaciĂłn de los nĂłdulos pulmonares ha tenido una importante
evolución en los últimos años, con el objetivo de reducir la morbimortalidad,
buscar la detección oportuna y temprana del cáncer de pulmón y el tratamiento
adecuado en cada caso en particular3.
Desde hace mucho tiempo se evalĂşan las caracÂterĂsticas de estos nĂłdulos,
buscando respuestas para el manejo Ăłptimo del nĂłdulo pulmonar4,
teniendo en cuenta el tamaño, los bordes y el rendimiento de métodos
especĂficos para tal fin. El primer avance destacado en el área, corresponde al
NTLS (The National Lung Screening Trial), que fue el primer estudio
multicéntrico randomizado que comparó el cribado de cáncer de pulmón en la Rx de
TĂłrax con la TomografĂa Computada de baja dosis, demostrando la posibilidad de
detectar el cáncer de pulmón en estadios más tempranos4,
obteniendo una buena sobrevida de los pacientes con resecciĂłn quirĂşrgica en estos
casos (Ăndice de supervivencia del 70% a 5 años). A partir de este estudio, se
crearon diversas escalas para la clasificaciĂłn de nĂłdulos pulmonares para
evitar excesos tanto de tratamientos y procediÂmientos invasivos, como de
radiaciĂłn de los pacientes. Actualmente, se utiliza ampliamente el sistema
Lung-RADS, las guĂas de recomendaciones de los nĂłdulos pulmonares de la
Sociedad Fleischner y las de la British Thoracic Society para el seguimiento de
nĂłdulos pulmonares5.
Todas ellas tienen criterios similares y se basan en la sospecha morfolĂłgica de
malignidad, que incluyen la densidad del nĂłdulo (sĂłlido, parcialmente sĂłlido o
en vidrio esmerilado), tamaño y, cuando está disponible, el crecimiento o
evoluciĂłn, que se aplican en distintos grupos de pacientes.
Por otro lado, estas recomendaciones aclaran el panorama ante el
hallazgo de un nĂłdulo pulmonar, para que el profesional pueda brindar una
informaciĂłn especĂfica y concisa al paciente, reduciendo tambiĂ©n factores
psicosociales negativos6.
En este punto debemos aclarar que, si bien el tabaquismo es un
factor predisponente importante en la detección del cáncer de pulmón, en este
estudio prescindimos del mismo dado que el fin fue valorar el score sin datos
adicionales.
Asimismo, las diferentes guĂas poseen algunos puntos prácticos que
tambiĂ©n comparten, para una clasificaciĂłn más especĂfica. Entre ellas, el
nĂłdulo debe ser medido en la ventana pulmonar, con cortes de 1,5 mm de espesor
y obteniendo un promedio de tamaño en caso de que la morfologĂa sea irregular7.
El sistema Lung-RADS8 es actualmente aplicable para
el cribado del cáncer de pulmón, sigue el formato de la clasificación del
cáncer de mama y convierte los datos continuos en informaciĂłn cateÂgorizada
segĂşn la gradaciĂłn sistemática de los nĂłdulos en 4 categorĂas básicas,
determinadas por la sospecha morfológica de malignidad, basándose en el nódulo
más sospechoso en caso de existir más de uno9.
Además, el sistema Lung-RADS posee guĂas de recomendaciĂłn para el seguimiento
de los casos particulares en los cuales los pacientes no puedan ser
categorizados de manera especĂficas por poseer escenarios ambiguos10; sin embargo, esos
escenarios no fueron planteados en los casos incluidos en este estudio, debido
a que se han usado estas guĂas pero fuera de un programa de screening.
En Argentina no se han publicado datos de screening reales para la
detecciĂłn de nĂłdulos en forma temprana y no se lo utiliza habitualmente dentro
de los estudios de rutina. De todas formas, dado que la incidencia y detecciĂłn
accidental de nĂłdulos pulmonares en estudios de rutina es muy alta, se aplicĂł
el sistema Lung-RADS en los pacientes de esta serie para el estudio de los
nĂłdulos pulmonares que se hubieren descubierto por otras causas o en la
bĂşsqueda individual de patologĂa tumoral dado que, por el hecho de contar con
una escala numérica, brinda una practicidad de clasificación mayor que las
otras guĂas disponibles con el mismo fin, permitiendo un mejor diálogo y
comprensiĂłn entre los diferentes profesionales involucrados en el manejo del
nĂłdulo pulmonar.
Dentro de lo establecido en las guĂas, los nĂłdulos sĂłlidos de
pequeño tamaño o que estĂ©n asociados a un componente lipĂdico o con
calcificaciones centrales o tipo “pop-corn” (Lung-RADS 1) suelen ser hamartomas
o granulomas, los cuales se mantienen estables. En este estudio, se excluyeron
los pacientes con categorĂa Lung RADS 1, pero se han incluido los pacientes
Lung RADS 2, o sea, nódulos de tamaño pequeño (mayores de 4 mm). Entre los
nĂłdulos estudiados de esta serie de pacientes (categorizados como Lung-RADS 2),
existiĂł una excepciĂłn debido a la necesidad de recategorizaciĂłn y el hallazgo
final de malignidad, dado que por su crecimiento y cambio morfolĂłgico, se
realizĂł punciĂłn biopsia percutánea con posterior cirugĂa que arrojĂł como
resultado el diagnĂłstico final de Adenocarcinoma. Entonces, a pesar de la
estadificaciĂłn inicial no preocupante desde el punto de vista clĂnico, es
necesario y muy imÂportante realizar los controles indicados por las guĂas
actualmente disponibles, en los lapsos previstos por las mismas, ante la
eventualidad de un falso negativo de los Lung-RADS 2.
En efecto, muchos de los casos necesitaron ser recategorizados en
los posteriores controles. Un estuÂdio realizado en el Centro Hospitalario
Nacional de Cáncer de Pulmón, en Tokyo, Japón, describe que los nódulos
sub-sĂłlidos, menores de 5 mm y con patrĂłn de vidrio esmerilado puro, suelen ser
lesiones correspondientes a Hiperplasia Adenomatosa AtĂpica (HAA) en su mayorĂa11. SegĂşn las guĂas de
anaÂtomĂa patolĂłgica, Ă©stos representan una lesiĂłn precursora del
adenocarcinoma, debido a que se trata de una proliferaciĂłn atĂpica menores de
0,5 mm de células cuboides, a lo largo de los alvéolos y en un gran número de
casos han sido visualizados en asociaciĂłn con piezas de adenocarcinoma12. Algunas de ellas
pueden presentar aumento de su tamaño o desarrollo de un componente sólido
reciĂ©n pasados los 3 a 5 años aproximadamente y, por tal razĂłn, algunas guĂas
no recomiendan su seguimiento anual4.
Otro estudio realizado en Tokio también asocia el desarrollo de la
HAA con una predisposición genética y han demostrado su coexistencia con
lesiones malignas tanto pulmonares primarias como secundarias, estableciendo
además que, si bien el tabaco no juega un rol en su aparición, sà lo hace en la
transformación y evolución hacia una lesión neoplásica13.
Los hallazgos de este estudio se correlacionan con estos datos,
dado que se realizó un seguimiento durante 4 años en 2 de los pacientes, con
posterior comprobación de un aumento de tamaño del nódulo en el último control,
lo que llevĂł a una recategorizaciĂłn del Lung-RADS y a una decisiĂłn de resecciĂłn
quirĂşrgica, obteniendo como resultado anatomopatolĂłgico final el diagnĂłstico de
Adenocarcinoma LepĂdico en estadio inicial.
En nuestro análisis estadĂstico, se estudiĂł la asociaciĂłn entre la
ClasificaciĂłn Lung-RADS obtenida y la presencia o ausencia de malignidad en el
examen anatomopatolĂłgico (Figura 2). El 100% de los casos clasificados
como Lung-RADS 2, actualmente con seguimientos anuales, no presentaron
malignidad. Pero, este porcentaje fue disminuyendo a medida que la graduaciĂłn
de la ClasificaciĂłn de Lung-RADS aumentaba. En Lung-RADS 3, solo el 22%
presentĂł malignidad; en Lung-RADS 4A, este porcentaje aumentĂł al 67% y ascendiĂł
al 77% en los pacientes con Lung-RADS 4B. En los pacientes con Lung- RADS 4X14, el 98% de los casos
presentaron malignidad. Los resultados de estas asociaciones entre la
categorizaciĂłn tomográfica/clĂnica y la histopatologĂa, fueron estadĂsticamente
significativos (p-valor < 0,0001).
En concordancia, un artĂculo publicado en el año 2016 en la
revista del Colegio Americano de RaÂdiologĂa, demostrĂł que la aplicaciĂłn del
ACR Lung-RADS aumentĂł el valor predictivo positivo en una cohorte de cribado
pulmonar TC en un factor de 2.5, a 17.3%, sin aumentar el número de exámenes
con resultados falsos negativos15.
Si bien es probable que el nĂşmero, tal vez no suficiente de
pacientes, sea una debilidad de este traÂbajo, podemos deducir que el empleo de
un sistema de categorizaciĂłn como el Lung-RADS, es de vital importancia en el
seguimiento de los nĂłdulos pulmonares, dado que los pacientes a los que se les
realiÂzaron los controles tomográficos, segĂşn la categorĂa correspondiente y
que presentaron cambios visibles en la tomografĂa, se beneficiaron de un
diagnĂłstico precoz con una buena sobrevida, persistiendo los pacientes
detectados en estadios iniciales con lesiones en “vidrio esmerilado”, o con
componente mixto, sin signos de progresiĂłn al momento de la recolecciĂłn de
datos. (n = 12).
Los pacientes que fueron detectados en estadĂos tempranos, fueron
operados. Solo un 27% de los pacientes (n = 27) se encontraban en un estadĂo
avanzado de la enfermedad al momento del diagnĂłstico.
Por otro lado, los pacientes con aspecto benigno en las imágenes
persisten con seguimientos anuales sin el empleo de métodos invasivos, lo que
genera también mayor tranquilidad en el paciente.
De entre los pacientes categorizados como Lung-RADS 4, solo uno
tuvo diagnĂłstico de benignidad, de origen infeccioso, por lo que recibiĂł
tratamiento especĂfico, no presentando ninguna alteraciĂłn en controles
posteriores y sin signos de alteraciones hasta el momento del cierre de esta
investigaciĂłn.
A los pacientes con nĂłdulos que se encontraron dentro de la
categorĂa 4 del Lung-RADS, se les brindĂł la posibilidad de realizar un
tratamiento precoz, sin necesidad de controles posteriores ni demoras del mismo
y, en algunos casos, la realizaciĂłn de mĂ©todos más especĂficos como PET16
o biopsia de pulmĂłn, para obtener un diagnĂłstico
anatomo-patolĂłgico de certeza previo a la conducta a determinar o para iniciar
los tratamientos de quimioterapia, como la neoadyuvancia, por ejemplo.
La patologĂa pulmonar, destacándose entre ellas el cáncer de
pulmĂłn, ha tomado fuerza en este ĂşltiÂmo tiempo, debido a factores no
necesariamente asociados al tabaquismo, ya que hay tipos histolĂłgicos que
afectan no solo a pacientes fumadores (como el adenocarcinoma), dado que la
poluciĂłn ambiental, el trabajo y el estilo de vida son factores importantes que
tiene un rol esencial en el desarrollo del mismo, además del tabaquismo. El
aporte de las nuevas tecnologĂas, la tomografĂa computada volumĂ©Âtrica
multicorte de fino espesor, como asà también la posibilidad de emplear bajas
dosis de radiación, obliga al médico actual a poner todo su empeño en ayudar al
paciente, con la premisa de prolongar la sobrevida y calidad de vida, teniendo
la obligaciĂłn de actualizarse y aplicar dichos conocimientos para brindar
informaciĂłn, educaciĂłn y la mejor atenciĂłn para el paciente. De esta manera, se
puede avanzar médicamente y lograr integrar en nuestro esquema de “screening”
al cáncer de pulmĂłn aplicando guĂas adecuadas, con el objetivo de detectar esta
patologĂa en estadios tempranos.
Cerca de la mitad de los cánceres pulmonares recién diagnosticados
se presentan como enfermedad avanzada, con una sobrevida promedio a los 5 años
del 17%. La identificaciĂłn en el tiempo adecuado y el tratamiento Ăłptimo de los
cánceres pulmonares en su etapa inicial, es esencial ya que, aquellos con
enfermedad localizada, elevan la sobrevida a los 5 años al 55%. Para ello, es
necesario utilizar sistemas de “cribado” de detección de cáncer que, como se
señaló más arriba, no se encuentra establecido aún en los sistemas de salud de
Argentina. Sin embargo, aplicando los criterios de las guĂas establecidas para
categorizaciĂłn y seguimiento de los nĂłdulos pulmonares que se descubren
incidentalmente en estudios convencionales, se puede contribuir a un buen
seguimiento de pacientes, con mayor probabilidad de detecciĂłn precoz de la
patologĂa maligna.
ConclusiĂłn
La aplicaciĂłn del sistema Lung-RADS en esta serie de pacientes ha
demostrado un buen manejo de seguimiento de los mismos, posibilitando en
algunos casos, la realizaciĂłn de resecciones pulmonares y, en otros, la
conducta expectante con cierto margen de seguridad, evitando en muchas
oportunidades la adopciĂłn de conductas agresivas innecesarias.
BibliografĂa
1. Yip R, Henschke C,
Yankelevitz D, Smith P. Thoracic Imaging: Alternative Definitions of Positive
Test Result at CT Lung Cancer Screening. Radiology 2014; 273(2): 591-6.
2. Sistema
de datos e informes pulmonares (Lung-Rads). Medical Criteria. http://medicalcriteria.com/web/es/lung-rads/.
Acceso en la web: 30/08/2019.
3. Kathlen L. Lung
Cancer Screening Update. J Thorac Imaging 2016; 31: 190-200.
4. Govert JA, Wahidi MM,
Goudar RK, Gould MK. Evidence for the Treatment of Patients With Pulmonary
Nodules: When Is It Lung Cancer? Journal Chest 2007; 132(3): 94-100.
5. Knipe H. Fleischner
Society pulmonary nodule recommendations: Guidelines 2017. Radiopaedia. https://radiopaedia.org/articles/fleischner-society-pulmonary-nodule-recommendations.
Acceso en la web: 12/06/2018.
6. Martin MD, Kanne JP,
Broderick LS, Constantine AG. The National Lung Screening Trial: Overview and
Study Design. Radiology 2011; 258(1): 243-53.
7. Wiener RS, Gould MK,
Woloshin S, Schwartz LM, Clark JA. What do you mean, a spot? a qualitative
analysis of patients’ reactions to discussions with their physicians about
pulmonary nodules. Chest 2013; 143(3): 672-7.
8. MacMahon H, Naidich
N, Goo JM, Lee KS, Leung A. Guidelines for Management of Incidental Pulmonary
Nodules Detected on CT Images: From the Fleischner Society 2017. Radiology 2017; 284(1):
230-1.
9. Kakinuma R, Muramatsu
Y, Kusumoto M, Tsuchida T, and cols. Solitary Pure Ground-Glass Nodules 5 mm or
Smaller: Frequency of Growth. Radiology2015; 276 (3): 873-82.
10. Kazerooni EA, Meyer
CA. Lung-RADS: Pushing the Limits. RadioGraphics 2017; 37: 1975-93.
11. Di Muzio B, Morgan
M. Lung-RADS. Radiopaedia https://radiopaedia.org/articles/lung-cancer-screening.
Acceso en la web: 04/03/2018.
12. Wu R. Lung tumor.
Dysplasia / carcinoma in situ. Bronchioloalveolar atypical
adenomatous hyperplasia (AAH). PathologyÂOutlines.com
website. https://www.pathologyoutlines.com/topic/lungtumorbronchAAH.html.
Acceso en la web: 02/10/2019.
13. Kitagawa H, Goto A,
Niki T, Hironaka M, Nakajima J, Fukayama M. Lung adenocarcinoma associated with
atypical adÂenomatous hyperplasia. A clinicopathological study with special
reference to smoking and cancer multiplicity. Pathology International 2003; 53(12):
826-7.
14. Chung K, Jacobs C,
Scholten E, Goo J , Prosch H, Col. Lung-RADS Category 4X: Does It Improve
Prediction of Malignancy in Subsolid Nodules? Radiology2017; 284(1): 269-70.
15. McKee J, Regis S,
McKee A, Flacke S, Wald C. Performance of ACR Lung-RADS in a clinical CT lung
screening program. JACR 2016; 13(2): 25-9.
16. Sim YT, Goh YG, Dempsey
MF, Has S, Poon FW. PET-CT evaluation of solitary pulmonary nodules:
correlation with maximum standardized uptake value and pathology. Lung 2013; 191(6):
623-7.