Autor : Burbano PÃĐrez Sonia, GÃģmez Querales Neil, Ãlvarez Paola, GonzÃĄlez Alejandra, Tummino Carlos, Asquineyer Yanina
Servicio de NeumonologÃa, Hospital Nacional Profesor Alejandro Posadas, El Palomar, Buenos Aires, Argentina
Correspondencia : Sonia Burbano PÃĐrez: soniabp83@hotmail.com
Introducción
La criptococosis afecta predominantemente a pacientes con compromiso de la inmunidad celular, más frecuente con VIH. La infección ocurre por inhalación del microorganismo presente en el excremento principalmente de las palomas. Produce una infección pulmonar inicial desde donde puede diseminar por vía hematógena a otros órganos, sobre todo meninges y sistema nervioso central causando una meningoencefalitis; también puede permanecer en forma latente y reactivarse cuando fallan los mecanismos inmunes.
Cryptococcus spp. son levaduras capsuladas. El género Cryptococcus se compone de dos especies patógenas: C. neoformans y C. gattii. Cryptococcus neoformans presenta dos variedades, var. grubii (serotipo A) y var. neoformans (serotipo D), Cryptococcus gattii incluye los serotipos B y C. C. neoformans var. neoformans se ha relacionado con la infección en pacientes inmunodeprimidos y su distribución es mundial y el C. neoformans var. gattii se ha descrito en infecciones de pacientes inmunocompetentes y su distribución se limita a países tropicales y subtropicales. Existen otras especies, como C. laurentii que pueden producir enfermedad en el huésped inmunocomprometido.
Caso clínico
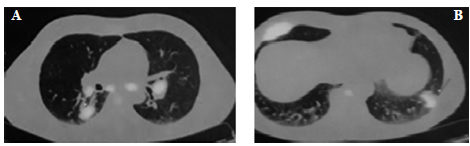
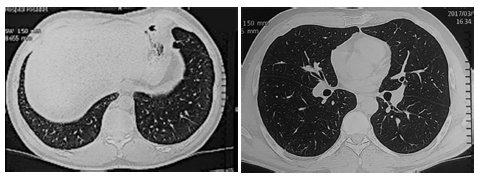
Paciente masculino de 45 años con antecedentes de VIH en tratamiento con terapia antiretroviral (TARV), Linfocitos T CD4 +, tuberculosis diseminada (año 2000) cumplió tratamiento por un año, linfoma de Hodgkin clásico esclerosis nodular estadio IV B, respondió en primer término al tratamiento con adriamicina, bleomicina, vinblastina y dacarbazina (ABVD). Se internó por fiebre persistente sin neutropenia. Al examen físico: febril y crepitantes en campo pulmonar superior izquierdo. Se realizó examen de laboratorio donde se observó anemia, plaquetopenia e hipertransaminasemia. En el PET-TC control de tratamiento, se evidenció actividad metabólica con extenso compromiso ganglionar supra e infra diafragmático, óseo, hepato-esplénico, pleuro-parietal derecho, en los lóbulos pulmonares inferiores se observaron imágenes pseudonodulares hipermetabólicas (SUV máx. 9.5) de márgenes irregulares, la de mayor tamaño en lóbulo inferior izquierdo. En el lóbulo superior izquierdo se observaron infiltrados alveolares con leve actividad metabólica (SUV máx. 1,1) (Figura 1). Se sospechó recaída de su enfermedad y/o proceso infeccioso. Se realizó fibrobroncoscopia (FBC): sin lesiones endoluminales, se realizó BAL en lóbulo inferior izquierdo. Se observaron en el examen directo levaduras capsuladas. En el cultivo desarrollo unas colonias cremosas que luego se identificaron como C. Laurentii. La antigenemia para Cryptococcus fue negativa, cultivo para koch, gérmenes comunes y directo para Pneumocystis jirovecii, fueron negativos. Cumplió tratamiento con anfotericina B (0.5 mg/kg/ día) por 14 días y continuó con fluconazol por 6 meses (400 mg día). Se realizó TC de control a los 20 días, sin infiltrados pulmonares y persistencia de adenopatías hiliares interpretándose como recaída de su linfoma (Figura 2) por lo que realizó tratamiento con ESHAP (etopósido, metilprednisolona, arabinósido de citosina y cisplatino) evolucionando con buena respuesta
Discusión
La criptococosis es una infección más frecuente en los hombres que mujeres, hecho relacionado tal vez con la mayor exposición de los hombres a este microorganismo 1. Se presenta con mayor frecuencia en pacientes inmunocomprometidos, especialmente en los pacientes con VIH-AIDS 2,3. Es la cuarta infección oportunista en pacientes con AIDS. Con el advenimiento del TARV su incidencia, ha declinado.3,4.
Esta infección puede encontrarse en otros grupos de pacientes enfermedades hematológicas, cáncer trasplante de órgano sólido, tratamiento inmunosupresor, etc); el pulmón y el SNC son los sitios donde habitualmente se presenta la enfermedad3-5.
Del género Cryptococcus, C neoformans y C gattii son responsables de enfermedad en el hombre. Otras especies eran considerados hongos saprófitos5 , pero en pacientes inmunocomprometidos pueden ser patógenos, en la última década se ha observado una incidencia creciente de Cryptococcus laurentii y albidus.
Los factores de riesgo asociados con la infección por C. laurentii son dispositivos invasivos, nutrición parenteral, exposición previa a esteroides, tratamiento inmunosupresor, bajo recuento de CD4, exposición a excremento de palomas y neutropenia5, 6, 10. Los casos publicados en la literatura son fungemias, meningitis, peritonitis, infecciones pulmonares, cutáneas y oftálmicas por C. laurentii. Se aisló con mayor frecuencia en sangre y LCR, la fungemia es la manifestación clínica más común7, 9, 10. En general, la infección por C. laurentii se presenta clínicamente con enfermedad febril,. la sintomatología varía según el órgano afectado10.
En pacientes inmunocompetentes la infección pulmonar puede progresar, remitir espontáneamente o permanecer estable y asintomática por períodos prolongados. En inmunosuprimidos, la enfermedad puede variar de asintomática a grave, la mortalidad puede llegar hasta el 42%11.
En todos los pacientes inmunodeprimidos que tengan criptococosis pulmonar y en todos los pacientes que tengan cualquier síntoma del SNC se debe realizar una punción lumbar para descartar meningitis.
La imagen radiológica más frecuente en la criptococosis son los nódulos, también se describen infiltrados alveolares o intersticiales parchados, lesiones cavitadas, masas pulmonares, uní o bilaterales, consolidaciones y derrame pleural11, 12.
La confirmación diagnóstica se realiza con el aislamiento del microorganismo en el cultivo mas un examen directo positivo y/o antigenemia positiva. Otros métodos diagnósticos a veces necesarios son la biopsia transbronquial, biopsia por toracoscopia y punción transtoracica con aguja ultrafina1,13. Entre los diagnósticos diferenciales se encuentran otras infecciones como tuberculosis pulmonar, otras micosis y neoplasias como linfoma o cáncer de pulmón.
El FDG-PET es muy sensible y preciso en la estadificación y evaluación de la respuesta al tratamiento de los linfomas. El uso de SUV para la discriminación entre enfermedades benignas y malignas ha sido ampliamente estudiado y la mayoría de los estudios establecen un SUV de 2.5 a 5.0 como un límite racional. En la criptococosis, los informes han sido poco concluyentes. Huang y otros, por ejemplo, observaron valores de SUV entre 2.2 y 11.614.
En el caso descripto, con antecedentes de tuberculosis pulmonar, con neoplasia maligna, gravemente inmunocomprometido por AIDS y por el uso de quimioterapia, es imprescindible el diagnóstico etiológico correcto de las imágenes pulmonares, por métodos invasivos y no invasivos.
El examen mitológico con directo y cultivos positivos más la respuesta clínica al tratamiento específico confirmaron el diagnostico.
Conflictos de interés: Los autores declaran no tener conflictos de intereses relacionados con el tema de esta publicación.
1. Martín-Mazuelos E, Valverde-Conde A. Criptococosis: diagnóstico microbiológico y estudio de la sensibilidad in vitro [Internet]. Madrid: SEIMC; 2001 [citado 13 de agosto de 2016]. Disponible en: https://www.seimc.org/contenidos/ccs/revisionestematicas/micologia/cripto.pdf.
2. Chayakulkeeree M, Perfect JR. Cryptococcosis. Infect Dis Clin N Am. 2006; 20(3): 507-44.
3. Ávila Sánchez D, Vindas Villalobos MA. Perfil epidemiológico y respuesta terapéutica de la infección por Cryptococcus sp. en pacientes de Costa Rica en el Hospital San Juan de Dios, Período 2008-2012. Revista Clínica Escuela de Medicina UCR-HSJD 2016; 6(1): 11-2.
4. Rodríguez DA, Pinilla AP. Cryptococcus laurentii infection of central catheter in critically ill child: in regards to a case and literature review. Infectio 2012; 16(1): 72-4.
5. Khawcharoenporn T, Apisarnthanarak A, Mundy LM. Non-neoformans cryptococcal infections: a systematic review. Infectio 2007; 35(2): 51-8.
6. Lynch JP, Schaberg DR, Kissner, DG, Kauffman CA. Cryptococcus Laurentii Lung Abscess. Am Rev of Resp Dis; 1981; 123(1): 1123-35.
7. Averbuch D, Boekhouty T, Falk R, et al. Fungemia in a cancer patient caused by -fluconazole- resistant Cryptococcus laurenti Medical Mycology 2002; (40): 479-84. DOI: 10.1080/mmy.40.5.479.484.
8. Banerjee P, Haider M, Trehan V, et al. Cryptococcus laurentii Fungemia, Indian Journal of Medical Microbiology, 2013; 31, (1): 75-77 ,DOI: 10.4103/0255-0857.108731
9. Kunova A, Krcmery V Jr, Breakthrough A, Cryptococcus laurentii Bloodstream Infections in Cancer Patients Receiving Antifungals. Scan J Infect Dis 2009; 31(3): 328. .Doi.10.1080/00365549950163725.
10. Asquez TO, Martinez BI, Campos RT, Criptococosis. Historia natural y estado actual del tratamiento. Acta Pediatr Mex 2005;18-28.
11. Esaki Muthu Shankar, Nagalingeswaran Kumarasamy, Devaleenol Bella, et al. Pneumonia and pleural effusion due to Cryptococcus laurentii in a clinically proven case of AIDS. Can Resp J. 2006; 13(5): 275-8. doi: 10.1155/2006/160451.
12. Sadhna S, Hawaldar R, Isolation of Cryptococcus Laurentii in Bal Fluid in an Asthmatic Patient. Indian J Microbiol Res 2015; 2: 72-5.
13. Hamerschlak N, Pasternak J, Wagner J, Fleury Perini G, Not all that shines is cancer: pulmonary cryptococcosis mimicking lymphoma in F fluoro-2-deoxy-D-glucose positron emission tomograph. Einstein (São Paulo). 2012; 10: 502-4. http://dx.doi.org/10.1590/S1679-45082012000400018.