Autor : Forcillo Marcos1, Picón Fuster Silvina Noelia1, Destefanis Claudia1, Gaggioli Matías1, Distefano Eduardo1, Botto Magdalena1, Villafañe Celeste1, Bertozzi Sebastián1, Baez Gretel1
1 Sección de Rehabilitación y Cuidados Respiratorios. Servicio de Kinesiología. Hospital Italiano Agustín Rocca, San Justo, provincia de Buenos Aires, Argentina
Correspondencia : Marcos Forcillo; e:mail: marcos.forcillo@hospitalitaliano.org.ar
Resumen
En la actualidad la debilidad adquirida en la unidad de cuidados intensivos conforma una entidad que abarca, en esta población de pacientes, tanto a la miopatía como a la polineuropatía. Esta entidad es la principal causa de debilidad en los pacientes críticos y se encuentra asociada al aumento de la morbimortalidad.
No existe un tratamiento electivo para este cuadro clínico. Más bien están disponibles medidas preventivas como la estimulación eléctrica neuromuscular, la cual se basa en la aplicación terapéutica de estimulación eléctrica al sistema nervioso periférico y al músculo simulando potenciales de acción que conllevan a la contracción muscular.
El objetivo de esta revisión es recopilar y organizar información relacionada a la aplicación de estimulación eléctrica neuromuscular en pacientes con debilidad adquirida en la unidad de cuidados intensivos para prevenir y/o tratar la debilidad muscular.
Palabras clave: Terapia por estimulación eléctrica; Enfermedades musculares; Cuidados críticos; Debilidad muscular; Polineuropatías.
Introducción
Ya hace más de cien años se comenzó a describir una patología que se instauraba en el paciente crítico caracterizada por la pérdida de fuerza y masa muscular1. En la década de 1980, Bolton y colaboradores realizaron una de las primeras publicaciones experimentales sobre la polineuropatía del paciente crítico2. En 1996, Latronico y colaboradores publicaron un artículo que describe a la afección del músculo esquelético (miopatía del paciente crítico) como una entidad que puede o no coexistir con la polineuropatía3. En la actualidad se habla de la debilidad adquirida en la unidad de cuidados intensivos (DAUCI) como una entidad que abarca tanto a la miopatía como a la polineuropatía del paciente crítico4. Investigaciones de los últimos veinte años llevadas a cabo en Europa y Canadá encontraron que la DAUCI es la principal causa de debilidad en los pacientes críticos5.
La debilidad muscular se acompaña muchas veces de disminución o pérdida de reflejos osteotendinosos, con conservación parcial de la musculatura facial. Afecta tanto a músculos periféricos como respiratorios, predominantemente a músculos proximales a nivel de la cintura pélvica y escapular, instaurándose de manera simétrica y con un patrón ascendente6. Uno de los síntomas predominantes de la presencia de la DAUCI es frecuentemente la falla del destete (weaning) de la ventilación mecánica, suceso íntimamente relacionado con la afección del nervio frénico y la atrofia del principal músculo inspiratorio, el diafragma6.
Los reportes de incidencia varían según la población de pacientes estudiados. La debilidad fue encontrada en un 26 a 65% de pacientes que requirieron ventilación mecánica durante 5 a 7 días, respectivamente7 y, el 25% de éstos permanecieron con debilidad hasta 7 días luego de salir de la sedación profunda6. En los pacientes con ventilación mecánica prolongada (> 10 días) se diagnosticó DAUCI en más de un 67% de la población estudiada. En pacientes con síndrome de distress respiratorio agudo (SDRA) la incidencia de DAUCI fue de un 60% y al momento del alta hospitalaria dicha incidencia se mantuvo en un 36%8.
La etiología de DAUCI se encuentra íntimamente relacionada a numerosos factores de riesgo predisponentes. La presencia y persistencia de sepsis, el síndrome de respuesta inflamatoria sistémica (SIRS) y la falla multiorgánica (FMO) parecen tener un rol jerárquico. La sepsis fue un hallazgo común en la mayoría de los pacientes con debilidad; además la incidencia reportada de DAUCI en pacientes con sepsis fue muy elevada2 por lo cual se considera un factor de riesgo independiente de complicaciones neuromusculares. La inmovilización y la ventilación mecánica en la fase aguda de la enfermedad crítica son factores sugestivos de generar debilidad y atrofia muscular. De cualquier manera la inmovilización per se pareciera no ser suficiente para explicar el grado de debilidad observado en esta población de pacientes6. El “silenciamiento mecánico” (pérdida de peso corporal y cambios en las proteínas contráctiles musculares) observado en modelos animales con soporte de ventilación mecánica fue suficiente para producir una pérdida significativa de miosina6. La hiperglicemia se asoció con DAUCI e incluso se definió como un factor de riesgo independiente; en coincidencia con la hipótesis de que la hiperglicemia puede perjudicar la microcirculación a nivel del sistema nervioso periférico6. Los corticoesteroides disminuyen la síntesis de proteínas y aumentan su catabolismo causando atrofia y debilidad muscular. Existen reportes y casos que describen el aumento en la incidencia de debilidad muscular en el paciente crítico cuando se combinaron corticoides con bloqueantes neuromusculares9 (BNM). Un ensayo clínico, controlado y randomizado, comparó el uso de BNM durante 48 horas vs placebo; no encontrándose un aumento de la incidencia de DAUCI en el grupo intervención10. La duración de la ventilación mecánica controlada puede contribuir a debilidad y atrofia diafragmática, entidad actualmente conocida como disfunción diafragmática inducida por la ventilación mecánica6.
La estimulación eléctrica neuromuscular (EENM), es una técnica que consiste en generar contracciones musculares visibles con dispositivos portátiles conectados a electrodos de superficie11. La EENM se utiliza actualmente de muchas formas para mejorar la fuerza muscular y el rendimiento. En los entornos clínicos, puede emplearse para mejorar la fuerza muscular, aumentar el rango de movimiento, reducir el edema, disminuir la atrofia y el dolor, planteándose además como una opción terapéutica para tratar y/o prevenir la debilidad en los pacientes críticos.
Ante el estímulo eléctrico por medio de electrodos de contacto el músculo inervado responde con una contracción que llega a su placa motriz a través del nervio correspondiente. En forma similar a lo que ocurre con la fisiología normal, se requiere un tiempo de recuperación de la fibra muscular para realizar una repetición del estímulo. Si bien en la actualidad el uso de EENM no se encuentra dentro del estándar de cuidados en las unidades de cuidados intensivos (UCI), numerosas investigaciones arrojan resultados prometedores cuando se usa esta terapia en el proceso agudo de la enfermedad mientras el paciente se encuentra con sedación profunda y sin la utilización voluntaria de su musculatura periférica.
El objetivo de esta revisión es recopilar y organizar información relacionada a la aplicación de EENM en pacientes con DAUCI para prevenir y/o tratar la debilidad muscular.
Métodos
Para el desarrollo de los objetivos planteados, se realizó una revisión bibliográfica en PubMed, BIREME y en la biblioteca digital del Hospital Italiano de Buenos Aires, limitándose a ensayos clínicos, revisiones bibliográficas, revisiones sistemáticas, estudios observacionales y estudios piloto que relacionen la debilidad adquirida en la unidad de cuidados intensivos con la electroestimulación neuromuscular. Se incluyeron solo trabajos en inglés, utilizando los siguientes términos MeSH unidos por el conector “AND”: Muscular Diseases, Polyneuropathies, Muscle Weakness, Electric Stimulation Therapy, Critical Care.
Se obtuvieron 52 artículos, de los cuales 30 fueron por repetición. Se excluyeron trabajos realizados en animales, población pediátrica y los que no especificaron la dosificación de EENM utilizada. Luego de este proceso, el número de artículos obtenidos para la presente revisión fue de 7 (siete).
Debilidad adquirida en la unidad de cuidados intensivos
Fisiopatología
En relación a la fisiopatología de DAUCI, podemos decir que los mecanismos son complejos e implican alteraciones estructurales y funcionales tanto en nervios como en músculos.
En la afección nerviosa, el principal hallazgo patológico es la degeneración axonal2. Factores que se ponen en juego son los cambios microvasculares en el endoneuro, desencadenados por la sepsis, que promueven la permeabilidad vascular y permiten la penetración de factores tóxicos a los extremos nerviosos6. El edema endoneural resultante del aumento en la permeabilidad vascular puede comprometer la entrega de energía al axón, siguiendo con la muerte axonal. Los efectos tóxicos y la disfunción mitocondrial provocados por la hiperglucemia podrían contribuir a este proceso6.
En la afección muscular varios factores intervienen alterando la estructura y la función. En primer lugar la atrofia muscular puede ocurrir precozmente por una disminución en la síntesis de proteínas musculares, generalmente involucrando a la miosina6. Recientemente, una citoquina inducida por el estrés orgánico, el factor de crecimiento y diferenciación 15 (GDF-15) se identificó como un mediador de atrofia muscular durante la enfermedad crítica12. Otros factores podrían contribuir al decremento de la función muscular, como la falta de excitabilidad de la membrana muscular, que conlleva a disfunción de los canales de sodio y afección de la homeostasis de calcio intracelular, alterando la contracción muscular6.
Evaluación y diagnóstico
Existen herramientas validadas para identificar DAUCI. En pacientes despiertos y colaboradores se utiliza el enfoque clínico basado en la escala Medical Research Council (MRC Sum Score). Se trata de una escala validada que clasifica la debilidad muscular en seis grupos musculares de miembro superior e inferior. La evaluación se realiza de manera bilateral y el rango va de 0 (ausencia de contracción) a 5 (fuerza normal) (Tabla 1)
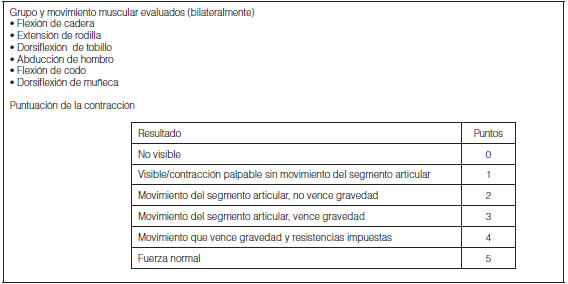
La sumatoria de estas evaluaciones da un resultado máximo de 60. Se definió DAUCI como un puntaje menor a 48 en el MRC sum score sin ninguna otra causa aparente de debilidad muscular4. Un MRC SUM SCORE < 48, está asociado a resultados clínicos importantes, interpretándose como predictor independiente de weaning prolongado de la ventilación mecánica, aumento en días de internación en la unidad de cuidados intensivos y en el hospital, aumento de la mortalidad a 180 días y disfunción faríngea13. El MRC sum score se propuso como una herramienta de evaluación de primera línea para pacientes con riesgo de desarrollar DAUCI4.
Electroestimulación neuromuscular (EENM)
Mecanismo de acción
La electroestimulación puede generar potenciales de acción en el nervio y en el músculo, que son como los producidos por la acción del sistema nervioso. En la electroestimulación transcutánea, uno de los electrodos contiene, durante un tiempo, un exceso de carga eléctrica; mientras que el otro exige un déficit de carga. Algunos de estos desplazamientos iónicos se producen en el líquido extracelular, con lo que parte de esta corriente pasa a través de la membrana nerviosa. Esta corriente induce una despolarización de la membrana nerviosa.
El efecto visible o palpable de la estimulación eléctrica es la contracción muscular. Al realizar estímulos eléctricos por medio de electrodos de contacto, se produce la excitación del sarcolema del nervio que inerva al músculo14.
En relación al tipo de onda empleado en EENM la más común se basa en un impulso cuadrado, equilibrado, simétrico y bifásico. El componente de corriente galvánica es nulo, por lo que no presenta efectos polares debajo de los electrodos. El área resultante debajo de la onda positiva es igual al área de la onda negativa, lo que hace que no se produzcan efectos polares, evitando así la acumulación a largo plazo de concentraciones de iones debajo de cada electrodo o dentro del tejido. Esto es una característica positiva, ya que se evitan reacciones dermatológicas adversas15.
En cuanto a la intensidad para producir un potencial de acción es decir, provocar una respuesta en los tejidos excitables, el estímulo eléctrico debe poseer una adecuada amplitud y duración. Esta amplitud mínima necesaria se denomina umbral de excitación. El estímulo eléctrico de amplitud o intensidad mínima se denomina estímulo umbral. Si la amplitud de un estímulo eléctrico es demasiado débil para producir un umbral de despolarización, el potencial de acción no se produce. Una membrana excitable (axón, fibra muscular) expuesta a un estímulo eléctrico subumbral no produce una modificación inmediata en su carga. Así como también, al exponerse a estímulos eléctricos sostenidos, la membrana puede, eventualmente, alcanzar un estado estable, en el cual la carga en la membrana alcanza el umbral en respuesta a la corriente aplicada externamente. En otros casos, la intensidad del estímulo puede hacerse demasiado elevada, incluso superior al nivel de tolerancia, para reclutar todos los axones motores. Por lo tanto, estímulos de intensidades muy elevadas no aumentan la respuesta y se tornan desagradables o dolorosos14.
Aparatología y técnica
La forma más conveniente de aplicar EENM es a través de los dispositivos portátiles. Estas unidades presentan la posibilidad de modificar y dosificar los distintos parámetros estableciendo programas personalizados. Algunos dispositivos vienen con regímenes pre programados según el objetivo del tratamiento (fortalecimiento, alivio del dolor).
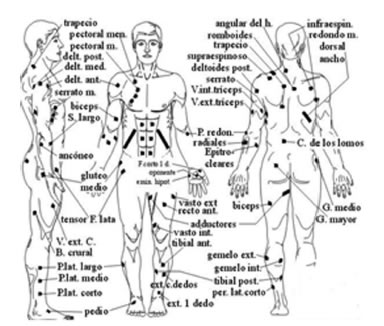
En la actualidad la mayoría de los electrodos para este tipo de intervención vienen pre-gelificados de fábrica, éstos se colocan sobre el músculo a estimular. Su posicionamiento influirá marcadamente en la respuesta muscular y debe considerarse cuidadosamente. La colocación sobre el punto motor produce mayores contracciones con menor intensidad empleada15. Se adjunta a la presente, una guía para encontrar los principales puntos motores musculares (Figura 1).
Resultados
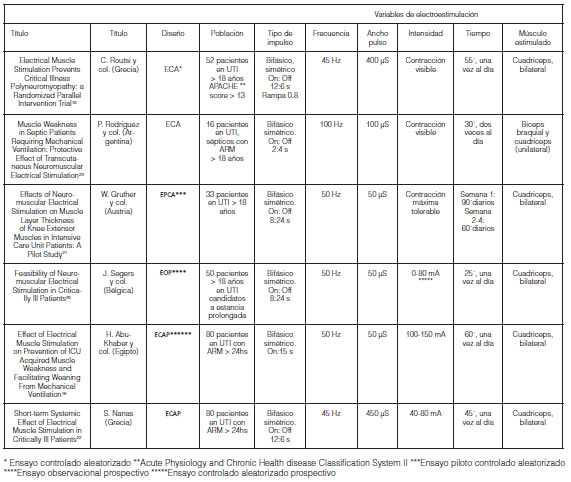
Fueron incorporados en esta revisión siete estudios que cumplían con los criterios de inclusión. En el año 2012 Hassan y col. realizaron un ensayo controlado, prospectivo, randomizado con 80 pacientes, evaluando la aplicación de EENM para prevenir DAUCI y facilitar el destete de la ventilación mecánica en una unidad de cuidados intensivos (grupo EENM n = 40 vs. grupo control n = 40). El autor concluye que con la aplicación diaria de EENM no se previene el desarrollo de DAUCI aunque su aplicación puede disminuir el grado de debilidad en la evaluación con el MRC sum score. En relación al destete de la ventilación mecánica se observó una reducción en el número de días de asistencia respiratoria mecánica (ARM) en el grupo EENM en comparación con el grupo control (9.010 ± 8.01 vs 11.97 ± 8.07 días) (p = 0.048)16.
La explicación teórica para este posible efecto de las EENM es la relación existente entre la musculatura periférica y la musculatura respiratoria. Ya que durante la aplicación de EENM se producen efectos sistémicos similares a los del ejercicio físico, que actúan como estímulo anabólico tanto en el sitio de aplicación (a nivel periférico) como a distancia (en la musculatura respiratoria)6. Algunas publicaciones sugieren que con el uso de EENM se podría disminuir la concentración plasmática de interleucina-6 (IL-6) tal como sucede con el ejercicio físico y en reposo, luego del mismo17. La IL-6 es una citoquina con actividad proinflamatoria que reduce la producción de factor de crecimiento insulínico tipo 1 (IGF-1) el cual tiene efectos promotores del crecimiento en casi todas las células del cuerpo, especialmente a nivel del músculo esquelético, cartílago, huesos, nervios, piel y pulmón6. En un ensayo clínico randomizado llevado a cabo en el año 2010 por Routsi y col. también se analizó la implementación de EENM para prevenir DAUCI y acortar los días de ventilación mecánica en 140 pacientes internados en una unidad de cuidados intensivos. La población de pacientes fue heterogénea. Los resultados del estudio arrojaron que la implementación diaria de EENM previene el desarrollo de DAUCI evaluado mediante MRC SUM SCORE (grupo EENM = 33-60 puntos vs. controles = 2-60 puntos; p = 0.04) y disminuye los días de ventilación mecánica (grupo EENM = 0-16 días vs. controles = 0-41 días; p = 0.003)18. Al comparar ambos trabajos se pueden apreciar diferencias en la población de pacientes y en la manera de implementar la EENM, además de que en ninguno se detalla la dosificación exacta aplicada.
Una revisión sistemática realizada en el año 2013 por Parry y col. se propuso identificar, evaluar y sintetizar la evidencia disponible sobre la efectividad y seguridad de la aplicación de EENM en la unidad de cuidados intensivos en pacientes con ARM en base a nueve estudios, de los cuales ocho fueron ensayos clínicos controlados y randomizados. La autora concluye que la aplicación de EENM podría preservar la fuerza y masa muscular en pacientes con estadía prolongada en la unidad de cuidados intensivos, sin observar beneficios en pacientes con score APACHE II (Acute Physiology And Chronic Health Evaluation II) > 20 puntos o que recibían EENM antes de los siete días de su ingreso a la unidad. Además no halló reportes de efectos adversos. Por último nombra la necesidad de identificar la población de pacientes que más se beneficiaría con esta intervención y hace hincapié en la heterogeneidad de los parámetros de dosificación administrados entre una publicación y otra19.
Un estudio observacional publicado en el año 2014 por R. Gosselink y col. analizó la factibilidad y seguridad en la aplicación de EENM en la unidad de cuidados críticos. La intervención resultó segura, no interfierió con otros dispositivos del entorno, ni afectó al personal de salud, tampoco modificó los signos vitales del paciente de manera significativa. Además se demostró que el edema de miembros, la sepsis y la administración de drogas vasoactivas limitaban la respuesta muscular al tratamiento con EENM (p < 0.001; 0.008 y 0.011 respectivamente)20.
Algunas publicaciones con pequeñas muestras de pacientes internados en UCI sugieren que las EENM preservan la masa muscular21, y ejerce efectos de corta duración a nivel de la microcirculación22. Por último en un ensayo randomizado realizado en 16 pacientes sépticos, en ARM, se aplicó EENM en un solo miembro, utilizando como control al miembro contralateral, encontrando mayor fuerza muscular en el miembro estimulado23.
En la Tabla 2 se describen los estudios analizados con mayor detalle.
Discusión
Existen varios aspectos a tener en cuenta en relación a la aplicación de EENM en los pacientes de la unidad de cuidados críticos.
Debe considerarse que existen condiciones particulares que podrían dificultar la aplicación de EENM. El edema de miembros va a aumentar la impedancia de los tejidos, y será necesaria una mayor intensidad dosificada para lograr una contracción visible y/o palpable.
Particular mención merece el hecho de que los pacientes que reciben vasoactivos podrían no tener los efectos deseados al recibir EENM, ya que en dicha condición el flujo sanguíneo será redireccionado a los órganos vitales, disminuyendo el afluente a la musculatura periférica, por lo cual el uso de drogas vasoactivas podría representar una contraindicación relativa para el uso de EENM probablemente relacionado con la dosis de vasoactivos que el paciente esté recibiendo.
Un gran porcentaje de los pacientes adquieren debilidad durante la internación en dicha unidad, que incluso persiste al momento del alta hospitalaria, viéndose afectada su capacidad física y su calidad de vida. Teniendo en cuenta esta elevada incidencia de DAUCI parece alentador contar con un elemento extra al momento de prevenir o de tratar esta patología con EENM. Más aún si contamos con el agregado de que los pacientes con DAUCI son candidatos a tener estancias hospitalarias y ventilación mecánica prolongadas, con aumento de la mortalidad hospitalaria y en UCI.
En pacientes bajo sedación, la aplicación de EENM logra contracciones musculares involuntarias, con el objetivo de mantener la actividad muscular, evitando cambios a nivel de la microvasculatura, de la estructura y de la función como la atrofia por desuso y la alteración del sistema bioenergético muscular (disfunción de canales de sodio y calcio intracelular). De todos modos, sería conveniente combinar la aplicación de EENM con un protocolo de movilización precoz, además de un control estricto de los factores de riesgo que predisponen a DAUCI.
Ninguno de los trabajos analizados consideró el estado neuromuscular, grado de movilidad ni actividades de la vida diaria de los pacientes previos a la internación. Esta información podría ser de utilidad para objetivar la evolución de los distintos grupos de pacientes, en relación con la aplicación de EENM.
Luego del análisis de la bibliografía se encontró que al aplicar EENM, se buscó una contracción visible y/o palpable en sesiones que duraron alrededor de 60 minutos, requiriendo distintas intensidades dosificadas para poder lograrlo. El interrogante que surge es: ¿buscamos entrenar o mantener la actividad muscular en los pacientes que se encuentran internados en la unidad de cuidados intensivos? ¿podríamos pensar en sesiones de EENM más prolongadas y con menor intensidad dosificada?
Consideramos que el concepto de entrenamiento no iría de la mano con la situación clínica de los pacientes críticos, siendo necesario valorar la posibilidad de aplicar EENM en sesiones en las que se puedan dosificar tiempos e intensidades acordes a esta población de pacientes, buscando objetivar las necesidades de los mismos, partiendo de la idea de que en la actualidad no existen protocolos de aplicación de EENM individualizados para esta población de pacientes en particular. Creemos que podría ser de gran utilidad aplicar esta terapéutica generando contracciones musculares de menor intensidad (sin buscar contracciones palpables de gran tenor) por mayor período de tiempo (mayor a una hora durante el día), simulando la actividad muscular alcanzada por los individuos cuando llevan a cabo sus actividades de la vida diaria (diferenciando esta metodología aplicada a la que realizan los autores en los estudios citados en la tabla de resultados expuesta con anterioridad). Estos aspectos podrían considerarse en futuras publicaciones.
Conclusión
Si bien la evidencia analizada avala el uso de EENM en la unidad de cuidados críticos, en relación a su eficacia, factibilidad y seguridad, ya que no presenta efectos adversos ni interfiere con otros artefactos del entorno, sería necesario en futuras investigaciones profundizar en aspectos inherentes a la dosificación específica para este grupo de pacientes, incluyendo variables de resultados a largo plazo, a partir de un seguimiento del paciente al alta hospitalaria, en cuanto a su calidad de vida, cumplimiento de las actividades de la vida diaria y reinserción laboral.
Conflictos de interés: Los autores del trabajo declaran no tener conflictos de intereses relacionados con esta publicación.
Bibliografía
1. Osler W. Principles and practice of medicine. New York: Appleton D 1892.
2. Bolton CF, Gilbert JJ, Hahn AF, Sibbald WJ. Polyneuropathy in critically ill patients. J Neurol Neurosurg Psychiatry. 1984; 47: 1223-1231.
3. Latronico N, Fenzi F, Recupero D, Guarneri B, Tomelleri G, Tonin P, De Maria G, Antonini L, Rizzuto N, Candiani A. Critical illness myopathy and neuropathy. Lancet. 1996; 347: 1579-1582.
4. Hermans G, Van den Berghe. Clinical review: intensive care unit acquired weakness. Critical Care. 2015;19: 274.
5. Leijten FSS, Harinck-de Werd JE, Poortvliet DCJ, De Weerd AW. The role of polyneuropathy in motor convalescence after prolonged mechanical ventilation. JAMA. 1995; 274: 1221-1225.
6. Friedrich OR, Van den Berghe G, Van Horebeek I, Hermans G, Rich MM, Larsson L. The sick and the weak: neuropathies/ myopathies in the critically ill-cellular mechanisms of complex disease entities in the ICU. Physiol Rev. 2015; 95(3): 1025- 109.
7. Ali NA, O’Brien Jr JM, Hoffmann SP, Phillips G, Garland A, Finley JC, et al. Acquired weakness, handgrip strength, and mortality in critically ill patients. Am J Respir Crit Care Med. 2008; 178: 261-8.
8. Bercker S, Weber-Carstens S, Deja M, Grimm C, Wolf S, Behse F, et al. Critical illness polyneuropathy and myopathy in patients with acute respiratory distress syndrome. Crit Care Med. 2005; 33: 711-5.
9. MacFarlane IA, Rosenthal FD. Severe myopathy after status asthmaticus. Lancet. 1977; 2: 615.
10. Papazian L, Forel JM,Gacouin A, Penot-Ragon C, Perrin G, Loundou A, Jaber S,Arnal JM, Perez D, Seghboyan JM, Constantin JM, Courant P, Lefrant JY, Guerin C, Prat G, Morange S, Roch A. Neuromuscular blockers in early acute respiratory distress syndrome. N Engl J Med. 2010; 363: 1107-1116.
11. Maffiuletti NA. Physiological and methodological considerations for the use of neuromuscular electrical stimulation. Eur J Appl Physiol. 2010; 110: 223-234.
12. Bloch SA, Lee JY, Syburra T, Rosendahl U, Griffiths MJ, Kemp PR, et al. Increased expression of GDF-15 may mediate ICU-acquired weakness by down-regulating muscle microRNAs. Thorax. 2015; 70: 219-28.
13. Mirzakhani H, Williams JN, Mello J, Joseph S, Meyer MJ, Waak K, et al. Muscle weakness predicts pharyngeal dysfunction and symptomatic aspiration in long-term ventilated patients. Anesthesiology. 2013; 119: 389-397.
14. Antón CC, Pastor Vega JM. Electroestimulación. En: Martínez Morillo M, Pastor Vega JM, Sendra Portero F. Manual de Medicina Física. Primera edición. España: Haurcort Brace; 1998. 133p-150p.
15. Albornoz Cabello M, Maya Martín J. Estimulación electrica neuromuscular. En: Albornoz Cabello M, Maya Martín J. Estimulación eléctrica transcutánea y neuromuscular. Primera edición. España: Elsevier; 2010. 35p-52p.
16. Hassan Abdelaziz Abu-Khaber, Amr Mohamed Zaki Abouelela, Esslam Mohammed Abdelkarim, Effect of electrical muscle stimulation on prevention of ICU acquired muscle weakness and facilitating weaning from mechanical ventilation, Alexandria Journal of Medicine. 2013; 49: 309-315.
17. Fischer CP. Interleukin 6 in acute exercise and training: what is the biological relevance. Exerc. Immunol Rev. 2006; 12: 6-33.
18. Routsi C, Gerovasili V, Vasileiadis I, Karatzanos E, Pitsolis T, Tripodaki ES, Markaki V, Zervakis D, Nanas S. Electrical muscle stimulation prevents critical illness polyneuromyopathy: a randomized parallel intervention trial. Crit Care. 2010; 14: R74
19. Selina M. Parry, Sue Berney, Catherine L. Granger, Renè Koopman, Doa El-Ansary, Linda Denehy. Electrical Muscle Stimulation in the Intensive Care Setting: A Systematic Review. Crit Care Med. 2013; 41(10): 2406-18.
20. Johan Seger, Greet Hermans, Frans Bruyninckx, Geert Meyfroidt, Daniel Langer, Rik Gosselink. Feasibility of neuromuscular electrical stimulation in critically ill patients, J Crit Care. 2014; 29(6): 1082-8.
21. Gruther W, Kainberger F, Fialka-Moser V, Paternostro-Sluga T, Quittan M, Spiss C, Crevenna R. Effects of neuromuscular electrical stimulation on muscle layer thickness of knee extensor muscles in intensive care unit patients:a pilot study. J Rehabil Med. 2010; 42: 593-597.
22. Gerovasili V, Tripodaki E, Karatzanos E, Pitsolis T, Markaki V, Zervakis D, Routsi C, Roussos C, Nanas S. Short-term systemic effect of electrical muscle stimulation in critically ill patients. Chest. 2009; 136: 1249-1256.
23. Rodriguez PO, Setten M, Maskin LP, Bonelli I, Vidomlansky SR, Attie S, Frosiani SL, Kozima S, Valentini R. Muscle weakness in septic patients requiring mechanical ventilation: protective effect of transcutaneous neuromuscular electrical stimulation. J Crit Care. 2012; 27: 319-328.