Autor : Josefina Villa, Nicolás Itcovici, Marcela Heres, Roberto DurĂ©, Marco SolĂs
FundaciĂłn Sanatorio GĂĽemes - Buenos Aires - Argentina
Correspondencia : Josefina Villa E-mail: josevlr@hotmail.com
Resumen
La coccidiodomicosis es una micosis sistémica endémica de América, producida por los hongos del género Coccidioides, C. immitis y C. posadasii. La mayor parte de las infecciones son benignas y autolimitadas, muy pocas desarrollan una enfermedad pulmonar grave y, un porcentaje mínimo, una enfermedad diseminada. Las infecciones complicadas del espacio pleural se han comunicado en muy pocos casos en la literatura. Se presenta el caso de un paciente inmunocompetente con una forma cavitada extensa asociada a empiema.
Palabras clave: Coccidioidomicosis; Micosis sistémicas endémicas; Infecciones del espacio pleural; Empiema.
Abstract
A Rare Cause of Empyema in an Immunocompetent Male
Coccidioidomycosis is a systemic mycosis endemic in America, caused by Coccidioides immitis and Coccidioides posadasii. Most of the infections are mild and self-limited; only a few of them develop a serious lung disease and a much smaller proportion cause a systemic disease. A few cases of infections complicating the pleural space infections have been reported in the literature.
We present a case of an immunocompetent patient, with a pulmonary Coccidiodiomycosis with extensive cavitary dissease associated to empyema.
Key words: Coccidioidomycosis; Systemic endemic mycosis; Pleural space infections; Empyema.
Introducción
La coccidioidomicosis es una infección micótica endémica del sudoeste de Estados Unidos y norte de México y de algunas áreas de Argentina, Brasil, Colombia, Guatemala, Honduras, Nicaragua, Paraguay y Venezuela1-4. En un estudio prospectivo se ha documentado que en zonas endémicas, Coccidioides immitis puede ser el agente causal del 16 al 44% de los casos de neumonía adquirida en la comunidad5. Sin embargo, en el 60% de los pacientes la infección primaria es asintomática y en el 40% restante en que los pacientes son sintomáticos, las manifestaciones clínicas son generalmente leves, con síntomas similares a la gripe: tos, fiebre, sudoración nocturna, dolor torácico tipo pleurítico6.
Aunque el dolor pleurítico es un síntoma común en los pacientes con coccidioidomicosis pulmonar, el derrame pleural es poco frecuente (7-20% de todos los pacientes sintomáticos, sólo el 2% son de gran volumen)7, 8, las infecciones complicadas del espacio pleural se han comunicado en muy pocos casos en la literatura9, 10.
Se presenta el caso de un empiema por coccidiodomicosis en un varón previamente sano, una presentación muy inusual de esta enfermedad. Se describe además una revisión de la literatura acerca de las características clínicas y de laboratorio de las coccidiodomicosis pulmonares complicadas.
Caso clínico
Se trata de un varón de 20 años de edad, sin antecedentes de relevancia, que fue evaluado en un hospital de su localidad por tos progresiva con expectoración escasa de 6 meses de evolución. El paciente no era tabaquista, ni consumía drogas ilícitas o alcohol.
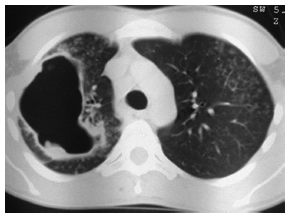
Nacido en Catamarca (oeste de Argentina), vivía con su familia y no había viajado fuera de su ciudad. El resultado de la prueba VIH había sido negativo dos meses antes de la presentación. Había trabajado como barrendero en los últimos dos años. El paciente nunca había trabajado en agricultura, tampoco recordaba contacto con animales o productos de origen animal. Se interpretó inicialmente el cuadro como una infección respiratoria leve y recibió amoxicilina/clavulánico (500 mg/125 mg). Debido a la persistencia de los síntomas del paciente, fue trasladado a un centro médico de Buenos Aires para su posterior evaluación. En las semanas siguientes, desarrolló disnea de esfuerzo, falta de apetito y registros febriles subjetivos. La tomografía computada de tórax (TAC) mostró una gran cavidad (10 cm de diámetro) asociada a opacidades en vidrio esmerilado centrolobulillares parcheadas y con patrón de árbol en brote bilateral. No presentó afectación de ganglios linfáticos (Fig. 1). La baciloscopia seriada de esputo fue negativa. El paciente había tenido pequeñas cantidades de esputo con estrías de sangre durante una semana. Fue admitido en otro hospital, donde tuvo un episodio de hemoptisis de gran volumen, superior a 300 cc de sangre fresca. La broncoscopia reveló una gran cantidad de sangre sobre el tercio inferior de la tráquea y el estudio no pudo completarse debido a que presentó severa desaturación de oxígeno. El paciente sufrió otro episodio de hemoptisis masiva y se realizó una lobectomía superior derecha de emergencia.
No presentó complicaciones postoperatorias y fue externado. Una semana posterior al alta, comenzó con registros febriles diarios, sudoración nocturna, escalofríos y malestar general; debido a la progresión de los síntomas, el paciente fue trasladado a nuestro hospital para su evaluación y tratamiento
Al examen físico lucía enfermo pero no con dificultad respiratoria. Su temperatura axilar fue de 37,5° C, la presión arterial de 120/80 mm Hg, la frecuencia cardíaca de 90 latidos por minuto y la saturación de oxígeno (SpO2) 98%. La auscultación pulmonar reveló estertores húmedos en todo el pulmón derecho. El resto de la exploración fue normal. En las pruebas de laboratorio, el paciente mostró un recuento de glóbulos blancos ligeramente elevado de 11.400 células/l, con recuento diferencial normal. El nivel de hemoglobina fue de 11 g/dl, con un hematocrito de 34%. La eritrosedimentación fue de 110 mm después de la primera hora. Los cultivos bacterianos del líquido pleural, esputo y sangre permanecieron negativos. La inmunodifusión para Coccidioides fue positiva. Se recibieron los resultados del ingreso previo: los cultivos de esputo para bacilos ácido-alcohol resistentes fueron negativos y el informe histopatológico de la lobectomía superior derecha mostró granulomas histiocíticos con inclusiones esferoidales de paredes gruesas.
La radiografía de tórax y la TC realizadas al ingreso mostraron extensa formación cavitada de paredes gruesas e irregulares con nivel hidroaéreo, en íntimo contacto con el espacio pleural asociado derrame pleural tabicado (Fig. 2).
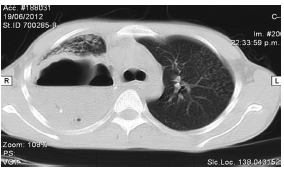
Se colocaron dos drenajes torácicos en la cavidad pleural derecha. El líquido extraído fue purulento con estrías de sangre. La tinción de Gram fue negativa pero hubo desarrollo de Coccidioides en el cultivo del líquido pleural. No presentó complicaciones postoperatorias. Se inició terapia antifúngica con anfotericina B liposomal 50 mg/kg/d y al cuarto día la fiebre desapareció. Luego de 15 días de tratamiento con anfotericina se rotó el esquema a fluconazol 400 mg/día vía oral. Permaneció internado durante 30 días en los cuales recibió nutrición parenteral. Seis meses más tarde, los síntomas del paciente se habían resuelto y la tomografía computarizada mostró una mejora considerable.
Discusión
En 1892 Alejandro Posadas describe en Argentina el primer caso en el mundo de coccidioidomicosis en un paciente llamado Domingo Escurra11. Cuatro años más tarde, en 1896, Rixford y Gilchrist describieron el primer caso en los EE.UU. Desde aquellas primeras descripciones, la Coccidiodomicosis es conocida tanto en Norteamérica como en Sudamérica12-14 principalmente como una infección respiratoria autolimitada15. La enfermedad es causada por hongos del género coccidiodes spp, que habitan suelos áridos. Existen dos subgrupos genéticamente diferenciables: C. immitis se limita geográficamente a la región del valle de San Joaquín de California, mientras que C. posadasii se encuentra en el desierto del suroeste de los Estados Unidos, México y América del Sur16. Pese a ser una micosis bien reconocida, la coccidioidomicosis enfermedad no es una patología frecuente en Argentina. Una revisión extensa de la red nacional de laboratorios micológicos del país17 describió sólo 118 casos documentados en un período de 117 años desde la descripción original de la enfermedad (1892 a 2009). La mayor parte de los casos clínicos se encuentran en las zonas áridas precordilleranas del país, con epicentro en el valle de Catamarca, donde nuestro paciente nació y residió toda su vida.
La manifestación más común de la infección por C. immitis es una forma pulmonar autolimitada, subaguda.
Un bajo porcentaje (0,2 a 0,5%) de las personas infectadas, especialmente los pacientes inmunodeprimidos, son más susceptibles al desarrollo de una enfermedad grave. La enfermedad comienza de 1 a 3 semanas después de la inhalación de artroconidias y se presenta con fiebre, tos e infiltrados pulmonares18. Las infecciones pulmonares no complicadas se resuelven en semanas o meses, a menudo sin tratamiento específico19, 20.
En la radiografía de tórax y la tomografía computarizada, pueden aparecer infiltrados unilaterales o bilaterales parcheados, o áreas de consolidación. A veces, como en nuestro caso, los pacientes no logran resolver la neumonía primaria y esta progresa a una infección pulmonar fibrocavitaria crónica caracterizada por sudoración nocturna, fatiga, fiebre, expectoración y pérdida de peso. El desarrollo de esta infección persistente se produce en menos del 1% de los pacientes. Hallazgos como cavidades y nódulos demuestran la progresión a una etapa complicada o residual de la coccidioidomicosis pulmonar21. La neumonía persistente se define por una duración mayor a 2 meses, asociada a extensos infiltrados22. En el curso de una neumonía persistente, puede desarrollarse una cavidad, por lo general es una lesión de pared delgada sin nivel hidroaéreo y única en el 90% de los casos. Aunque la mayoría de las cavidades son generalmente de 2 a 4 cm de diámetro, en ocasiones pueden ser más grandes (> 6 cm).
Las formas de evolución de la coccidioidomicosis primaria incluyen la curación sin complicaciones, el coccidioidoma, la neumonía persistente o progresiva, la coccidioidomicosis pulmonar crónica, la coccidioidomicosis diseminada, la enfermedad osteoarticular y la participación del sistema nervioso central23. Los pacientes inmunodeprimidos y los pacientes con diabetes mellitus son particularmente susceptibles a padecer una infección severa y a presentar complicaciones secundarias, incluyendo la neumonía crónica o la enfermedad recidivante15, 24. Además, una gran exposición al inóculo puede acortar el tiempo de incubación y predisponer a enfermedades más severas. Sin embargo, nuestro paciente era un joven sano que, a pesar de vivir en una zona endémica, no tenía ninguna condición asociada, ni estaba expuesto a ninguna de las situaciones asociadas a brotes epidémicos, como son las excavaciones arqueológicas, los ejercicios de entrenamiento militar o las actividades recreativas que se producen en lugares desérticos25.
El desarrollo de una forma progresiva persistente de coccidiodomicosis en un paciente que, como el que describimos, no tiene ninguna enfermedad subyacente es extremadamente inusual26.
En su primera consulta, el cuadro se interpretó como una infección respiratoria bacteriana. Eso es muy común debido a que los síntomas de coccidioidomicosis se parecen mucho a otras infecciones respiratorias comunes. Una erupción cutánea en un paciente que vive en una zona endémica podría haber sido sugerente, las erupciones transitorias ocurren en aproximadamente el 10-50% de los pacientes, otras afectaciones cutáneas (por lo general debido a los fenómenos inmunológicos como eritema tóxico, eritema nodoso y eritema simple) puede orientar el diagnóstico. Sin embargo, nuestro paciente no mostró ninguna manifestación dermatológica sugerente de una infección por C. immitis.
Otro hallazgo potencialmente sugestivo de coccidioidomicosis podría haber sido el aumento del tamaño de los ganglios del mediastino. Las adenopatías se han informado en aproximadamente el 20% de los casos y con mayor frecuencia se presentan de forma ipsilateral a los infiltrados parenquimatosos. El compromiso de los ganglios mediastinales se asocia con mayor riesgo de enfermedad diseminada7. En nuestro paciente, ni las radiografías iniciales ni la TC mostraron la presencia de adenomegalias.
No sólo es extremadamente rara la presencia de una neumonía persistente en un paciente joven inmunocompetente, sino que sólo un pequeño porcentaje del total de los pacientes requieren cirugía como tratamiento definitivo o adyuvante como ocurrió con nuestro paciente. Jaroszewski y col24 comunicaron la experiencia en procedimientos quirúrgicos realizados en pacientes con coccidiodomicosis durante 10 años en la Mayo Clinic de Arizona (una zona altamente endémica). En dicha serie, de 1496 pacientes con coccidiodomicosis, solo 6% requirieron cirugía y sólo 40% de ellos requirieron resección por persistencia de síntomas o progresión de la enfermedad a pesar del tratamiento antifúngico adecuado. Solamente 18 cavidades (1,2% de la población total estudiada) requirieron tratamiento quirúrgico como tratamiento.
La mayoría de los pacientes con enfermedad cavitaria no presentan síntomas, solo hallazgos radiológicos. Los pacientes sintomáticos pueden presentar (como nuestro paciente) hemoptisis, tos, fiebre y dolor torácico localizado, así como sudoración nocturna y pérdida de peso 27. Excepcionalmente, las cavidades crónicas pueden desarrollar complicaciones graves, como las bolas fúngicas de C. immitis u otros hongos (por ejemplo, aspergillus) o la sobreinfección bacteriana. Cuando la lesión cavitaria es (como en el presente caso) una manifestación de una infección persistente, la ruptura en el espacio pleural con el desarrollo de empiema se produce en menos de 3% de todos los casos y es la complicación más grave. Las indicaciones para la cirugía incluyen una cavidad mayor de 4 cm, rápida expansión al espacio pleural, hemoptisis grave o persistente, bola fúngica sintomática, o una fístula broncopleural28. El objetivo para cualquier paciente debería ser la resección suficientemente temprana para evitar las complicaciones graves, como el derrame pleural, neumotórax, empiema y la fístula broncopleural. En los pacientes que presentaron ruptura de la cavidad debido a la presencia de complicaciones de la misma, la morbilidad postquirúrgica fue muy alta (57%)10.
Este paciente fue sometido a cirugía debido a la hemoptisis masiva que presentó en el momento de la admisión al primer hospital de referencia. La enfermedad (como se puede apreciar en la primera TC) ya estaba en una etapa muy avanzada y la cirugía también hubiera sido el tratamiento de elección para prevenir las complicaciones, aún en ausencia de hemoptisis. Desafortunadamente, la consulta tardía y el diagnóstico erróneo inicial, impidieron el inicio temprano de la terapia antifúngica que, probablemente, podría haber evitado el desarrollo de una complicación grave.
Los primeros estudios, antes de la era de la terapia antifúngica, recomendaban la resección quirúrgica de estas cavidades grandes o secundariamente infectadas, empiema y fístulas bronquiales29. Estos mostraron una tasa de complicaciones postoperatorias del 13%, con una tasa de mortalidad de 1,7%. Las complicaciones incluyeron cavidades persistentes, cavidades recurrentes y empiema, con o sin fístula broncopleurocutanea. Estudios más recientes, posteriores a la introducción de la anfotericina B30, mostraron que la tasa de complicaciones postoperatorias se redujo de 20% sin anfotericina B a 4% con la administración de anfotericina B postoperatoria. La serie más reciente de Jaroszewski y col.24 mostró una tasa de morbilidad del 21% y una mortalidad hospitalaria del 2% después de la resección de lesiones cavitarias con complicaciones secundarias.
La experiencia de la literatura muestra que (como en nuestro caso) el retraso en el tratamiento quirúrgico con concomitante empeoramiento de la enfermedad también puede generar complicaciones en el acto quirúrgico y contribuir a complicaciones postoperatorias. En todas las series, las fístulas bronquiales fueron las complicaciones más comunes después de la resección de grandes cavidades. En la serie de Jaroszewski y col24 la lobectomía para la resección de grandes cavidades (como requirió nuestro paciente) se asoció con fístulas prolongadas en el 39% de los casos. La evolución tórpida postoperatoria de nuestro paciente fue de cierta manera la esperada según lo previamente comunicado en la literatura, sobre todo teniendo en cuenta que no sólo requirió la resección una gran cavidad, sino que fue una cirugía de urgencia.
La complicación final de nuestro paciente fue el desarrollo de un empiema. Al momento de la primera admisión hospitalaria, presentaba una enfermedad avanzada, por esta razón es difícil determinar si el compromiso pleural fue previo a la lobectomía o se produjo como una complicación de la intervención quirúrgica.
Los derrames pleurales se producen en el 7% –20% de todos los pacientes sintomáticos y la mayoría de estos se cree que son el resultado de la extensión directa de la infección del parénquima al espacio pleural8,29. Otros mecanismos incluyen la rotura de un granuloma subpleural o el desarrollo de pleuritis secundaria a complejos inmunes producida por antígenos del coccidioides7. El diagnóstico de la etiología del derrame pleural suele hacerse mediante pruebas serológicas, ya que son casi siempre positivas, pero sobre todo por biopsia pleural. El cultivo de líquido pleural y los esputos suelen tener un rendimiento bajo del 20% y 11%, respectivamente10.

La recrudescencia es definida como un score de menos de 50% que se eleva a más del 50%
A pesar de ser frecuente la presencia de derrame pleural, el empiema como manifestación primaria de la coccidioidomicosis es inusual. En una serie previa a la utilización de agentes antifúngicos, Smith y col.31 reportaron una tasa de ruptura de cavidades del 2,6%. La ruptura de una cavidad puede también producir neumotórax, pioneumotórax o una fístula broncopleural32.
La revisión de la literatura realizada por Crum- Ciamflore en 200610 reveló sólo 9 casos de infecciones complicadas del espacio pleural. Más recientemente, Merchant y col, en California, comunicaron cinco casos donde el diagnóstico de C. immitis se confirmó por cultivo del líquido pleural. Los autores interpretan que la capacidad de C. immitis para crecer en el líquido pleural puede explicar el aumento de la incidencia de empiema en la coccidioidomicosis en comparación con otras infecciones fúngicas pulmonares. Todos sus pacientes con empiema requieren toracotomía y decorticación además de tratamiento antifúngico específico33. Nuestro paciente pudo ser tratado solamente con un drenaje torácico percutáneo, pero debido a la persistencia del nivel hidroaéreo debió colocarse una válvula de Heimlich que quedó colocada más de 60 días.
La adición de agentes antifúngicos al tratamiento quirúrgico ha sido motivo de controversia y algunos autores sugirieron que la terapia antifúngica no es necesaria después del debridamiento quirúrgico completo 34. Sin embargo, la mayoría de los expertos recomiendan el tratamiento antifúngico en casos de la enfermedad pulmonar complicada24, 28, especialmente en las rupturas de cavidades al espacio pleural, al menos durante 3 a 6 meses. A pesar de la alta morbilidad y estadías hospitalarias prolongadas, en los casos con derrames pleurales complicados los resultados fueron satisfactorios y no se comunicaron muertes en la literatura10.
Nuestro paciente presentó una prueba de inmunodifusión positiva. La serología es la herramienta de diagnóstico más utilizado. El 90% presenta serología positiva al repetir las pruebas en un periodo de 8 semanas. Sin embargo, un tercio de los individuos con enfermedad cavitaria tendrá serología negativa.
Hoy en día, las pruebas serológicas incluyen enzimoinmunoanalisis (EIA), los títulos de fijación de complemento (FC), e inmunodifusión. Estas pruebas detectan 2 antígenos diferentes, a saber, la precipitación en tubo y la fijación del complemento. La EIA es el más fácil y menos costoso de realizar, pero su sensibilidad y especificidad es menor. En la enfermedad temprana, pueden haber falsos negativos35, 36. Los anticuerpos IgG también pueden ser medidos y cuantificados por fijación del complemento en laboratorios de referencia. Esta prueba es específica para el diagnóstico. El título de FC también tiene cierta importancia pronóstica, ya que un título más alto indica una infección más grave. Las pruebas de FC normalmente se tornan positivas después de la EIA. Los títulos de FC pueden ser seguidos como un indicador de actividad de la enfermedad, un aumento es a menudo indicativo de recaída de la enfermedad25.
La inmunodifusión (ID) de IgM y de IgG es otro método disponible en la práctica clínica general. El ID de la IgM es menos sensible que el EIA, pero es más específico y se prefiere cada vez más para el diagnóstico serológico en la práctica clínica. Estudios experimentales han demostrado que las pruebas serológicas se positivizan 2 o 3 semanas después de la inoculación y las pruebas cutáneas pueden tardar 40 días para ser positivas37.
En nuestro paciente, el cultivo del líquido pleural fue positivo y los resultados histopatológicos obtenidos en la cirugía fueron positivos para coccidiodomicosis. El diagnóstico histopatológico requiere la demostración de esférulas con endosporas (que fueron observados en nuestro paciente dentro de granulomas no caseosos). Las esférulas sin endosporas no son diagnósticos, aunque sí sugerentes10.
El diagnóstico definitivo de la coccidioidomicosis se realiza con aislamiento de C. immitis en una muestra clínica. En nuestro paciente, el tejido obtenido durante la cirugía fue negativo pero luego se obtuvo crecimiento de Coccidioides en el líquido pleural purulento obtenido durante el drenaje. El cultivo del microorganismo se puede realizar en la mayoría de los medios de laboratorio y el crecimiento se produce normalmente después de 2-7 días25, 38.
Nuestro paciente recibió tratamiento inicial con anfotericina liposomal. La anfotericina B está actualmente reservada para la infección pulmonar grave, así como para la enfermedad sistémica. Cualquier neumonía severa con deterioro del intercambio gaseoso se considera generalmente como una indicación de tratamiento con anfotericina21.
Aunque no hay datos controlados, la mayoría de los autores creen que el fluconazol es menos efectivo en estos pacientes 10. El paciente presentó complicaciones graves y se encontraba en un estado crítico después de su primera cirugía. El criterio clínico fue utilizar el medicamento que fuera potencialmente más eficaz y es por eso que se utilizó la anfotericina.
Esa decisión es, sin embargo, controvertida. Para varios autores, los azoles son actualmente los agentes preferidos para el tratamiento de la mayoría de las formas de coccidioidomicosis28, 39. Una de las principales dificultades es evaluar con precisión la respuesta al tratamiento una vez que se ha instaurado la terapia. El Mycoses Study Group40 ha propuesto un sistema de puntuación de varios componentes para los pacientes con coccidioidomicosis sin compromiso meníngeo. Los pacientes se puntúan inicialmente y la sumatoria de puntos define el puntaje basal pre-tratamiento. Una respuesta exitosa se considera una reducción del 50% o más de la puntuación basal en un intervalo de 3 meses40.
Nuestro paciente tuvo una puntuación inicial de 12. Recibió anfotericina liposomal durante quince días y luego se rotó a fluconazol. La puntuación al octavo mes se redujo en un 60%. Los criterios para suspender el tratamiento de la coccidioidomicosis no están bien definidos. Para pacientes sin compromiso meníngeo, 6, 9, o 12 meses de “éxito” (definido como una puntuación menor del 50% de la puntuación basal según los criterios del Mycoses Study Group) fue la duración de la terapia utilizada en diversos ensayos clínicos. La recaída de la enfermedad es común (casi el 30% de los casos en enfermedad no meníngea) tras el tratamiento con azoles. Se recomienda por lo tanto la observación continúa durante años41-43. Nuestro paciente fue tratado con fluconazol durante doce meses y no se observó recaída en 18 meses de seguimiento.
Conclusión
Se presenta el caso de un paciente joven inmunocompetente, que desarrolló una enfermedad pleuropulmonar muy grave debido a coccidiodiomicosis. La mayor morbilidad en este caso se debió al diagnóstico tardío. En cualquier infección pulmonar grave o crónica en un paciente que viva o haya viajado a un área endémica, se debe considerar el diagnóstico de coccidioidomicosis. Aun cuando la mayoría de las infecciones son leves y autolimitadas, algunos pacientes pueden sufrir complicaciones potencialmente mortales que se pueden prevenir mediante el diagnóstico y tratamiento tempranos.
Agradecimientos: Los autores agradecen al Dr. Ricardo Negroni y a la Dra. María Teresa Verón por sus valiosos comentarios sobre este caso y a la Dra. Silvia Quadrelli por su ayuda en la preparación de este manuscrito.
Conflicto de intereses: Los autores declaran no tener conflictos de intereses.
1. Stevens DA. Current concepts: coccidioidomycosis. N Engl J Med 1995; 332: 1077-1082.
2. Abbott KH, Cutler OI. Chronic coccidioidal meningitis: review of the literature and report of seven cases. Arch Pathol 1936; 21: 320-330.
3. Negroni R. Evolución de los conocimientos sobre aspectos clínico-epidemiológicos de la Coccidioidomicosis en las Américas. Rev Argent Microbiología 2008; 40: 246-256.
4. Baptista Rosas RC, Riquelme M. Epidemiología de la coccidioidomicosis en México. Revista Iberoamericana de Micología 2007; 24: 100-105.
5. Valdivia L. Coccidioidomycosis as a common cause of community-acquired pneumonia. Emerg Infect Dis 2006; 12: 958-962.
6. Chiller TM, Gagliani JN, Stevens, DA. Coccidioidomycosis. Infect Dis Clin North Am 2003; 17: 41-57.
7. Batra P. Pulmonary coccidioidomycosis. J Thorac Imaging 1992; 7: 29-38.
8. Einstein HE, Chia JK, Meyer RD. Pulmonary infiltrate and pleural effusion in a diabetic man. Clin Infect Dis 1992; 14: 955-960.
9. Bayer AS, Yoshikawa TT, Galpin JE, Guze LB. Unusual syndromes of coccidioidomycosis: diagnostic and therapeutic considerations. A report of 10 cases and review of the English literature. Medicine 1976; 55: 131-152.
10. Crum-Cianflone NF, Truett AA, Teneza-Mora N, et al. Unusual presentations of coccidioidomycosis: a case series and review of the literature. Medicine 2006; 85: 263-277.
11. Posadas A. Un nuevo caso de micosis fungoidea con psorospermias. Círculo Med Argent 1892; 5: 585-587.
12. Wanke B. Coccidioidomicose. Rev Soc Bras Med Trop 1994; 27: 375-378.
13. Galgiani JN. Coccidioidomycosis: a regional disease of national importance. Rethinking approaches for control. Ann Intern Med 1999; 130: 293-300.
14. Negroni R. Coccidioidomicosis. Epidemiología, clínica y tratamiento. Rev Arg Micología 1994; 17: 3-8.
15. Saubolle MA, McKellar PP, Sussland D. Epidemiologic, clinical, and diagnostic aspects of coccidioidomycosis. J Clin Microbiol 2007; 45: 26-30.
16. Canteros CE, Toranzo A, Suarez-Alvarez R, Davel G, Castanon-Olivares LR, Napoli J. Identidad genética del hongo causante del primer caso de coccidioidomicosis descripto por Alejandro Posadas en 1892. Medicina 2009; 69: 215-20.
17. Canteros CE, Toranzo A, Ibarra-Camou B, et al. La coccidioidomicosis en Argentina, 1892-2009. Rev argent Microbiol 2010; 42: 261-268.
18. Bayer AS. Fungal pneumonias; pulmonary coccidioidal syndromes; Primary and progressive primary coccidioidal pneumonias-diagnostic therapeutic, and prognostic considerations. Chest 1981; 79: 575-583.
19. Kerrick SS, Lundergan LL, Galgiani JN. Coccidioidomysosis at a university health service. Am Rev Respir Dis 1985; 131: 100-102.
20. Werner SB, Pappagianis D, Heindl I, Mickel A. An epidemic of coccidioidomycosis among archeology students in northern California. N Engl J Med 1972; 286: 507-512.
21. Spinello IM, Munoz A, Johnson RH. Pulmonary coccidioidomycosis. Semin Respir Crit Care Med 2008; 29: 166-173.
22. Drutz DJ, Catanzaro A. Coccidioidomycosis: state of the art. Part I. Am Rev Respir Dis 1978; 117: 559-585.
23. Anstead GM, Graybill JR. Coccidioidomycosis. Infect Dis Clin North Am 2006; 20: 621-643.
24. Jaroszewski DE, Halabi WJ, Blair JE, et al. Surgery for pulmonary coccidioidomycosis: a 10-year experience. Ann Thorac Surg 2009; 88: 1765-1772.
25. Crum NF, Lederman ER, Stafford CM, Parrish JS, Wallace MR. Coccidioidomycosis: a descriptive survey of a reemerging disease. Clinical characteristics and current controversies. Medicine 2004; 83: 149-175.
26. Bava AJ, Negroni R, Robles AM, Arechavala A, Bianchi MH. Estudio de algunas características epidemiológicas de 194 casos de paracoccidioidomicosis diagnosticados en el Hospital Muñiz. Rev Arg Micol 1995; 18: 15-22.
27. Galgiani JN. Coccidioidomycosis. West J Med 1993; 159: 153-171.
28. Galgiani JN, Ampel NM, Blair JE, et al. Infectious Diseases Society of America. Coccidioidomycosis. Clin Infect Dis 2005; 41: 1217-1223.
29. Lonky SA, Catanzaro A, Moser K, et al. Acute coccidioidal pleural effusion. Am Rev Respir Dis 1976; 114: 681-688.
30. Grant AR, Melick DW. The surgical treatment of cavitary pulmonary coccidioidomycosis. Arch Surg 1967; 94: 559- 565.
31. Smith CE, Beard RR, Saito MT. Pathogenesis of coccidioidomycosis with special reference to pulmonary cavitation. Ann Intern Med 1948; 29: 623-655.
32. Takamura M, Stark P. Diagnostic case study. Coccidioidomycosis: pleural involvement. Semin Respir Infect 2001; 16: 280.
33. Merchant M, Romero AO, Libke RD, Joseph J. Pleural effusion in hospitalized patients with Coccidioidomycosis. Respir Med 2008; 102: 537-540.
34. Cunningham R, Einstein H. Pulmonary cavities with rupture. J Thorac Surg 1982; 84: 172-177.
35. Pappagianis D. Serologic studies in coccidioidomycosis. Sem Resp Infect. 2001; 16: 242-250.
36. Dosanjh A, Theodore J, Pappagianis D. Probable false-positive coccidioidal serologic results in patients with cystic fibrosis. Pediatr Transplant 1998; 2: 313-317.
37. Negroni R, Finquelievich JL, Elías Costa MR. Estudio de la coccidioidomicosis experimental en ratas Wistar. Rev argent Micol 1985; 8: 7-11.
38. Stockman L, Clark KA, Hunt JM, Roberts GD. Evaluation of commercially available acridinium ester-labeled chemiluminescent DNA probes for culture identification of Blastomyces dermatitidis,Coccidioides immitis, Cryptococcus neoformans, and Histoplasma capsulatum. J Clin Microbiol 1993; 31: 845-850.
39. Vanden Bossche H, Marichal P, Gorrens J, et al. Mode of action studies: Basis for the search of new antifungal drugs. Ann N Y Acad Sci 1988; 544: 191-207.
40. Catanzaro A, Galgiani JN, Levine BE, et al. Fluconazole in the treatment of chronic pulmonary and nonmeningeal disseminated coccidioidomycosis. Am J Med 1995; 98: 249-256.
41. Galgiani JN, Catanzaro A, Cloud GA, et al. Comparison of oral fluconazole and itraconazole for progressive, nonmeningeal coccidioidomycosisda randomized, double-blind trial. Ann Intern Med 2000; 133: 676-686.
42. Galgiani JN, Ampel NM, Catanzaro A, et al. Practice guidelines for the treatment of coccidioidomycosis. Clin Infect Dis 2000; 30: 658-661.
43. Graybill JR. Treatment of coccidioidomycosis. Ann N Y Acad Sci 1988; 544: 451-470.