Autor : Nicolás Itcovici1, 2, Sebastián Lamot1, Marco SolĂs1, Berta Roth3, Silvia Quadrelli1, 4
1FundaciĂłn Sanatorio GĂĽemes 2Hospital Cetrángolo 3Instituto de OncologĂa Angel Roffo 4Hospital Británico
Correspondencia : Nicolás Itcovici Domicilio postal: Teodoro GarcĂa 2384 8vo CP 1426 CABA. E-mail: nitcovici@intramed.net
Resumen
Las enfermedades oncológicas ocupan en todo el mundo el tercer lugar como causa de muerte. El tórax es un destino de varias de las potenciales complicaciones que sufren estos pacientes y que pueden, en muchos casos, hacer más tórpida la evolución, interferir la respuesta al tratamiento e incluso amenazar la vida del paciente. Las complicaciones torácicas de las enfermedades malignas se producen por efecto directo del tumor (por invasión o compresión de estructuras vecinas) o de manera indirecta por los efectos sistémicos del tumor o por los efectos colaterales del tratamiento. El objetivo de la presente revisión es describir las complicaciones torácicas más frecuentes de las enfermedades malignas.
Abstract
Thoracic Complications of Malignant Diseases Malignant diseases are the third cause of death worldwide. Chest is the target of many complications occurring in these patients at some time of the disease evolution . Those complications may impair the recovery, interfere with the response to treatment and are occasionally life-threatening. They caused by direct effect of tumor due to invasion or compression of regional organs or by indirect effect due to systemic spread or treatment side reactions. The aim of this review is to describe the most frequent thoracic complications of malignant diseases.
Los pacientes con enfermedad oncológica de cualquier origen suelen experimentar complicaciones médicas, tanto de urgencia como de emergencia, que son el resultado directo o indirecto de la enfermedad maligna subyacente.
Las complicaciones de los tumores intratorácicos pueden deteriorar significativamente la calidad de vida de un paciente, incluso pueden ser fatales a menos que se reconozcan y se traten adecuadamente. Es fundamental el conocimiento de este tema, no sólo para el grupo de especialidades que atienden esta patología, sino también para médicos clínicos y generalistas que muy posiblemente sean quienes tengan contacto inicial con el paciente.
Si bien estas complicaciones generan potencialmente gran morbilidad y mortalidad, su manejo adecuado determina en gran medida la evolución global de la enfermedad. Las complicaciones torácicas de las enfermedades malignas pueden dividirse en directas e indirectas según el mecanismo de acción.
Las complicaciones por efecto directo incluyen la compresión u obstrucción mecánica de las estructuras vecinas a la masa tumoral, incluyendo el síndrome de vena cava superior (SVCS), compresión traqueal y neumonía post-obstructiva entre otras (Tabla 1). Además, los tumores pueden invadir directamente una estructura vecina, con el daño a su integridad. Los ejemplos incluyen invasión vascular que provoca hemorragia o el compromiso del conducto torácico que origina un quilotórax. El compromiso neoplásico pleural puede causar neumotórax o derrame pleural maligno y la invasión a través de las paredes de las vías aéreas centrales o el esófago puede dar lugar a una fístula traqueo-esofágica o bronco-esofágica.

Por otro lado, las complicaciones indirectas (Tabla 2) de las enfermedades malignas incluyen manifestaciones sistémicas de la propia enfermedad, como estado de hipercoagulabilidad, lo que lleva a la trombosis venosa profunda y embolia pulmonar, y un estado de inmunocompromiso, que da lugar a diversas infecciones, así como los síndromes paraneoplásicos con una gran variedad de manifestaciones.

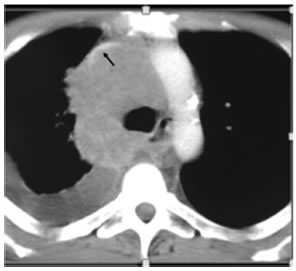
En este texto revisaremos algunas de las complicaciones torácicas que se encuentran con más frecuencia y en cuyo reconocimiento y manejo, el neumonólogo puede tener un rol esencial. No son parte de esta revisión las distintas formas de metástasis parenquimatosas de patología oncológica ni la obstrucción de la vía aérea por enfermedad maligna pulmonar o extrapulmonar que por su especificidad requieren un tratamiento por separado.
1. Complicaciones de enfermedades malignas intratorácicas relacionadas directamente con el tumor
Síndrome vena cava superior
El síndrome de vena cava superior (SVCS) relacionado con la malignidad es generalmente debido a la compresión por un tumor voluminoso o la formación de trombos intraluminales tumorales. El cáncer de pulmón es la causa más común del SVCS1. Representa el 65-80% de los casos según diferentes series publicadas2. Tanto la masa tumoral como las metástasis mediastinales pueden comprimir la vena cava. El SVCS es más frecuente en pacientes con cáncer de pulmón de células pequeñas (CPCP) que en pacientes con cáncer de pulmón no pequeñas células (CPNPC). En el momento del diagnóstico, el SVCS puede ser observado en 10% de los pacientes con CPCP y en 1.7% de los pacientes con CPNPC3. Otras causas pueden ser linfoma, tumores del timo, cáncer de esófago o enfermedad metastásica de un tumor primario extratorácico. La presencia de edema en esclavina y disnea son características típicas del SVCS. La circulación colateral se produce en los sistemas venosos de la ácigos, intercostales, mediastinal, paravertebral, hemiácigos, toracoacromioclavicular y transhepática, (fístula sistémico-portal). Estas vías colaterales pueden ponerse mejor en evidencia con reconstrucciones multiplanares y tridimensionales4. Los signos de alerta de severidad del SVCS incluyen estridor (que puede indicar la presencia de edema laríngeo), confusión y obnubilación (por edema cerebral).
La tomografía computarizada con contraste endovenoso es la prueba más comúnmente utilizada para el diagnóstico de la obstrucción de vena cava superior (OVCS). Permite, en general, el diagnóstico preciso y puede mostrar el grado, nivel y causa de la misma. La presencia de vasos colaterales dilatados es altamente sugestiva de OVCS, con una sensibilidad del 96% y una especificidad del 92%4, 5. La venografía por resonancia magnética es una alternativa que está siendo utilizada cada vez más. Tiene una sensibilidad y especificidad del 100% así como gran precisión para evaluar las grandes venas centrales6, 7.
En el pasado, el SVCS se consideraba una emergencia médica. Sin embargo, varios estudios retrospectivos han demostrado que en ausencia de edema laríngeo, compresión de la vía aérea central o edema cerebral, no existe riesgo inmediato8. Por esta razón, se debe siempre realizar el diagnóstico de la causa y la toma de biopsia, ya que las modalidades de tratamiento pueden variar ampliamente dependiendo de la histología del tumor maligno.
El tratamiento de la OVCS incluye tanto la colocación de un stent intravascular como el tratamiento con quimio y radioterapia1. La elección del tratamiento depende del tipo de tumor, la extensión de la enfermedad, la gravedad de los síntomas, y el pronóstico del paciente9. La esperanza de vida media en pacientes con SVCS es de aproximadamente 6 meses, con un rango de 1.5 a 9.5 meses. Sin embargo, las estimaciones varían ampliamente dependiendo de la agresividad tumoral10. La modalidad de tratamiento adoptado tiene fundamentalmente la intención de paliar los síntomas. Ocasionalmente, en algunos tumores se podrá tener expectativas de curación de la enfermedad y el enfoque de tratamiento permitirá la conversión de un método paliativo inicial a uno definitivo cuando el estado del paciente lo determine.
La presencia de edema laríngeo u obstrucción de la tráquea en la TC puede requerir intervenciones urgentes como la colocación de tubo endotraqueal. El edema cerebral asociado con SVCS requiere las técnicas convencionales de manejo y, por supuesto, descartar causas intracraneales de edema cerebral11.
Los esteroides se utilizan a menudo como una medida temporal para reducir el edema y los síntomas asociados, aunque no hay evidencia que documente la eficacia ni la dosis potencialmente útil. En una revisión retrospectiva de 107 pacientes, el uso de esteroides y diuréticos vs ningún tipo de terapia farmacológica, tuvo una similar tasa de mejoría clínica (aproximadamente 84%)8. Debe evaluarse que la administración de esteroides conlleva el riesgo de enmascarar otros diagnósticos, especialmente ante la sospecha de linfoma12.
Para lograr el rápido alivio de los síntomas, la colocación de un stent endovascular es el tratamiento de elección. El crecimiento del tumor intramural o la presencia de trombosis se consideran contraindicaciones absolutas para su uso13.
La colocación del stent intravascular se realiza generalmente bajo anestesia local en la sala de hemodinámia14, 15. Ante la presencia de un coágulo, se deben utilizar trombolíticos, aunque su beneficio en este contexto sigue sin estar claro y la morbilidad del procedimiento es mayor cuando se asocia el uso de trombolíticos16, 17. Incluso en ausencia de un trombo visible, algunos autores recomiendan la administración de anticoagulación profiláctica (por ejemplo, con heparina de bajo peso molecular) después de la colocación del stent, dado el mayor riesgo de trombosis asociado a las enfermedades malignas. El beneficio de esta medida no es claro. El uso de esteroides tampoco es mencionado en la mayoría de los estudios10. Tampoco es clara la ventaja de un tipo particular de stent sobre otros18.
En una revisión sistemática de diferentes opciones de tratamiento para la OVCS en pacientes con cáncer de pulmón, la colocación de stents endovasculares mejoró los síntomas en el 95% de los casos. Estas tasas de mejoría son superiores a la quimio y radioterapia, que muestran tasas de respuesta del 84% y el 78%, y tasas de recaída del 17% y el 19% para el CPCP y CPNPC respectivamente. Luego de la colocación del stent, el 10.7% de la los pacientes experimentaron una OVCS debido a trombo dentro de la prótesis vascular o crecimiento interno del tumor en un lapso de entre 3 días a 8 meses. En el 76.5% de todos los pacientes con recaída, la permeabilidad del stent pudo ser restaurada por trombolisis o mediante la inserción de un stent adicional. Estudios más recientes mostraron hallazgos similares19, 15. En cuanto a la comparación con otros métodos de tratamiento, el stent percutáneo auto expansible demostró mejor control de los síntomas que la radioterapia, lo que sugiere que debe ser la primera elección20. No hay ensayos controlados que comparen la eficacia del stent endovascular con radiación o quimioterapia. La colocación de stents endovasculares en pacientes con SVCS es un método relativamente sencillo, accesible en nuestro medio y que debe ser enfáticamente considerado (como otros métodos de tratamiento paliativo) en todo paciente con una expectativa de vida superior a los dos o tres meses.
La eficacia de la quimioterapia depende del tipo histológico. En CPCP, la quimioterapia sola ofrece respuesta de la OVCS en el 76.9% y la radioterapia sola en el 77.6%. La respuesta de la OVCS obtenida en un número pequeño de pacientes que recibieron quimio-radioterapia sincrónica fue del 83.3%. En el CPNCP, la mejoría de la OVCS luego de quimioterapia o radioterapia es menos convincente (59% y 63% respectivamente). La tasa de respuesta en caso de quimiorradioterapia sincrónica fue sólo del 31.3%3. Linfomas, CPCP y tumores de células germinales son considerados por muchos como los tumores sensibles a la quimioterapia, con altas tasas de respuesta e inicio rápido de la reducción del tumor. La quimioterapia puede aliviar los síntomas del SVCS en hasta el 80% de los pacientes con linfoma no Hodgkin12. Por lo tanto, la quimioterapia se utiliza con frecuencia como tratamiento inicial para el SVCS de estos tumores. La radioterapia aislada puede ser utilizada y puede proporcionar una respuesta rápida, pero por lo general se obtienen peores resultados a largo plazo y sólo se utiliza en pacientes que no son candidatos para quimioterapia12.
El tratamiento del SVCS secundario a enfermedad oncológica debe ser individualizado, basado en tratamientos anteriores y el pronóstico general. Para los pacientes con una esperanza de vida corta, la atención debería centrarse en el alivio de los síntomas a corto plazo. Para los pacientes con mejor pronóstico, el tratamiento no debe ser dirigido sólo a la obstrucción sino a tratar de mejorar la supervivencia. Para los pacientes con un diagnóstico reciente de cáncer sensible a quimioterapia, como CPCP, linfomas y los tumores de células germinales, la quimioterapia sistémica como intervención inicial es razonable. Para los pacientes con un diagnóstico reciente de CPNCP, parece recomendable la colocación de stent endovascular o radioterapia como primera intervención. Para los pacientes que tienen tumores recurrentes o progresivos y SVCS sintomático que ya han recibido radioterapia mediastinal, se recomienda considerar la colocación de stents endovasculares para el manejo de síntomas. Para los pacientes con obstrucción severa que son tratados con radioterapia, un ciclo corto de corticoides (dexametasona 4 mg vía oral dos a cuatro veces al día) es razonable durante la radioterapia para evitar mayor compromiso debido al edema causado por la aguda respuesta de la radioterapia.
Derrame pleural
Los pacientes oncológicos desarrollan con frecuencia derrames pleurales (DP) tanto benignos como malignos. A menudo estos pueden ser de gran tamaño, lo que lleva a la compresión del parénquima pulmonar adyacente, con el consecuente compromiso respiratorio. Los derrames pleurales benignos pueden ser consecuencia de una obstrucción linfática por el tumor, neumonía post-obstructiva o disminución de la presión oncótica. Los derrames malignos son generalmente por extensión directa a la pleura.
Las principales causas de derrames pleurales malignos (DPM) son el cáncer de pulmón (37% de todos los derrames malignos), mama, ovario y linfoma21. El DPM se define como aquel en el que se encuentran células malignas en el líquido o en la biopsia. En ausencia de evidencia de citología tumoral, pero en presencia de enfermedad maligna conocida, se suele hablar de derrame paramaligno. La pleura es un blanco frecuente en cáncer de mama. En un estudio de necropsia, Thomas et al22 encontraron metástasis en la pleura visceral y parietal en el 75% y el 50% de los casos, respectivamente. El derrame es más comúnmente unilateral e ipsilateral al tumor primario23. Estos autores22 especulan que la lateralidad de la metástasis pleural en el cáncer de mama se debe a la diseminación linfática. El adenocarcinoma es el tipo histológico más común. Los DPM secundarios a mesoteliomas generalmente (aunque hay excepciones) se asocian a una neoplasia pleural sólida.
En el 10% de los pacientes con DPM es masivo24. La tomografía computarizada o la ecografía, tienen mayor sensibilidad para identificar pequeños derrames pleurales (cercana al 100%)25.
Deslauriers y Mehran26 revisaron el rol de la toracoscopía en el diagnóstico y tratamiento de las enfermedades pleurales. Estos autores comunicaron que una combinación de toracoscopía con citología, biopsia y estudios bacteriológicos ofrecían resultados negativos en sólo el 2.5% de los derrames, en comparación con 33% a 63% cuando se realiza biopsia pleural por aguja. En particular, se subraya la importancia de la toracoscopía en el diagnóstico del mesotelioma maligno. El examen citológico del líquido pleural es poco fiable para el diagnóstico de este tumor, con un rendimiento diagnóstico de sólo el 20%. El mesotelioma maligno tiene preferencia por los ángulos costofrénicos los cuales no son accesibles a la aguja de biopsia, pero sí fácilmente visibles a través del toracoscopio. La visualización directa de la pleura contribuye a un marcado incremento del rendimiento diagnóstico (85% a 94%)26.
Durante el curso de su enfermedad, 50% de las pacientes con cáncer de mama, 25% con cáncer de pulmón y más del 90% de los mesoteliomas, desarrollan síntomas secundarios a derrame pleural27. Hasta el 50% de los pacientes no refieren mejoría clínica luego de una toracocentesis21 ya que la disnea tiene origen en causas asociadas como linfangitis carcinomatosa o atelectasia por obstrucción bronquial. En caso de mejoría de síntomas luego de una toracocentesis, es posible repetir el procedimiento si el DP recidiva. Esta conducta puede ser adecuada en pacientes con mal estado general y con una supervivencia limitada de semanas a meses, en quienes se evalúa que un procedimiento de más envergadura (como la toracoscopía con sellamiento pleural) puede resultar demasiado agresivo. Sin embargo, debe considerarse el riesgo de infección por toracocentesis recurrentes y la posibilidad de que se produzcan adherencias pleurales que, después de dos o tres procedimientos, impidan drenar adecuadamente el espacio pleural. Si bien la colocación de un tubo de drenaje suele proporcionar una evacuación adecuada de la cavidad pleural, alrededor del 80% de los pacientes con DPM presentan recurrencia del derrame dentro de los 30 días después de retirado el tubo. Si bien existe controversia, la mayor parte de los autores acuerdan que en pacientes con un Karnofsky mayor de 30 o un PS (ECOG) 1, la pleurodesis por toracoscopía es el método de elección28.
No hay discusión acerca de que en pacientes con un buen performance status y DPM refractarios, se debe ofrecer pleurodesis con agentes esclerosantes. Para lograr la fusión de ambas pleuras se pueden utilizar diferentes métodos, como método mecánico, resección parcial de pleura o pleurodesis química (este último de elección). Entre los agentes esclerosantes, el talco sin amianto ha demostrado ser superior a otros agentes comúnmente usados , con una tasa de éxito del 81% -100% en comparación con la tetraciclina (del 70-75%)29. Revisiones de varios estudios informan que el talco provee los más altos índices de éxito de pleurodesis (71 a 96%)30, 31. Los efectos adversos del talco incluyen disnea, fiebre, dolor torácico, atelectasia, neumonía, arritmias, empiema e insuficiencia respiratoria aguda, que puede progresar a síndrome de distrés respiratorio agudo (SDRA)32. Maskell y col.33 demostraron que los pacientes a quienes se les realizaba pleurodesis con talco de pequeño tamaño de partícula (50% de partículas <15 μm) tenían un gradiente alveolo-arterial de O2 a las 48hs, superior al de aquellos en quienes la pleurodesis se les realizó con talco de partícula >15 μm33. En un estudio multicéntrico de 558 pacientes con DPM con talco de pequeña partícula, no hubo muertes, casos de SDRA o neumonitis34.
Una revisión de la base de datos Cochrane revisó 36 estudios randomizados controlados que incluyeron 1499 pacientes sometidos a pleurodesis, apoyando el uso de esclerosantes para prevenir la recurrencia de los DPM35. En esta revisión el talco fue el más eficaz de los esclerosantes con un riesgo relativo de no recurrencia de 1.34 a favor del talco comparado con la bleomicina, tetraciclina o tubo de drenaje solo. No hubo incremento de la mortalidad asociado a la pleurodesis. En una encuesta de 859 neumonólogos que en su conjunto habían realizado más de 8300 pleurodesis, la mayoría prefería el uso de talco para todos los DPM, incluido el mesotelioma36. Debe tenerse en cuenta que el talco aumenta la captación de F-18 FDG en tomografía por emisión de positrones y así simular tumores malignos pleurales que pueden persistir en imágenes hasta por 10 años37.
La instilación del esclerosante se puede realizar a través de un tubo en el tórax, lo cual es un procedimiento sencillo, eficaz y ampliamente disponible que ofrece la posibilidad de utilizarlo en pacientes con DPM recurrente y mal estado general38. La realización de VATS ofrece la ventaja de una evacuación completa de la cavidad pleural así como de una visualización de la superficie pleural, lo que permite la toma de múltiples biopsias que alcanzan una precisión diagnóstica del 100%. Por otra parte, se pueden liberar las adherencias y lograr una expansión pulmonar completa que permite una adecuada distribución del talco nebulizado bajo visión directa. Para alcanzar una alta eficacia del procedimiento, los pulmones deben expandirse completamente durante el proceso de pleurodesis. Si el pulmón no es capaz de una expansión completa se produce un aumento de la presión negativa intrapleural que favorece el llenado de la cavidad pleural ex vacuo hasta que el equilibrio de la presión hidrostática se restablece, lo que resulta en un derrame pleural de tamaño variable. Varios estudios compararon la eficacia y seguridad del talco en suspensión a través de un tubo de toracostomía versus la insuflación toracoscópica de talco, y revelaron resultados contradictorios. Algunos autores sugieren que no existe una clara diferencia en la eficacia entre estos dos métodos27. No se ha realizado ningún ensayo a gran escala, multicéntrico, que compare pleurodesis química mediante catéteres vs. toracoscopía para determinar los riesgos relativos, los costos y beneficios31. En la revisión sistemática Cochrane antes mencionada, se analizaron dos ensayos que trataron a 112 pacientes con DPM con talco ya sea por toracoscopía o toracotomía o por tubo utilizando varias sondas pleurales de diferentes tamaños35. El riesgo relativo para la no recurrencia de DPM fue ligeramente a favor de la toracoscopía (1.19). Si la toracoscopía no está disponible, la pleurodesis con talco por tubo tiene una alta tasa de éxito y es una opción a considerar31.
La tasa de respuesta a la pleurodesis depende del tipo de tumor (menor en el mesotelioma, mayor en el carcinoma de mama). Una glucosa en el líquido pleural < 60 mg/dl, un índice de Karnofsky < 70, la presencia de derrame masivo, un pH del líquido pleural< 7.20, la presencia de alteraciones en el parénquima y los niveles de LDH> 600 U/l han demostrado ser factores de riesgo para la falla de la pleurodesis39.
La pleurodesis está contraindicada si el pulmón está atrapado o hay derrame pleural multiloculado. En el “síndrome de pulmón atrapado” un requisito previo para una pleurodesis exitosa es la realización de una decorticación toracoscópica, normalmente asociada con mayor morbilidad. El objetivo del tratamiento en pacientes con derrame pleural es una paliación exitosa de los síntomas y una no recidiva del derrame en la radiografía de tórax. Si debido al mal estado general del paciente con una esperanza de vida muy corta o una incompleta re-expansión pulmonar después de una evacuación del líquido pleural, la realización de una pleurodesis no es posible, se puede insertar un catéter permanente para el drenaje intermitente lo que permitirá el tratamiento ambulatorio. Un catéter insertado en forma ambulatoria mediante una técnica con o sin guía ecográfica permite el drenaje intermitente de grandes volúmenes de líquido pleural40, 41. Esto proporciona alivio de la disnea en el 94 a 100% de los pacientes independientemente del tipo celular42, 43 con una duración de al menos 30 días en el 90%44. La mayoría de los pacientes tratados con catéteres tunelizados no requieren procedimientos posteriores. Las tasas de éxito son más altas cuando el derrame pleural ocupa 20% o menos del hemitórax42. Distintos estudios han mostrado que entre el 40 y el 73% de los pacientes tratados con catéteres tunelizados experimentan pleurodesis espontánea al cabo de 2 a 6 semanas de drenaje42, 45. Es más probable que ocurra pleurodesis espontánea en pacientes con cáncer de mama o tumores ginecológicos primarios, ausencia de irradiación de la pared torácica, positividad citológica y la reexpansión completa del pulmón subyacente46. La resolución de DPM permite la extracción del catéter en el 60% de los pacientes tratados46. Si la pleurodesis espontánea no se produce, los catéteres tunelizados proporcionan acceso para la instilación de agentes esclerosantes para una pleurodesis química47. Las complicaciones tempranas como el neumotórax, enfisema subcutáneo y el dolor se observaron en el 8% de los pacientes. En el 14% de todos los pacientes se observaron complicaciones tardías relacionadas con al catéter, como la infección o su desprendimiento. La fusión entre las pleuras con la posterior retirada del catéter se logró en 11 de los 51 pacientes (21%). En resumen, el catéter permanente parece ser una opción segura para el tratamiento del DPM en el manejo ambulatorio48 y es una opción a considerar en primera instancia para pacientes en los que se sospecha pulmón atrapado.
Algunos pacientes, que no pueden someterse a pleurodesis y que no pueden manejar el drenaje intermitente con catéteres tunelizados en el hogar, pueden beneficiarse con derivación pleuroperitoneal49. Se obtiene un control efectivo de los síntomas hasta en el 95% de los pacientes. La tasa de complicaciones es del 15%49.
Derrame pericárdico maligno
El desarrollo de taponamiento cardíaco secundario a un derrame pericárdico maligno (DPeM) es sin duda una verdadera emergencia oncológica. La pericardiocentesis de urgencia a menudo salva vidas, pero este procedimiento rara vez es un tratamiento adecuado debido a que el derrame se repite por lo general rápidamente a menos que se tomen medidas para evitar la subsiguiente acumulación de líquido.
En pacientes oncológicos hasta el 40% de los derrames pericárdicos pueden ser benignos50. Puede producirse engrosamiento inflamatorio o derrame pericárdico secundariamente a la administración de radioterapia o quimioterapia, o por obstrucción al drenaje linfático, particularmente en pacientes con compromiso de ganglios linfáticos mediastinales. La pericarditis inflamatoria también se puede ver como parte de la enfermedad injerto contra huésped en pacientes con trasplante de médula ósea anterior y debido a causas infecciosas en pacientes inmunodeprimidos.
El desarrollo de derrame pericárdico maligno (DPeM) no es infrecuente en pacientes con neoplasias diseminadas. La incidencia en series de autopsia varía entre 5% y 53% según el tumor primitivo51, 52. Dado que la mayor parte de los pacientes están asintomáticos, la incidencia es siempre mayor en los estudios de autopsias que en las series clínicas. Los tumores que invaden el pericardio más frecuentemente son el carcinoma de pulmón (36% de los casos de DPeM), mama, linfomas, leucemias y melanoma. Estos tumores explican el 75% de todos los DPeM diagnosticados clínicamente53 aunque prácticamente cualquier tumor puede comprometer el pericardio. El pericardio es el único sitio de metástasis hasta en 20% de los carcinomas de pulmón53. Las metástasis miocárdicas son mucho menos frecuentes y están habitualmente asociadas con el melanoma o el linfoma, siendo más probable la invasión hematógena.
Hay varios mecanismos posibles para el desarrollo de metástasis pericárdicas o DPeM incluyendo la extensión directa de una neoplasia adyacente; la diseminación linfática del compromiso de los ganglios linfáticos cercanos al pericardio y la diseminación hematógena. Los derrames malignos pueden ser hemorrágicos y pueden acumularse lenta o rápidamente. La principal complicación de un DPeM es la restricción del llenado cardíaco con compromiso hemodinámico que requiere intervención urgente. La extensión directa es más frecuente en los grandes carcinomas broncogénicos, los tumores de esófago o menos frecuentemente de mama y la diseminación hematógena en los melanomas.
El DPeM generalmente es de comienzo insidioso y puede ser la primera manifestación de un tumor no diagnosticado. Es una complicación seria ya que puede amenazar la vida del paciente de manera rápida si se produce taponamiento pericárdico. En la serie de Thurber y colaboradores, la presencia de DPeM contribuyó a la muerte en 85% de los pacientes51. Una de las manifestaciones posibles de un DPeM es la presencia de arritmias, especialmente en presencia de compromiso miocárdico. La presencia de una arritmia de iniciación súbita en un paciente con cáncer siempre debe hacer sospechar el compromiso pericárdico y/o miocárdico54 y obliga a la realización de un ecocardiograma para diagnosticar la presencia de derrame pericárdico. El diagnóstico de DPeM generalmente se confirma por pericardiocentesis. Los resultados de la citología son positivos en 80-90% de los pacientes con DPeM55.
El primer paso en el tratamiento del derrame pericárdico es el drenaje percutáneo guiado por ecocardiografía56 para proporcionar un alivio rápido de los síntomas. La guía mediante ecocardiografía se ha consolidado como la técnica estándar para el drenaje del líquido pericárdico. En el estudio de 1127 procedimientos realizados en 977 pacientes, la pericardiocentesis guiada por ecocardiografía fue exitosa en el 97% de los casos con complicaciones entre el 1.2% y 3.5%57. Las complicaciones de la pericardiocentesis incluyen la rotura ventricular, arritmias, neumotórax, infarto y/o laceración arterial coronaria e infección. Las tasa de recurrencia del derrame pericárdico a los 90 días puede ser tan alta como el 90% en pacientes con cáncer.
Las estrategias disponibles para minimizar el riesgo de recurrencia son el tratamiento quirúrgico, la terapia esclerosante y la quimioterapia local.
Las intervenciones quirúrgicas más comunes son la pericardiotomía subxifoidea o la creación de una ventana pleuropericárdica por videotoracoscopía o toracotomía izquierda. Este procedimiento se asocia con una baja morbilidad, mortalidad y tasas de recurrencia y se puede considerar como una alternativa razonable de diagnóstico o modalidad de tratamiento para la pericardiocentesis en pacientes seleccionados58.
La cirugía torácica asistida por video (VATS) permite la resección de un área del pericardio más amplia comparada con el acceso subxifoideo, sin la morbilidad de la toracotomía59. El cirujano puede crear una ventana pleuropericárdica y evaluar la patología pleural concomitante, especialmente frecuente en los pacientes con DPeM. Una desventaja de la VATS es que requiere de anestesia general con ventilación de un solo pulmón, situación riesgosa en pacientes gravemente enfermos.
La pericardiotomía con balón es un procedimiento donde se coloca un catéter en el espacio pericárdico guiado por radiología. El inflado del balón crea un canal para el paso de fluido en el espacio pleural, donde la reabsorción se produce más fácilmente. La pericardiotomía con balón puede ser útil en los derrames recurrentes.
El principio de estos métodos consiste en crear una comunicación persistente a través de la que se drena el líquido e inducir una reacción inflamatoria que genere una adhesión de las dos capas del pericardio56. La ventaja de los procedimientos quirúrgicos sobre la pericardiocentesis fue documentada por varios estudios. Un análisis retrospectivo publicado en 2008 en relación con el tratamiento del DPeM confirmó la eficacia y seguridad de la pericardiotomía con balón como procedimiento inicial. La tasa de recurrencia luego de la pericardiotomía con balón fue del 7.4% vs. 14.3% después de la aspiración simple60.
Otro tratamiento disponible es la esclerosis pericárdica. Se ha sugerido que un procedimiento eficaz se logra instilando en el saco pericárdico diferentes agentes esclerosantes o con actividad citostática, como tetraciclinas, bleomicina, tiotepa o radionúclidos. Los primeros agentes utilizados fueron la tetraciclina y la doxiciclina, cuya eficacia fue documentada en varios estudios61, pero estos agentes fueron acompañados por una gran cantidad de eventos adversos como dolor torácico o fiebre. Varios estudios evaluaron el efecto de la bleomicina esclerosante en DPeM documentando su superioridad frente a agentes esclerosantes puros, fundamentalmente debido a la menor morbilidad62 y mayor eficacia que el drenaje pericárdico solo63.
La terapia esclerosante intrapericárdica se asocia a buenos resultados en cuanto a la prevención de recaídas y mejora la supervivencia. La ausencia de derrame pericárdico 30 días después del drenaje se obtiene en el 70 a 90% de los pacientes tratados, sin variaciones significativas entre los distintos tratamientos. Son necesarios estudios aleatorios, caso-control para evaluar el mejor agente para el tratamiento de los derrames pericárdicos malignos.
Por último, hay que destacar la posibilidad de realizar quimioterapia intrapericárdica. El objetivo es la regresión de las metástasis pericárdicas y miocárdicas por una alta concentración local del fármaco antineoplásico. El carboplatino64, el cisplatino o la mitoxantrona han sido utilizados para intentar el control de derrame pericárdico refractario. La supervivencia después del tratamiento intrapericárdico depende mucho del tumor primitivo y si bien ha sido reportada para el global de los pacientes una mediana de 115 días, si el primario es carcinoma de mama la misma se extiende a 272 días en el 72% de los pacientes con cáncer de mama, linfomas o leucemias lo que muestra supervivencias superiores al año65. El tratamiento de las metástasis pericárdicas de carcinoma de pulmón con radioterapia ha mostrado supervivencias más prolongadas que el drenaje aislado (22.5 vs 17.5 semanas).
Quilotórax
En ocasiones, el derrame pleural obedece a daño en el conducto torácico, con la resultante producción de un derrame quiloso. Las neoplasias más comúnmente asociadas con esta complicación son el linfoma y las metástasis mediastinales masivas. Las opciones de tratamiento incluyen el drenaje pleural, la pleurodesis, la derivación pleuroperitoneal, y la ligadura del conducto torácico66. En pacientes con linfoma relacionado con quilotórax refractario a la quimioterapia y radioterapia, la pleurodesis toracoscópica con talco tiene una tasa aceptable de complicaciones y una tasa de éxito cercana al 100%. La derivación pleuroperitoneal se considera un tratamiento seguro y eficaz en el tratamiento del quilotórax persistente en niños en ausencia de ascitis quilosa.
2. Complicaciones relacionadas con el tratamiento de los tumores malignos intratorácicos
Trombosis vena cava superior
Las causas del síndrome de vena cava superior han cambiado dramáticamente en los últimos 50 años. Antes de 1949, los tumores malignos representaban sólo un tercio de los casos, mientras que en la actualidad, las neoplasias intratorácicas son la causa del 90% o más de los casos.
La etiología benigna más frecuente de la trombosis de VCS en pacientes con cáncer es la presencia de un catéter venoso central a largo plazo. Durante la última década, el uso cada vez mayor de dispositivos de acceso venoso colocados centralmente se ha traducido en un aumento de la OVCS, secundaria a trombosis en pacientes con trastornos malignos y no malignos. De hecho, la trombosis venosa central está en el segundo lugar, luego de la infección, como el peligro más grave asociado con los catéteres intravasculares. En estudios recientes, la incidencia de trombosis con el uso de catéteres de silicona osciló entre el 0% y 16%. Puel et al revisaron su experiencia con 379 pacientes que recibieron quimioterapia a través de dispositivos de acceso venoso. Diez pacientes desarrollaron trombosis sintomática (nueve con la vena cava superior y uno en la vena subclavia izquierda). Se observó una fuerte correlación entre la posición del catéter y la incidencia de trombosis. Aquellos catéteres colocados en la parte superior de la vena cava izquierda estaban en mayor riesgo (28.6%) de trombosis67. Pequeñas series han reportado que el tratamiento con estreptoquinasa y uroquinasa tenía una buena resolución de la trombosis en aproximadamente 7 días68.
b. Enfermedad torácica inducida por radiación
Varios tipos de radiación y ángulos de haz se utilizan en el tratamiento de pacientes con tumores malignos torácicos dependiendo de la localización, la extensión y el diagnóstico etiológico de la enfermedad. Incluso los diferentes terapeutas de una misma institución pueden elegir diferentes métodos de tratamiento69. La aparición de radio-opacidades en pacientes en tratamiento con terapia de radiación obliga a considerar en el diagnóstico diferencial a la neumonitis radiante, la recurrencia local por diseminación linfática del tumor y las complicaciones infecciosas70. La forma y distribución de la enfermedad pulmonar inducida por radiación varía con los diferentes métodos de radiación. La interpretación de las radiografías de tórax suele ser difícil sin un conocimiento preciso de los métodos de radiación utilizados. En general, los cambios pulmonares inducidos por radiación se limitan habitualmente al volumen irradiado71.
La tasa de aparición de este tipo de manifestaciones ha cambiado a lo largo de la historia de la radioterapia, ya que la incorporación de diversas técnicas de optimización física de distribución de dosis (RT tridimensional conformada, RT de Intensidad modulada, técnicas estereotáxicas) ha reducido en gran medida su ocurrencia. El empleo extendido de herramientas de evaluación de planes de tratamiento, como los histogramas de dosis volumen, ha permitido la adaptación personalizada con reducción de complicaciones en tejidos sanos cuando las restricciones pueden ser respetadas. Así lo atestiguan series de instituciones relevantes como el MDACC.
Se reconocen dos etapas clínicas distintas en la enfermedad pulmonar inducida por radiación: una fase temprana, transitoria, caracterizada por neumonitis con gran reacción inflamatoria y una etapa posterior que se caracteriza por fibrosis crónica. La neumonitis por radiación por lo general ocurre alrededor de 4-12 semanas después de la finalización de la radioterapia72. La fibrosis puede tomar entre 6-24 meses para su desarrollo pero por lo general se mantiene estable después de 2 años.
Las manifestaciones radiológicas de la enfermedad pulmonar inducida por radiación (EPIR), incluyen opacidades en vidrio esmerilado o consolidación en la fase aguda y bronquiectasias por tracción, pérdida de volumen y consolidación en la última fase73. Sin embargo, los recientes avances en las técnicas de irradiación pueden producir manifestaciones radiológicas de EPIR que no son típicas. La discusión interdisciplinaria con el radioterapeuta es importante para facilitar el diagnóstico y el tratamiento de estos pacientes.
Aunque la neumonitis por radiación por lo general se produce en el pulmón irradiado, puede ocurrir fuera de las áreas de tratamiento hasta en el 20% de los pacientes71, 74. Los cambios que se ven fuera de la zona irradiada suelen ser similares pero menos marcados. La hipótesis prevalente es que representan una reacción de hipersensibilidad75. Ocasionalmente puede existir derrame pleural ipsilateral, con frecuencia asociado con atelectasia pulmomar70.
A pesar de que las opacidades de la neumonitis por radiación pueden resolver sin secuelas radiológicas cuando el daño es limitado, en los casos de lesiones más graves hay progresión a la fibrosis70. Esta se manifiesta radiológicamente como un área bien definida de pérdida de volumen, cicatrices, y bronquiectasias por tracción. La consolidación típicamente tiene un borde relativamente definido que se ajusta a las áreas de irradiación76. La fibrosis y la pérdida de volumen acentúan la diferencia entre la zona de pulmón irradiado y las áreas normales del pulmón. La misma puede verse en pacientes sin evidencia previa de neumonitis por radiación clínicamente evidente70.
Son factores de riesgo para la neumonitis por radiación (NR) la edad avanzada, la afectación de campos medios e inferiores del pulmón y la presencia de comorbilidades. El tabaquismo activo parece proteger contra NR, aunque se desconocen las razones77.
El diagnóstico de NR es a menudo difícil por las condiciones del daño radiante a las estructuras adyacentes (esófago, pericardio). Ante la presencia de neumonitis radiante aguda, siempre debe considerarse y excluirse la posible presencia de infección como causa del cuadro clínico y radiológico. En la neumonitis radiante con importante compromiso fibroso, el diagnóstico suele facilitarse por la marcada delimitación geográfica, la coexistencia con cambios sugestivos de mediastinitis actínica y la coincidencia con el área irradiada.
No está definida la mejor modalidad de tratamiento. El uso de prednisona, en dosis de 50 a 60 mg por día durante una semana seguido de disminución progresiva de la dosis, ha demostrado disminuir los síntomas y mejorar la función pulmonar78. Sin embargo, hay poca evidencia de que el tratamiento antiinflamatorio intensivo, si bien mejora los signos y síntomas, tenga algún efecto sobre evolución a fibrosis o el pronóstico de la fibrosis ya establecida79. Dados los efectos secundarios relacionados a los glucocorticoides, su administración debería ser analizada cuidadosamente caso a caso80. La pentoxifilina (Trental) se ha comunicado como potencialmente beneficiosa en la prevención de la toxicidad pulmonar temprana y tardía81.
Otros efectos torácicos de la radiación incluyen cambios en el árbol traqueobronquial, la pleura y el mediastino. Puede desarrollarse estenosis traqueal muchos años después de la radioterapia. En ocasiones la distorsión del árbol bronquial es simplemente consecuencia de la fibrosis avanzada.
Los derrames pleurales asociados a RT son radiológicamente indistinguibles de los derrames malignos, pero el desarrollo de un derrame dentro de los 6 meses de la RT, la coexistencia de neumonitis por radiación y sobre todo la resolución del derrame son sugestivos de un derrame inducido por radiación70. En ocasiones se ha comunicado neumotórax espontáneo luego de radioterapia torácica, por lo general, en pacientes que desarrollaron fibrosis actínica.
El uso de radioterapia mediastinal de haz externo puede producir calcificación de los ganglios linfáticos, especialmente en pacientes tratados por linfoma (normalmente linfoma de Hodgkin). La calcificación no es radiológicamente evidente hasta al menos I2 meses luego de la finalización de la radioterapia82.
Luego de la radioterapia mediastinal se pueden desarrollar quistes tímicos. Aunque generalmente estos son pequeños y radiográficamente invisibles, también pueden ser grandes y simular enfermedad residual o recurrente83.
Las complicaciones cardíacas luego de la radiación suelen ser tardías e insidiosas. Incluyen la pericarditis aguda y crónica, la enfermedad coronaria, los trastornos en la conducción eléctrica y la miocardiopatía84. Las complicaciones cardíacas son una complicación probable de los tratamientos de radioterapia en mediastino y mama, sobre todo cuando la radiación afecta más del 65% del área cardíaca. La mayor parte de la literatura se refiere al tratamiento de la enfermedad de Hodgkin, ya que los pacientes con esta enfermedad tienden a ser jóvenes y tener supervivencias prolongadas y por tanto tienen más posibilidades de manifestar complicaciones cardíacas tardías. Es relevante mencionar que el rol histórico de la radioterapia en el tratamiento de esta patología ha variado, se ha reducido sustancialmente su uso a favor de esquemas combinados, lo cual, asociado a la utilización de técnicas más selectivas y reducción de dosis y volúmenes de irradiación, ha contribuido a una menor incidencia de complicaciones. Pericarditis, ángor, infarto de miocardio y arritmias son cuadros clínicos potenciales. El infarto de miocardio es la complicación fatal más común. La incidencia de la enfermedad isquémica del corazón aumenta a los 10 años de iniciado el tratamiento radiante, al sumarse los naturales procesos de envejecimiento85.
Muchos pacientes con disfagia, que recibieron radiación mediastinal, no tienen alteraciones radiológicas. El hallazgo más común es la dismotilidad esófagica86. La radiación directa genera inflamación del esófago en el corto plazo. En el largo plazo se puede desarrollar estenosis y dilatación esofágica.
Los riesgos relacionados con el tratamiento de las neoplasias pulmonares son generalmente previsibles y pueden ser minimizados mediante la selección adecuada de los pacientes que tienen más probabilidades de beneficiarse del tratamiento con el menor riesgo de toxicidad
Conclusiones
Existe un amplio espectro de manifestaciones torácicas en pacientes con cáncer de cualquier origen. El tórax es un blanco frecuente de enfermedad metastásica en el parénquima, la pleura, el pericardio y los ganglios linfáticos. Las complicaciones del tratamiento son variables e incluyen complicaciones relacionadas con la cirugía (principalmente infección), radiación (neumonitis radiante y cardiotoxicidad) y la quimioterapia (neumonía).
Conocer las características radiológicas de las complicaciones torácicas en pacientes con cáncer permite la interpretación adecuada de la imagen en función del contexto clínico. El manejo multidisciplinario es esencial para discutir los tratamientos recibidos y su potencial influencia en el diagnóstico etiológico actual, pero fundamentalmente para evaluar el pronóstico de la enfermedad en su conjunto y decidir como un equipo de tratamiento acerca de los costos y beneficios de cada modalidad terapéutica.
A pesar de que el compromiso torácico secundario generalmente está asociado a enfermedad avanzada, muchas de estas complicaciones tienen opciones de tratamientos que mejoran considerablemente la calidad de vida y en las cuales el neumonólogo puede hacer un aporte fundamental.
Por último, cuando la opción terapéutica no es efectiva para resolver la complicación, debe resaltarse la importancia en paliar los síntomas para acompañar al paciente en la última etapa de su enfermedad y trabajar en conjunto fundamentalmente con los médicos de cuidados paliativos.
Agradecimientos: Agradecemos al Dr. Juan Carlos Spina (Hospital Británico de Buenos Aires) por el aporte de la imagen del síndrome de vena cava superior.
Conflicto de intereses: Los autores declaran que no tienen conflicto de intereses.
1. Kvale PA, Selecky PA, Prakash UBS. Palliative care in lung cancer: ACCP evidence based clinical practice guidelines. Chest 2007; 132: 368-403.
2. Gompelmann D, Eberhardt R, Herth F. Advanced Malignant Lung Disease: What the Specialist Can Offer. Respiration 2011; 82 :111-23.
3. Rowell NP, Gleeson FV. Steroids, radiotherapy, chemotherapy and stents for superior vena caval obstruction in carcinoma of the bronchus: a systematic review. Clin Oncol 2002; 14: 338-51.
4. Eren S, Karaman A, Okur A. The superior vena cava syndrome caused by malignant disease. Imaging with multi-detector row CT. Eur J Radiol 2006; 59: 93-103.
5. Kim HJ, Kim HS, Chung SH. CT diagnosis of superior vena cava syndrome: importance of collateral vessels. AJR Am J Roentgenol 1993; 161: 539-42.
6. Lin J, Zhou KR, Chen ZW, Wang JH, Yan ZP, Wang YX. Vena cava 3D contrast-enhanced MR venography: a pictorial review. Cardiovasc ntervent Radiol 2005; 28: 795-805.
7. Thornton MJ, Ryan R, Varghese JC, Farrell MA, Lecey B, Lee MJ. A three-dimensional gadolinium-enhanced MR venography technique for imaging central veins. AJR Am J Roentgenol 1999; 173: 999-1003.
8. Schraufnagel DE, Hill R, Leech JA, Pare JA. Superior vena caval obstruction. Is it a medical emergency? Am J Med 1981; 70: 1169-74.
9. Yu JB, Wilson LD, Detterbeck FC: Superior vena cava syndrome-a proposed classification system and algorithm for management. J Thorac Oncol 2008; 3: 811-4.
10. Rowell NP, Gleeson FV: Steroids, radiotherapy, chemotherapy and stents for superior vena caval obstruction in carcinoma of the bronchus. Cochrane Database Syst Rev 4: 2001; CD001316.
11. Wan JF, Bezjak A. Superior vena cava syndrome. Emerg Med Clin North Am 2009; 27: 243-55.
12. Perez-Soler R, McLaughlin P, Velasquez WS, et al: Clinical features and results of management of superior vena cava syndrome secondary to lymphoma. J Clin Oncol 1984; 2: 260-6.
13. Padley SPG, Hansell DM. Imaging techniques; in Albert RK, Spiro SG, Jett JR (eds): Clinical Respiratory Medicine, 3”” ed. Philadelphia: Mosby Elsevier, 2008, p 1-68.
14. Greillier L, Barlesi F, Doddoli C, et al. Vascular stenting for palliation of superior vena cava obstruction in non-small-cell lung cancer patients: a future ‘standard’ procedure?. Respiration 2004; 71:178-83.
15. Nagat T, Makutani S, Uchida H, et al. Follow-up results of 71 patients undergoing metallic stent placement for the treatment of a malignant obstruction of the superior vena cava. Cardiovasc Intervent Radiol 2007; 30: 959-67.
16. Wilson LD, Detterbeck FC, Yahalom J. Clinical practice. Superior vena cava syndrome with malignant causes. N Engl J Med 2007; 356:1862-9.
17. Rrowe MT, Davies CH, Gaines PA. Percutaneous management of superior vena cava occlusions. Cardiovasc Intervent Radiol 1995; 18: 367-72.
18. Schindler N, Vogelzang RL. Superior vena cava syndrome. Experience with endovascular stents and surgical therapy. Surg Clin North Am 1999; 79: 683-94.
19. Torre JP, Gimenez C, Kleisbauer JP. Vascular stenting for palliation of superior vena cava obstruction in non-small-cell lung cancer patients: a future ‘standard‘ procedure? Respiration 2004; 71: 178-83.
20. Smayra T, Otal P, Chabbert V, et al. Long-term results of endovascular stent placement in the superior caval venous system. Cardiovasc Intervent Radiol 2001; 24: 388-94.
21. Khaleeq G, Musani AI. Emerging paradigms in the management of malignant pleural effusion. Respir Med 2008; 102: 939-48.
22. Thomas JM, Redding WH, Sloane JP. The spread of breast cancer: importance of the intrathoracic lymphatic route and its relevance to treatment. Br J Cancer 1979; 40: 540-7.
23. Connolly JE Jr, Erasmus JJ, Patz EF Jr. Thoracic manifestations of breast carcinoma: metastatic disease and complications of treatment. Clin Radiol 1999; 54: 487-94.
24. Neragi-Miandoab S. Surgical and other invasive approaches to recurrent pleural effusion with malignant etiology. Support Care Cancer 2008; 16: 1323-31.
25. Midthun DE, Jett JR: Lung tumors. In Albert RK, Spiro SG, Jett JR (eds): Clinical Respiratory Medicine 3”” ed. Philadelphia: Mosby Elsevier,2008, p 605-32.
26. Deslauriers J, Mehran RJ. Role of thoracoscopy in the diagnosis and management of pleural diseases. Semin Thorac Cardiovasc Surg 1993, 5: 284-93.
27. Stefani A, Natali P, Casali C, Morandi U. Talc poudrage versus talc slurry in the treatment of malignant pleural effusion: a prospective comparative study. Eur J Cardiothorac Surg 2006; 30: 827-32.
28. Burrows C, Mathews C, Colt H. Predicting survival in patients with recurrent sintomatic malignant pleural effusions. Chest 2000; 117: 73-8.
29. Cardillo G, Facciolo F, Carbone L et al. Long term follow up of video-assisted talc pleurodesis in malignant recurrent pleural effusions. Eur J Cardio-thoracic Surg 2002; 21: 302-6.
30. Mager HJ, Maesen B, Verzijlbergen F, Schramel F. Distribution of talc suspension during treatment of malignant pleural effusion with talc pleurodesis. Lung Cancer 2002; 36: 77-81.
31. Tan C, Sedrakyan A, Browne J, Swift S, Treasure T. The evidence on the effectiveness of management for malignant pleural effusion: a systematic review. Eur J Cardiothorac Surg 2006; 29: 829-38.
32. De Campos JR, Vargas FS, de Campos Werebe E, et al. Thoracoscopy talc poudrage: a 15-year experience. Chest 2001; 119: 801-6.
33. Maskell NA, Lee YC, Gleeson FV, Hedley EL, Pengelly G, Davies RJ. Randomized trials describing lung inflammation after pleurodesis with talc of varying particle size. Am J Respir Crit Care Med 2004; 170: 377-82.
34. Janssen JP, Collier G, Astoul P. Safety of pleurodesis with talc poudrage in malignant pleural effusion: a prospective cohort study. Lancet 2007; 369: 1535-9.
35. Shaw P, Agarwal R. Pleurodesis for malignant pleural effusions. Cochrane Database Syst Rev 2004; 1: CD002916.
36. Lee YC, Baumann MH, Maskell NA. Pleurodesis practice for malignant pleural effusions in five English-speaking countries: survey of pulmonologists. Chest 2003; 124: 2229-38.
37. Peek H, Van der Bruggen W, Limonard G. Pleural FDG uptake more than a decade after talc pleurodesis. Case Report Med 2009; 2009: 650-864.
38. Aydogmus U, Ozdemir S, Cansever L, Sonmezoglu Y, Kocaturk Cl, Bedirhan MA. Bedside talc pleurodesis for malignant pleural effusion: factors affecting success. Ann Surg Oncol 2009; 16: 740-50.
39. Martínez-Moragón E, Aparicio J, Sanchis J, Menéndez R, Cruz Rogado M, Sanchis F. Malignant pleural effusion: prognostic factors for survival and response to chemical pleurodesis in a series of 120 cases. Respiration 1998; 65: 108-13.
40. Van den Toorn LM, Schaap E, Surmont VF, Pouw EM, van der Rijt KC, van Klaveren RJ. Management of recurrent malignant pleural effusions with a chronic indwelling pleural catheter. Lung Cancer 2005; 50: 123-7.
41. Putnam Jr JB, Light RW, Rodriguez RM, et al. A randomized comparison of indwelling pleural catheter and doxycycline pleurodesis in the management of malignant pleural effusions. Cancer 1999; 86: 1992-9.
42. Tremblay A, Michaud G. Single-center experience with 250 tunnelled pleural catheter insertions for malignant pleural effusion. Chest 2006; 129: 362-8.
43. Pien GW, Gant MJ, Washam CL, Sterman DH. Use of an implantable pleural catheter for trapped lung syndrome in patients with malignant pleural effusion. Chest 2001; 119: 1641-6.
44. Pollak JS, Burdge CM, Rosenblatt M, Houston JP, Hwu WJ, Murren J. Treatment of malignant pleural effusions with tunneled long-term drainage catheters. J Vasc Interv Radiol 2001; 12: 201-8.
45. Musani AI, Haas AR, Seijo L, Wilby M, Sterman DH. Outpatient management of malignant pleural effusions with small-bore, tunneled pleural catheters. Respiration 2004; 71: 559-66.
46. Warren WH, Kim AW, Liptay MJ. Identification of clinical factors predicting PleurX catheter removal in patients treated for malignant pleural effusion. Eur J Cardiothorac Surg 2008; 33: 89-94.
47. Pollak JS. Malignant pleural effusions: treatment with tunneled long-term drainage catheters. Curr Opin Pulm Med 2002; 8: 302-7.
48. Sioris T, Sihvo E, Salo J, Räsänen J, Knuuttila A: Long-term indwelling catheter (PleurX) for malignant pleural effusion unsuitable for talc pleurodesis. Eur J Surg Oncol 2009; 35: 546-51.
49. Genc O, Petrou M, Ladas G, Goldstraw P. The long-term morbidity of pleuroperitoneal shunts in the management of recurrent malignant effusions. Eur J Cardiothorac Surg 2000; 18: 143-6.
50. Buzaid AC, Garewal HS, Greenberg BR. Managing malignant pericardial effusion. West J Med 1989; 150: 174-9.
51. Thurber DL, Edwards JE, Achor RW. Secondary malignant tumors of the pericardium. Circulation 1962; 26: 228-41.
52. Adenle AD, Edwards JE. Clinical and pathologic features of metastatic neoplasms of the pericardium. Chest 1982; 81: 166-9.
53. Deloach JF, Haynes JW. Secondary tumors of heart and pericardium; review of the subject and report of one hundred thirty-seven cases. AMA archives of internal medicine 1953; 91: 224-49.
54. Waller BF, Taliercio CP, Howard J, Green F, Orr CM, Slack JD. Morphologic aspects of pericardial heart disease: Part II. Clin Cardiol 1992; 15: 291-8.
55. DG Meyers, DJ Bouska. Diagnostic usefulness of pericardial fluid cytology Chest 1989; 95: 1142-3.
56. Lestuzzi C. Neoplastic pericardial disease: old and current strategies for diagnosis and management. World J Cardiol 2010; 2: 270-9.
57. Tsang TS, Enriquez-Sarano M, Freeman WK, et al. Consecutive 1127 therapeutic echocardiographically guided pericardiocenteses: clinical profile, practice patterns, and outcomes spanning 21 years. Mayo Clin Proc 2002; 77: 429-36.
58. Motas C, Motas N, Rus O, Horvat T. Left paraxiphoidian approach for drainage of pericardial effusions. Interact Cardiovasc Thorac Surg 2010; 10: 4-5.
59. Palma JH, Gaia DF, Guilhen JC, Branco JN, Buffolo E. Video-thoracoscopic pericardial drainage in the treatment of pericardial effusions. Rev Bras Cir Cardiovasc 2009; 24: 44-9.
60. Swanson N, Mirza I, Wijesinghe N, Devlin G. Primary percutaneous balloon pericardiotomy for malignant pericardial effusion. Catheter Cardiovasc Intervent 2008; 71: 504-7.
61. Shepherd FA, Morgan C, Evans WK, Ginsberg JF, Watt D, Murphy K. Medical management of malignant pericardial effusion by tetracycline sclerosis. Am J Cardiol 1987; 60: 1161-6.
62. Liu G, Crump M, Goss PE, Dancey J, Shepherd FA. Prospective comparison of the sclerosing agents doxycycline and bleomycin for the primary management of malignant pericardial effusion and cardiac tamponade. J Clin Oncol 1996; 14: 3141-7.
63. Kunitoh H, Tamura T, Shibata T, et al. JCOG Lung Cancer Study Group, Tokyo, Japan: A randomized trial of intrapericardial bleomycin for malignant pericardial effusion with lung cancer (JCOG9811). Br J Cancer 2009; 100: 464-9.
64. Moriya T, Takiguchi Y, Tabeta H, et al. Controlling malignant pericardial effusion by intrapericardial carboplatin administration in patients with primary non-small-cell lung cancer. Br J Cancer 2000; 83: 858-62.
65. Wilkes JD, Fidias P, Vaickus L, Perez RP. Malignancy-related pericardial effusion. 127 cases from the Roswell Park Cancer Institute. Cancer 1995; 76: 1377-87.
66. Romero S. Nontraumatic chylothorax. Curr Opin Pulm Med 2000; 6: 28791.
67. Puel V, Caudry M, Le Metayer P. Superior vena cava thrombosis related to catheter malposition in cancer chemotherapy given with implanted ports. Cancer 1993, 72: 2248-52.
68. Morales M, Comas V, Trujillo M, Dorta J. Treatment of catheter-induced thrombotic superior vena cava syndrome: a single institution’s experience. Support Care Cancer 2000; 8: 334-8.
69. Emami B, Graham MV. Lung. Principles and practice of radiation oncology. In: Perez CA, Brady LW, (eds) 3rd ed. Philadelphia: Lippincott-Raven, 1998, p 1181-1220.
70. Libshitz HI, Southard ME. Complication of radiation therapy: the thorax. Semin Roentgenol 1974; 9: 41-9.
71. Ikezoe J, Morimoto S, Takashima S, Takeuchi N, Arisawa J, Kosuka T. Acute radiation-induced pulmonary injury: computed tomography evaluation. Semin Ultrasound CT MR 1990; 11: 409-16.
72. Park KJ, Chung JY, Chun MS, Suh JH. Radiation-induced lung disease and the impact of radiation methods on imaging features. RadioGraphics 2000; 20: 83-98.
73. Ooi GC, Kwong DL, Chan KN, et al. Serial HRCT lung changes after 3-field radiation treatment of breast cancer. Clin Radiol 2000; 55: 817-24.
74. Bell J, McGivern D, Bullimore J, Hill J, Davies ER, Goddard P. Diagnostic imaging of post-irradiation changes in the chest. Clin Radiol 1988; 39: 109-19.
75. Gibson PG, Bryant DH, Morgan OW, et al. Radiation-induced lung injury: a hypersensitivity pneumonitis? Ann Intern Med 1988; l09: 288-90.
76. Libshitz HI, Brosof AB, Southard M. Radiographic appearance of the chest following extended field radiation therapy for Hodgkin’s disease. Cancer 1973; 32: 206-15.
77. Vogelius IR, Bentzen SM. A literature-based meta-analysis of clinical risk factors for development of radiation induced pneumonitis. Acta Oncol 2012; 51: 975-83.
78. Monson JM, Stark P, Reilly JJ, et al. Clinical radiation pneumonitis and radiographic changes after thoracic radiation therapy for lung carcinoma. Cancer 1998; 82: 842-50.
79. Williams JP, Johnston CJ, Finkelstein JN. Treatment for radiation-induced pulmonary late effects: spoiled for choice or looking in the wrong direction? Curr Drug Targets 2010; 11: 1386-94.
80. Kwok E, Chan CK. Corticosteroids and azathioprine do not prevent radiation-induced lung injury. Can Respir J 1998; 5: 211-4.
81. Ozturk B, Egehan I, Atavci S, Kitapci M. Pentoxifylline in prevention of radiation-induced lung toxicity in patients with breast and lung cancer: a double-blind randomized trial. Int J Radiat Oncol Biol Phys 2004; 58: 213-9.
82. Logan PM. Thoracic manifestations of external beam radiotherapy. AJR Am J Roentgenol 1998; 171: 569-77.
83. Baron RL, Sagel SS, Baglan Ri. Thymiccysts following radiation therapy for Hodgkin’s disease. Radiology 1981; 141: 593.
84. Loyer EM, Delpassand ES. Radiation induced heart disease: imaging features. Semin Roentgeno! 1993; 28: 32l-32.
85. Gaya AM, Ashford RF.Cardiac complications of radiation therapy. Clin Oncol 2005; 17: 153-9.
86. DuBrow RA. Radiationchanges in hollow viscera. Semin Roentgeno 1994; 24: 38-52.