Autor : Antonio Alexander Castro Altuna1,2, Catalina Alexandra Calle Delgado1, 2, Santiago Ramiro Cadena Mosquera2
1Universidad San Francisco de Quito 2 Hospital Carlos Andrade MarĂn (USFQ-HCAM). Quito-Ecuador
Correspondencia : Dr. Alexander Castro A. Email: alex95_3@hotmail.com
Resumen
Las manifestaciones pulmonares contribuyen significativamente a la morbilidad y
mortalidad de las miopatías inflamatorias idiopáticas; dichas enfermedades engloban
2 grandes entidades, como son la polimiositis (PM) y la dermatomiositis (DM), grupo
heterogéneo de enfermedades sistémicas autoinmunes, en las que el músculo es el
blanco inapropiado de una destrucción mediada por la inmunidad. Su principal característica es la debilidad muscular y la identificación de una inflamación subyacente en
la biopsia muscular.
Aunque el principal órgano diana es el músculo estriado, la piel y el pulmón, entre otros órganos internos, se afectan con frecuencia, por lo que las miopatías inflamatorias se consideran enfermedades sistémicas. El compromiso pulmonar es cada vez más reconocido como una complicación grave y una causa frecuente de morbi-mortalidad en estas
enfermedades. Entre las complicaciones pulmonares podemos mencionar la neumonía
por aspiración, la hipoventilación, la enfermedad pulmonar intersticial y una especial
mención merece el neumomediastino espontáneo en pacientes con diagnóstico previo
tanto de polimiositis (PM), como de dermatomiositis (DM) en quienes se han reportado
alrededor de 3 casos a nivel mundial.
El neumomediastino espontáneo (NE) es una entidad clínica de origen desconocido y
evolución benigna que afecta especialmente, pero no exclusivamente, a personas o individuos jóvenes, el mismo que en ocasiones se explica por rotura alveolar como resultado
de una afección parenquimatosa periférica en enfermedades intersticiales que producen
panalización; sin tener una historia previa de traumatismo torácico.
Palabras clave: Neumomediastino; Polimiositis; Dermatomiositis; Enfisema subcutáneo; Fibrosis pulmonar
Abstract
Pneumomediastinum and spontaneous pneumothorax in a patient with
dermatomyositis. Report of a case and review of the literature
Pulmonary manifestations contribute significantly to morbidity and mortality of idiopathic inflammatory myopathies, which include two large conditions, polymyositis (PM)
and dermatomyositis (DM). These are a heterogeneous group of systemic autoimmune
diseases, in which the muscle is the target of an inappropriate immune-mediated
destruction. Its main features are muscle weakness and identification of underlying
inflammation on muscle biopsy.
Although the main target organ is skeletal muscle, also skin and lungs, among other
organs, are often affected by the so-called inflammatory myopathies systemic diseases.
Pulmonary involvement is increasingly recognized as a serious complication and a
frequent cause of morbidity and mortality in these diseases. Pulmonary complications
include aspiration pneumonia, hypoventilation, interstitial lung disease and in particular spontaneous pneumomediastinum of which about 3 cases have been reported in the
world in patients with a previous diagnosis of both polymyositis and dermatomyositis .
The spontaneous pneumomediastinum is a benign clinical entity of unknown origin
that affects especially, but not exclusively, young people. It is sometimes explained by
alveolar rupture caused by the presence of honeycomb due to a peripheral parenchymal
interstitial disease, without having a previous history of chest trauma.
Key words: Pneumomediastinum; Polymyositis; Dermatomyositis; Subcutaneous emphysema; Pulmonary fibrosis
Introducción
La dermatomiositis (DM) y la polimiositis (PM),
son enfermedades inflamatorias sistémicas que
afectan principalmente al músculo esquelético.
Estas entidades también pueden comprometer otras
estructuras como la piel, el sistema articular y otros órganos internos, especialmente el pulmón1. Pueden
considerarse dentro del grupo de enfermedades
raras debido a su baja incidencia. Estudios epidemiológicos establecen una incidencia anual media
de 2,1 a 7,7 casos nuevos por millón de habitantes1.
La afectación visceral más frecuente es el pulmón, con comunicaciones que estiman la prevalencia desde el 10 hasta el 60%1. La afección respiratoria más frecuente en pacientes con DM y PM es
el compromiso intersticial1, 2, 13, 15, generalmente de
instalación subaguda o crónica. Es frecuente que
los anticuerpos antisintetasa, en especial los antiJo-1 (antihistidil-ARNt sintetasa) sean positivos,
con lo cual se constituye el síndrome antisintetasa caracterizado por la presencia de miopatía
inflamatoria (DM o PM), neumopatía intersticial
y artritis, fiebre, fenómeno de Raynaud y “manos
de mecánico”1, 2, 4, 13. Con mucha menor frecuencia,
se puede desarrollar una neumonitis intersticial
aguda de curso fulminante, con destrucción del
parénquima pulmonar, neumomediastino y anticuerpos antisintetasa negativos, cuyo sustrato
patológico es el daño alveolar difuso (DAD) y que
suele conducir a una insuficiencia respiratoria
irreversible en un plazo de meses a pesar de un
tratamiento inmunosupresor intenso; el trasplante
pulmonar es la única opción terapéutica34.
La disminución de los valores de la capacidad vital
forzada (CVF) puede estar magnificada por la coexistencia de afectación de los músculos respiratorios.
El neumomediastino es la presencia de aire libre
alrededor de las estructuras mediastinales, ocurre después de traumatismos, mediastinitis aguda y
ventilación mecánica. Sin embargo el neumomediastino también puede surgir espontáneamente,
en ausencia de cualquier causa obvia. El neumomediastino espontáneo (NE) ha sido comunicado
como una complicación poco frecuente de diversos
tipos de enfermedades intersticiales asociadas a
patologías del tejido conectivo; la miositis inflamatoria es la enfermedad más frecuente del tejido
conectivo asociada con neumomediastino2, 13. En series recientes de pacientes con DM/PM y enfermedad pulmonar intersticial, solo 8 comunicaciones
mencionaron la presencia de neumomediastino,
estimándose una prevalencia del 8.3% de neumomediastino o neumotórax entre pacientes con DM/PM1, 23. Por otro lado, los mecanismos fisiopatológicos, los desenlaces y los factores pronósticos
del neumotórax o neumomediastino asociados
con enfermedades del tejido conectivo no han sido
evaluados. Algunos autores especulan que la causa
del neumotórax podría ser el daño alveolar en áreas
periféricas del parénquima secundario a maniobras
de hiperpresión torácica, con la consiguiente salida
de aire al intersticio y posteriormente al mediastino2, 3, sin embargo, en los pocos casos comunicados
no se documentó la presencia de un daño pulmonar con áreas quísticas o bullas. También se ha
mencionado que dichas miopatías se acompañan
de lesiones traqueobronquiales necrotizantes de
naturaleza vasculítica cuya perforación podría ser
la causa del neumomediastino2, 3.
El NM es una rara complicación de la DM/PM,
con una incidencia de 2/100 000, pero que acompaña con frecuencia a los casos de mayor agresividad
clínica y ocasionalmente se asocia a neumotórax
espontáneo2. Se presenta el caso de una paciente
con DM y NM que ingresa al servicio de Neumología del Hospital “Carlos Andrade Marín”, por
presentar dicha entidad.
Caso clínico
Paciente de 52 años, femenina, fumadora (4 paquetes/año), diagnosticada de dermatomiositis (DM)
1 mes atrás, en base a los 2 primeros criterios de
Boham (debilidad muscular progresiva y elevación
de las enzimas musculares, con lesiones dérmicas
características), no se realizó el anti-Jo pues no se
disponía de dicho reactivo en el hospital, se inició tratamiento con prednisona 15 mg/d, cloroquina
250 mg/d, azatriopina 50 mg/d. En ese momento
fue diagnosticada además de enfermedad intersticial pulmonar.
La paciente había presentado 6 meses atrás un
cuadro que fue interpretado como neumonía; fue
dada de alta con resolución del cuadro pero con
persistencia de la tos y expectoración purulenta. Al
momento del diagnóstico de la DM se solicitó una
tomografía axial computada (TAC) de tórax, que
puso en evidencia la presencia de enfermedad intersticial. La espirometría mostró CVF: 1.96 (68%);
VEF1: 1.84 (77%) y una relación VEF1/CVF 94%.
La broncoscopía demostró una inspección normal
y todos los cultivos fueron negativos. La citología
fue negativa para células neoplásicas. No se realizó biopsia transbronquial. A los 20 días del diagnóstico inicial y a los 8 días de realizarse la broncoscopía,
la paciente presentó dolor de gran intensidad a
nivel de tórax anterior, con tumefacción de cara y
cuello, los síntomas se incrementaron y asistió al
servicio de emergencias.
Al examen físico la paciente estaba estable hemodinámicamente, afebril, no se observaron signos
de vasculitis, presentaba un leve dolor muscular y
articular, y mostraba importante enfisema subcutáneo a nivel de cara y cuello. El laboratorio mostró leucopenia (3 610), con hemoglobina y hematocrito
normales (14.6 g/dl y 45,3%) y neutrofilia (71.7%).
Una TAC de cuello mostró enfisema subcutáneo
importante anterior, lateral y posterior. La TAC de
tórax demostró hiperdensidades basales de predominio derecho, y enfisema subcutáneo (Figuras 1, 2 y 3). Una nueva broncoscopía realizada durante
la internación fue normal; este examen se realizó en busca de lesiones traqueo-bronquiales o fístulas
que justifiquen el NM.
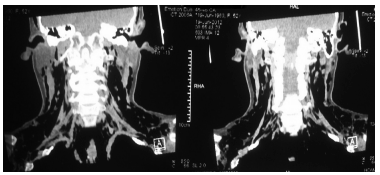
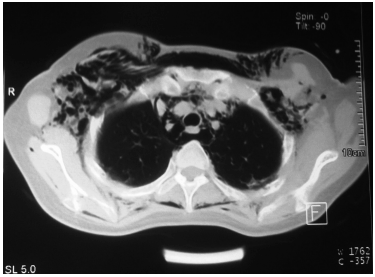
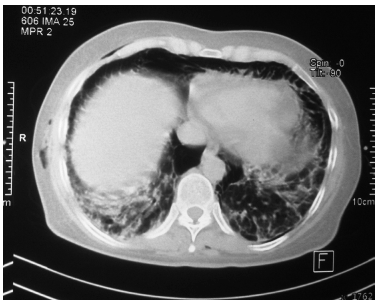
Un esofagograma y una endoscopía digestiva alta fueron normales, excepto por la presencia de eritema y algunas erosiones planas de 2 mm en el antro. Se realizaron dichos estudios para descartar la presencia de fístulas esofágicas.
Se indicó tratamiento ajustando la dosis de corticoide, aumentando a prednisona 30 mg/d asociada a omeprazol 40 mg/d, se añade cloroquina 250 mg/d, y se continúa con la azatioprina a la misma dosis de 50 mg/d; por la candidiasis faríngea encontrada se añade fluconazol 150 mg/d, con lo que se evidencia una mejoría lenta pero favorable, luego de algunos días de permanecer hospitalizada se indica su egreso en buenas condiciones generales con remisión de su sintomatología respiratoria y del enfisema subcutáneo.
Discusión
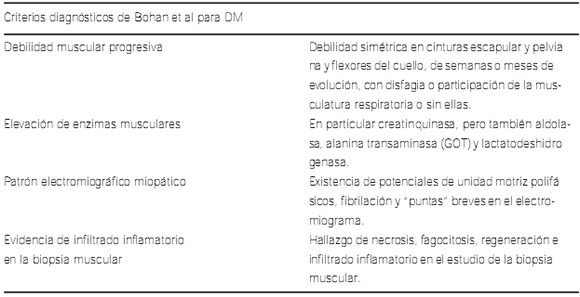
Tradicionalmente los términos DM/PM se utilizan para definir una serie de enfermedades sistémicas, que se caracterizan por miopatía inflamatoria mediada por mecanismos autoimunitarios. La forma de presentación más común de estas enfermedades es la debilidad muscular, que suele afectar de forma característica a la musculatura esquelética proximal. Los músculos flexores del cuello y la musculatura estriada de la orofaringe se afectan con frecuencia y pueden ser causa de disfagia con eventuales alteraciones de la deglución y neumonía aspirativa. El diagnóstico de la DM/PM se establece en base a los criterios de Bohan (Tabla 1). Nuestra paciente cumplía con lesiones dérmicas y los 2 primeros criterios de Bohan.
La DM tiene frecuente afectación pulmonar. En
pacientes con DM/PM, la enfermedad pulmonar
intersticial es una complicación con una prevalencia entre el 5% al 65%22. La misma puede adoptar
diferentes formas, principalmente la neumonía
intersticial no específica (NINE), la neumonía
intersticial usual (NIU) y la bronquiolitis obliterante con neumonía organizada (NO). Ha sido
ocasionalmente comunicada la presencia de patrón
de daño alveolar difuso (DAD).
La afectación pulmonar de la DM/PM puede aparecer antes, durante o después del diagnóstico de la afección muscular. Aunque habitualmente aparece
cuando la enfermedad muscular está ya diagnosticada24, 40, 41, la presentación simultánea de ambas
condiciones es común y la enfermedad pulmonar
intersticial precede al diagnóstico de la enfermedad
muscular en casi el 20% de los pacientes5, 33.
La presencia de anti-Jo-1 aumenta el riesgo de
neumopatía intersticial en pacientes con dermatomiositis. Este anticuerpo está presente en el 20%
de dermatomiositis y en el 70% de pacientes con
neumopatía intersticial. Los pacientes con afectación pulmonar tienen mayor mortalidad que los
pacientes con DM/PM aislada1, esta varía según
los diferentes estudios entre el 40 y el 62%2, 4, 13.
En 1990, Marguerie et al32 definen al síndrome
antisintetasa en base al estudio retrospectivo de
29 pacientes que presentaron anti-Jo1 positivo.
Se han identificado a la actualidad al menos siete
anticuerpos antisintetasa. Los siete están dirigidos
contra enzimas que acetilan el tRNA. El Anti-Jo1,
o antisintetasa histidyl-tRNA sintetasa, es la antisintetasa más común, se encuentra en el 20-30%
de los pacientes con miositis inflamatoria29.
Aproximadamente 3-5% de los casos del síndrome antisintetasa se manifiestan como síndromes
de superposición con otras enfermedades del tejido
conectivo incluyendo artritis reumatoide (AR),
lupus, esclerosis sistémica (SSc), síndrome de
Sjögren. La presencia de enfermedad intersticial
comanda el pronóstico en estos pacientes y su
presencia conlleva más del 40% de exceso en la
mortalidad esperada26.
El neumomediastino (NM) es una rara complicación de las miopatías inflamatorias idiopáticas
(DM/PM), el primer caso fue descripto en 1986 y desde entonces se han comunicado poco más
de 50 casos. El neumotórax espontáneo ha sido
raramente comunicado como complicación de la
AR, el lupus, la SSc y la DM infantil.
Más de la mitad de los pacientes con DM que
desarrollan neumomediastino presentan la variante
amiopática de la DM31. Aunque la DM y la PM son
dos veces más frecuentes en mujeres que en hombres, la miositis complicada por neumomediastino
es más frecuente en hombres. Los factores de riesgo
descriptos para NM en DM incluyen la enfermedad
intersticial27, 30, 35 y el tratamiento con esteroides28.
En algunas series se ha descrito como el paciente
tipo para la aparición de NM, el individuo joven,
con enfermedad de reciente comienzo, intersticiopatía, vasculopatía cutánea, leve o nula elevación
de la CPK y que recibe tratamiento esteroideo2.
Nuestro paciente comparte algunas características mencionadas en la literatura, como la
presencia de intersticiopatía, reciente comienzo
de la enfermedad, leve elevación de las enzimas
musculares y el tratamiento esteroideo. A diferencia de lo que reporta la literatura, la paciente
no tenía una edad menor de cuarenta años y no
presentaba una vasculopatía cutánea manifiesta
al momento del ingreso.
Algunos casos han sido asociados a enfermedad
intersticial severa37. Si bien en varios de los casos
reportados la evolución fue fatal34, 39, Le Goff et
al comunicaron que la tasa de mortalidad fue del
34.4%, con hasta 25% de los pacientes que fallecieron
dentro del primer mes de ocurrencia del NM. Estos
autores también describieron que uno de los factores
asociados con menor supervivencia fue la ausencia
de debilidad muscular, la baja capacidad vital (CV)
inicial y la disminución marcada de la DLCO31.
Los pacientes que presentan cualquier enfermedad intersticial pulmonar (EIP) (incluida la
fibrosis pulmonar idiopática-FPI) están en riesgo
de desarrollar NM. Estudios retrospectivos han estimado que 5-14.7% de los pacientes con FPI tienen
NM detectable en la TAC23. Se ha propuesto que la
aparición del NM podría deberse a un hipotético
debilitamiento del tejido intersticial pulmonar
debido al tratamiento con corticosteroides. Para
la mayoría de los autores la verdadera causa sería
la gravedad de la propia afectación intersticial. Sin
embargo, la ausencia de tal afectación en algunos
casos de NM obliga a plantear otras hipótesis patogénicas, entre las que se menciona la perforación
de las lesiones necróticas traqueobronquiales de naturaleza vasculítica antes comentadas, cuando
se encuentra su presencia en la broncoscopía2, 4, 5, 13.
Aunque no observamos signos de vasculopatía en nuestra paciente (tales como el infarto
periungueal o las lesiones ulcerativas), el rol de
la vasculitis como mecanismo patogénico no se
puede descartar. Nuestra paciente había recibido
prednisona solamente por un mes42. Yamanishi et
al42 sugirieron que el efecto debilitante de los
corticoides sobre el tejido intersticial pulmonar
podría contribuir al NM. Alternativamente, la
fibrosis en sí misma podría llevar a la ruptura de
las lesiones quísticas y ser la causa del NM21, 27. El
tratamiento óptimo de los pacientes con EIP no
ha sido determinado, aunque la recomendación
más habitual es el tratamiento inmunosupresor
agresivo, generalmente en base a corticoides en
altas dosis, ciclofosfamida y, en casos severos, rituximab38. En la mayor parte de los casos de NM
comunicados, se eligió intensificar el tratamiento
inmunosupresor aunque no hay evidencias para
apoyar esta conducta.
El uso exitoso de tacrolimus ha sido comunicado
en un caso de neumomediastino asociado a artritis
reumatoide. Se trata de un solo caso de AR complicado por EIP con múltiples imágenes quísticas
en el que el NM tuvo evolución favorable con la
administración de tacrolimus36.
Nuestra paciente fue tratada con prednisona 30
mg/d, omeprazol 40 mg/d, cloroquina 250 mg/d, y
azotioprina 50 mg/d, sin intensificar la inmunosupresión que venía recibiendo. La paciente resolvió el NM y recuperó su clase funcional previa,
manteniendo la enfermedad estable durante los 6
meses desde la aparición del NM hasta la fecha.
Conclusiones
El NM es una complicación rara y severa de la
EIP asociada a DM-PM o, más raramente, a otras
enfermedades del tejido conectivo. Ocurre más frecuentemente en DM amiopática y puede preceder
la aparición de los síntomas musculares.
El presente caso de NM con neumotórax espontáneo y enfisema subcutáneo en una paciente con
previo diagnóstico de DM es la primera comunicación en América Latina de una miopatía inflamatoria idiopática con esta complicación infrecuente.
Aquellos pacientes con DM que tienen EIP, signos de vasculitis y no tienen debilidad muscular
son los que están en mayor riesgo de desarrollar NM durante el tratamiento con esteroides y debieran ser monitoreados más estrechamente. No hay
evidencias sobre el mejor manejo del NM pero, si
no mejora rápido, probablemente el tratamiento
inmunosupresor intensivo debiera iniciarse en
seguida para aumentar la chance de recuperación.
1. De Prado Prieto L, Triano Sánchez R, García Vadillo A. Afectación Pulmonar que Simula un Tumor como Manifestación Inicial de Polimiositis. Situaciones Clínicas Colmenar, Madrid-España. SEMERGEN, 2009; 35(1): 49-50.
2. Ramón De Dios J, López De Goikoetxea A, Vesga J.C, Tómas L, Zorrilla V, Lobo J.L. Neumomediastino y Daño Alveolar Difuso. Afección Pulmonar Severa por Dermatomiositis. Reumatol Clin. 2009; 5(2): 76-79.
3. Maupeou F, Chiavassa-Gandois H, Giron J, Zabraniecki L, No N, Proporcionada B, Railhac JJ. El neumomediastino espontáneo y dermatomiositis: enfoque fisiopatológico por imágenes. Journal of Hospital Infection 2003; 20(6c): 965-968.
4. Rodrigues A, Jacomelli M, Scordamaglio P.R, Rossi Figueiredo V. Spontaneous pneumomediastinum associated with laryngeal lesions and tracheal ulcer in dermatomyositis. Rev. Bras. Reumatol 2012; 52 (5): 796-799.
5. Le Goff B, Cherín P, Cantagrel A, et al. Pneumomediastinum in Interstitial Lung Disease Associated With Dermatomyositis and Polymyositis. American College of Rheumatology. Arthritis & Rheumatism (Arthritis Care & Research) 2009; 61: 108-118.
6. Selva O´Callaghan A, Trallero Araguás E. Miopatías inflamatorias. Dermatomiositis, polimiositis y miositis con cuerpos de inclusión. Reumatol Clin. 2008; 4(5): 197-206.
7. Mauroka H, Honda S, Takeo M, et al. A case of polymyositis complicated with interstitial pneumonitis and pneumomediastinum. Mod Rheumatol 2006; 16(1): 55-57.
8. Shimamoto K, Ozaki Y, Amuro H, et al. Three cases of polymyositis/dermatomyositis complicated by pneumomediastinum. Nihon Rinsho Meneki Gakkai Kaishi 2008; 31(1): 56-61.
9. Sandhya P, Shyamkumar Nidugala Keshava, Debashish Danda, Prasanta Padhan, John Mathew, Sridhar Gigikote. Pneumorrhachis and pneumomediastinum in connective tissue disease-related interstitial lung disease: case series from a tertiary care teaching hospital in South India. Rheumatology International 2012; 32(5): 1415-1419.
10. Kameda H, Takeuchi T. Recent advances in the treatment of interstitial lung disease in patients with polymyositis/dermatomyositis. Endocrine, Metabolic & Immune Disorders 2006; 15(7): 409-415.
11. Tong SQ, Shi XH, Su J.M, Zhao Y, Zhang F.C. Clinical analysis of pneumomediastinum complicated in polymyo- complicated in polymyo- in polymyositis and dermatomyositis. Zhonghua Yi Xue Za Zhi. 2006; 86(9): 624-627.
12. Cáceres M, Syed Z, Braud R, Weiman D, Garrett E. Spontaneous Pneumomediastinum: A Comparative Study and Review of the Literature. Ann Thorac Surg. 2008; 86(3): 962-966. doi:10.1016/j.athoracsur.2008.04.067.
13. Restrepo Escobar M, González Naranjo L, Pantoja Márquez A, Ramírez Gómez L, Vásquez Duque G. Complicaciones pulmonares de las miopatías inflamatorias idiopáticas: a propósito de un caso con miopatía diafragmática. Revista Colombiana de Reumatología 2009; 16(3): 301-309.
14. Douglas W, Tazellar H, Hartman T, et al. Polymyositis-Dermatomyositis-associated Interstitial Lung Disease. Am J Respir Crit Care Med 2001; 164(5): 1182-1185.
15. Kang E.H, Lee E.B, Shin K.C, Im C.H, Chung D.H, Han S.K, Song Y.W. Interstitial lung disease in patients with polymyositis, dermatomyositis and amyopatihc dermatomyositis. Rheumatology 2005; 44: 1282-1286.
16. Korkmaz C, Ozkan R, Akay M, Hakan T. Pneumomediastinum, subcutaneous emphysema associated with dermatomyositis. Rheumatology 2001; 40: 476-478.
17. Masrouha K.Z, Kanj N, Uthman I. Late-onset pneumomediastinum in dermatomyositis. Rheumatol Int 2009; 30(2): 291-292.
18. Neves FS, Shinjo SK, Carvalho JF, Levy-Neto M, Borges CTL. Spontaneous pneumomediastinum and dermatomyositis may be a not so rare association: report of a case and review of the literature. Clin Rheumatol. 2007; 26: 105-7.
19. Targoff IN. Autoantibodies and Their Significance in Myositis. Current Rheumatology Reports. 2008; 10: 333-340.
20. Leslie KO, Trahan S, Gruden J. Pulmonary Pathology of the Rheumatic Diseases. Seminars Respirat Crit Care Med 2007; 28: 369-378.
21. Cicuttini FM, Fraser KJ. Recurrent pneumomediastinum in adult dermatomyositis. J Rheumatol1989; 16: 384-6.
22. Fathi M, Lundberg IE; Interstitial lung disease in polymyositis and dermatomyositis, Curr Opin Rheumatol 2005; 17: 701-706.
23. Franquet T, Gimenez A, Torrubia S, Sabate JM, Rodríguez Arias JM. Spontaneous pneumothorax and pneumomediastinum in IPF. Eur Radiol 2000;10: 108-13.
24. Frazier AR, Miller RD. Interstitial pneumonitis in association with polymyositis and dermatomyositis. Chest 1974; 65: 403-7.
25. Grau JM, Miro O, Pedrol E, et al. Interstitial lung disease related to dermatomyositis: comparative study with patients without lung involvement. J Rheumatol 1996; 23: 1921-6.
26. Hochberg MC, Feldman D, Stevens MB, Arnett FC, Reichlin M. Antibody to Jo-1 in polymyositis/dermatomyositis: association with interstitial pulmonary disease. J Rheumatol 1984; 11: 663-5.
27. Isfer RS, Nakao SK, Cernea SS. Dermatomyositis associated with pneumomediastinum and subcutaneous cellular tissue emphysema. Br J Rheumatol 1994; 33: 1092.
28. Jansen TL, Barrea P, Van Engelen BG, Cox N, Laan RF, Van de Putte LB. Dermotomyositis with subclinical myositis and spontaneous pneumomediastinum with pneumothorax: case report and review of the literature. Clin Exp Rheumatol1998; 16: 733-5.
29. Kaminski H, Santillan C, Wolfe G. Autoantibody testing in neuromuscular disorders, part II: neuromuscular junction, hyperexcitability, and muscle disorders. J Clin Neuromusc Dis 2000; 2: 96-105.
30. Kono H, Inokuma S, Nakayama H, Suzuki M. Pneumomediastinum in dermatomyositis: association with cutaneous vasculopathy. Ann Rheum Dis 2000; 59: 372-6.
31. Le Goff B, Chérin P, Cantagrel A, et al. Pneumomediastinum in generally accounts only 5-11% of DM cases interstitial lung disease associated with dermatomyositis and polymyositis. Arthritis Rheum. 2009 Jan 15; 61(1): 108-18.
32. Marguerie C, Bunn CC, Beynon HL, et al. Polymyositis, pulmonary fibrosis and autoantibodies to aminoacyl-tRNA synthetase enzymes. Q J Med 1990; 77: 1019–38
33. Marie I, Hachulla E, Chérin P, et al. Interstitial lung disease in polymyositis and dermatomyositis. Arthritis Rheum. 2002 Dec 15; 47(6): 614-22.
34. Matsuda Y, Tomii M, Kashiwazaki S. Fatal pneumomediastinum in dermatomyositis without creatine kinase elevation. Intern Med. 1993 Aug; 32(8): 643-7.
35. Nagai Y, Ishikawa O, Miyachi Y. Pneumomediastinum and subcutaneous emphysema associated with fatal interstitial pneumonia in dermatomyositis. J Dermatol1997; 24: 482-4.
36. Ochi S, Kubota T, Sugihara T, Ogawa J, Komano Y, Nonomura Y, Miyasaka N. Nihon Rinsho Meneki Gakkai Kaishi. 2008 Feb; 31(1): 62-7.
37. Onishi S, Ono F, Hasegawa H, Yasukawa M. Pneumomediastinum and massive subcutaneous emphysema associated with dermatomyositis. Intern Med. 2012; 51(24): 3449-50.
38. Powell C, Kendall B, Wernick R, Heffner JE. A 34-year-old man with amyopathic dermatomyositis and rapidly progressive dyspnea with facial swelling: diagnosis. Pneumomediastinum and subcutaneous emphysema secondary to amyopathic dermatomyositis-associated interstitial lung disease. Chest 2007; 132: 1710-3.
39. Saraya T, Tanaka Y, Ohkuma K, Sada M, Tsujimoto N, Takizawa H, Goto H. Massive tension pneumomediastinum. Intern Med. 2012; 51(6): 677.
40. Schwarz MI, Sutarik JM, Nick JA, Leff JA, Emlen JW, Tuder RM. Pulmonary capillaritis and diffuse alveolar hemorrhage: a primary manifestation of polymyositis. Am J Respir Crit Care Med 1995; 151: 2037-40.
41. Songcharoen S, Raju SF, Pennebaker JB. Interstitial lung disease in polymyositis and dermatomyositis. J Rheumatol 1980; 7: 353-60.
42. Yamanishi Y, Maeda H, Konishi F et al. Dermatomyositis associated with rapidly progressive fatal interstitial pneumonitis and pneumomediastinum. Scand J Rheumatol1999; 28: 58-61