Instituciones Participantes :AsociaciĂłn Argentina de OncologĂa ClĂnica, AsociaciĂłn Argentina de CirugĂa, AsociaciĂłn Argentina de Medicina Respiratoria, AsociaciĂłn Argentina de BroncoesofagologĂa, AsociaciĂłn MĂ©dica Argentina, Instituto Nacional del Cáncer, Instituto de OncologĂa “Angel H. Roffo”, Sociedad Argentina de CancerologĂa, Sociedad Argentina de CirugĂa Torácica, Sociedad Argentina de PatologĂa, Sociedad Argentina de RadiologĂa, Sociedad Argentina de Terapia Radiante OncolĂłgica, Academia Nacional de Medicina.
Julio de 2017
Las Sociedades fueron convocadas por la Academia Nacional de Medicina, por intermedio del Instituto de Estudios Oncológicos, ante la iniciativa de la Sociedad Argentina de Terapia Radiante Oncológica. Las entidades autoras, miembros del Programa Argentino de Consensos de Enfermedades Oncológicas y del Programa Nacional de Consensos Inter-Sociedades avalan la actualización de este Consenso Multidisciplinario que aúna los criterios propuestos por los profesionales involucrados en la prevención, diagnóstico y tratamiento del Carcinoma de Pulmón de Células No Pequeñas (CaPCNP).
Las Instituciones autoras se comprometen a difundir y promover el uso del contenido de este documento en todas las áreas y entidades responsables del manejo de la Salud, PAMI, Institutos Nacionales, Provinciales y Municipales, Colegios Médicos, entidades de Medicina Prepaga, Obras Sociales, Mutuales, Superintendencia de Seguros de Salud de la Nación, Hospitales de Comunidad, Hospitales Universitarios y demás entidades relacionadas; y su aplicación por todos los especialistas del país.
Julio de 2017
TABLA DE CONTENIDOS
EPIDEMIOLOGÍA
Incidencia, prevalencia y supervivencia
Factores genéticos
Factores de riesgo
Quimioprevención
ESTUDIOS HISTOPATOLÓGICO Y MOLECULAR
Clasificación OMS, 2015
Factores pronósticos y predictivos de respuesta terapéutica
Estudios moleculares
Estadificación patológica
DIAGNÓSTICO
Pesquisa y detección temprana.
Síntomas
Diagnóstico por imágenes
Broncoscopía
Nódulo solitario de pulmón
Estadificación mediastinal
Detección de metástasis a distancia
Estrategias para la estadificación
Evaluación prequirúrgica
TRATAMIENTO
Estadios I Y II
Tratamiento quirúrgico
Tratamiento radiante
Estadio III
Quimiorradioterapia
Quimioterapia asociada a cirugía
Combinación quimio-radioterapia de inducción y cirugía
Tratamiento radiante
Quimioterapia adyuvante
Estadio IV
Primera línea de tratamiento
Terapia de mantenimiento
Segunda línea de tratamiento
SITUACIONES ESPECIALES
Tumores de la pared costal, de bronquios próximos a la carina y mediastino
Vértice pulmonar
Nódulos satélites
SBRT en enfermedad avanzada
TRATAMIENTOS PALIATIVOS
Obstrucción de la vía aérea central
Derrame pleural
Tos
Disnea
Síndrome de vena cava (SVCS)
Hemoptisis
Síntomas de las metástasis a distancia
ANEXOS
Anexo 1
Anexo 2
Anexo 3
Anexo 4
EPIDEMIOLOGÍA
- Incidencia, prevalencia y supervivencia
- Factores genéticos
- Factores de riesgo
- Quimioprevención
Incidencia, prevalencia y supervivencia
El cáncer de pulmón (CaP) es la causa de muerte por cáncer más frecuente, siendo responsable del 24% de la mortalidad en hombres y 21% en mujeres1, 2, con una tendencia creciente. A principios del siglo XX el CaP era una neoplasia de escasa frecuencia con una mortalidad anual de 10 por 100.000 hombres. En 1950 su incidencia ya había aumentado seis veces lo que motivó que se realizaran los primeros estudios epidemiológicos que vincularon al CaP con el tabaco. Su incidencia aumentó significativamente en las mujeres en paralelo al incremento del hábito de fumar en el sexo femenino; y es así que, en Estados Unidos, la mortalidad por CaP en mujeres en 1986 cruzó la curva de mortalidad por cáncer de mama. En el año 2006, la mortalidad por CaP fue más alta que la asociada a cáncer de mama, próstata y colon combinados. Para el 2009 la Sociedad Americana del Cáncer (American Cancer Society) había proyectado una incidencia de 116.090 nuevos casos en hombres y 103.350 en mujeres1-4.
El CaP es una neoplasia de muy mal pronóstico. La mayor supervivencia global a los 5 años es la observada en Estados Unidos y alcanza el 15%, mientras que en Europa es alrededor del 8%, igual que en los países con menor desarrollo económico. En China, a pesar del bajo índice de tabaquismo se observa una mayor incidencia de CaP en las mujeres comparada con la observada en las europeas. La mortalidad en el Reino Unido ha disminuido tanto en hombres como en mujeres jóvenes. En otros países de Europa la incidencia sigue en aumento4, 5.
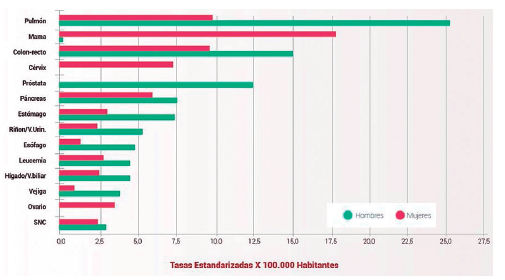
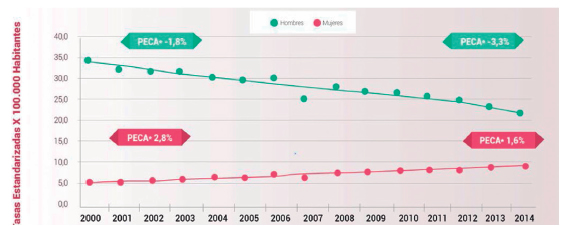
La incidencia estimada por el Centro Internacional de Investigaciones sobre el Cáncer (International Agency for Research on Cancer - IARC) en 20126, para Argentina, fue de 11.244 casos anuales para hombres y mujeres, que corresponde al 9,8% de los casos nuevos de cáncer anuales. El CaP ocasiona más de 9.000 defunciones por año en ambos sexos representando el 15% de la mortalidad por cáncer (Figura 1) y continúa siendo la causa principal de muerte por esta afección con diferencias importantes entre sexos, ya que el 70% de los fallecimientos se produjeron en hombres. Sin embargo, se observa un descenso marcado en el sexo masculino especialmente a partir del año 2012 con un porcentaje estimado de cambio anual (PECA) del 3,3%, mientras que se observa un incremento en las mujeres7 (PECA: 2,8% hasta 2011 y 1,6% promedio en los años subsiguientes) (Figura 2).
Referencias
1. Billelo K, Murin S, Mathay R. “Epidemiology, etiology and prevention of lung cancer”. Clinics in Chest Medicine. Lung Cancer 2002; 23 (1): 1.
2. Alberg A, Samet J. Epidemiology of lung cancer CHEST 2002; 123 (1): 21S.
3. Cancer facts and figures 2009. American Cancer Society. En http://www.cancer.org/
4. Estimated New Cancer Cases and Deaths by Sex, US, 2009. American Cancer Society. En: http://www.cancer.org/
5. Eurocare 4. Survival of Cancer in Europe. En: http://www.eurocare.it/
6. SIVER/INC- Ministerio de Salud de la Nación en base a los datos de Globocan 2012. Argentina 2016. En: http://www.msal.gov.ar/inc/acerca-del-cancer/incidencia/
7. SIVER/INC- Ministerio de Salud de la Nación en base a registros de la Dirección de Estadísticas e Información de Salud. Argentina, 2016. En: http://www.msal.gov.ar/inc/acerca-del-cancer/mortalidad/
El hecho de que sólo un 16% aproximadamente de los fumadores desarrollen CaP sugiere un perfil de susceptibilidad individual para esta enfermedad1. Aunque se han identificado genotipos susceptibles, aún no se ha reconocido un determinado linaje genético2. Estudios epidemiológicos de caso-control y de cohorte sugieren que los familiares de un probando (portador identificado de la enfermedad) tienen un riesgo dos veces superior de desarrollar de este tipo de cáncer en relación con la población general, independientemente del hábito tabáquico3, 4. El aumento del riesgo sería mayor aún en familiares de pacientes no fumadores con diagnóstico de CaP a edad temprana y en familias con varios casos diagnosticados5.
Los posibles genes candidatos a conferir mayor susceptibilidad al CaP se encuentran en el locus 6q 23-25, especialmente en individuos con escasa exposición al tabaco6. Por otra parte, la presencia de una variedad de polimorfismos en genes implicados en el metabolismo de los carcinógenos del tabaco (CYP1A1, GSTM1, y GSTT1)7, 8, el ciclo celular (ciclina D, p53 y MDM)9, 10, la reparación del ADN (XRCC1-3 y ERCC1)11, los sensores del daño al ADN (ATM), la reparación tipo miss match (LIG1, LIG3, MLH1 y MSH6)12, inflamación y genes que regulan la estructura de la cromatina (DNMT3b, MBD1)13 se correlacionaron con el aumento del riesgo para esta enfermedad.
Los datos actuales sustentan la participación de un mecanismo poligénico en la susceptibilidad al CaP, es decir, diferentes alelos involucrados que en forma aditiva o multiplicativa confieren un genotipo de riesgo. La identificación de estos genotipos constituye una prioridad en los estudios de epidemiología molecular a fin de detectar subgrupos de individuos (fumadores o no) con riesgo de desarrollar CaP que pudieran beneficiarse de programas de detección precoz.
Referencias
1. Peto R, Darby S, Deo H, et al. Smoking cessation and lung cancer in the UK since 1950: combination of national statistics with two case-control studies. BMJ. 2000; 321: 323.
2. De Vita V, Hellman, Rosemberg. Cancer: Principles and Practice of Oncology. Lippincott Williams and Wilkins. 8th edition, 2008: 887-973.
3. Tokuhata GK, Lilienfeld AM. Familial aggregation of lung cancers in humans. J Natl Cancer Inst. 1963; 30: 289.
4. Hemminki K, Li X, Czene K. Familial risk of cancer: data for clinical counseling and cancer genetics. Int J Cancer. 2004; 108(1): 109.
5. Matakidou A, Eisen T, Houlston R. Systematic review of the relationship between family history and lung cancer risk. Br J Cancer. 2005; 93(7): 825.
6. Bailey-Wilson J, Amos C, Pinney S, et al. A major lung cancer susceptibility locus maps to chromosome 6q23-25. Am J Hum Genet. 2004; 75(3): 460.
7. Raimondi S, Boffetta P, Anttila S, et al. Metabolic gene polymorphisms and lung cancer risk in non-smokers. An update of the GSEC study. Mutat Res. 2005; 592(1-2): 45.
8. Wenzlaff A, Cote M, Bock C, et al. CYP1A1 and CYP1B1 polymorphisms and risk of lung cancer among never smokers: a population-based study. Carcinogenesis. 2005; 26(12): 2207.
9. Gautschi O, Hugli B, Ziegler A, et al. Cyclin D1 (CCND1) A870G gene polymorphism modulates smoking-induced lung cancer risk and response to platinum-based chemotherapy in non–small-cell lung cancer (NSCLC) patients. Lung Cancer. 2006; 51(3): 303.
10. Zhang X, Miao X, Guo Y, et al. Genetic polymorphisms in cell cycle regulatory genes MDM2 and TP53 are associated with susceptibility to lung cancer. Hum Mutat. 2006; 27(1): 110.
11. Wang Y, Liang D, Spitz M, et al. XRCC3 genetic polymorphism, smoking, and lung carcinoma risk in minority populations. Cancer. 2003; 98(8): 1701.
12. Landi S, Gemignani F, Canzian F, et al. DNA repair and cell cycle control genes and the risk of young-onset lung cancer. Cancer Res. 2006; 66(22): 11062.
13. Shen H, Wang L, Spitz MR, et al. A novel polymorphism in human cytosine DNA-methyltransferase-3B promoter is associated with an increased risk of lung cancer. Cancer Res. 2002; 62(17): 4992.
a) Tabaco
El tabaquismo es la principal causa de CaP y se identifica como factor de riesgo en aproximadamente el 90% de los casos detectados en los países occidentales1. La composición de los cigarrillos ha cambiado; se han agregado filtros de acetato de celulosa y se han reducido los niveles de alquitrán y nicotina. Esto sugeriría una atenuación del riesgo de CaP, sin embargo, ello no ha ocurrido debido al agregado de otras sustancias como amoníaco y acetaldehídos2. Por otro lado, el riesgo aumenta con la duración del hábito de fumar y el número de cigarrillos fumados por día3. El fumar tabaco en pipa también ha sido establecido como una causa de CaP4. El consumo de productos no tabáquicos, como el humo derivado del quemado del papel usado para envolver la marihuana aún permanece en discusión, dado que usualmente se consumen ambas sustancias por separado o en el mismo cigarrillo5, 6.
b) Exposición ocupacional
El asbesto (o amianto) es uno de los factores más estudiados7; las pruebas epidemiológicas demostraron un aumento de siete veces del riesgo de CaP en personas expuestas. También presentan riesgo aumentado los trabajadores relacionados con la industria del arsénico, azufre, cloruro de vinilo, hematita, materiales radiactivos, cromatos de níquel, productos de carbón, gas mostaza, éteres de cloro metilo, gasolina y derivados del diésel, hierro, berilio, sílice, etc.8-11. La relacion del CaP con el radón, un gas radiactivo resultante de la desintegración natural del uranio, se estableció por primera vez en los minerossup, demostrándose más tarde que las personas expuestas a niveles elevados en sus casas tenían alto riesgo de desarrollar CaP13.
c) Factores ambientales
Existe asociación causal entre la exposición ambiental al humo del tabaco y el CaP lo que permite explicar el riesgo superior al 20% de desarrollar CaP descripto en no fumadores14. La convivencia con una pareja fumadora fue de un 20% para las mujeres y 30% para los hombres, mientras que la exposición al humo ambiental de tabaco en el lugar de trabajo aumenta el riesgo entre un 12 y 19%15. Otro factor ambiental que puede contribuir es la contaminación atmosférica, en las grandes ciudades16. En las últimas décadas, muchos estudios destacaron el papel de las partículas de materiales nocivos (metales de transición, iones sulfato y nitrato, y compuestos orgánicos) como factores predisponentes17. En países asiáticos la modalidad de cocinar con aceites a altas temperaturas en ausencia de extractores de humo es otro factor de riesgo. Asimismo, se ha relacionado el CaP con el tiempo total de trabajo en cocinas medido en años y la exposición a humos o vapores de carbón18, 19. La probable influencia de agentes infecciosos como el virus del papiloma humano (VPH) tipos 16/18 hallado en mujeres no fumadoras con CaP continúa aún en evaluación20, 21. Por último, estudios de casos y controles evaluaron la influencia de la dieta señalando que frutas y verduras, fuente de vitaminas antioxidantes y otros micronutrientes, tendrían un efecto protector; en tanto otros autores han encontrado perjudicial el alto consumo de carne22, 23.
d) Factores del huésped
Algunos grupos han sugerido que las mujeres fumadoras son más susceptibles al CaP en comparación con pares varones y que, aquellas que ya han desarrollado la enfermedad, se comportan de manera diferente a los hombres; consideran que la diferencia podría deberse a un factor hormonal24. Algunos de esos estudios analizan la terapia de reemplazo hormonal (TRH); aunque esta hipótesis ha generado resultados contradictorios ya que otros autores no han podido confirmar esta asociación25, 26. Por lo tanto, se requiere mayor investigación acerca de un posible vínculo de los estrógenos con el desarrollo del CaP.
Referencias
1. Parkin DM, Pisani P, Lopez AD, et al. At least one in seven cases of cancer is caused by smoking: Global estimates for 1985. Int J Cancer. 1994; 59: 494-504.
2. The health effects of active smoking: a report of the Surgeon General. Washington, DC. US Government Printing Office, US Department of Health and Human Services, 2004.
3. Doll R, Peto R. Cigarette smoking and bronchial carcinoma: dose and time relationships among regular smokers and lifelong non-smokers. J Epidemiol Community Health. 1978; 32: 303-313.
4. Boffetta P, Pershagen G, Jockel KH, et al. Cigar and pipe smoking and lung cancer risk: a multicenter study from Europe. J Natl Cancer Inst. 1999; 91: 697-701.
5. Berthiller J, Straif K, Boniol M, Voirin N, et al. Cannabis smoking and risk of lung cancer in men: a pooled analysis of three studies in Maghreb. J Thorac Oncol. 2008; 3(12): 1398-403.
6. Aldington S, Harwood M, Cox B, Weatherall M, et al. Cannabis and Respiratory Disease Research Group. Cannabis use and risk of lung cancer: a case-control study. Eur Respir J. 2008; 31(2): 280-6.
7. Asbestos in public and commercial buildings: a review and a synthesis of current knowledge. Cambridge, MA: Health Effects Institute, Asbestos Research Committee, Literature Review Panel, 1991.
8. Alberg A, Yung R, Strickland P, et al. Respiratory cancer and exposure to arsenic, chromium, nickel and polycyclic aromatic hydrocarbons. Clin Occup Environ Med. 2002; 2: 779-801.
9. Cohen AJ, Higgins MWP. Health effects of diesel exhaust: epidemiology. In: Diesel exhaust: a critical analysis of emissions, exposure, and health effects; a special report of the Institute’s Working Group. Cambridge, MA: Health Effects Institute. 1995: 251-292.
10. Hessel PA, Gamble JF, Gee JB, et al. Silica, silicosis, and lung cancer: a response to a recent working group report. J Occup Environ Med. 2000; 42: 704-720.
11. Gibb H, Haver C, Gaylor D, et al. Estimates of Cancer Risk from Ingested Arsenic. Environmental Health Perspectives 28 October 2010. doi: 10.1289/ehp.1002427.
12. Health Effects of Exposure to Radon: Committee on Health Risks of Exposure to Radon (BEIR VI). Board on Radiation Effects Research. Comisión on Life Sciences. National Research Council. 1999, Nacional Academy Press. Washington, D. C. En: https://www.nap.edu/read/5499/chapter/1#iv
13. Catelinois O, Rogel A, Laurier D et al. Lung Cancer Attributable to Indoor Radon Exposure in France: Impact of the Risk Models and Uncertainty Analysis. Environmental Health Perspectives (National Institute of Environmental Health Science). 2006; 114(9): 1361-1366.
14. Boffetta P. Human cancer from environmental pollutants: the epidemiological evidence. Mutat Res. 2006; 608(2): 157-162.
15. Centers for Disease Control, Prevention (CDC). Annual smoking-attributable mortality, years of potential life lost, and productivity losses- United States, 1997-2001. MMWR Morb Mortal Wkly Rep. 2005; 54: 625-628.
16. Dockery DW, Pope CA III, Xu X, et al. An association between air pollution and mortality in six US cities. N Engl J Med. 1993; 329: 1753-1759.
17. Castanas E. Human health effects of air pollution. Environ Pollut. 2008; 151(2): 362-367.
18. Yu IT, Chiu YL, Au JS, et al. Dose-response relationship between cooking fumes exposures and lung cancer among Chinese nonsmoking women. Cancer Res. 2006; 66: 4961-4467.
19. Kleinerman RA, Wang Z, Wang L, et al. Lung cancer and indoor exposure to coal and biomass in rural China. J Occup Environ Med .2002; 44: 338-344.
20. Georgieva S, Lordanov V, Sergieva S. Nature of cervical cancer and other HPV - associated cancers. J BUON. 2009; 14(3): 391-398.
21. Cheng YW, Chiou HL, Shue GT, et al. The association of human papillomavirus 16/18 infection with lung cancer among nonsmoking Taiwanese women. Cancer Res. 2001; 61: 2799-28803.
22. Brennan P, Butler J, Agudo A, et al. Joint effect of diet and environmental tobacco smoke on risk of lung cancer among nonsmokers. J Natl Cancer Institute. 2000; 92: 426-7.
23. Schabath MB, Hernandez LM, Wu X, et al. Dietary phytoestrogens and lung cancer risk. JAMA. 2005; 294: 1493-1504.
24. Patel JD, Bach PB, Kris MG. Lung cancer in US women: A contemporary epidemic. JAMA. 2004; 291: 1763-1768.
25. Blackman JA, Coogan PF, Rosenberg L, et al. Estrogen replacement therapy and risk of lung cancer. Pharmacoepidemiol Drug Saf. 2002; 11: 561-567.
26. Schabath MB, Wu X, Vassilopoulou-Sellin R, et al. Hormone replacement therapy and lung cancer risk: A case-control analysis. Clin Cancer Res. 2004; 10: 113-123.
Las estrategias de quimioprevención pueden ser primarias (individuos sanos), secundarias (pacientes con enfermedad preneoplásica) o terciarias (pacientes previamente tratados y curados de un CaP).
Pese a la evidencia epidemiológica de que los sujetos que consumen mayor cantidad de frutas y vegetales y que muestran mayores niveles de betacaroteno tienen menor prevalencia de CaP1, 2, los ensayos clínicos sobre prevención primaria han mostrado un aumento estadísticamente significativo de la incidencia de CaP en fumadores que recibieron suplementos de betacaroteno3, 4. Los estudios de prevención secundaria con diversos retinoides o retinol para revertir las lesiones premalignas han mostrado resultados neutrales o desfavorables5-7. Estudios preliminares con anetol-ditioletiona en fumadores con displasia bronquial revelaron disminución de la tasa de progresión8, 9. Los ensayos clínicos en prevención terciaria han resultado sistemáticamente negativos (Vitamina A y N-acetilcisteína y betacarotenos)10-13. Hay actualmente una serie de ensayos clínicos en marcha basados en la evidencia epidemiológica previa14-20, la mayoría de ellos en Fase II, que analizan inhibidores de la ciclooxigenasa (COX), iloprost, modificadores de los leucotrienos, selenio, extractos de té verde y brócoli. Si bien hay acuerdo sobre la necesidad de continuar esta línea de investigación hasta el momento no hay evidencias para recomendar ninguna estrategia de quimioprevención.
Referencias
1. Block G, Patterson B, Subar A. Fruit, vegetables and cancer prevention: a review of the epidemiological evidence. Nutr Cancer. 1992; 18: 1-29.
2. van Poppel G, Goldbohm RA. Epidemiologic evidence for beta-carotene and cancer prevention. Am J Clin Nut.r 1995; 62: 1393 S-1402S.
3. The Alpha-tocopherol Beta Carotene Cancer Prevention Study Group. The effect of vitamin E and beta-carotene on the incidence of lung cancer and other cancers in male smokers. New Engl J Med. 1994; 330: 1029-1035.
4. Omenn GS, Goodman GE, Thornquist MD, et al. Effects of a combination of beta-carotene and vitamin A and cardiovascular disease. N Engl J Med. 1996; 334: 1150-1155.
5. Lee JS, Lippman SM, Benner SE, et al. Randomized placebo-controlled trial of isotretinoin in chemoprevention of bronchial squamous metaplasia. J Clin Oncol. 1994; 12: 937-945.
6. Kurie JM, Lee JS, Khuri FR, et al. N-(4-hydroxyphenyl) retinamide in the chemoprevention of squamous metaplasia and dysplasia of the bronchial epithelium. Clin Cancer Res. 2000; 6: 2973-2979.
7. Arnold AM, Browman GP, Levine MN, et al. The effect of the synthetic retinoid etredinate on sputum cytology: results from a randomized trial. Br J Cancer. 1992; 65: 737-743.
8. Khuri FR, Lotan R, Kemp B, et al. Retinoic acid receptor-beta as a prognostic indicator in stage I non-small cell lung cancer. J Clin Oncol. 2000; 18: 2798-2804.
9. Lam S, MacAulay C, Le Riche JC, et al. A randomized phase IIb trial of anethole dithiolethione in smokers with bronchial dysplasia. J Natl Cancer Inst. 2002; 94: 1001-1009.
10. Pastorino U, Infante M, Maioli M, et al.: Adjuvant treatment of stage I lung cancer with high-dose vitamin A. J Clin Oncol. 1993; 11: 1216-1222.
11. van Zandwijk N, Dalesio O, Pastorino U, et al. EUROSCAN, a randomized trial of vitamin A and N-acetylcysteine in patients with head and neck cancer or lung cancer. For the European Organization for Research and Treatment of Cancer Head and Neck and Lung Cancer Cooperative Groups. J Natl Cancer Inst. 2000; 92: 977-986.
12. Lippman SM, Lee JJ, Karp DD, et al. Randomized phase III intergroup trial of isotretinoin to prevent second primary tumors in stage I non-small-cell lung cancer. J Natl Cancer Inst. 2001; 93: 605-618.
13. Mayne ST, Cartmel B, Baum M, et al. Randomized trial of supplemental betacarotene to prevent second head and neck cancer. Cancer Res. 2001; 61: 1457-1463.
14. Krysan K, Reckamp KL, Sharma S, Dubinett SM. The potential and rationale for COX-2 inhibitors in lung cancer. Anticancer Agents Med Chem. 2006; 6: 209-220.
15. Keith RL, Miller YE, Hoshikawa Y, Moore MD, et al. Manipulation of pulmonary prostacyclin synthase expression prevents murine lung cancer. Cancer Res. 2002; 62: 734-740.
16. Keith RL, Miller YE, Hudish TM, Girod CE, et al. Pulmonary prostacyclin synthase overexpression chemoprevents tobacco smoke lung carcinogenesis in mice. Cancer Res. 2004; 64: 5897-5904.
17. Tang DG, Chen YQ, Honn KV. Arachidonate lipoxygenases as essential regulators of cell survival and apoptosis. Proc Natl Acad Sci USA. 1996; 93: 5241-5246.
18. Gunning WT, Kramer PM, Steele VE, Pereira MA. Chemoprevention by lipoxygenase and leukotriene pathway inhibitors of vinyl carbamate-induced lung tumors in mice. Cancer Res. 2002; 62: 4199-4201.
19. van den Brandt PA, Goldbohm RA, van’t Veer P, Bode P, et al. A prospective cohort study on selenium status and the risk of lung cancer. Cancer Res. 1993; 53: 4860-4865.
20. Reid ME, Duffield-Lillico AJ, Garland L, Turnbull BW, et al. Selenium supplementation and lung cancer incidence: an update of the nutritional prevention of cancer trial. Cancer Epidemiol Biomarkers Prev. 2002; 11: 1285-1291.
ESTUDIOS HISTOPATOLÓGICO Y MOLECULAR
- Clasificación de la OMS, 2015
- Factores pronósticos y predictivos de respuesta terapéutica
- Estudios moleculares
- Estadificación patológica (pTNM) 8° Edición 2017
Clasificación de la OMS, 2015
La clasificación vigente de tipos histológicos de tumores es la publicada por la Organización Mundial de la Salud (OMS) en el año 2015 (Tabla 1)1

La clasificación 2015 de la OMS incorpora avances en el diagnóstico tumoral mediante la aplicación de técnicas de inmunohistoquímica (IHQ) y moleculares para su tipificación. Los principales cambios residen en la clasificación de adenocarcinomas y toma como base la propuesta de un panel multidisciplinario internacional de expertos de las siguientes instituciones: Asociación Internacional para el estudio del Cáncer de Pulmón, Sociedad Americana del Tórax, Sociedad Europea de Respiratorio (International Association for the Study of Lung Cancer/American Thoracic Society/European Respiratory Society) 20112 con relevantes implicancias diagnósticas, pronósticas y terapéuticas.
Esta clasificación incluye lineamientos para el diagnóstico en pequeñas muestras de tejido y muestras citológicas en casos no quirúrgicos, recomendaciones para piezas resecadas, y la incorporación de nuevas variantes para los Adenocarcinomas (ADC).
También se incorporaron cambios en los Carcinomas de Células Escamosas (CaCE) eliminando algunas variantes y reemplazándolas por los subtipos queratinizante y no queratinizante como en otros órganos de la economía3.
Los tumores neuroendocrinos, previamente dispersos en la clasificación OMS 20044, se han agrupado y se eliminaron algunas variantes de los Carcinomas de Células Grandes (CaCG), restringiéndose esta categoría sólo a los tumores indiferenciados que no demuestran diferenciación glandular ni escamosa con pruebas inmunohistoquímicas (IHQ).
Por último, se han reclasificado y resignificado tumores poco frecuentes según los actuales conocimientos de pruebas de IHQ y moleculares, como el Neumocitoma Esclerosante (ex Hemangioendotelioma Esclerosante), incorporado nuevas entidades como el NUT Carcinoma de proteína nuclear testicular (NUT Ca) cuya génesis se debe a rearreglos del gen de la proteína nuclear testicular, y agrupado los Tumores Pecomatosos (Tumores PEC), etc.
a) Recomendaciones metodológicas para la clasificación tumoral con fuertes implicancias terapéuticas
En esta nueva clasificación se ha expandido el uso de la IHQ en comparación con su aplicación muy restringida en las clasificaciones previas incluyendo la clasificación OMS 2004. Hoy se recomienda el uso de IHQ para definir diferenciación escamosa y glandular en tumores poco diferenciados con técnicas de rutina como hematoxilina-eosina (HE) y mucina, no sólo en muestras pequeñas o citológicas sino también en piezas resecadas, especialmente en ADC sólido, CaCE no queratinizante y CaCG, así como también para el diagnóstico de Carcinomas Pleomórficos (CaPleo) y Carcinomas Neuroendocrinos (CaNE). El objetivo es lograr un subtipificación histológica más precisa debido a que algunos fármacos son aprobados por los organismos encargados de su regulación para tipos histológicos específicos5, 6.
Esta clasificación también recomienda enfáticamente tratar las muestras con el cuidado máximo para permitir la realización de tests moleculares (identificación de mutaciones de EGFR, rearreglos de ALK y ROS1 y determinación de niveles de PDL1) pues definen tratamientos concretos con fármacos de nueva generación6.
b) Recomendaciones para biopsias pequeñas y muestras citológicas
Esta es la primera clasificación que establece criterios y terminología estandarizada para el diagnóstico tumoral en muestras pequeñas de tejido o citológicas, teniendo en cuenta que 2/3 de los pacientes serán diagnosticados en estadios no quirúrgicos con muestras obtenidas por broncoscopía, lavado broncoalveolar o punción (Tablas 2 y 3).
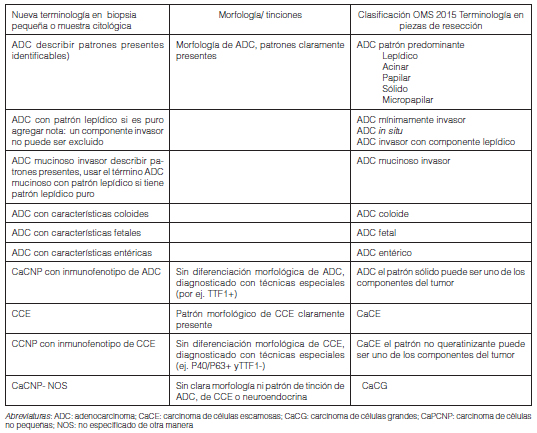
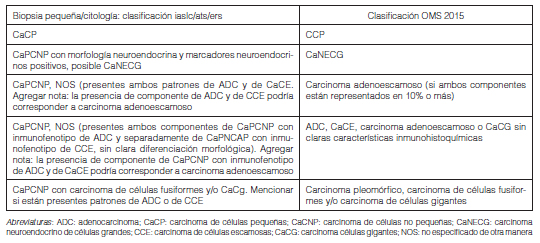
Se recomienda restringir el uso del término Carcinoma Pulmonar de Células No Pequeñas (CaPCNP) lo máximo posible y clasificar a los tumores según el subtipo histológico específico.
Para ello, en aquellos casos en que el tumor no muestre una diferenciación morfológica categórica escamosa o glandular con HE o mucina se debe realizar inmunomarcación con un único marcador de 8
ADC (TTF1) y de CaCE (p63 o p40)7-9. Aquellos casos positivos con TTF1 serán diagnosticados como CaPCNP con inmunofenotipo de ADC y los que expresen exclusivamente marcación escamosa CaPCNP con inmunofenotipo de CaCE. Cuando la diferenciación no pueda ser demostrada se recomienda utilizar la terminología de CaPCNP no especificado de otra manera (CaPCNP-NOS) sin especificar subtipo histológico ni origen dado que la ausencia de diferenciación neumonocítica plantea la posibilidad de carcinoma metastásico6.
Las muestras deben ser tratadas con el máximo cuidado a fin de resguardar material útil y suficiente para posteriores determinaciones moleculares. La responsabilidad en el manejo de la muestra no es exclusiva del patólogo, sino que debe ser compartida por el equipo multidisciplinario10, ya que incluye procedimientos previos como la extracción y fijación inicial, e incluso debería involucrar aquellas áreas administrativas institucionales responsables de la compra de equipamiento e insumos.
c) Grado histológico del CaP
En la mayoría de los casos no existe sistema de graduación validado. Algunos, como los CaNE se pueden clasificar en 3 grados [I Carcinoide Típico, II Carcinoide atípico y III Carcinoma de células pequeñas (CaCAP)] y CaNE de células grandes (CaNECG). En otros casos el propio diagnóstico implica alto grado, como en el CaCG y el CaPleo.
En el caso de los ADC, la aplicación de la nueva clasificación mencionando el patrón arquitectural predominante es una aproximación al grado de diferenciación. La mayoría de los estudios coinciden en que el patrón lepídico de ADC implica bajo grado, el acinar y el papilar grado intermedio y, el sólido y micropapilar alto grado; relacionándose el grado directamente con los índices de recurrencia y supervivencia modificando el pronóstico, como lo afirman varias publicaciones11, 12. El reconocimiento de un patrón cribiforme de ADC se correlaciona con peor pronóstico, dato que podría utilizarse para reconocer alto grado en ADC con patrón acinar13.
En los casos de CaCE o para posteriores estratificaciones por grados entre el patrón acinar y papilar de ADC se puede definir el grado por las características nucleares, aunque esto requiere profundizar los estudios.
d) Clasificacion de CaP en piezas de resección
Las siguientes entidades requieren para su diagnóstico el estudio histológico completo de las piezas de resección y no es posible diagnosticarlas en biopsias pequeñas o muestras de citología.
- ADC in situ (AIS)
- ADC mínimamente invasor (MIA)
- Carcinoma de células grandes (CaCG)
- Carcinoma adenoescamoso (CaAE)
- Carcinoma pleomórfico (CaPleo)
d.1 Adenocarcinoma
Los mayores cambios en la clasificación son los siguientes:
- La discontinuación de los términos “carcinoma bronquiolo alveolar” por tratarse de una expresión confusa que comprende entidades invasoras y no invasoras con muy diferentes pronósticos; y “ADC con subtipos mixtos” porque no ayuda a la estratificación de los ADC en grupos de diferente pronóstico.
- El empleo del término “lepídico” para definir un patrón no invasor presente en un ADC invasor (previamente clasificado como Carcinoma bronquiolo alveolar).
- La incorporación de la categoría AIS entre las lesiones preinvasoras junto a la Hiperplasia Adenomatosa Atípica (Tabla 4) y la categoría MIA para definir un ADC de buen pronóstico (Tabla 5).
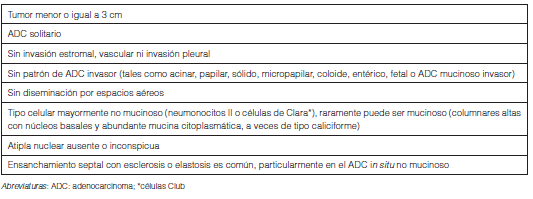
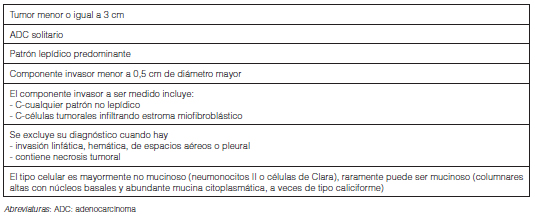
- La clasificación del ADC invasor se debe hacer de acuerdo al patrón histológico predominante luego del exhaustivo estudio histológico estimando semicuantitativamente los porcentajes de cada subtipo presente en incrementos de a 5%. Aunque pudiera existir un caso con cantidades iguales de dos componentes diferentes, es recomendable afinar el conteo para elegir el patrón predominante. Es recomendable mencionar todos los patrones y sus porcentajes dado que ese dato puede ser útil para estimar la importancia de los considerados de alto grado aunque se encuentren en muy baja cantidad, como el micropapilar, o para poder comparar tumores múltiples. Al respecto, se recomienda clasificar como patrón micropapilar no lepídico a aquel con un componente micropapilar dentro de los espacios aéreos en un área de patrón lepídico; y como patrón micropapilar no acinar al caracterizado por la presencia de un componente micropapilar dentro de los espacios glandulares en un área de patrón acinar.
- Se recomienda mencionar la diseminación aerógena en el informe histopatológico cuando esta característica está presente. Recientemente descripta, ésta consiste en nidos micropapilares o sólidos o células neoplásicas individuales situados adentro de espacios aéreos en el parénquima adyacente por afuera del borde del tumor y se considera un indicador de recurrencia en resecciones localizadas. Este signo se ha incorporado a la definición de invasión para diferenciar ADC lepídico de AIS y MIA14, 15. La clasificación como “ADC lepídico, podría corresponder a AIS” cuando un tumor mayor a 3 cm de diámetro en el estudio histológico completo con inclusión total estuviera constituido por un patrón lepídico puro; y como “ADC lepídico, podría corresponder a MIA” cuando un tumor mayor a 3 cm de diámetro con estudio histológico completo con inclusión total estuviera constituido por un patrón lepídico con un foco de invasión menor o igual a 0,5 cm en su mayor diámetro. El término “ADC mucinoso invasor” se reserva para para aquellos ADC invasores mucinosos previamente clasificados como Carcinoma bronquiolo alveolar mucinoso.
- Se recomienda discontinuar los subtipos de ADC “de células claras” y “de células en anillo de sello” como diagnóstico y su reconocimiento como términos descriptivos cuando estén presentes aún en pequeña cantidad; así como del término de “Cistoadenocarcinoma mucinoso” e incluirlo bajo la categoría de “ADC coloide”.
Recomendaciones para el diagnóstico de AIS o MIA
Sólo puede confirmarse el diagnóstico de certeza en el estudio de la totalidad del tumor.
En el estudio intraoperatorio sólo puede establecerse que la lesión tiene crecimiento predominantemente lepídico. Es aún controvertida la utilidad y seguridad de la biopsia intraoperatoria para distinguir entre AIS y MIA de otros tipos de ADC16.
El estudio intraoperatorio del margen de resección de estas lesiones es casi imposible si el mismo es próximo a la lesión. Aún no es claro el pronóstico de los AIS y MIA en resecciones limitadas ya que la mayoría de ellos han sido descriptos en piezas de resección como lobectomías16.
d.2 Carcinoma de células escamosas
Los mayores cambios en la clasificación en CaCE consisten en:
- Clasificarlos en queratinizantes (si existe inequívoca queratinización de cualquier tipo y en cualquier cantidad) y no queratinizantes (debido a que muchos ADC muestran morfología escamoide su diagnóstico requiere expresión de marcadores escamosos como P63 o P4017). La presencia o ausencia de queratinización no parece modificar el pronóstico.
- Considerar al carcinoma basaloide como el único subtipo reconocido dentro de los CaCE. Conforma diagnóstico cuando el componente basaloide se expresa en más del 50% del tumor. Cuando es igual o menor al 50% se describe como “con características basaloides”. Algunas publicaciones postulan un pronóstico más pobre para este subtipo de CaCE.
- No reconocer al cáncer de células claras como un subtipo, sino como una característica histológica que puede ocurrir tanto en los queratinizantes como en los no queratinizantes. Puede mencionarse como “con características de células claras”.
- Posteriormente a la publicación de la clasificación se describió la importancia de reconocer la diseminación aerógena de los CaCE (con los mismos criterios que para los patrones sólido o micropapilar de los ADC) como predictor independiente de recurrencia18.
d.3 Carcinoma de células grandes
El diagnóstico del CaCG está restringido a piezas de resección. Es un diagnóstico de exclusión luego de evaluar diferenciación escamosa o glandular y neuroendocrina. En la clasificación actual todos los subtipos han sido movidos a las categorías de ADC, CaCE, CaNE o a un grupo de “otros y carcinomas inclasificables”.
d.4 Carcinoma sarcomatoide
Es un término general que comprende los CaPleo, los CaCG, los Carcinomas de células fusiformes puros, Carcinosarcomas y el Blastoma pulmonar. Se recomienda utilizar estos términos específicos en lugar de la nomenclatura general para evitar confusiones, principalmente con sarcomas. Los criterios de clasificación y la clasificación misma no se han modificado respecto del 2004. Su diagnóstico requiere el estudio completo de la pieza de resección.
Referencias
1. Travis W, Brambilla E, Burke AP, Marx A, Nicholson AG. WHO Classification of Tumours of the Lung, Pleura, Thymus and Heart. Lyon: International Agency for Research on Cancer. 2015.
2. Travis W, Brambilla E, Noguchi M, et al. IASLC/ATS/ERS International Multidisciplinary Classification of Lung Adenocarcinoma. J Thorac Oncol. 20011; 6 (2): 244-285.
3. Travis W. The 2015 WHO classification of lung tumors. Pathologe. 2014; 35 [Suppl 2]: 188-188.
4. Travis W, Brambilla E, Muller-Hermelink HK, Harris CC, eds. Tumours of the lung, pleura, thymus and heart. Pathology and Genetics. WHO Classification of Tumours. IARC 2004.
5. Rossi G, Pelosi G, Graziano P, Barbareschi M and Papotti M. A Reevaluation of the Clinical Significance of Histological Subtyping of None Small Cell Lung Carcinoma: Diagnostic Algorithms in the Era of Personalized Treatments. Review Article. Int J Surg Pathol. 2009; 17: 206.
6. Travis W, Brambilla E, Nicholson A, et al. On Behalf of the WHO Panel. The 2015 WHO classification of lung tumors. Impact of Genetic, Clinical and Radiologic Advances Since the 2004 Classification. J Thorac Oncol. 2015; 10: 1243–1260.
7. Loo PS, Thomas SC, Nicolson MC, et al. Subtyping of undifferentiated non-small cell carcinomas in bronchial biopsy specimens. J Thorac Oncol. 2010; 5(4): 442-447.
8. Bishop JA, Teruya-Feldstein J, Westra WH, Pelosi G, et al. p40 (ΔNp63) is superior to p63 for the diagnosis of pulmonary squamous cell carcinoma. Mod Pathol. 2012; 25 (3): 405-15.
9. Pelosi G, Fabbri A, Bianchi F, Maisonneuve P, et al. ΔNp63 (p40) and thyroid transcription factor-1 immunoreactivity on small biopsies or cellblocks for typing non-small cell lung cancer: a novel two-hit, sparing-material approach. .J Thorac Oncol. 2012; 7 (2): 281-290.
10. Brambilla E. Lung cáncer: multidisciplinary approach for management. Eur Resp J. 2010; 35: 717-720.
11. Yoshizawa A, Motoi N, Riely GJ, Sima CS, et al. Impact of proposed IASLC/ATS/ERS classification of lung adenocarcinoma: prognostic subgroups and implications for further revision of staging based on analysis of 514 stage I cases. Mod Pathol. 2011; 24(5): 653-64.
12. Travis WD, Brambilla E, Geisinger KR. Histological grading in lung cancer: one system for all or separate systems for each histological type? Eur Respir J. 2016; 47(3): 720-723.
13. Warth A, Muley T, Kossakowski C, et al. Prognostic impact and clinicopathological correlations of the cribriform pattern in pulmonary adenocarcinoma. J Thorac Oncol 2015; 10: 638-644.
14. Kadota K, Nitadori JI, Sima CS, et al. Tumor spread through air spaces is an important pattern of invasion and impacts the frequency and location of recurrences following limited resection for small stage I lung adenocarcinomas. J Thorac Oncol. 2015; 10: 06-814.
15. Warth A, Muley T, Kossakowski CA, et al. Prognostic impact of intraalveolar tumor spread in pulmonary adenocarcinoma. Am J Surg Pathol. 2015; 39: 793-801.
16. Eguchi T, Kadota K, Park BJ, Travis WD, et al. The new IASLC/ATS/ERS lung adenocarcinoma classification: what the surgeon should know. Semin Thorac Cardiovasc Surg. 2014; 26 (3): 210-22.
17. Kadota K, Nitadori J, Rekhtman N, Jones DR, et al. Reevaluation and reclassification of resected lung carcinomas originally diagnosed as squamous cell carcinoma using immunohistochemical analysis. Am J Surg Pathol. 2015; 39: 1170-1180.
18. Lu S, Tan KS, Kadota K, Eguchi T, et al.Spread through Air Spaces (STAS) Is an Independent Predictor of Recurrence and Lung Cancer-Specific Death in Squamous Cell Carcinoma. J Thorac Oncol. 2017; 12 (2): 223-234.
Factores pronósticos y predictivos de respuesta terapéutica
El estudio de factores vinculados con el pronóstico de la evolución tumoral contribuye a identificar pacientes con riesgo de progresión más acelerada.
a) Tipo histológico
El tipo histológico del carcinoma está asociado a una presentación clínica, la presencia de determinados factores de riesgo y a características en su evolución. Dentro de los CaPNCP, los ADC en general presentan mayor potencial de metástasis a distancia que los CaCE. Los CaGC y los Carcinomas sarcomatoides tienen peor pronóstico aún en estadios tempranos1, 2.
Acorde a la clasificación OMS 2015 la mayor parte de los ADC infiltrantes muestran un patrón de crecimiento mixto y se clasifican según el patrón de crecimiento predominante, debiendo consignarse el porcentaje de cada uno dada su relación con diferente evolución clínica en función del potencial metastásico. Los de mejor pronóstico, excluyendo el componente lepídico que puede estar presente en estos tumores, son los ADC con patrones acinar y papilar y, los asociados a mayor potencial metastásico son los patrones sólido y micropapilar. Más recientemente se ha descripto, pero no incluido en la clasificación OMS 2015, el patrón de crecimiento cribiforme con alto potencial metastásico y mal pronóstico3-5.
Si bien hay algunas propuestas al respecto, no existe un sistema bien establecido para determinar grados histológicos o citológicos tanto en ADC como en CaCE2, 6.
b) Embolias vasculares
Es recomendable mencionar la presencia de embolias vasculares tanto linfáticas como sanguíneas, ya que si bien no están incluidas en la estadificación como un predictor de evolución, existen estudios que las asocian a peor pronóstico7, 8. Recientemente se ha mencionado, tanto para el ADC como para el CaCE, a la diseminación intraalveolar del tumor considerada una forma de metástasis intrapulmonar, como indicadora de mal pronóstico9, 10.
c) Otros marcadores
c.1 Valor pronóstico
Hasta el momento, si bien se han evaluado numerosos biomarcadores para establecer su valor pronóstico, no existe ninguno recomendado que deba incluirse en el estudio de rutina de un tumor pulmonar, más allá de estudios de investigación.
Se han evaluado factores de proliferación y apoptosis (Ki67, p53, Rb, bcl-2, ciclina D1, inhibidores de kinasa dependiente de ciclina como p21 y p27), así como también moléculas de adhesión (E- caderinas, CD44), factores asociados a angiogénesis, reparación de ADN (ERCC-1, RRM-1), pero con resultados contradictorios en muchos casos.
Algunas modificaciones moleculares presentes en el tumor están asociadas a variaciones del pronóstico (mutaciones del gen EGFR); lo mismo se observa en el examen de linfocitos intratumorales (TILs) (relación TILs/CD8); expresión de PD-L1 y otros análisis relacionados con la respuesta inmune. Hasta la actualidad ni las alteraciones moleculares ni de la respuesta inmune vinculadas con el pronóstico tumoral se incluyen en los estudios de rutina11, 12.
c.2 Predicción de respuesta terapéutica
En los últimos años el desarrollo de agentes dirigidos a blancos moleculares y de inmunoterapia ha determinado, en algunos casos, la necesidad de efectuar test adicionales sobre la muestra en la que se efectúa el diagnóstico de CaP. Dada la evolución rápida de los estudios clínicos con estos tratamientos y la aparición de nuevos fármacos y técnicas de estudio de las alteraciones moleculares y del sistema inmune, las guías referidas a estos temas se deben actualizar en periodos más cortos. Ciertos conceptos generales con respecto a las pruebas relacionadas con estas terapéuticas son útiles para todas ellas.
Si bien estos examenes podrían solicitarse desde el momento del diagnóstico del CaP acelerando los tiempos hasta el resultado, es necesario realizarlos cuando los pacientes tienen indicación de estos tratamientos y las pruebas pretenden examinar la respuesta terapéutica. (Indicaciones referidas en el Capítulo de terapias con blancos moleculares e inmunoterapia pág 15).
Sobre todo en relación a la inmunoterapia, debe consignarse que, en ocasiones, el examen está asociado con mejor respuesta terapéutica pero es una prueba complementaria no obligatoria para instaurar dicho tratamiento.
Las pruebas deben realizarse utilizando las técnicas, plataformas diagnósticas y reactivos que han sido validados por los estudios clínicos u otros estudios posteriores como determinantes de la respuesta terapéutica.
Estudios moleculares
a) Biomarcadores predictivos de respuesta a tratamientos dirigidos contra blancos moleculares13, 14
a.1 Mutaciones del gen de EGFR (Epidermal Growth Factor Receptor)
Cuando los pacientes son potenciales candidatos a terapéutica con inhibidores de tirosinaquinasa (TKI) del gen EGFR, su selección requiere la determinación de mutaciones en los exones 18 a 21 del dominio tirosina quinasa del gen10. También se recomienda investigar la presencia de mutación T790M del exón 20 del mismo gen en aquellos pacientes que han recibido inhibidores de tirosinaquinasa de EGFR y han desarrollado resistencia a dicha terapéutica15.
El estudio puede realizarse en muestras de tejido tumoral de tamaño variable y/o en muestras citológicas. El método para la determinación de la presencia de mutaciones es la PCR- secuenciación, en sus diferente, con diferente sensibilidad de acuerdo a la cantidad y proporción de células tumorales. Es recomendable utilizar un método que permita determinar la presencia de mutaciones en una muestra con al menos 10% de células tumorales. Los métodos más utilizados en nuestro medio son Sanger y qPCR alelo específica. Actualmente se han comenzado a incorporar sistemas de Secuenciación de Nueva Generación (NGS) para determinar la presencia de grupos de alteraciones moleculares simultáneamente. La detección por IHQ del receptor de EGFR y las técnicas de amplificación de EGFR (técnicas de hibridación in situ: FISH, CISH, SISH) no son útiles para predecir respuesta a TKI15. Existen anticuerpos comerciales para determinación por IHQ de las dos mutaciones más frecuentes de los exones 19 y 21. Su uso sólo se recomienda por excepción cuando la muestra no es suficiente para los métodos de secuenciación mencionados previamente16.
a.2 Rearreglo del gen ALK
Cuando los pacientes son potenciales candidatos a recibir terapéutica con inhibidores de la proteína de fusión de ALK, se recomienda la determinación del rearreglo del gen ALK (gen de fusión o de la proteína de fusión ALK/EMl4 y ALK/otros genes asociados)
Las técnicas validadas para este propósito son la de FISH (hibridación fluorescente in situ) y la IHQ.
La técnica de FISH es la de break appart utilizando sonda Vysis. La muestra debe tener al menos 50 células tumorales bien preservadas, con clara señalización y control simultáneo en un corte con HE para identificar dichas células; considerándose positivo el hallazgo de 15% o más de células con señal indicadora de fusión ALK (separación de las señales roja y verde o la presencia de señal roja sola)17. La técnica de IHQ validada como predictor de respuesta terapéutica utiliza el anticuerpo anti ALK clon D5F3 empleado con los sistemas de detección y amplificación Optiview de Ventana (CDx)10; no habiéndose descripto el número mínimo de células tumorales en la muestra necesario para esta determinación. Existen otros anticuerpos para determinar ALK (clon 5A4); correctamente validados han demostrado muy buena correlación con el FISH. No se debe utilizar el anticuerpo anti ALK 1 empleado habitualmente en el diagnóstico de linfomas18.
a.3 Rearreglo gen ROS1
La presencia de gen de fusión de ROS1 en aquellos pacientes candidatos a terapéuticas se establece usando inhibidores de dicho gen. Se puede investigar en forma secuencial en pacientes negativos para alteraciones de EGFR y ALK, o simultáneamente. El método inicial recomendado, dada la baja frecuencia de dicha fusión, es la IHQ con el clon D4D6 en plataformas automatizadas utilizando sistemas de amplificación y detección que hacen más sensible el método. Los casos positivos por IHQ serán confirmados por FISH. Para determinar positividad por IHQ se utiliza un sistema de puntuación que evalúa intensidad y porcentaje de células positivas. La técnica de FISH es similar a la empleada para evaluar ALK y la positividad también se define como 15% o más de células con separación de señales o señal roja sola. A diferencia de la determinación de ALK no existen, salvo el clon de anticuerpo, un kit ni plataforma de IHQ ni sonda de FISH específicas para realizar estas determinaciones19, 20.
b) Otras pruebas moleculares
Hasta el momento no hay otros tratamientos con blancos moleculares aprobados que requieran la evaluación de alteraciones moleculares adicionales. El uso de paneles en sistemas NGS permite la analizar simultáneamente diversos grupos de alteraciones moleculares, en número variable de acuerdo al panel utilizado. Los resultados proporcionan información acerca de cambios moleculares conocidos como blancos para terapias dirigidas con fármacos en uso, y de otras alteraciones moleculares adicionales. El informe de dichos casos deberá incluir claramente los hallazgos y describir su utilidad terapéutica21, 22.
c) Biopsia líquida
Existe extensa bibliografía acerca de la determinación de alteraciones moleculares en sangre y otros líquidos corporales con potencial utilidad clínica para establecer la sensibilidad de los pacientes con CaP a los tratamientos dirigidos a un blanco terapéutico. Hasta la actualidad la única técnica validada en la práctica clínica es la investigación de mutaciones de resistencia del gen de EGFR (T790M) en pacientes que progresan luego de un tiempo de haber recibido inhibidores de tirosinaquinasa de dicho gen, cuando no se tiene acceso a una nueva muestra de tejido. La técnica más frecuentemente utilizada es de qPCR alelo-específica. Sin duda en el futuro la utilización en la práctica clínica de estos estudios será mucho más amplia23.
d) Inmunoterapia
El desarrollo de la inmunoterapia se asocia, en algunos casos, a la búsqueda de algunos marcadores para lograr un mayor beneficio. La evaluación de la respuesta inmune a través de un biomarcador no es tan lineal como en el caso del estudio de alteraciones moleculares de las células tumorales. La respuesta inmune es un fenómeno dinámico que permite analizar un momento puntual. Eso ha originado que, hasta el momento, los biomarcadores utilizados para valorar la potencial respuesta a inmunoterapia no sean del todo precisos. Por otro lado no siempre estos análisis son estrictamente necesarios para prescribir
estas terapéuticas, son los casos de las llamadas pruebas diagnósticas complementarias (complementary diagnosis) cuya realización sólo en pocos casos es estrictamente necesaria (companion diagnosis).
Hasta la actualidad, las inmunoterapias aprobadas para CaP están acotadas a los resultados de la determinación de PD-L1 por IHQ. Esta prueba es compleja en la práctica porque cada fármaco anti PD-1 o anti PD-L1 se asocia a un clon determinado de IHQ anti PD-L1, efectuado sobre una plataforma diagnóstica específica, diferente para cada sustancia24. Esta área está en permanente revisión y se esperan cambios significativos relacionados con las pruebas necesarias para prescribir estos tratamientos. La recomendación más prudente probablemente sea seguir las guías internacionales y las condiciones de aprobación locales de cada medicamento.
Al momento actual, el tratamiento con pembrolizumab depende de la determinación de PD-L1 por IHQ con el clon 22C3 presentado como kit de la compañía DAKO, realizado en plataforma DAKO. Esta es la única prueba “companion diagnostic”. El porcentaje de células tumorales necesarias para prescribir pembrolizumab varía de acuerdo a su utilización en primera o segunda línea. Para primera línea se requiere un porcentual mayor al 50% de células tumorales con marcación de membrana, completa o incompleta, de cualquier intensidad17. Para segunda línea el hallazgo de 1% o más de células positivas habilita el tratamiento25.
Los tratamientos con nivolumab y atezolizumab están supeditados a otras pruebas de IHQ, no siendo estrictamente necesarias para indicar el tratamiento (test diagnósticos complementarios). Para nivolumab se recomienda emplear el anticuerpo 28-8 en kit de DAKO con la misma plataforma DAKO recomendada para pembrolizumab; se considera candidato a recibir este fármaco el paciente con 1% o más de células tumorales con marcación de membrana.
El tratamiento con atezolizumab depende de los resultados de una prueba de IHQ que utiliza clon SP142 en kit de la compañía Ventana realizada en plataforma automatizada de Ventana; es el único examen que evalúa simultáneamente porcentaje de células tumorales y de células inmunes aplicando una escala de puntuación para ambas marcaciones.
Se han realizado varios estudios que tratan de armonizar estos anticuerpos y plataformas para otorgar mayor facilidad y acceso a los testeos; se espera que de estas investigaciones surjan en poco tiempo cambios que afectarán lo expuesto previamente. Hasta la actualidad las pruebas que sólo evalúan células tumorales y que utilizan los anticuerpos 22C3, 28.8 y SP263 han demostrado buena correlación entre sí26-28. El anticuerpo SP263 Ventana se utiliza actualmente en los ensayos clínicos con durvalumab.
Referencias
1. Corrin B. Pathology of the lungs. Churchill Livingstone, Eds. 2000: 241-280.
2. Travis WD, Brambilla E, Geisinger KR. Histological grading in lung cancer: one system for all or separate systems for each histological type? Eur Respir J. 2016; 47(3): 720-3.
3. Yim J, Zhu LC, Chiriboga L, Watson H, et al. Histologic Featuress are important prognostic indicators in early stages lung adenocarcinomas. Modern Pathology. 2009; 20: 233-241.
4. Zhao Y, Wang R, Shen X, et al. Minor Components of Micropapillary and Solid Subtypes in Lung Adenocarcinoma are Predictors of Lymph Node Metastasis and Poor Prognosis. Ann Surg Oncol. 2016; 23(6): 2099-2105.
5. Warth A, Muley T, Kossakowski C, Stenzinger A, et al. Prognostic impact and clinicopathological correlations of the cribiform pattern in pulmonary adenocarcinoma. J Thorac Oncol. 2015; 10: 638-644.
6. Sica G, Yoshizawa A, Sima C, Azzoli C, et al. A Grading System of Lung Adenocarcinomas Based on Histologic Pattern is Predictive of Disease Recurrence in Stage I Tumors. Am J Surg Pathol. 2010; 34(8): 1155-1162.
7. Naito Y, Goto K, Nagai K, Ishii G, et al. Vascular invasion is a strong prognostic factor after complete resection of node-negative non-small cell lung cancer. Chest. 2010; 65(12): 1092-1098.
8. Shoji F, Haro A, Yoshida T, et al. Prognostic significance of intratumoral blood vessel invasion in pathologic stage IA non-small cell lung cancer. Ann Thorac Surg. 2010; 89(3): 864.
9. Warth A, Muley T, Kossakowski CA, Goeppert B, et al. Prognostic Impact of Intraalveolar Tumor Spread in Pulmonary Adenocarcinoma. Am J Surg Pathol. 2015; 39(6): 793-801.
10. Lu S, Tan KS, Kadota K, Eguchi T, et al. Spread through Air Spaces (STAS) Is an Independent Predictor of Recurrence and Lung Cancer-Specific Death in Squamous Cell Carcinoma. J Thorac Oncol. 2017; 12(2): 223-234.
11. Tang H, Wang S, Xiao G, Schiller J, et al. Comprehensive evaluation of published gene expression prognostic signatures for biomarker-based lung cancer clinical studies. Ann Oncol 2017. doi: 10.1093.
12. Yan X, Jiao SC, Zhang GQ, Guan Y, Wang JL. Tumor-associated immune factors are associated with recurrence and metastasis in non-small cell lung cancer. Cancer Gene Ther 2017. doi: 10.1038/cgt.2016.40.
13. CAP/AMP/IASLC molecular testing guidelines. Draft of update 2016. IASLC website.
14. Sholl LM. The Molecular Pathology of Lung Cancer. Surg Pathol Clin. 2016; 9(3): 353-378.
15. Roy-Chowdhuri S, Aisner DL, Allen TC, Beasley MB, et al. Biomarker Testing in Lung Carcinoma Cytology Specimens: A Perspective From Members of the Pulmonary Pathology Society. Arch Pathol Lab Med. 2016; 140(11): 1267-1272
16. Keedy WL, Temin S, Somerfield MR et al. American Society of Clinical Oncology Provisional Clinical Opinion: Epidermal Growth Factor Receptor (EGFR) Mutation Testing for Patients With Advanced Non–Small-Cell Lung Cancer Considering First-Line EGFR Tyrosine Kinase Inhibitor Therapy. J Clin Onco.l 2011; 29(15): 2121-2127.
17. Mc Leer-Florin A, Moro Sibilot D, Melis A, SalameireD, et al. Dual IHC and FISH testing for ALK gene rearrangement in lung adenocarcinomas in routine practice: a French study. J Thorac Oncol. 2012; 7(2): 348-354.
18. Ma H, Yao WX, Huang L et al. Efficacy of D5F3 IHC for detecting ALK gene rearrangement in NSCLC patients: a systematic review and meta-analysis. Efficacy of D5F3 IHC for detecting ALK gene rearrangement in NSCLC patients: a systematic review and meta-analysis. Oncotarget. 2016; 7(43): 70128-70142.
19. Bubendorf L, Büttner R, Al-Dayel F, Dietel M, et al. Testing for ROS1 in non-small cell lung cancer: a review with recommendations. Virchows Arch. 2016; 469(5): 489-503.
20. Kaderbhai CG, Boidot R, Beltjens F, Chevrier S, et al. Use of dedicated gene panel sequencing using next generation sequencing to improve the personalized care of lung cancer. Oncotarget. 2016; 7(17): 24860-24870.
21. Shao D, Lin Y, Liu J, Wan L, et al. A targeted next-generation sequencing method for identifying clinically relevant mutation profiles in lung adenocarcinoma. Sci Rep. 2016; 6: 22338.
22. Sholl LM, Aisner DL, Allen TC, Beasley MB, et al. Liquid Biopsy in Lung Cancer: A Perspective From Members of the Pulmonary Pathology Society .Arch Pathol Lab Med. 2016; 140(8): 825-829.
23. Kerr K. Hirsh F. PD-L1 immunohistochemestry. Friend or Foe. Arch Pathol Lab Med. 2016; 140: 326–331.
24. Herbst RS, Baas P, Perez-Gracia JL, Felip E, et al. P2.41 (also presented as PD1.06): Pembrolizumab versus Docetaxel for Previously Treated NSCLC (KEYNOTE-010): Archival versus New Tumor Samples for PD-L1 Assessment: Track: Immunotherapy. J Thorac Oncol. 2016; 11(10S): S242-S243.
25. Reck M, Rodríguez-Abreu D, Robinson AG, Hui R, Csöszi T, et al. KEYNOTE-024 Investigators.. Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer. N Engl J Med. 2016; 375(19): 1823-1833.
26. Hirsh F, McElhinny A, Stanforth D, Ranger-Moore J, et al. PD-L1 Immunohistochemistry Assays for Lung Cancer: Results from Phase 1 of the Blueprint PD-L1 IHC Assay Comparison Project. J Thorac Oncol. 2017; 12(2): 208-222.
27. Scheel AH, Dietel M, Heukamp LC, Jöhrens K, et al. Harmonized PD-L1 immunohistochemistry for pulmonary squamous-cell and adenocarcinomas. Modern Pathology 2016; 29: 1165-1172.
28. Neuman T, London M, Kania-Almog J, Litvin A, et al. A Harmonization Study for the Use of 22C3 PD-L1 Immunohistochemical Staining on Ventana’s Platform. J Thorac Oncol 2016; 11(11): 1863-1868.
Estadificación patológica del cáncer de pulmón (pTNM) 8° Edición 2017
Las recomendaciones para la clasificación TNM provienen del análisis de las bases de datos de la International Association for the Study of Lung Cancer (IASLC), la revisión de artículos publicados y un amplio y multidisciplinario consenso, que fue realizado por la IASLC por solicitud de la Union of the International Cancer Control (UICC) y el American Joint Comitee on Cancer (AJCC), instituciones que las incorporaron en sus respectivos manuales de la 8a Edición 20171, 2.
a) Clasificación histopatológica posquirúrgica
La evaluación del tumor primario (T) se realiza en la pieza resecada o en una muestra de tejido tomada por biopsia la cual debe ser apropiada para evaluar la categoría más alta de T.
Para evaluar el compromiso ganglionar (N) la técnica de resección debe permitir determinar con precisión la ausencia o presencia de metástasis en los ganglios linfáticos regionales.
Establecer o descartar la presencia de metástasis a distancia (M) implica un estudio microscópico. Datos clínicos y patológicos pueden combinarse solamente si la información disponible es parcial.
a.1 T (Tumor)
TX: tumor no evaluado o tumor descubierto por células positivas en citología de esputo o lavado bronquial, pero sin evidencia en imágenes o en endoscopía
T0: sin evidencia de tumor primario.
Tis: tumor in situ: Tis. Tis (AIS) para adenocarcinoma in situ, Tis (SCIS) para carcinoma escamoso in situ.
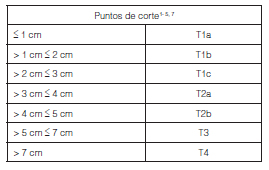
T1: tumor ≤ 3 cm en su mayor dimensión, rodeado por pulmón o pleura visceral, sin evidencia broncoscópica de invasión más proximal que el bronquio lobar (*)
T1mi: adenocarcinoma mínimamente invasor
T1a: tumor ≤ 1 cm en su mayor dimensión (*)
T1b: tumor > 1 cm y ≤ 2 cm en su mayor dimensión
(*) También se considera T1a a un tumor de presentación muy infrecuente, con diseminación superficial a lo largo del bronquio, de cualquier tamaño con componente invasor limitado a la pared del bronquio, que puede extenderse al bronquio principal.
T1c: tumor >2 cm y ≤ 3 cm en su mayor dimensión
T2: tumor > de 3 cm ≤ 5cm en su mayor dimensión.
T2a: tumor > 3 cm ≤ 4 cm (**)
T2b: tumor > 4 cm ≤ 5 cm
o con cualquiera de las siguientes características:
Tumor que invade bronquio principal a cualquier distancia de la carina pero sin comprometerla
Tumor que invade la pleura visceral (PL1-PL2)
Tumor asociado con atelectasia o neumonitis obstructiva, que se extiende a la región hiliar que puede comprometer parte o todo el pulmón.
(**) T2a si presenta alguna de estas características y no se puede determinar el tamaño
T3: tumor > 5 cm ≤ 7 cm en su mayor dimensión o que invade directamente cualquiera de las siguientes estructuras: pleura parietal (PL3), pared torácica (incluyendo tumor del sulcus), nervio frénico, pleura o pericardio parietal o; nódulo(s) tumoral separado del tumor principal en el mismo lóbulo.
T4: tumor > 7 cm en su mayor dimensión o; que invade cualquiera de las siguientes estructuras: diafragma, mediastino, corazón, grandes vasos, tráquea, nervio laríngeo recurrente, esófago, cuerpos vertebrales, carina o; nódulo/s tumoral separado del tumor principal en diferente lóbulo ipsilateral.
a.2 N (Ganglios linfáticos regionales)
NX: los ganglios linfáticos no pueden ser evaluados.
N0: confirmación microscópica de ausencia de metástasis en ganglios linfáticos regionales.
N1: confirmación microscópica de metástasis en ganglios linfáticos ipsilaterales peribronquiales y/o hiliares y intrapulmonares, incluidos ganglios linfáticos con invasión directa.
N2: confirmación microscópica de metástasis en ganglios mediastinales y/o subcarinales ipsilaterales.
N3: confirmación microscópica de metástasis en ganglios linfáticos mediastinales contralaterales; hiliar contralateral; escaleno ipsi o contralateral; o supraclavicular.
a.3 M (Metástasis a distancia)
M0: sin metástasis a distancia.
M1: presencia de metástasis.
M1a: nódulo(s) tumoral separado en pulmón contralateral. Tumor con nódulos pleurales o derrame pleural o pericárdico maligno(*)
M1b: metástasis extratorácica única en un solo órgano. Compromiso de un único ganglio linfático no regional
(*) En la mayoría de los casos la presencia de derrame pleural o pericárdico es debido al tumor. En casos excepcionales si el estudio citológico reiterado es negativo, si los líquidos no son hemorrágicos ni exudativos y en correlación con datos clínicos puede interpretarse como derrame no asociado al tumor.
M1c: múltiples metástasis extratorácicas en uno o varios órganos
b) Datos relevantes a la hora de establecer el pTNM3
b.1 Tamaño tumoral (Tabla 1)
Se recomienda registrar la medida del tumor previamente a la fijación en formol, ya que se ha demostrado que en tumores de poco tamaño esta técnica puede cambiar el T.
Se indica medir al menos el mayor diámetro con regla y precisión milimétrica, sin “redondeos” ni estimaciones.
Para definir la categoría T de los tumores subsólidos* es requisito medir la parte invasora ya que es la que determina el pronóstico, pero se recomienda documentar también el tamaño total del tumor (incluyendo ambos componentes)4.
(*) Los nódulos “subsólidos” o parcialmente sólidos son aquellos que presentan en la imagen de tomografía computada una parte sólida y una en vidrio esmerilado. Microscópicamente corresponden a adenocarcinomas no mucinosos con un componente lepídico y otro invasor.La medida de los tumores después de terapia de inducción debe realizarse multiplicando el porcentaje de células viables por el tamaño total de la lesión.
b.2 Invasión pleural 5, 6
Si la invasión pleural (PL) en cortes con HE de los tumores de menos de 3 cm es dudosa, se indica realizar coloración para fibras elásticas, y establecer los siguientes niveles:
PL0: Tumor localizado dentro del parénquima pulmonar o que llega al tejido conectivo pleural sin atravesar la lámina elástica
PL1: Tumor que invade la pleura a través de la lámina elástica
PL2: Tumor que invade la superficie de la pleura visceral
PL3: Tumor que invade la pleura parietal o la pared torácica
Los tumores con invasión directa a un lóbulo adyacente a través de la cisura o por extensión directa en algún punto donde la cisura es deficiente deben clasificarse como T2a, a menos que otro criterio le asigne una categoría T más alta.
Las categorías de T considerando el compromiso pleural se describen en la Tabla 2, no obstante es necesario tener en cuenta las otras características que definen cada categoría.

b.3 Nódulos múltiples
Las recomendaciones se aplican a aquellas lesiones encontradas tanto en el estudio macroscópico como en el microscópico, y difieren según el patrón de presentación de la enfermedad3, 7-9.
c) Criterios patológicos después de la resección
c.1 Tumores primarios sincrónicos y metacrónicos
Tipos histológicos claramente diferentes (p. ej.: adenocarcinoma y carcinoma escamoso)
Claras diferencias por una evaluación histológica exhaustiva
Carcinoma escamoso que se origina en un carcinoma escamoso in situ
Criterios relativos: ausencia de metástasis ganglionar; patrón de biomarcadores diferente
Aplicar TNM en cada uno de los nódulos
c.2 Nódulos separados con histología similar (metástasis intrapulmonares)
Criterios patológicos: histología similar a tumor primario que NO son múltiples focos de adenocarcinoma in situ, mínimamente invasor o patrón lepídico.
La Tabla 3 resume la clasificación según la localizacion

c.3 Adenocarcinoma patrón lepídico multifocal
El diagnóstico requiere evaluación histológica detallada.
Aplica si una o varias lesiones son AIS, MIA o lepídico y hay otro nódulo subsólido sin biopsia.
Los nódulos pueden identificarse previamente a la cirugía o ser solamente un hallazgo patológico.
No deben ser considerados los focos de hiperplasia adenomatoide atípica.
Independientemente de la localización de las lesiones se clasifica con el T más alto y, entre paréntesis, el número de lesiones o “m” por múltiples; N y M se aplican colectivamente a estos tumores.
c.4 Adenocarcinoma de crecimiento difuso tipo neumónico
Es la presentación típica de los adenocarcinomas mucinosos invasores, pero pueden presentarla también adenocarcinomas no mucinosos o mixtos.
Aunque el patrón lepídico es el más frecuente puede ser heterogéneo y presentar otros (acinar, micropapilar, papilar).
Si es un único foco se determina el T por el tamaño tumoral. Si son múltiples focos se define el T por las diferentes localizaciones como se describió previamente. Si el tamaño tumoral es difícil de establecer y hay evidencias de compromiso en otro lóbulo ipsilateral se aplica T4.
d) Prefijos
Cuando se evalúa un tumor que ha recibido terapéuticas multimodales previamente se coloca el prefijo “y” (yTNM).
Cuando se evalúa una recidiva tumoral luego de un período libre de lesión se coloca el prefijo “r” (rTNM).
e) N- Ganglios metastásicos
El hallazgo de células tumorales en un ganglio linfático por pruebas de IHQ (citoqueratina) se puede consignar, pero no se recomienda su utilización para la estadificación.
Se proponen subestadíos patológicos en el factor N como descriptores prospectivos (aún no considerados en el actual TNM) dado el diferente pronóstico según sea la estación ganglionar única o múltiple.
N1a compromiso un sólo nivel N1
N1b compromiso múltiples niveles N1
N2a1 un sólo nivel N2 “skip” metástasis (N2 única sin N1)
N2a2 un sólo nivel N2 con pN1
N2b múltiples niveles N223
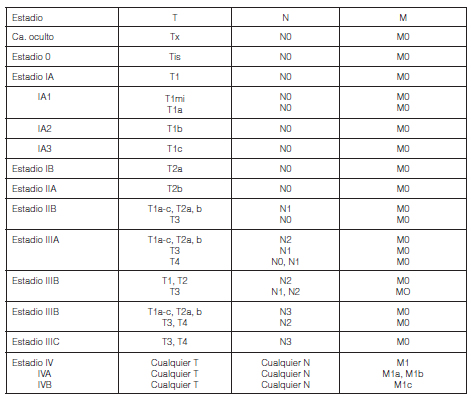
En la Tabla 4 se describe la 8° edición de la clasificación TNM de cáncer de pulmón definida por la OMS.
f) Protocolo de informe de pieza de resección de CaP
El informe anatomopatológico de la pieza de resección de un CaP puede ser descriptivo o limitarse al llenado de una lista de ítems preestablecidos (checklist). El College of American Pathologists posee y publica prácticos checklist para el estudio e informe completo de las piezas tumorales.
Sea cual fuere el método empleado, el informe debe contener todos los elementos que permitan establecer el TNM con la consiguiente estadificación. Si el patólogo desconoce el resultado de los estudios que permiten determinar la presencia o no de metástasis puede consignar todos los datos referentes al T y al N por él estudiados y completar con Mx, dejando al médico tratante la finalización de la estadificación.
El estudio de la pieza debe permitir definir el tipo histológico tumoral, la presencia o no de tumores satélites o sincrónicos, la presencia o no de lesiones in situ u otras lesiones pre invasivas.
Es necesario estudiar el margen de resección bronquial (anillo bronquial) y, si el tumor está cercano a dicho margen, consignar la distancia y la presencia o no de lesiones in situ proximales al tumor principal.
Es requisito estudiar la pleura y, cuando sea necesario, utilizar coloración para fibras elásticas para establecer el compromiso tumoral o no de esta estructura.
Se deben disecar y estudiar los ganglios incluidos en la pieza de resección tumoral; e informar el resto de los ganglios en forma individual separados por regiones de acuerdo a la identificación realizada por el cirujano al hacer la resección.
Si se ha utilizado sutura mecánica se recomienda estudiar la distancia del tumor a la misma, y evaluar el área como margen de resección. Si el tumor está cercano al margen de resección se puede hacer un estudio citológico mediante impronta (antes de retirarla), o por lavado (una vez retirada) analizando el líquido de lavado posteriormente. Se pinta el borde del área de resección de la sutura y luego se consigna en el informe si dicho margen está comprometido y el resultado del estudio citológico del área de la sutura mecánica. Es aconsejable que el informe incluya la presencia de algunos factores de pronóstico (descriptos anteriormente).
Si la lesión ha sido tratada previamente consignar el grado de respuesta (necrosis y en lo posible porcentaje de células viables).
g) Clasificación del tumor residual (R)3
Rx: no puede establecerse la presencia de tumor residual.
R0: resección completa. Confirmación microscópica de que los márgenes de resección están libres de tumor. Para ello se requiere examen histológico de seis estaciones o ganglios linfáticos, que deben incluir tres estaciones o ganglios linfáticos del mediastino, uno debe ser subcarinal 7 y tres del hilio u otras regiones N1. (Si todos los ganglios linfáticos resecados son negativos pero no se cumple con el número requerido se clasifica N0).
R1 (cy+): Se cumplen criterios de R0, pero el lavado pleural es positivo para células neoplásicas.
R1 (is): Se cumplen criterios de R0 pero se encuentra un carcinoma in situ en el margen de resección bronquial.
R1: resección incompleta microscópica. Evidencia microscópica de tumor residual en los márgenes de resección; hay extensión extracapsular en los márgenes de los ganglios linfáticos; existe derrame pleural o pericárdico positivos [R1 (cy+)]
R2: resección incompleta macroscópica. Evidencia macroscópica de tumor residual en márgenes de resección; evidencias de extensión extracapsular en los márgenes de los ganglios linfáticos resecados; ganglios linfáticos positivos no resecados; presencia de nódulos pleurales o pericárdicos.
-R0 (un): resección incierta. No hay evidencia macro ni microscópica de tumor residual pero se evaluaron menos estaciones ganglionares que las recomendadas para establecer pN, o la estación ganglionar resecada o muestreada más alta es positiva.
Referencias
1. Brierly JB, Gosporadowicz MK, Wittekind C, editores. UICCC TNM Classification of Malignant Tumours, 8th edition. Publicado por John Wiley & Sons, 2017.
2. Amin MB, Edge S, Greene F, Byrd DR, et al. (Editores). AJCC Cancer Staging Manual. Publicado por Springer, 2017.
3. Rami-Porta R, Detterbeck W, Travis WD, Asamura H. New site-specific Recommendations Proposed by the IASLC. Staging Manual in Thoracic Oncology, 2nd edition. Publicado por Editorial Rx Press, 2016.
4. Travis WD, Asamura H, Bankier A et al. The IASLC Lung Cancer Staging Project: proposal for coding T categories for Subsolid Nodules and assessment of Tumor size in Part- Solid in the Forthcoming 8th Edition of the TNM Classification of Lung Cancer. J Thorac Oncol. 2016; 11: 1204-1223.
5. Travis WD, Brambilla E, Rami-Porta R et al. Visceral pleural invasión: pathologic criteria and use of elastic stains. Proposals for the 7th Edition of the TNM Classification of Lung Cancer. J Thorac Oncol. 2008; 10: 1384-1390.
6. Rami-Porta R, Bolejack V, Crowley J, et al. The IASLC Lung Cancer Staging Project: proposals for the revisions of the T descriptors in the Forthcoming 8th Edition of the TNM Classification of Lung Cancer. J Thorac Oncol. 2015; 10: 990-1003.
7. Detterbeck FC, Nicholson AG, Franklin WA et al. The IASLC Lung Cancer Staging Project: summary of the proposals for revision of the classification of lung cancers with multiple pulmonary sites of involvement in the forthcoming 8th edition of the TNM classification of lung cancer. J Thorac Oncol. 2016; 11: 639-650.
8. Detterbeck FC, Nicholson AG, Franklin WA et al. The IASLC Lung Cancer Staging Project: background data and proposed criteria to distinguish separate primary lung cancer from metastatic foci in patients with two lung tumors in the forthcoming 8th edition of the TNM classification of lung cancer. J Thorac Oncol. 2016; 11:651-665.
9. Detterbeck FC, Marom EM, Arenberg DA et al. The IASLC Lung Cancer Staging Project: proposals for application of TNM staging rules to lung cancer presenting as multiple nodules with ground glass or lepidic features or a pneumonic-type of involvement in the forthcoming 8th edition of the TNM classification of lung cancer. J Thorac Oncol. 2016; 1: 666-680.
DIAGNÓSTICO
- Pesquisa (screening) y detección temprana
- Síntomas
- Diagnóstico por imágenes
- Broncoscopía
- Nódulo solitario de pulmón
- Estadificación mediastinal
- Detección de metástasis a distancia
- Estrategias para la estadificación
- Evaluación prequirúrgica
Pesquisa (screening) y detección temprana
La signosintomatológica del CaP se suele manifestar en estadios avanzados, en los que la mortalidad es elevada1. El objetivo de la pesquisa o “screening” es reducir la morbimortalidad del CaP al detectarlo (y tratarlo) de manera temprana. Para ello se requiere identificar la población de riesgo y utilizar un método que genere el menor daño posible a un costo accesible para aplicar como política de salud a nivel nacional.
a) Radiografía (Rx) de tórax
La Rx de tórax constituye un método relativamente económico, accesible y que expone al paciente a baja dosis de radiación (Rx de tórax simple aproximadamente 0,1 mSv). Este método, permite evaluar la caja torácica en busca de lesiones pulmonares, mediastinales o pleurales. En lo que respecta al CaP los ensayos clinicos no han moestrado asociación enre Rx de tórax como método de screening y reducción estadísticamente significativa de la mortalidad2. Esto se atribuye a la baja sensibilidad del método para detectar lesiones pequeñas, estadios en el que el cáncer tiene mayor posibilidad de ser curable.
b) Tomografía computada (TC)
La TC, si bien es un método más costoso y menos accesible que la Rx, detecta mayor cantidad de nódulos y cáncer (incluyendo los estadios tempranos)3. Esta mayor sensibilidad ha demostrado reducir la mortalidad por CaP en pacientes de alto riesgo4-7. Además de los costos y disponibilidad la TC presenta como desventaja que incrementa la radiación a la que se expone el paciente versus la Rx. En respuesta a este punto, y el avance en el campo de la radio-protección en TC, surgen los protocolos “low dose”.
c) Tomografía computada “low dose” (TCLD)
Con el término TCLD, nos referimos a protocolos de adquisición que reducen significativamente la dosis de radiación respecto a la TC estándar, manteniendo una calidad suficiente para detectar lesiones pulmonares con un valor diagnóstico similar al de estándar8. La dosis de una TCLD es aproximadamente 1/4 a 1/6 de la TC estándar (TCLD 1,5 a 2 mSv versus 7mSv TCS).
Desventajas de la TCLD. Radiación: aunque disminuye la radiación respecto a la TC standard, continúa siendo superior a la de una RX convencional. Falsos positivos: si bien aumenta el rédito diagnóstico y reduce la mortalidad en grupos de riesgo se debe tener en cuenta que también presenta mayor número de falsos positivos respecto de la Rx5. “Incidentalomas”: se advierte un mayor número de hallazgos incidentales, situaciones que expondrán al paciente a nuevos procedimientos diagnósticos (más tomografíascon mayor radiación, procedimientos invasivos no exentos de complicaciones), mayor ansiedad por parte del paciente y mayores gastos para el sistema de salud)5. Como posible solución se planteó estandarizar los informes utilizando criterios como los del American College of Radiology (ACR), que por medio de los “Lung-Rads” (Tabla 1) con los que se ha demostrado reducción de los falsos positivos en el screening con TCLD6-14. Las diferentes sociedades internacionales continúan recomendando la necesidad de definir el costo-efectividad, el grupo con un alto riesgo real, el valor de las acciones de screening individuales fuera de un programa nacional y detalles técnicos sobre los protocolos más adecuados de pesquisa y manejo de los hallazgos positivos.
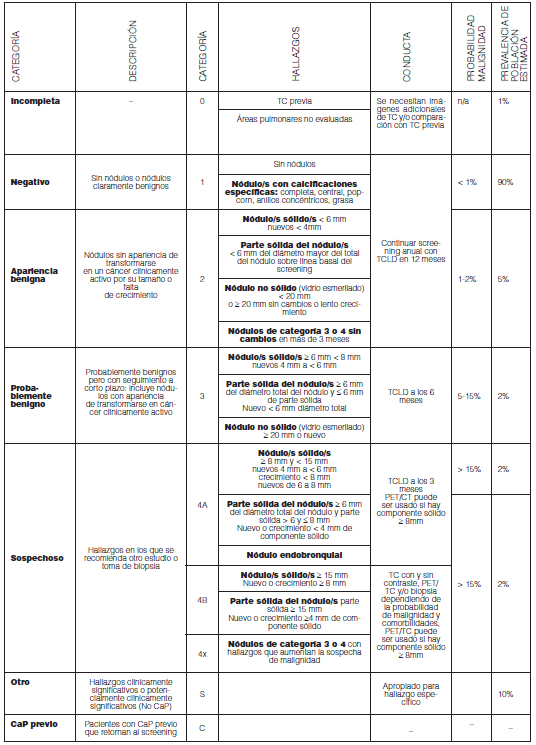
Especificaciones del equipamiento e interpretación de la TCLD7-8. Para conseguir un estudio clínicamente aceptable, el tomógrafo debe ser de 16 o más filas de detectores, con velocidad de rotación del gantry < 0,5 seg y con la posibilidad de adquirir cortes < 2,5 mm de espesor. Para su correcta interpretación, el estudio debe ser evaluado por un médico especialista en imágenes. Es ideal que el especialista cuente con plataformas capaces de generar reconstrucciones multiplanares (MPR) y proyecciones de máxima intensidad (MIP). La participación de especialistas en diagnóstico por imágenes y los informes estandarizados pueden reducir el sobrediagnóstico.
d) Población de riesgo
Se considera población de riesgo a los adultos de 55 a 80 años de edad, con antecedentes de tabaquismo 30 paquetes/años, que actualmente fuman o han dejado de fumar en los últimos 15 años. Tener presente que el screening no reemplaza al cese del tabaquismo como medida de prevención, incluso se beneficia cuando estas medidas se asocian9-13. Se aconseja informar claramente a cada paciente acerca de los riesgos relacionados con la radiación y la posibilidad de hallazgos de lesiones indeterminadas14.
Respecto del screening de CaP y en base a la evidencia el Comité de Expertos sugiere
El screening no reemplaza a la prevención primaria, se debe incentivar al paciente a abandonar el habito tabáquico.
La Rx de tórax no constituye una herramienta validada como método de screening de CaP.
No existe actualmente evidencia suficiente que aclare las controversias para plantear planes nacionales estandarizados de screening de CaP con TCLD
Estimular el estudio en nuestro país del impacto del screening con TCLD. evaluando los resultados en conjunto con grupos de trabajo multidisciplinario y el impacto económico para en un futuro poder plantear programas nacionales de screening.
La TCLD requiere equipamiento adecuado, interpretación por especialistas en diagnóstico por imágenes, y decisión de las conductas por grupos multidisciplinarios.
Indicación individual: brindar conocimiento al paciente de los beneficios y riesgos potenciales del screening con TCLD (riesgos relacionados con la radiación y al hallazgo de lesiones indeterminadas) y decidir en conjunto con su médico la realización o no del examen.
Referencias
1. Ten Haaf K, van Rosmalen J, de Koning HJ. Lung cancer detectability by test, histology, stage and gender: estimates from the NLST and the PLCO trials. Cancer Epidemiol Biomarkers Prev. 2015; 4: 154-61.
2. Oken MM, Hocking WG, Kvale PA, et al. Screening by chest radiograph and lung cancer mortality: the Prostate, Lung, Colorectal, and Ovarian (PLCO) randomized trial. JAMA. 2011; 306: 1865-73.
3. Doria-Rose VP, Szabo E. Screening and prevention of lung cancer. In: Kern- stine KH, Reckamp KL, eds. Lung cancer: a multidisciplinary approach to diagnosis and management. New York: Demos Medical Publishing. 2010: 53-72.
4. Sone S, Takashima S, Li F, et al. Mass screening for lung cancer with mobile spiral computed tomography scanner. Lancet. 1998; 351(9111): 1242-1245.
5. National Lung Screening Trial Research Team, Aberle DR, Adams AM, et al. Reduced lung cancer mortality with low-dose computed tomographic screening. N Engl J Med. 2011; 365(5): 395-409.
6. International Early Lung Cancer Action Program Investigators, Henschke CI, Yankelev- itz DF, et al. Survival of patients with stage I lung cancer detected on CT screening. N Engl J Med. 2006; 355(17): 1763-1771.
7. Henschke CI, McCauley DI, Yankelevitz DF, et al. Early Lung Cancer Action Project: overall design and ndings from baseline screening. Lancet. 1999; 354(9173): 99-105.
8. Larke FJ, Kruger RL, Cagnon CH, Flynn MJ, et al. Estimated Radiation Dose Associated with Low-Dose Chest CT of Average- Size Participants in the National Lung Screening Trial. AJR. 2011; 197: 1165-1169.
9. Ashraf H, Tonnesen P, Holst Pedersen J, Dirksen A, et al. Effect of CT screening on smoking habits at 1-year follow-up in the Danish Lung Cancer Screening Trial (DLCST). Thorax. 2009; 64(5): 388-392.
10. Taylor KL, Cox LS, Zincke N, Mehta L, et al. Lung cancer screening as a teachable moment for smoking cessation. Lung Cancer. 2007; 56(1): 125-134.
11. Townsend CO, Clark MM, Jett JR, et al. Relation between smoking cessation and receiving results from three annual spiral chest computed tomography scans for lung carcinoma screening. Cance.r 2005; 103(10): 2154-2162.
12. van den Bergh KA, Essink-Bot ML, Borsboom GJ, Scholten ET, et al. Long-term effects of lung cancer computed tomography screening on health-related quality of life: the NELSON trial. Eur Respir J. 2011; 38(1): 154-161.
13. van den Bergh KA, Essink-Bot ML, Borsboom GJ, et al. Short-term health-related quality of life consequences in a lung cancer CT screening trial (NELSON). Br J Cancer. 2010; 102(1): -34.
14. Pinsky P, Gierada D, Black W, et al. Performance of Lung-RADS in the National Lung Screening Trial: A Retrospective Assessment Ann Intern Med. 2015; 162(7): 485-491.
En el momento del diagnóstico del CaP la mayoría de los pacientes presentan síntomas. Estos pueden ser debidos al tumor primario, compromiso de la cavidad torácica, metástasis, y/o síndromes paraneoplásicos1- 5. Desde la aparición de los síntomas a la primera consulta existe una demora que varía entre los 45 días a los 2 años. Los síntomas más frecuentes son tos, disnea, dolor torácico; y como síntoma general la pérdida de peso.
El laboratorio inicial debe incluir hemograma, glucemia, GOT/GPT, fosfatasa alcalina, bilirrubina, albúmina, electrolitos, uremia, creatininemia y calcemia3, 5.
Un resultado anormal de cualquiera de estos valores puede orientar a un compromiso secundario de otro órgano, o un síndrome paraneoplásico.
Referencias
1. Andersen HA, Prakash UBS. Diagnosis of symptomatic lung cancer. Semin Respir Med. 1982; 3: 165-175.
2. American Thoracic Society, European Respiratory Society. Pretreatment evaluation of non-small-cell lung cancer. Am JRespir Crit Care Med. 1997; 156: 320-332.
3. Spiro S, Gould M and Colice G. Initial evaluation of the patient with lung cancer: symptoms, signs, laboratory tests and paraneoplastic syndromes: ACCAP evidenced-based clinical practice guidelines (2nd Edition). Chest. 2007; 132: 149-160.
4. Chute G, Greenberg ER, Baron J, Korson R, Baker J, Yates J. Presenting conditions of 1539 population-based lung cancer patients by cell type and stage in New Hampshire and Vermont. Cance.r 1985; 56: 2107-2111.
5. Mazzone PJ, Arroliga AC. Endocrine paraneoplastic syndromes in lung cancer. Curr Opin Pulm Med. 2003; 9: 313-320.
a) Síndromes Paraneoplásicos
Del 5 al 10% de los pacientes con CaP presentan síndromes paraneoplásicos1. La producción de sustancias con actividad biológica originadas en el tumor (hormonas o citoquinas) o en respuesta a su presencia (anticuerpos) explica cómo se producen algunos de estos síndromes.
Los síndromes neurológicos (síndrome miasténico de Eaton-Lambert, encefalopatía límbica, polineuropatía y degeneración cerebelosa) se asocian casi exclusivamente con los carcinomas neuroendócrinos o carcinomas de células pequeñas, (1-2% de los pacientes)1-3. La hipercalcemia maligna se encuentra en 2 a 6% en el momento del diagnóstico y hasta en un 12% durante el seguimiento, debido a niveles elevados de actividad símil paratohormona (rPTH)1, 4. La secreción inadecuada de hormona antidiurética se evidencia en el 5% de los pacientes con CaP, y se resuelve en el 80% de los individuos con CCP que responden al tratamiento1, 4. El síndrome de Cushing secundario a la producción de ACTH se asocia a enfermedad avanzada y tiene una respuesta pobre a la quimioterapia1, 4.
Referencias
1. Spiro S, et al. Initial Evaluation of the Patient with Lung Cancer: Symptoms, Signs, Laboratory Tests, and Paraneoplastic Syndromes: ACCAP Guidelines (2nd Edition) Evidenced-Based Clinical Practice. Chest. 2007; 132: 149-160.
2. Mareska M, Gutmann L. Lambert-Eaton myasthenic syndrome. Semin Neurol. 2004; 24: 149-153.
3. Titulaer MJ, Soffietti R, Dalmau J et al. Screening for tumours in paraneoplastic syndromes: report of an EFNS Task Force. Eur J Neurol. 2011; 18(1): 19-e3.
4. Mazzone PJ et al. Endocrine paraneoplastic syndromes in lung cancer. Curr Opin Pulm Med. 2003; 9(4): 313-20.
Diagnóstico por imágenes
a) Radiografía de tórax
La Rx de tórax es un estudio ampliamente realizado; es el primer estudio solicitado ante la sospecha de CaP. Su dosis de exposición es de 0,1 mSv. Ya está demostrado que en el screening de CaP con este método no disminuye mortalidad, pero en el total de las Rx que se realizan se recomienda aprovechar al máximo su interpretación para la detección de cáncer incidental1-4. Es importante resaltar que es más completo un examen de frente y perfil; la incidencia lateral es importante para evaluar las áreas pulmonares ocultas por el corazón y diafragma y es muy importante en la evaluación del mediastino e hilios pulmonares. Se recomienda usar alto Kilovoltaje (120-140 Kvp). Uno de los indicadores de calidad de los Servicios de Diagnóstico es el porcentaje de exámenes informados5, por lo tanto, se recomienda que el mayor porcentaje posible, sean informadas por especialistas en Diagnóstico por Imágenes capacitados en la detección de patologías, supervisión de errores de técnica y promoción de sus correcciones6. Corresponde recordar las proyecciones adicionales (ej: descentrada de vértice, radioscopías, etc.), utilizadas para confirmar la presencia de nódulos o de superposición de estructuras. La observación de la evolución de lesiones con estudios radiológicos previos es siempre importante. La radiología digital, está desarrollando múltiples programas (sistema CAD de detección asistida por computadora, sustracción ósea)7-11 que mejoran la detección de nódulos pulmonares. Los hallazgos de la Rx de tórax pueden aclararse con TCLD.
b) Tomografía computada
La TC es el método que se utiliza para aclarar dudas diagnósticas de la Rx y siempre se realiza ante la sospecha clínica de CaP. La dosis de radiación de la TC convencional es de 5-7 mSv. Puede ser con o sin contraste endovenoso. El contraste permite una mejor evaluación del mediastino, ayuda a caracterizar nódulos y lesiones pleurales. La TCLD utilizada en el screening siempre se realiza sin contraste. El American College of Radiology ha creado el sistema Lung-Rads que permite emitir un informe estructurado que facilita la comparación entre estudios, también se establecieron recomendaciones según los hallazgos. La dosis de radiación es de 1,5 mSv12, 15-20.
Se recomienda que los cortes abarquen los huecos supraclaviculares y las glándulas suprarrenales; y las estructuras óseas con ventana ósea. La TC es el método para valorar la extensión del tumor primario y determinar el T clínico. Tiene una sensibilidad y especificidad del 70-90% en la evaluación del tamaño tumoral, atelectasias adyacentes, extensión a pared torácica y mediastinal y detección de nódulos adicionales13. Junto con la tomografía por emisión de positrones (PET), la TC y la TCLD son los métodos utilizados para la estadificación del cáncer de pulmón14-22.
c) Tomografía por emisión de positrones/TC (PET/TC)
Se demostró que la PET sumada a la TC (PET/TC) mejora la estadificación y colabora a seleccionar mejor a los pacientes que irán a cirugía23, 24.
La PET/TC es útil para la detección temprana de CaP en pacientes con nódulos pulmonares solitarios; su uso puede evitar cirugías inútiles en pacientes de bajo riesgo o beneficiar con cirugías curativas en aquellos de alto riesgo. Se considera normal el valor estándar de Captación (SUV) ≤ 2,523-26.
En lesiones > 1 cm presenta 98% de sensibilidad y 70-90% de especificidad con un alto valor predictivo negativo (98%)27, 28. La PET/TC no es útil en lesiones < 8-10 mm, y en ciertos tipos histológicos (falsos negativos en adenocarcinoma lepídico, ADC in situ y carcinoide típico, y falsos positivos en procesos inflamatorios o infecciosos)27, 28.
d) Resonancia Magnética
La Resonancia Magnética (RM) tiene utilidad en tumores del sulcus superior para evaluación de la extensión y el compromiso óseo y de partes blandas29, 30.
Existen múltiples secuencias específicas para pulmón, entre ellas las de difusión de cuerpo entero utilizadas para estatificación, y las de secuencia STIR muy útiles para detectar metástasis mediastinales y en el screening de CaP31. La RM es el estudio de elección en la detección de metástasis cerebrales del CaP32.
Referencias
1. National Lung Cancer Screening Trial. http://www.nci.nih.gov/nlst 2008. Accessed July 2, 2009.
2. Gavelli G, Giampalma E. Sensitivity and specificity of chest X-ray screening for lung cancer: review article. Cance.r 2000; 89(11 suppl): 2453–2456.
3. Monnier-Cholley L, Carrat F, Cholley BP, Tubiana JM, Arrivé L. Detection of lung cancer on radiographs: receiver operating characteristic analyses of radiologists, pulmonologists, and anaesthesiologists performance. Radiology. 2004; 233(3): 799-805.
4. de Hoop B, Schaefer-Prokop C, Gietema H, et al. Screening for Lung Cancer with Digital Chest Radiography: Sensitivity and Number of Secondary Work-up CT Examinations. Radiology. 2010; 255: 629-663.
5. Guía de gestión de los servicios de radiología SERAM. Julio 2014. En: seram.es/modules.php?name=documentos&lang=ES...guiadegestion
6. de Hoop B, De Boo D, Gietema H, et al. Computer-aided Detection of Lung Cancer on Chest Radiographs: Effect on Observer Performance CH Radiology. 2010; 257: 532-540.
7. Li F, Engelmann R, Metz Ch, Doi K, MacMahon H. Lung Cancers Missed on Chest Radiographs: Results Obtained with a Commercial Computer-aided Detection Program Radiology. 2008; 246: 273-280.
8. Freedman MT, Benedict Lo S, Seibel J, Bromley Ch. Lung Nodules: Improved Detection with Software That Suppresses the Rib and Clavicle on Chest Radiographs. Radiology. 2011; 260: 265-273.
9. Schalekamp S, van Ginneken B, Koedam E, et al. Computer-aided Detection Improves Detection of Pulmonary Nodules in Chest Radiographs beyond the Support by Bone-suppressed Images. Radiology 2014; 272: 252-261.
10. Li F, Engelmann R, Pesce L, et al. Small Lung Cancers: Improved Detection by Use of Bone Suppression Imaging-Comparison with Dual-Energy Subtraction Chest Radiography. Radiology 2011; 261: 937-949.
11. McAdams HP, Samei E, Dobbins J, Tourassi GD, Ravin CE. Recent advances in chest radiography. Radiology. 2006; 241(3): 663-683.
12. Detterbeck FC, Mazzone PJ, Naidich DP, et al. Screening for lung cancer: Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest. 2013; 143: e78S-92S.
13. British Thoracic Society BTS recommendations to respiratory Physicians for organizing the care of patients with lung cancer. The Lung Cancer Working Party of the BTS standars of care comitee. Thorax. 1998; 1: S1-S8.
14. Wynants J, Stroobants S, Dooms Ch, Vansteenkiste J. Staging of Lung Cancer Radiologic Clinics of North America. 2007; 45(4): 609-625.
15. Jaklitsch MT, Jacobson FL, Austin JH, et al. The American Association for Thoracic Surgery guidelines for lung cancer screening using low-dose computed tomography scans for lung cancer survivors and other high-risk groups. J Thorac Cardiovasc Surg. 2012; 144: 33-38.
16. Wender R, Fontham ET, Barrera E, Jr, et al. American Cancer Society lung cancer screening guidelines. CA Cancer J Clin. 2013; 63: 107-17.
17. Eberth JM, Qiu R, Linder SK, et al. Computed tomography screening for lung cancer: a survey of society of thoracic radiology members. J Thorac Imaging. 2014; 29: 289-92.
18. Bach PB, Mirkin JN, Oliver TK, et al. Benefits and harms of CT screening for lung cancer: a systematic review. JAMA. 2012; 307: 2418-29.
19. Kovalchik SA, Tammemagi M, Berg CD, et al. Targeting of low-dose CT screening according to the risk of lung-cancer death. N Engl J Med. 2013; 369: 245-54.
20. Baldwin DR, Duffy SW, Wald NJ, et al. UK Lung Screen (UKLS) nodule management protocol: modelling of a single screen randomised controlled trial of low-dose CT screening for lung cancer. Thorax. 2011; 66: 308-13.
21. Field JK, Oudkerk M, Pedersen JH, et al. Prospects for population screening and diagnosis of lung cancer. Lancet. 2013; 382: 732-41.
22. Lung CT Screening Reporting and Data System (Lung-RADS). ACR. En: http://www.acr.org/Quality-Safety/Resources/LungRADS
23. Fischer B, Lassen U, Mortensen J, et al. Preoperative Staging of Lung Cancer with Combined PET–CT N Engl J Med. 2009; 361: 32-39.
24. Marom E, Sarvis S, Herndon H and Patz E Jr. T. Lung Cancers: Sensivity of Diagnosis with Fluorodeoxyglucose PET. Radiology. 2002; 223: 453-459.
25. Aquino SL, Kuester LB, Muse VV, Halpern EF, Fischman AJ. Accuracy of transmission CT and FDG-PET in the detection of small pulmonary nodules with integrated PET/CT. Eur J Nucl Med Mol Imaging. 2006; 33 (6): 692–696.
26. Wahl RL, Jacene H, Lodge MA. From RECIST to PERCIST J Nucl Med. 2009; 50(Suppl1): 1225-150s.
27. UyBico S, Wu C, Suh R, et al. Lung Cancer Staging Essentials: The New TNM Staging System and Potential Imaging Pitfalls. RadioGraphics. 2010; 30: 1163-1181.
28. Cheran SK, Nielsen ND, Patz EF Jr. False-negative findings for primary lung tumors on FDGpositron emission tomography: staging and prognostic implications. AJR. 2004; 182(5): 1129-1132.
29. Chin A Yi, Kyung Min Shin, Kyung Soo Lee, et al. Non-Small Cell Lung Cancer Staging: Efficacy Comparison of IntegratedPET/CT versus 3.0-T Whole-Body MR Imaging. Radiology. 2008; 248: 632-642.
30. Dae Wook Yeh, Kyung Soo Lee, Joungho Han, et al. Mediastinal Nodes in Patients with Non–Small Cell Lung Cancer: MRI Findings with PET/CT and Pathologic Correlation. AJR. 2009; 193: 813-821.
31. Biederer J, Beer M, Hirsch W, et al. MRI of the lung (2/3). Why … when … how? Insights Imaging. 2012; 3 (4): 355-371.
32. Kohei Yokoi, Noriki Kamiya, Haruhisa Matsuguma, Suguru Machida, et al. Detection of Brain Metastasis in Potentially Operable Non-small Cell Lung Cancer*: A Comparison of CT and MRI. Chest. 1999; 115(3): 714-719.
Broncoscopía
La broncoscopía es de utilidad para el diagnóstico y estadificación del CaP. En lesiones centrales, mediante lavado y cepillado bronquial, biopsia directa y/o punción transbronquial con aguja fina, la broncoscopía tiene una sensibilidad global de 88% y una especificidad de 100%. En las lesiones periféricas la sensibilidad global es del 78%; 34% si presentan un tamaño < 2 cm y 63% si son > 2 cm.
La ecografía endobronquial (EBUS por su sigla en inglés) con transductor radial, aumenta la sensibilidad en lesiones distales (73%) así como también la navegación electromagnética (71%). La autofluorescencia y las imágenes en banda angosta (NBI por su sigla en inglés) son útiles en lesiones centrales incipientes1.
Referencias
1. Establishing the Diagnosis of Lung Cancer. Diagnosis and Management of Lung Cancer, 3rd ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Patricia Rivera et al. CHEST. 2013; 143(5) (Suppl): e142S–e165S.
Nódulo pulmonar solitario
El Nódulo Pulmonar Solitario (NPS) se define como una radioopacidad única menor a 3 cm de diámetro rodeada de tejido pulmonar sano1. Son muchos los diagnósticos diferenciales de los NPS y debido a sus variadas características anatomopatológicas es fundamental estudiar extensamente la lesión previamente a la toma de decisiones. La prevalencia de malignidad del NPS depende de variables clínicas e imagenológicas alcanzando un rango del 2% al 86% para aquellas lesiones de hallazgo incidental. Una situación en la que el hallazgo de un NPS no merece un seguimiento es su estabilidad en el tiempo por dos años o más. En otros casos, dependiendo de diferentes características, se debe realizar un control periódico imagenológico.
a) Característic
as morfológicas
a.1 Tamaño
Los NPS grandes tienen mayor probabilidad de malignidad2. Aproximadamente el 80% de los NPS benignos son < 2 cm; a pesar de ello el 15% de las lesiones de etiología maligna son < 1 cm. Un aumento del 26% del diámetro corresponde a una duplicación en su volumen4. El tiempo de duplicación de un NPS maligno es variable, teniendo un rango entre 20 y 300 días. En caso de un nódulo con aspecto de vidrio esmerilado se recomienda considerar un mayor tiempo de seguimiento debido a la posibilidad de estar frente a un adenocarcinoma in situ de lento crecimiento5.
a.2 Márgenes
Los márgenes se clasifican en lisos, lobulados e irregulares. Un tercio de los NPS con márgenes lisos son malignos, por lo que esta característica no indica benignidad. Alrededor de un 40% de los NPS con márgenes lobulados son etiología maligna. Los bordes irregulares tienen un alto valor predictivo, alrededor del 90%, de malignidad2.
a.3 Localización
En relación a la localización de los NPS de origen neoplásico, diferentes estudios demostraron que aproximadamente el 70% de los tumores malignos de pulmón se encuentran ubicados en los lóbulos superiores6.
a.4 Calcificaciones y grasa intranodular
La calcificación es la principal característica distintiva entre el NPS benigno y maligno3. La calcificación de distribución central, laminada, difusa o en popcorn corresponde a características benignas; en tanto los patrones de calcificación excéntrica y el punteado aumentan la posibilidad de estar frente a un NPS de etiología maligna7. La presencia de grasa intranodular aumenta la posibilidad de benignidad, siendo los ejemplos clásicos los lipomas o hamartomas.
a.5 Densidad
En relación a la atenuación del NPS según los hallazgos tomográficos, se pueden clasificar en sólidos, subsólidos y no sólidos8. En un estudio sobre 233 pacientes con diagnóstico definitivo de CaP, el 81% eran nódulos sólidos, 7% subsólidos y el 12% no sólidos, mientras que la frecuencia de malignidad fue de 32%, 63% y 13% respectivamente9.
En relación a la toma de biopsia en NPS indeterminados, la indicación de obtención de tejido para su diagnóstico se basa en dos características principales: densidad del nódulo (sólido versus subsólido) y tamaño (> 8 mm y < 8 mm)10. En el caso de nódulos sólidos, la obtención de tejido para biopsia se considera en relación a la probabilidad pretest de malignidad; aquellos con una alta probabilidad pretest usualmente son sometidos a biopsia10. En NPS sólidos > 8 mm la probabilidad pretest de malignidad varía de forma significativa por lo cual se recomienda utilizar modelos cuantitativos en base a características imagenológicas y clínicas. Los NPS < 8 mm tienen una muy baja probabilidad de malignidad (1% < 4 mm y 2 a 6% entre 4 y 8 mm). Frente a un NPS subsólido la conducta es diferente ya que a pesar de tener una prevalencia de malignidad del 63%, su baja tasa de replicación celular permite una conducta de control y seguimiento sin necesidad de toma de biopsia inicial11.
Referencias
1. Kanne JP, Jensen LE, Mohammed TL, et al. ACR appropriateness criteria radiographically detected solitary pulmonary nodule. J Thorac Imaging. 2013; 28 (1): W1-3. doi: 10.1097/RTI.0b013e31827657c8.
2. Winer-Muram HT. The solitary pulmonary nodule. Radiology. 2006; 239: 34-49.
3. Erasmus JJ, Connolly JE, McAdams HP, et al. Solitary pulmonary nodules: Part I. Morphologic evaluation for differentiation of benign and malign lesions. Radiographics. 2000; 20: 43-58.
4. Erasmus J, Connolly J. Solitary pulmonary nodules: Part II. Evaluation of the indeterminate nodule. Radiographics. 2000; 20: 59-66.
5. Gould MK, Fletcher J, Iannettoni M, et al. Evaluation of patients with pulmonary nodules: when is it lung cancer? ACCAP evidence based clinical practice guidelines (2nd edition). Chest. 2007; 32: 108S-130S.
6. Swensen S, Viggiano R, Midthun D, et al. Lung nodule enhancement at CT: multicenter study. Radiology. 2000; 214: 73-80.
7. Ost D, Fein M, Feinsilver S. The solitary pulmonary nodule. N Engl J Med. 2003; 348: 2535-42.
8. Silva C, Marchiori E, Souza Junior A, et al. Consenso brasileiro ilustrado sobre la terminologia dos descritores e padroes fundamentais da TC de torax. J Bras Pneumol. 2010; 36: 99-123.
9. Henschke C, Yankelevitz D, Mirtcheva R, et al. CT screening for lung cáncer: frecuency and significance of part-solid and nonsolid nodules. AJR Am J Roentgenol. 2002; 178: 1053-7.
10. Gould M, Donington J, Lynch W, et al. Evaluation of individuals with pulmonary nodules: when is it lung cancer? Diagnosis and Management of lung cancer, 3rd ed: American Collage of Chest Physicians evidence-based clinical practice guidelines. Chest. 2013; 143 (5 Suppl): e93S-e120S.
11. van´t Westeinde S, de Koning H, Xu D, Hoogsteden H, van Klaveren R. How to deal with indicentally detected pulmonary nodules less tahn 10 mm in size on CT in a healthy person. Lung Cancer. 2008; 60: 151-159.
b) Seguimiento del nódulo pulmonar solitario
Un nódulo pulmonar es una opacidad radiológica esférica, circunscrita, de diámetro máximo 30 mm y no asociada a atelectasia, agrandamiento hiliar o derrame pleural. La TC detecta nódulos milimétricos y nódulos subsólidos con un abordaje distintivo, según se describe a continuación.
Los nódulos subsólidos incluyen a los nódulos en vidrio esmerilado, como así también a los nódulos parcialmente sólidos que combinan un componente en vidrio esmerilado. La frecuencia de nódulos se estima en 1 o 2 por cada 1.000 radiografías1. La prevalencia de nódulos en la TC practicada en adultos fumadores es muy alta, del 20 al 50%, generalmente < 10 mm1-3.
La Fleischner Society(*) estableció, en el año 2005, sus primeras guías para el manejo de nódulos sólidos pulmonares que resultan indeterminados durante su evaluación tomográfica, dividiendo a los pacientes en bajo y alto riesgo en base a su relacion con el consumo de tabaco1-3.
(*) La Fleischner Society es una entidad multidisciplinaria dedicada al diagnóstico y tratamiento de enfermedades pulmonares. Fundada en 1969, esta institución debe su nombre a la memoria de Félix Fleischner, un educador inspirador, clínico e investigador que hizo muchas contribuciones al campo de la radiología de tórax.
b.1 NPS sólidos < 8 mm
El seguimiento de los nódulos pulmonares sólidos con diámetro < 8 mm se describe en la Figura 1.
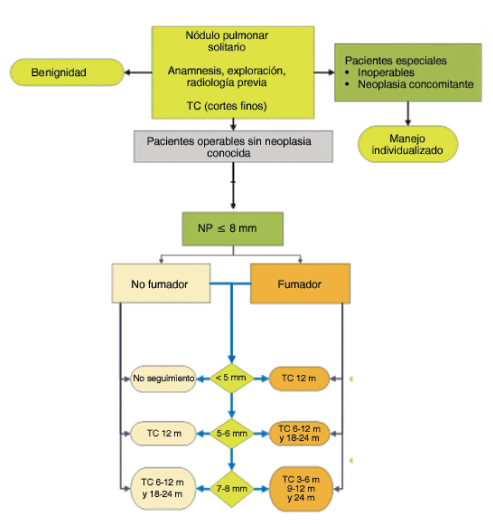
b.2 NPS sólido > 8 mm 1-3
En todos los casos (fumador o no) se indica control estricto a los 3 meses con PET-TC o biopsia en base a las características del nódulo y el paciente.
Características a evaluar del nódulo. Patrón de calcificaciones: central, difuso, laminado o en pop corn (benignos) y puntillado o periférico (mayor posibilidad de malignidad). Crecimiento: estabilidad de
tamaño por 2 años, es altamente sugestivo de benignidad. Bordes: lisos sugieren benignidad; lobulados sugieren posibilidad intermedia de malignidad; espiculados sugieren malignidad. Broncograma aéreo o cavitaciones: su presencia indica mayor riesgo de malignidad. Contraste endovenoso: en general, el realce endovenoso del nódulo sugiere malignidad.
b.3 Otras categorías1-3
Ganglio intrapulmonar: es una entidad benigna separada del resto cuya forma es oval, ahusada o triangular, de bordes definidos, que asienta sobre las cisuras y no requiere seguimiento.
Hamartoma pulmonar: es la lesión benigna de pulmon más frecuente, puede estar formada por tejido conectivo, músculo, grasa o calcio. De pocos milímetros hasta 5 cm de diámetro. El contenido graso o calcificaciones en pop corn son altamente sugerentes de esta entidad.
b.4 NPS subsólido
En el año 2013 la Fleischner Society lanzó sus recomendaciones para el seguimiento de los nódulos mixtos y en vidrio esmerilado puros (Figura 2) a los cuales no incluía previamente. A estos pacientes no los clasifica en fumadores y no fumadores ya que el adenocarcinoma puede afectar a pacientes jóvenes y no fumadores4. En la Tabla 1 se compara la clasificación de la Fleishner Society del año 2013 con los crietrios Lung Rads del American College of Radiology
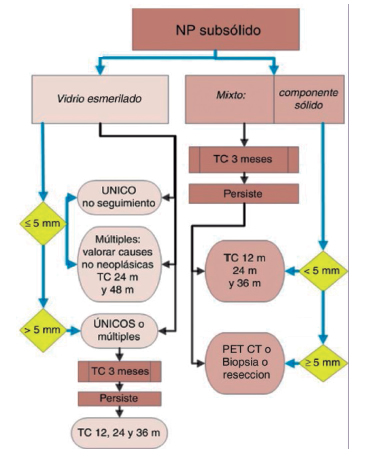

Referencias
1. Macmahon H, Austin JH, Gamsu G et-al. Guidelines for management of small pulmonary nodules detected on CT scans: a statement from the Fleischner Society. Radiology. 2005; 237(2): 395-400.
2. Truong MT, Ko JP, Rossi SE et-al. Update in the evaluation of the solitary pulmonary nodule. Radiographics. 2014; 34(6): 1658-79.
3. MacMahon H., Austin J., GamsuG, Herold C., el al. Guidelines for Management of Small Pulmonary Nodules Detected on CT Scans: A Statement from the Fleischner Society. Radiology. 2005; 237(2): 395-400.
4. Naidich DP, Bankier AA, MacMahon H et-al. Recommendations for the management of subsolid pulmonary nodules detected at CT: a statement from the Fleischner Society. Radiology. 2013; 266(1): 304-17.
Estadificación mediastinal
El estadio ganglionar del mediastino afecta directamente el pronóstico y el plan de tratamiento ya que la presencia de metástasis en ganglios linfáticos mediastinales indica enfermedad avanzada (Estadio IIIA o IIIB)1.
La evaluación se puede realizar con eficacia con diversas técnicas invasivas: aguja fina transbronquial (TBNA por su sigla en inglés), aguja fina guiada por ultrasonido esofágico (EUS-NA por su sigla en inglés), aguja fina transbronquial guiada por ultrasonido endobronquial (EBUS-TBNA por su sigla en inglés), o por mediastinoscopía (biopsia quirúrgica por medio de mediastinoscopía cervical estándar, mediastinoscopía extendida o videotoracoscopía)2, 3.
Las técnicas no invasivas para evaluar los ganglios del mediastino pretenden determinar el tamaño de los ganglios linfáticos mediante TC o analizar su metabolismo con PET, pero estos exámenes no proporcionan un diagnóstico definitivo y, a menudo no son suficientes para excluir a los pacientes de la alternativa de tratamiento quirúrgico. La selección del estudio apropiado depende de la disponibilidad del método y la topografía de los ganglios afectados.
a) EBUS y EBUS-TBNA
Son los procedimientos de elección en la estadificación inicial del mediastino. Estas técnicas permiten la obtención de imágenes de estructuras profundas midiendo y registrando el reflejo de ondas sonoras de alta frecuencia, continuas o intermitentes. La punción se realiza con una aguja fina de 21 gauges que pasa a través del canal de trabajo del endoscopio2, 3. El broncoscopio cuenta en su extremo distal con un transductor lineal que emite el sonido y captura las imágenes más allá de la pared traqueal o bronquial con una profundidad desde los 3 mm a 8 cm a partir del transductor, permitiendo ver en tiempo real la penetración de la aguja en el ganglio seleccionado. Además, el ecógrafo bronquial a través
de la medición del flujo por Doppler permite identificar estructuras vasculares y quísticas2-4. Es una práctica ambulatoria, se realiza bajo sedación consciente o neurolepto-analgesia, y dura entre 30 a 60 minutos. Es necesaria la presencia del médico patólogo para evaluar las muestras. La sensibilidad ha sido estimada entre 85 y 92% y la especificidad es del 100%. El valor predictivo negativo (VPN) es alto cuando se lo compara con la mediastinoscopía5, 6. En una exhaustiva revisión de 2.756 procedimientos se confirmó una sensibilidad del 89% con especificidad del 100% y un VPN del 91%. Al combinarse con ecoendoscopía esofágica la sensibilidad aumenta al 91%7. No obstante, en todo paciente con sospecha de enfermedad mediastinal y un EBUS-TBNA negativo debe confirmarse el resultado con mediastinoscopía1. Cuando el EBUS-TBNA se compara con la TBNA convencional la sensibilidad para detectar metástasis es superior, excepto en el grupo de ganglios subcarinales en que la TBNA convencional alcanza igualmente buenos resultados6 (Tabla 1). El EBUS es un procedimiento seguro sin descripciones de complicaciones graves, únicamente se han reportado sangrado leve, neumotórax (1/500 procedimientos), mediastinitis (1/750 estudios); sin reportes de mortalidad5-7.
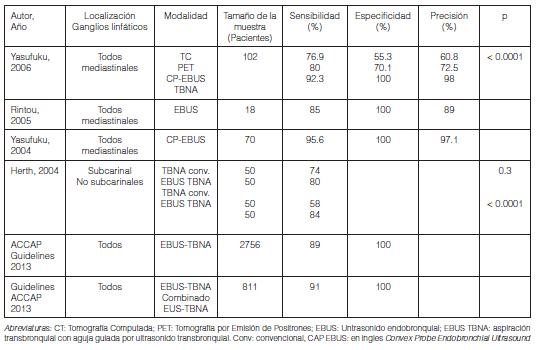
Referencias
1. Diagnosis and management of lung cancer: ACCAP Guidelines. Invasive Mediastinal Staging of Lung Cancer ACCAP Evidence-Based Clinical Practice Guidelines (2nd Edition) Chest 2007; 132: 202S F-220S.
2. Sheski MP. Endobronchial Ultrasound. Chest. 2008; 133: 264-270.
3. Kunst P, Herth F. Combined EBUS Real Time TBNA and Conventional TBNA are the Most Cost-effective Means of Lymph Node Staging. JoB, January 2008.
4. Shirakawa T, Teruomi M, Becker H. The Layer Structure of Central Airways as Described by EBUS. Journal of Bronchology. 2008; 15(3): 129-133.
5. Lederle N, Kelly R, Sawhney M, Bakman Y, et al. Staging Ultrasound on Non-small Cell Lung Cancer Impact of Preoperative Endoscopic. Chest. 2007; 132: 916-921.
6. Herth F, Annema J, Eberhardt R, Yasufuku K, et al. Endobronchial Ultrasound With Transbronchial Needle Aspiration for Restaging the Mediastinum in Lung Cancer. JCO. 2008: 3346-3351.
7. Silvestri g et al. Methods for Staging Non-small Cell Lung Cancer. Diagnosis and Management of Lung Cancer, 3rd ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. CHEST. 2013; 143(5 Suppl): e211S-e250S
b) Mediastinoscopía
La mediastinoscopía es el estándar de oro de los métodos de diagnóstico invasivo prequirúrgico para la patología del mediastino medio1-3. Se realiza con anestesia general. Esta técnica permite biopsiar bajo visión directa las estaciones 2R, 4R, 2L, 4L y 7; la mediastinoscopía extendida alcanza las estaciones ganglionares 5 y 6 pero no es un procedimiento que se implemente de manera estándar3, 4. El procedimiento tiene 87% de sensibilidad para descartar enfermedad mediastinal y una especificidad del 100%5-7. Las estaciones 5 y 6 y la región más posterior de las estaciones 7, 8 y 9 no son accesibles a la mediastinoscopía estándar, siendo en parte causa de falsos negativos. Se recomienda el estudio histopatológico intraoperatorio para la evaluación de la representatividad de la muestra. En una revisión con 10.648 pacientes la sensibilidad resultó algo menor 81% con idéntica especificidad y 91% de VPN8.
La mediastinoscopía puede ser sistemática o selectiva. Es sistemática si se efectúa en todos aquellos pacientes en los que se planea una resección pulmonar9, 10. Es selectiva si sólo se realiza en individuos con adenomegalias observadas en la TC o hipercaptación en la PET y/o ante ciertos hallazgos clínicos y factores de riesgo como adenocarcinoma, tumores centrales, tamaño tumoral > 3 cm11-15. En aquellos pacientes con CaP y adenomegalias mediastinales detectadas en la TC (ganglio > 10 mm de diámetro mayor transverso) o ganglios hipermetabólicos mediastinales en la PET, el diagnóstico histológico es mandatorio16-18. Las complicaciones son poco frecuentes, pero son potencialmente graves, especialmente las hemorragias. La morbilidad reportada es del 0,6 al 3%, el riesgo de hemorragia de 0,1 al 6% y la mortalidad de 0 al 0.3%6, 19, 20.
La mediasdinoscopía está indicada en: sospecha o diagnóstico de CaP y evidencia de enfermedad hiliar/ mediastinal en la estadificación no-invasiva (TC o PET); sospecha o diagnóstico de CaP, con estadificación no-invasiva negativa [N0], pero con tumor primario > 3 cm de diámetro o lesiones centrales; ante la presencia de evidencia de enfermedad mediastinal en la TC o PET y una TBNA estándar o EBUS-TBNA negativo para confirmar la ausencia de metástasis mediastinales16-17, 21. Se recomienda biopsiar al menos las siguientes estaciones: paratraqueales derechos [4R], izquierdos [4L] y subcarinales [7].
Referencias
1. Carlens E. Mediastinoscopy: A Method for Inspection and Tissue Biopsy in the Superior Mudiastinum. Dis Chest. 1959; 36: 343.
2. Robinson L, Ruckdeschel J, Wagner H, et al. Treatment of Non-small Cell Lung Cancer-Stage IIIA. CHEST. 2007; 132: 243S- 265S.
3. Venissac N, Alifano M, Mouroux J. Video-assisted mediastinoscopy: experience from 240 consecutive cases. Ann Thorac Surg. 2003; 76: 208-212.
4. Ginsberg RJ. Extended cervical mediastinoscopy. A single staging procedure for bronchogenic carcinoma of the left upper lobe. J Thorac Cardiovasc Surg. 1987; 94: 673-8.
5. Coughlin M, Deslauriers J, Beaulieu M, et al. Role of mediastinoscopy in pretreatment staging of patients with primary lung cancer. Ann Thorac Surg. 1985; 40: 556-560.
6. Hammoud Z, Anderson R, Meyers B, et al. The Current Role of Mediastinoscopy in the Evaluation of Thoracic Disease. J Thorac Cardiovasc Surg. 1999; 118: 894-899.
7. Abdala F, Abdala O, Poleri C, et al. Utilidad de la mediastinoscopía sistemática en el diagnóstico y la estadificación del cáncer de pulmón. Revista Argentina de Medicina Respiratoria. 2006; 6(1): 51-53.
8 Silvestri et al. Methods for Staging Non-small Cell Lung Cancer. Diagnosis and Management of Lung Cancer, 3rd ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. CHEST. 2013; 143 (5 Suppl): e211S-e250S38
9. DeLeyn P, Lardinois D, Van Schil P, et al: ESTS guidelines for preoperative lymph node staging for non-small cell lung cancer. Eur J Cardiothorac Surg. 2007; 32: 1-8.
10. De Leyn P, Vansteenkiste J, Cuypers P, et al. Role of cervical mediastinoscopy in staging of non-small cell lung cancer without enlarged mediastinal lymph nodes on CT scan. Eur J Cardiothorac Surg. 1997; 12: 706-712.
11. Choi Y, Shim Y, Kim J, et al.: Mediastinoscopy in Patients with Clinical Stage I Non–Small Cell Lung Cancer. Ann Thorac Surg. 2003; 75: 364-366.
12. Meyers BF, Haddad F, Siegel BA, et al. Cost-effectiveness of routine mediastinoscopy in computed tomography and positron emission tomography-screened patients with stage I lung cancer. J Thorac Cardiovasc Surg. 2006; 131: 822-829.
13. Defranchi S, Cassivi S, Nichols, F, et al. N2 Disease in T1 Non-Small Cell Lung Cancer. Ann Thorac Surg. 2009; 8: 924-928.
14. Reed C, Harpole D, Posther K, et al. Results of the American College of Surgeons Oncology Group Z0050 Trial: The utility of positron emission tomography in staging potentially operable non–small cell lung cancer. J Thorac Cardiovasc Surg. 2003; 126: 1943-1951.
15. Scott WJ. Positron emission tomography (PET) and combined imaging modalities for staging lung cancer. Surg Clin N Am. 2002; 82: 477-495.
16. Lee P, Port J, Korst R, et al. Risk Factors for Occult Mediastinal Metastases in Clinical Stage I Non-Small Cell Lung Cancer. Ann Thorac Surg. 2007; 84: 177-81.
17. Wallace MB, Pascual JM, Raimondo M, et al. Minimally invasive endoscopic staging of suspected lung cancer. JAMA. 2008; 299: 540-546.
18. Ernst A, Anantham D, Eberhardt R, Krasnik M, Herth FJ. Diagnosis of mediastinal adenopathy-real-time endobronchial ultrasound guided needle aspiration versus mediastinoscopy. J Thorac Oncol. 2008; 3: 577-582.
19. Defranchi S, Edell E, Daniels C, et al. Mediastinoscopy in Patients with Lung Cancer and Negative Endobronchial Ultrasound Guided Needle Aspiration. Ann Thorac Surg in press.
20. Park BJ, Flores R, Downey RJ, et al. Management of major hemorrhage during mediastinoscopy. J Thorac Cardiovasc Surg 2003; 126: 726-731.
21. Urschel JD. Conservative management (packing) of hemorrhage complicating mediastinoscopy. Ann Thorac Cardiovasc Surg. 2000; 9-12.
c) Ultrasonografía endoscópica
La ultrasonografía endoscópica (EUS por su sigla en inglés) es un sistema operativo que incorpora en la punta de un esofagoscopio un transductor de ultrasonido de alta frecuencia, para proporcionar imágenes de alta resolución (ecoendoscopía esofágica). Este método permite reconocer estructuras ganglionares y vasculares más allá de la pared esofágica (E1)1-4.
c.1 Punción con aguja fina a través del EUS (EUS-FNA por su sigla en inglés)
El acceso por EUS-FNA a grupos ganglionares del mediastino posterior e inferior5-8, del ligamento pulmonar6, 9 y a los de la ventana aortopulmonar5, permite complementar la EBUS y aún la mediastinoscopía, ya que no es posible acceder con estos métodos diagnósticos a todas estas estaciones ganglionares. En general es un examen complementario de la EBUS. Publicaciones recientes muestran la posibilidad de realizar la ecoendoscopía bronquial y esofágica con el mismo equipo (E2). La invasión ganglionar puede demostrarse aún sin ganglios de tamaño patológico (E8) (E9). La tasa de complicaciones es de 0.5 al 2.3%10, 11.
Entre sus ventajas cuenta que es un método de diagnóstico mini invasivo, se puede llevar a cabo en un paciente ambulatorio, sin anestesia general. Permite el acceso a grupos ganglionares del mediastino posterior, que son inaccesibles al EBUS y la mediastinoscopía. La exactitud en este contexto es del 96%. Posibilita la obtención de muestras de lesiones < 1 cm, en tiempo real, en forma rápida y con mínimas complicaciones.
Referencias
1. Kondo D, Imaizumi M, Abe T, et al. Endoscopic ultrasound examination for mediastinal lymph node metastases of lung cancer. CHEST. 1990; 98: 586.
2. Mog Lee, Byung-Ho Nam ,Jae Ill Zo Soo-Hyun Lee, et al. Potentially Operable Lung Cancer Bronchoscope in Mediastinal Staging of Fine-Needle Aspiration Using an Ultrasound Transbronchial and Transesophageal. CHEST. 2010; 138 (4): 795- 802.
3. Fritscher-Ravens A, Soehendra N, Schirrow L, et al. Role of transesophageal endosonography-guided fine-needle aspiration in the diagnosis of lung cancer. CHEST. 2000; 117: 339.
4. Annema JT, Veselic M, Rabe KF. EUS-guided FNA of centrally located lung tumours following a non-diagnostic bronchoscopy. Lung Cancer. 2005; 48: 357.
5. Fritscher-Ravens, A, Davidson, BL, Hauber, HP, et al. Endoscopic ultrasound, positron emission tomography, and computerized tomography for lung cancer. Am J Respir Crit Care Med. 2003; 168: 1293.
6. Savides, TJ, Perricone, A. Impact of EUS-guided FNA of enlarged mediastinal lymph nodes on subsequent thoracic surgery rates. Gastrointest Endosc. 2004; 60: 340.
7. Annema, JT, Veselic, M, Rabe, KF. EUS-guided FNA of centrally located lung tumours following a non-diagnostic bronchoscopy. Lung Cancer. 2005; 48: 357.
8. LeBlanc, JK, Devereaux, BM, Imperiale, TF, et al. Endoscopic ultrasound in non-small cell lung cancer and negative mediastinum on computed tomography. Am J Respir Crit Care Med. 2005; 171: 177.
9. Wallace M, Ravenel J, Block M, et al. Endoscopic ultrasound in lung cancer patients with a normal mediastinum on computed tomography. Ann Thorac Surg. 2004; 77: 1763.
10. Larsen S, Krasnik M, Vilmann P, et al. Endoscopic ultrasound guided biopsy of mediastinal lesions has a major impact on patient management. Thorax. 2002; 57: 98.
11. Singh P, Camazine B, Jadhav Y, et al. Endoscopic ultrasound as a first test for diagnosis and staging of lung cancer: a prospective study. Am J Respir Crit Care Med. 2007; 175: 345
d) Punción aspiración transbronquial con aguja fina (TBNA por su sigla en inglés)
La TBNA es una técnica endoscópica que consiste en la toma de una muestra citológica y/o histológica de las estaciones ganglionares adyacentes a la vía aérea a través del broncoscopio1-4. La ventaja de la punción transbronquial con aguja fina con respecto de los métodos quirúrgicos, es que es una técnica mínimamente invasiva, que se realiza durante la broncoscopía diagnóstica, de manejo ambulatorio y sin requerir anestesia general, con un porcentaje muy bajo de complicaciones.
La TBNA permite tomar muestra de los grupos ganglionares hiliares [10R y 10L], paratraqueales derechos [4R], paratraqueales izquierdos [4L] y subcarinales [7]1, 5-7. Esta técnica debe ser el primer procedimiento durante la broncoscopía diagnóstica por sospecha de CaP a fin de evitar la contaminación de la muestra. Las muestras deben tomarse empezando por la estación de peor pronóstico: N3, luego N2 y finalmente N1. Una muestra de TBNA adecuada es aquella que contiene linfocitos, siendo necesaria la presencia de un citopatólogo en el lugar de trabajo para evaluar la representatividad del espécimen. Las muestras pueden clasificarse como malignas, sospechosas o negativas. En una revisión de series con 2408 casos de TBNA13 la sensibilidad fue del 78%, la especificidad y el valor predictivo positivo se acercan al 100%. Sin embargo, el valor predictivo negativo es bajo (77%), por esta razón al obtener un resultado negativo debemos continuar con la evaluación del compromiso ganglionar por otros métodos14, 16-18. La TBNA es un procedimiento seguro. En un metanálisis se describe un porcentaje de complicaciones mayores de 0.3 %8,15 con baja tasa de complicaciones9-12.
Referencias
1. Wang KP, Brower R, Haponik EF, et al. Flexible transbronchial needle aspiration for staging of bronchogenic carcinoma. CHEST. 1983; 84: 571-576.
2. Patel N, Pohlman A, Husain A, et al. Conventional Transbronchial Needle aspiration decreases the rate of surgical sampling of intrathoracic limphadenopathy. CHEST. 2007; 131: 773-778.
3. Patelli M, Agli LL, Poletti V, et al. Role of fiberscopic transbronchial needle aspiration in the staging of N2 disease due to non-small cell lung cancer. Ann Thorac Surg 2002; 73: 407-411.
4. Harrow EM, Abi-Saleh W, Blum J, et al. The utility of transbronchial needle aspiration in the staging of bronchogenic carcinoma. Am J Respir Crit Care Med. 2000; 161: 601-607.
5. Rusch V, Asamura H, Watanabe H, Giroux D, et al., on Behalf of the Members of the IASLC Staging Committe. The IASLC Lung Cancer Staging Project: A Proposal for a New International Lymph Node Map in the Forthcoming Seventh Edition of the TNM Classification for Lung Cancer. Journal of Thoracic Oncology. 2009; 4 (5): 568-577.
6. Diette GB, White P Jr, Terry P, Jenckes M, Rosenthal D, Rubin HR: Utility of on-site cytopathology assessment for bronchoscopic evaluation of lung masses and adenopathy. CHEST. 2000; 117: 1186-1190.
7. Ayers M, Beamis J, Metha A. Flexible bronchoscopy in the 21st Century. Clinics in Chest Medicine 2001; 22(2): 355–364.
8. Holty JE; Kuschner WG; Gould MK. Accuracy of transbronchial needle aspiration for mediastinal staging of non-small cell lung cancer: a meta-analysis. Thorax. 2005; 60 (11): 949-5.
9. Kucera RF, Wolfe GK, Perry ME. Hemomediastinum after transbronchial needle aspiration [letter]. CHEST. 1986; 90: 466.
10. Epstein SK, Winslow CI, Brecher SM, et al. Polymicrobial bacterial pericarditis after transbronchial needle aspiration. Am Rev Respir Dis. 1992; 146: 523-525.
11. Harrow EM; Oldenburg FA Jr; Lingenfelter MS; Smith AM Jr. Transbronchial needle aspiration in clinical practice. A five-year experience. CHEST. 1989; 96 (6): 1268-72.
12. Sterling BE. Complication with a transbronchial histology needle. CHEST. 1990; 98: 783-784.
13. Silvestri G et al. Methods for Staging Non- small Cell Lung Cancer. Diagnosis and Management of Lung Cancer, 3rd ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. CHEST. 2013; 143 (5) (Suppl): e211S– e250S.
14. Shure D, Fedullo PF. The role of transcarinal needle aspiration in the staging of bronchogenic carcinoma. CHEST. 1984 86: 693-696.
15. Schenk DA, Chambers SL, Derdak S, et al. Comparison of the Wang 19 gauge and 22 gauge needles in the mediastinal staging of lung cancer. Am Rev Respir Dis. 1993; 147: 1251-1258.
16. Holty JE, Kuschner WG, Gould MK. Accuracy of transbronchial needle for mediastinal staging of non-small cell lung cancer: a meta-analysis. Thorax. 2005 60: 949-955.
17. Haponik EF, Cappellari JO, Chin R, et al. Education and experience improve transbronchial needle aspiration performance. Am J Respir Crit Care Med. 1995; 151 (6): 1998-2002.
18. Davenport RD. Rapid on-site evaluation of transbronchial aspirates. CHEST. 1998; 98: 59-61.
e) Cirugía torácica video asistida-Videotoracoscopía (VATS por su sigla en inglés)
La VATS izquierda es una alternativa a la mediastinoscopía anterior (procedimiento de Chamberlain) y a la mediastinoscopía extendida (Ginsberg). Permite biopsiar no sólo los grupos 5 y 6, sino también acceder a los grupos paraesofágicos (grupo 8), del ligamento pulmonar (grupo 9), el grupo 7 posterior y los ganglios hiliares (grupo 10). La VATS derecha explora los grupos paratraqueales (grupos 2 y 4), paraesofágicos (grupo 8), subcarinales (grupo 7), del ligamento pulmonar (grupo 9) y los ganglios hiliares (grupo 10). Además, la VATS permite visualizar el tumor primitivo, explorar la cavidad pleural y confirmar o descartar compromiso metastásico. En una revisión de 246 procedimientos videoasistidos la sensibilidad fue del 99% con óptima especificidad (100%) y alto valor predictivo negativo (96%)1.
Indicaciones: Estadificación de tumores del lóbulo superior izquierdo. Evaluación de grupos no accesibles a la mediastinoscopía cervical cuando no se dispone de ecografía transbronquial o transesofágica. Pacientes con contraindicación para realizar mediastinoscopía cervical (traqueostomía definitiva, cirugías previas, radioterapia mediastinal). Evaluación de nódulos pulmonares localizados en un lóbulo distinto al tumor primitivo (ipsi o contra lateral)2.
Referencias
1. Silvestri G et al. Methods for Staging Non-small Cell Lung Cancer. Diagnosis and Management of Lung Cancer, 3rd ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. CHEST 2013; 143 (5) (Suppl): e211S-e250S.
2. Goldstraw P, Crowley J, Chansky K, et al. “IASLC Staging Manual in Thoracic Oncology”, 2007. J Thorac Oncol. 2007; 2: 706-714.
Detección de metástasis a distancia
Los pacientes que presentan metástasis a distancia se incluyen en el estadio IV, esto confiere un pronóstico y tratamiento diferentes. Es prioridad asegurar con los métodos adecuados la exclusión de metástasis a distancia a la hora de evaluar un paciente para cirugía con intención curativa (Tabla 1).

En el momento del diagnóstico el 57% de los pacientes presentan diseminación a otros órganos1; los sitios más frecuentemente comprometidos son cerebro, huesos, glándulas suprarrenales, hígado, pleura o pericardio, como así también adenopatías a distancia2.
En paciente con sospecha clínica de metástasis cerebrales o estadios III o IV debería realizarse RM de cerebro; de no ser posible este método se aconseja la realización de TAC de cerebro; no se recomienda PET-TC. El compromiso óseo se puede manifestar con dolor y fracturas patológicas que predominan en esqueleto axial y región proximal de huesos largos. El centellograma óseo es de utilidad pero los hallazgos deben confirmarse histológicamente. Numerosos estudios han reportado que la PET-TC es superior al centellograma para la detección de metástasis óseas (especificidad de 91%)3. La afectación suprarrenal habitualmente es silente y puede detectarse en la PET o tomografía de abdomen superior. La PET-TC tiene mayor sensibilidad (89%) y especificidad (88%)4. El compromiso hepático puede ser asintomático o manifestarse con fiebre y dolor asociado a disfunción hepática; puede valorarse mediante ecografía, TC, RM o PET-TC. La ecografía pierde sensibilidad con lesiones < 2 cm al igual que la TAC con lesiones < 1 cm. En la TC una lesión hipocaptante con signo del halo tiene un valor predictivo positivo del 98% y una especificidad del 93% en la predicción de malignidad; la RM con gadolinio tiene mayor precisión diagnóstica que la TC5. La PET puede descubrir 5 a 20% de las lesiones ocultas, no sospechables clínicamente6, 7. Confiere mayor sensibilidad y especificidad que la TC convencional en la estadificación del CaP. Su especificidad para la descubrir metástasis extratorácicas es de 0.95 (IC95% 0.92:0.97) sin embargo, la sensibilidad es 0.77 (IC95%: 0.77-0.88)8. La PET-TC debería considerarse en todos los pacientes candidatos a cirugía con intención curativa si se encuentra disponible; sin embargo, los hallazgos positivos deben confirmarse con métodos histo/citopatológicos. En este contexto es importante, a la hora de elegir el sitio de toma de muestra para histología, considerar que el material obtenido pueda asegurar diagnóstico y estadificación como así también que permita tener el tejido suficiente para efectuar análisis específicos que orienten un abordaje terapéutico personalizado.
Referencias
1. Siegel R, Miller K, Jemal A. Cancer statistics. CA Cancer J Clin 2017; 67: 7-30.
2. De Vita V, Hellman and Rosemberg ed Lippincot Williams and Wilkins (2008). Cancer Principles and Practice 8 th edition: Lung Cancer.. 2008: 887- 973.
3. Song JW, Oh YM, Shim TS, et al. Efficacy comparison between 18F-FDG PET/CT and bone scintigraphy in detecting bony metastases of non-small-cell lung cancer. Lung Cance.r 2009; 65: 333-8.
4. Cho AR, Lim I, Na II, et al. Evaluation of adrenal masses in lung cancer patients using F-18 FDG PET/CT. Nucl Med Mol Imaging. 2011; 45: 52–8.
5. Ward J, Robinson PJ, Guthrie JA, Downing S, et al. Liver metastases in candidates for hepatic resection: comparison of helical CT and gadolinium- and SPIO- enhanced MR imaging. Radiology. 2005; 237: 170-80.
6. De Wever W, Stroobants S, Coolen J, Verschakelen JA. Integrated PET/TC in the staging of non small cell lung cancer: technical aspects and clinical integration. Eur Resp J. 2009; 33: 201-212.
7. Fischer B, Lassen U, Mortensen L, et al. Preoperative staging of lung cancer with combined PET-CT. N Engl J Med. 2009; 361: 32-39.
8. Yihua W, Peiwei L, Honghe Z, et al. Diagnostic value of fluorine 18 fluorodeoxyglucose positron emission tomography/computed tomography for the detection of metastases in non–small-cell lung cancer patients. Int. J. Cancer. 2013; 132: E37–E47.
Estrategias para la estadificación
La estadificación del CaP es crítica para realizar una descripción estandarizada de la enfermedad con un lenguaje común que permita orientar el tratamiento a seguir y establecer el pronóstico de los pacientes, facilitando además la investigación y comparación de resultados de diferentes estudios clínicos.
La responsabilidad de la estadificación exacta la comparten el cirujano de tórax, el neumonólogo, el radiólogo, el patólogo y el oncólogo. Un sistema uniforme de estadificación permite a cada participante involucrado en el tratamiento del paciente comunicar los resultados de manera inequívoca.
a) Detección de metástasis
El paradigma en la estadificación clínica es excluir la presencia de metástasis ganglionares con la mayor exactitud para ofrecer al paciente el mejor tratamiento posible –que es la resección pulmonar–, ya que el compromiso ganglionar mediastinal indica mal pronóstico.
La identificación preoperatoria de metástasis debe realizarse de forma no invasiva con TC y/o PET. Si se dispone de PET, una PET negativa por su alta sensibilidad excluye la necesidad de estadificación invasiva o mini-invasiva posterior, excepto en los casos de alto riesgo de compromiso mediastinal (ganglios > 15 mm en la TC o captación N1 en la PET). El paso siguiente es un método mini-invasivo (TBNA, EBUS-TBNA y EUS-FNA) o invasivo (mediastinoscopía, mediastinoscopía cervical extendida o VATS).
Cabe señalar que el EBUS-TBNA tiene un rol creciente como estándar en la estadificación mediastinal, siendo comparable en sensibilidad y especificidad a la mediastinoscopía con la ventaja de su mínima invasividad. Es preferible reservar la mediastinoscopía para la re-estadificación del mediastino en caso de considerarse la posibilidad de una intervención quirúrgica post tratamiento neoadyuvante.
No hay, al momento, un algoritmo de estadificación único aplicable a todos los pacientes con CaP. El estándar de evaluación del mediastino (y de estadificación en general) está cambiando, sin embargo, debemos tener en cuenta las limitaciones en nuestro medio en cuanto a la disponibilidad y experiencia para la realización de exploraciones mínimamente invasivas como las que se han descripto hasta aquí (Figura 1). En la Figura 2 se describe la modalidad de incorporación de PET, cuando se tiene fácil acceso a esta técnica.
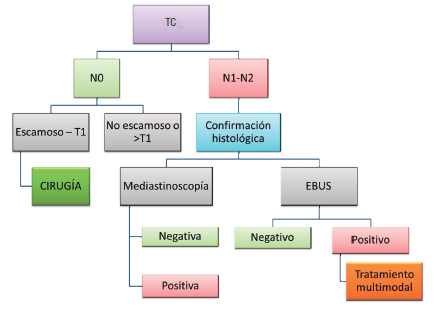
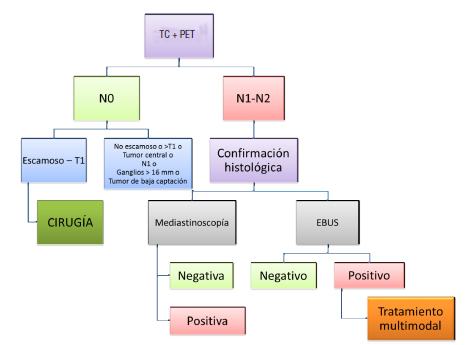
Evaluacion prequirúrgica
Los pacientes con CaP frecuentemente presentan comorbilidades que incrementan el riesgo de la resección quirúrgica del tumor1, 2. El objetivo de la evaluación prequirúrgica (EPQ) consiste en identificar estas comorbilidades, y estimar el riesgo de complicaciones perioperatorias (CPO) considerando la condición clínica y la reserva funcional respiratoria y cardiovascular del paciente2-5. Asimismo, la EPQ permite implementar estrategias para reducir la probabilidad de CPO y establecer un pronóstico de discapacidad postquirúrgica2, 4, 6.
a) Factores de riesgo de complicaciones postoperatorias
a.1 Procedimiento quirúrgico
El riesgo se incrementa con la extensión anatómica de la resección, y disminuye cuando la intervención se efectúa utilizando procedimientos mínimamente invasivos y en centros especializados con mayor volumen de casos2, 3, 7, 8.
a.2 Comorbilidades
Las comorbilidades incluyen EPOC, isquemia miocárdica, disfunción ventricular, arritmias, deterioro renal y diabetes2, 3, entre otras. La edad avanzada y la quimio-radioterapia de inducción pueden implicar mayor riesgo de CPO, especialmente luego de la neumonectomía2, 3. La suspensión del tabaquismo activo 2 a 4 semanas antes de la intervención parece reducir la probabilidad de CPO9. Las guías internacionales concuerdan en que resulta prioritaria la valoración del estado cardiovascular sugiriéndose el empleo de escalas de riesgo basadas en los antecedentes de eventos y/o factores de riesgo cardiovascular5, 9, 10.
a.3 Condición funcional respiratoria
La evaluación respiratoria con estimación de la pérdida funcional consecutiva a la resección resulta esencial para valorar el riesgo de CPO en todos los pacientes, y más especialmente en aquellos con enfermedad respiratoria concurrente como la EPOC.
b) Evaluación de función respiratoria
La modalidad de la evaluación funcional respiratoria ha sido consensuada en recientes guías internacionales3, 5, 9-11.
b.1 Espirometría y DLCO
Ambas evaluaciones están indicadas en todos los pacientes candidatos a cirugía de resección pulmonar deben realizar una espirometría y el estudio de la difusión de monóxido de carbono (DLCO), dado que valores disminuidos del VEF1 y/o de DLCO están asociados con un mayor riesgo de complicaciones pulmonares y de mortalidad post-operatoria3, 9, 12, 13. Es necesario medir ambos parámetros ya que valoran diferentes aspectos de la fisiología pulmonar (vía aérea e intercambio gaseoso), y aún con espirometría normal la DLCO disminuida es un fuerte predictor independiente de CPO12, 13. La evaluación del riesgo quirúrgico basada en los valores de función pulmonar preoperatorios no toma en cuenta la magnitud de la resección ni la calidad funcional del tejido a resecar. Para evaluarlo más adecuadamente se utilizan los valores estimados de VEF1 y DLCO posteriores a la resección, expresados tanto en valores absolutos (ppoVEF1 y ppo DLCO) como en porcentajes del predicho (%ppoVEF1 y %ppo DLCO). Para su cálculo se emplean ecuaciones (*) que consideran el aporte funcional del parénquima a resecar utilizando el centellograma pulmonar de perfusión cuantitativo o bien el recuento de los segmentos broncopulmonares funcionantes a ser extirpados5, 9, 14-16.
b.2 Centellograma
Se utiliza para predecir la función postoperatoria en la neumonectomía, mientras que su valor es limitado para la lobectomía debido a que el método superpone la contribución funcional de los segmentos contiguos de dos lóbulos diferentes. En este caso se prefiere el recuento de los segmentos broncopulmonares funcionantes que serán resecados9, sobre la base de un total de 19 segmentos broncopulmonares (10 para el pulmón derecho y 9 para el izquierdo).
c) Ecuaciones para el cálculo de la función pulmonar postoperatoria
La ecuación debe considerar el VEF1 preoperatorio post-broncodilatador o su valor más elevado. Una vez obtenido el ppoVEF1 se calcula el % del predicho (%ppoVEF1). De manera análoga pueden calcularse el valor de ppo DLCO y %ppoDLCO. Cuando VEF1 y DLCO preoperatorios son > 80% del predicho, o con cuando ppoVEF1 y ppoDLCO son > 60% del predicho, se presume un bajo riesgo quirúrgico aún para la neumonectomía. Si se estima un valor de ppoVEF1 o ppoDLCO < 60% del predicho, es necesario evaluar la capacidad de ejercicio con medición del consumo máximo de oxígeno ((VO2max) para determinar el riesgo quirúrgico con mayor precisión. Para ello puede recurrirse a la prueba de ejercicio cardiopulmonar (PECAP), o bien a una prueba de ejercicio reglada de baja tecnología (PEBT) como el shuttle walk test incremental (SWTi) o la prueba de escaleras. Mientras que la medición directa del VO2max con la PECAP provee el mayor poder discriminativo de riesgo mediante un estudio de complejidad relativamente elevada, las PEBT son más sencillas y económicas permitiendo estimar el valor del VO2max real3, 5, 10. Como desventaja, la prueba de escaleras no se halla estandarizada en su duración o velocidad de ascenso, como tampoco en cuanto al nivel de pendiente. Un valor de SWTi > 400 metros (25 shuttles) o una prueba de escaleras > 22 metros de ascenso corresponderían a un VO2max > 15 mL/kg/min, el cual es indicativo de un riesgo quirúrgico aceptable17. Valores inferiores a los señalados para las PEBT o un valor estimado de ppoVEF1 o ppoDLCO < 30% requieren la realización de la PECAP5 (Figura 3). La PECAP con medición de VO2max evalúa la respuesta cardiovascular, respiratoria y metabólica con un ejercicio máximo, proveyendo una detallada información acerca de la reserva fisiológica, los factores limitantes involucrados, y el riesgo potencial de CPO3, 5, 10. La PECAP simula el stress quirúrgico dentro de un ámbito controlado, realizándose habitualmente en una banda deslizante o en cicloergómetro, aunque en situaciones especiales puede recurrirse a un ergómetro de brazos18. Distintos estudios han demostrado que los pacientes con VO2max > 20 mL/kg/min (> 75% del predicho) presentan un bajo riesgo para la resección, incluyendo la neumonectomía. Por otro lado, los pacientes con VO2max entre 10 y 15 mL/ kg/min (35 a 75% del valor predicho) presentan mayor riesgo de CPO y una tasa de morbimortalidad más elevada. Un VO2max < 10 mL/kg/min o 35% del predicho es generalmente se considerado como una contraindicación para realizar resecciones mayores e implica un elevado riesgo de mortalidad postoperatoria3-5. De esta manera, el valor del VO2max resulta útil para una evaluación más precisa del riesgo de CPO, especialmente en pacientes con función pulmonar limitada. Finalmente, algunas complicaciones clínicas observadas durante el acto quirúrgico, tales como la hipertensión arterial reactiva y la isquemia miocárdica o periférica, pueden ser pesquisadas previamente en la PECAP. Muchos de estos trastornos suelen no ser detectables en reposo, pero son evidenciados con un ejercicio incremental adecuado19.
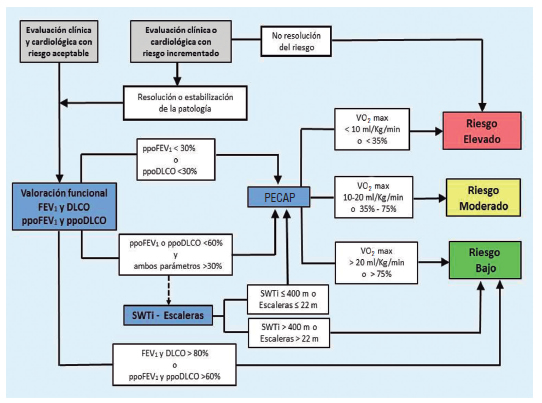
Ecuaciones para el cálculo de la función pulmonar postoperatoria5
Para neumonectomía: ppoVEF1 = VEF1 preoperatorio × (1 - % perfusión del pulmón a resecar/100)
Para lobectomía: ppoVEF1 = VEF1 preoperatorio × x (1 – n° de segmentos funcionantes a resecar/n° total de segmentos funcionantes)
d) Escalas prequirúrgicas de riesgo
Las escalas de riesgo identifican factores asociados a morbimortalidad postoperatoria constituyendo un modelo para la toma de decisiones. Resultan útiles para estratificar grupos de riesgo, evaluar la supervivencia general de la enfermedad, y elaborar los contenidos del consentimiento informado preoperatorio2, 20. Sin embargo, presentan limitaciones para evaluar el riesgo individual, por lo que no deberían utilizarse para indicar la cirugía ni para excluir un paciente de esta opción terapéutica5. La escala Thoracoscore20 considera las variables más significativas para la cirugía torácica, habiendo demostrado un valor predictivo independiente para mortalidad intrahospitalaria. Recientemente se ha publicado una serie retrospectiva21 en la que los predictores más significativos de mortalidad hospitalaria fueron la edad, el sexo (mayor en el masculino), el puntaje de la American Society of Anesthesiologists (ASA), la capacidad funcional (Zubrod/OMS), la severidad de la disnea (mMRC), la extensión de la resección y el ppoFEV1, entre otras variables (Figura 3)
Referencias
1. Little A, Greer Gay E, Gaspar L, et al. National survey of non-small cell lung cancer in the United States: Epidemiology, pathology and patterns of care. Lung Cancer. 2007; 57: 253-260.
2. Kozower B, Sheng S, O’Brien S, et al. STS Database Risk Models: Predictors of Mortality and Major Morbidity for Lung Cancer Resection. Ann Thorac Surg. 2010; 90: 875-883.
3. Van Tilburg P, Stam H, Hoogsteden H, et al. Pre-operative pulmonary evaluation of lung cancer patients: a review of literature. Eur Respir J. 2009; 33: 1206-1215.
4. Licker M, Schnyder J, Frey J, et al. Impact of Aerobic Exercise CaPacity and Procedure-Related Factors in Lung Cancer Surgery ERJ. 2011; 37: 1189-1198.
5. Brunelli A, Kim A, Berger K, et al. Physiologic Evaluation of the Patient with Lung Cancer Being Considered for Resectional Surgery. Diagnosis and Management of Lung Cancer, 3rd ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. CHEST. 2013; 143 (5)(Suppl): e166-e190S.
6. Win T, Groves A, Ritchie A, et al. The Effect of Lung Resection on Pulmonary Function and Exercise CaPacity in Lung Cancer Patients. Respir Car.e 2007; 52 (6):720-726.
7. Licker M, de Perrot M, Höhn L, et al. Perioperative mortality and major cardio-pulmonary complications after lung surgery for non-small cell carcinoma. European Journal of Cardio-thoracic Surgery .1999; 15: 314-319.
8. Bach P, Cramer L, Schrag D, et al. The Influence of Hospital Volume on Survival after Resection for Lung Cancer. N Engl J Med. 2001; 345: 181-188.
9. Brunelli A, Charloux A, Bolliger C, et al., on behalf of the European Respiratory Society and European Society of Thoracic Surgeons joint task force on fitness for radical therapy. ERS/ESTS clinical guidelines on fitness for radical therapy in lung cancer patients (surgery and chemo-radiotherapy). Eur Respir J. 2009; 34: 17-41.
10. Salati M. and Brunelli A. Risk Stratification in Lung Resection. Curr Surg Rep. 2016; 4: 37.
11. Spyratos D, Zarogoulidis P, Porpodis K, et al. Preoperative evaluation for lung cancer resection. J Thoracic Dis. 2014; 6(S1): S162-S166.
12. Brunelli A, Refai MA, Salati M, et al. Carbon monoxide lung diffusion CaPacity improves risk stratification in patients without airflow limitation: evidence for systematic measurement before lung resection. European Journal of Cardio-Thoracic Surgery. 2006; 29: 567-570.
13. Ferguson MK, Vigneswaran WT. Diffusing CaPacity Predicts Morbidity After Lung Resection in Patients Without Obstructive Lung Disease. Annals Thorac Surg. 2008; 85: 1158-1165.
14. Bolliger CT, Wyser C, Roser H, et al. Lung Scanning and Exercise Testing for the Prediction of Postoperative Performance in Lung Resection Candidates at Increased Risk for Complications. CHEST. 1995; 108: 341-348.
15. Zeiher BG, Gross TJ, Kern JA, et al. Predicting Postoperative Pulmonary Function in Patients Undergoing Lung Resection. CHEST. 1995; 108: 68-72.
16. Wu M-T, Pan H-B, Chiang AA, et al. Prediction of Postoperative Lung Function in Patients with Lung Cancer: Comparison of Quantitative CT with Perfusion Scintigraphy. AJR. 2002; 178: 667-672.
17. Brunelli A, Refai M, Xiumé F, et al. Performance at symptom-limited stair- climbing test is associated with increased cardiopulmonary complications, mortality, and costs after major lung resection. Ann Thorac Surg. 2008; 86: 240-7; discussion 247-8.
18. ATS/ACCAP Statement on cardiopulmonary exercise testing. Am J Respir Crit Care Med. 2003; 167: 211.
19. Brunelli A, Al Refai M, Monteverde M, Borri A, Salati M, Fianchini A. Predictors of exercise oxygen desaturation following major lung resection. Eur J Cardiothorac Surg. 2003; 24: 145-8.
20. Falcoz PE, Conti M, Brouchet L, Chocron S, et al. The Thoracic Surgery Scoring System (Thoracoscore): risk model for in-hospital death in 15,183 patients requiring thoracic surgery. J Thorac Cardiovasc Surg. 2007; 133 (2): 325-32.
21. Brunelli A, Salati M, Rocco G, et al. European risk models for morbidity (EuroLung1) and mortality (EuroLung2) to predict outcome following anatomic lung resections: an analysis from the European Society of Thoracic Surgeons database. European Journal of Cardio-Thoracic Surgery (Online 2016, Oct 15. In press 2017).
22. Brunelli A, Rodriguez Moncalvo J, Brea Folco J et al. CHEST. 2013; 143 (Suppl): e166S-e190S.
TRATAMIENTO
- Estadios I y II
- Estadio III
- Estadio IV
- Situaciones especiales
Estadios I y II
a) Tratamiento quirúrgico
La cirugía es el tratamiento estándar para pacientes médicamente operables con CaPCNP en estadio clínico I y II, en los que no hay evidencia de compromiso mediastinal en el curso de la estadificación previa a la cirugía. Si bien no se dispone de estudios prospectivos randomizados que comparen la cirugía aislada con otros tratamientos, el argumento para implementar este abordaje se sustenta en datos consistentes aportados por estudios retrospectivos de cohortes y en registros de bases de datos, que muestran mayores tasas de supervivencia después de la cirugía en comparación con otras modalidades terapéuticas. En estas series la supervivencia a 5 años estimada en pacientes con estadio I oscila entre el 60 y el 80%, y entre el 30% y el 50% para estadio II1, 2. Por el contrario, aquellos pacientes sin tratamiento muestran una supervivencia a 5 años del 15% al 20%3.
Recomendación
- En pacientes en estadios I y II y sin contraindicaciones médicas, se recomienda la resección quirúrgica.
Múltiples ensayos clínicos mostraron que los resultados quirúrgicos a corto plazo (morbi-mortalidad) y a largo plazo (supervivencia a 5 años) son superiores cuando la intervención es realizada por un cirujano torácico especializado1. Un estudio observó una mortalidad global del 11.5%, 10.1% y 6.4% para la neumonectomía y del 4.1%, 3.0% y 2.3% para lobectomía cuando el especialista que realizó la resección fue un cirujano general, un cirujano cardíaco o un cirujano torácico, respectivamente4. El análisis de 12.862 pacientes operados en hospitales del Reino Unido mostró una supervivencia mayor en los centros con un volumen de resecciones de más de 150 casos por año ersus las instituciones con un volumen de resecciones menor a 70 casos (HR 0.78; 95% CI 0.67 a 0.90)5.
Recomendación
- Se aconseja que los pacientes sean evaluados por un cirujano torácico, aun si se consideran terapéuticas no quirúrgicas.
a.1 Lobectomía
Basándose en un análisis retrospectivo de series de casos el estudio randomizado realizado por el Lung Cancer Study Group en 1995 definió la lobectomía como el tratamiento “estándar de excelencia” del CaPCNP en pacientes candidatos a cirugía. Los resultados revelaron un mayor nivel de recurrencia local en aquellos a quienes se realizaron resecciones sublobares versus los pacientes que fueron sometidos a lobectomías6.
Recomendaciones
- En pacientes con CaPCNP estadios I y II en condiciones médicas para tratamiento quirúrgico se recomienda lobectomía sobre resecciones sublobares.
- En tumores proximales que no pueden ser resecados por lobectomía, siempre que sea posible, la resección del manguito es preferible a la neumonectomía. Los resultados oncológicos son equivalentes, hay una mejor preservación de la función pulmonar y se evitan las complicaciones asociadas a la neumonectomía7.
- Para los pacientes con CaPCNP de localización central, en los que se puede lograr una resección completa se sugiere una lobectomía con resección en lugar de una neumonectomía.
a.2 Resección por cirugía torácica video asistida (VAT)
Existen estudios que indican que se pueden lograr tasas similares de curación en aquellos pacientes intervenidos con VAT en comparación con la toracotomía. De acuerdo a una revisión reciente, existen numerosas evidencias sólidas de que este enfoque mínimamente invasivo es factible, seguro y oncológicamente eficiente, ofreciendo a los pacientes varias ventajas sobre la toracotomía abierta tradicional, como menor morbimortalidad y tiempo de internación. También demuestran una supervivencia a largo plazo al menos equivalente al abordaje tradicional, particularmente para la enfermedad en estadio temprano (I y II)8.
Recomendación
- La VAT es una alternativa válida a la toracotomía en pacientes candidatos a resección anatómica (lobectomía o segmentectomía) en centros con experiencia en esta técnica.
a.3 Resecciones sublobares (RS)
Se distinguen dos tipos de procedimientos para las RS: las resecciones en cuña (no anatómicas) y la segmentectomía (resección anatómica que incluye la ligadura selectiva de bronquio, arteria y vena de un segmento determinado)9.
En pacientes mayores de 75 años o con riesgo elevado lobectomía por la presencia de comorbilidades las RS, especialmente en tumores < 2 cm, pueden realizarse sin diferencia significativa en cuanto a recurrencia local o supervivencia a largo plazo10. Un margen de 2 cm puede considerarse adecuado para estas resecciones.
Recomendación
- En pacientes con comorbilidades que no pueden tolerar una resección lobar o mayor, se recomienda RS sobre tratamiento no quirúrgico. Un margen de resección igual o mayor a 2 centímetros se considera adecuado.
- El subgrupo de pacientes con adenocarcinoma in-situ puede ser considerado para una resección sublobar por su baja agresividad. En el contexto de aplicación clínica se consideran candidatos a esta intervención los pacientes con lesiones en vidrio esmerilado puro o con un área sólida < 5 mm en la TAC11. Estudios prospectivos que evaluaron 94 pacientes con resección sublobar por adenocarcinoma in situ o mínimamente invasivo < 2 cm no mostraron progresión ni recurrencia luego de un seguimiento promedio de 50 meses12, 13.
- Para los pacientes en estadio clínico I con lesiones predominantemente subsólidas o en vidrio esmerilado menores o iguales a 2 cm, una resección sublobar con márgenes negativos se sugiere sobre la lobectomía
a.4 Relevamiento de estaciones ganglionares
Para la evaluación intraquirúrgica de los ganglios pulmonares y mediastinales se utiliza la clasificación de la European Society of Thoracic Surgeons que describe las siguientes opciones: vaciamiento (resección de ganglios y tejido mediastinal de los grupos mediastinales homolaterales), muestreo sistemático (biopsia de todas las estaciones) y muestreo dirigido (biopsia de ganglios de aspecto patológico)14.
Un estudio de cohorte randomizado multiinstitucional no mostró diferencias en la supervivencia entre vaciamiento mediastinal y muestreo sistemático en pacientes con CaPCNP estadio I15. Un ensayo clínico randomizado mostró mayor supervivencia global y reducción de recidivas distantes y locales en pacientes N1 positivos (analizados conjuntamente con una sola estación N2) en aquellos tratados con vaciamiento mediastinal16. Los hallazgos son apoyados por datos de un estudio de cohorte no randomizado que mostró un control local de la enfermedad superior en el grupo con vaciamiento mediastinal en pacientes con enfermedad en estadio II17.
Recomendación
- En estadio clínico I y II de CaPCNP se recomienda muestreo ganglionar sistemático o vaciamiento mediastinal para una correcta estadificación patológica.
- En CaPCNP estadio clínico I sometidos a una resección anatómica en la que no se detecta compromiso mediastinal en el muestreo intraoperatorio, el vaciamiento mediastinal no ha demostrado beneficios y no se recomienda.
- En CaPCNP estadio clínico I sometidos a una resección anatómica con compromiso mediastinal (N1 o N2 oculto) el vaciamiento mediastinal mejora la supervivencia y disminuye la recurrencia local, por lo que es recomendado.
En la Tabla 1 se describen las estrategias de abordaje terapéutico recomendadas para el CaPCNP estadio II.

Referencias
1. Howington JA, Blum MG, Chang AC, Balekian AA, Murthy SC. Treatment of stage I and II non-small cell lung cancer: Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. CHEST. 2013; 143(5 Suppl): e278S-313S.
2. Manser R, Wright G, Hart D, Byrnes G, Campbell D, Wainer Z, Tort S. Surgery for local and locally advanced non-small cell lung cancer. Cochrane Database of Systematic Reviews. 2005, Issue 1. Art. No: CD004699.
3. Detterbeck FC, Gibson CJ. Turning gray: the natural history of lung cancer over time. J Thorac Oncol. 2008; 3(7): 781- 792.
4. Schipper PH, Diggs BS , Ungerleider RM , Welke KF. The influence of surgeon specialty on outcomes in general thoracic surgery: a national sample 1996 to 2005. Ann Thorac Surg. 2009; 88(5): 1566-1572.
5. Lüchtenborg M, Riaz SP, Coupland VH et al. High procedure volume is strongly associated with improved survival after lung cancer surgery. J Clin Oncol. 2013; 31 (25): 3141-6.
6. Ginsberg RJ, Rubinstein LV: Randomized trial of lobectomy versus limited resection for T1 N0 non-small cell lung cancer. Lung Cancer Study Group. Ann Thorac Surg. 1995; 60(3): 615-622.
7. Ferguson MK, Lehman AG. Sleeve lobectomy or pneumonectomy: optimal management strategy using decision analysis techniques. Ann Thorac Surg. 2003; 76(6): 1782.
8. Vannucci F, Gonzalez-Rivas. Is VATS lobectomy standard of care for operable non-small cell lung cancer? Lung Cancer .2016; 00: 114-9.
9. Rami-Porta R, Tsuboi M, et al. Resecciones sublobares. Eur Respir J. 2009; 33: 426-435.
10. Schubert M, Abbas G, Pennathur A, et al. Sublobar resection for early stage lung cancer. Seminars in thoracic and cardiovascular surgery. 2010; 22: 22-31.
11. Wilshire CL, Louie BE, et al. Radiologic Evaluation of Small Lepidic Adenocarcinomas to Guide Decision Making in Surgical Resection. Ann Thorac Surg .2015; 100(3): 979-88.
12. Yoshida J, Nagai K, Yokose T, et al. Limited resection trial for pulmonary ground-glass opacity nodules: fifty-case experience. J Thorac Cardiovasc Surg. 2005; 129(5): 991-996.
13. Koike T, Togashi K, Shirato T, et al. Limited resection for noninvasive bronchioloalveolar carcinoma diagnosed by intraoperativepathologic examination. Ann Thorac Surg. 2009; 88(4): 1106–1111.
14. Lardinois D, De Leyn P, Van Schil P, et al. ESTS guidelines for intraoperative lymph node staging in non-small cell lung cancer. Eur J Cardiothorac Surg. 2006; 30(5): 787-792.
15. Darling GE, Allen MS, Decker PA, et al. Randomized trial of mediastinal lymph node sampling versus complete lymphadenectomy during pulmonary resection in the patient with N0 or N1 (less than hilar) non-small cell carcinoma: results of the American College of Surgery Oncology Group Z0030 Trial. J Thorac Cardiovasc Surg .2011; 141(3): 662-670.
16. Izbicki JR, Passlick B, Pantel K, et al. Effectiveness of radical systematic mediastinal lymphadenectomy in patients with resectable non-small cell lung cancer: results of a prospective randomized trial. Ann Surg. 1998; 227(1): 138-144.
17. Lardinois D, Suter H, Hakki H, et al. Morbidity, survival, and site of recurrence after mediastinal lymph-node dissection versus systematic sampling after complete resection for non-small cell lung cancer. Ann Thorac Surg. 2005; 80(1): 268-274.
b) Tratamiento radiante
Se aconseja el radioterapia (RT) para los estadios tempranos del CaPCNP cuando: no son pasibles de cirugía1, necesitan tratamiento radiante posterior a la cirugía1. Se recomienda utilizar nuevas técnicas1, 2 ya que la RT 2D lleva a errores en el volumen del blanco a irradiar, presenta toxicidad no medible de los tejidos sanos y permite sólo dosis radiantes totales bajas, con el consiguiente pobre control local (Ver Tabla 1 Anexo 2)
b.1 RT Externa con técnicas de Radioterapia Tridimensional Conformada (3D) o Radioterapia de Intensidad Modulada (IMRT)
Estas metodologías son preferidas cuando se trata de tumores en estadios IIA ó IIB inoperables4. La dosis recomendada es de 60 - 70Gy con fraccionamientos de 1.8Gy a 2.0Gy/día. Se utilizan como tratamiento combinado de quimio-radioterapia post cirugía en pacientes candidatos a una reintervención y persisten como R1 o R25 (Se define como R0: resección completa con margen negativo; R1: Resección con remanente microscópico/margen comprometido y R2: Resección incompleta con remanente macroscópico) (Ver Tabla 2 de Anexo 2)
En casos de resultados postquirúrgicos R0 N2 eventualmente podría utilizarse la RT luego de la quimioterapia adyuvante, pero esta última es el tratamiento de preferencia6-8.
b.2 Radioterapia Estereotáxica Extracraneal (Stereotactic Body Radiation Therapy -SBRT); Radioterapia Ablativa Extracraneal (Stereotactic Ablative Radiation Therapy-SART)
Aproximadamente el 17% de los pacientes con CaP se presentarán con enfermedad temprana T1 T2 N0. Estos porcentajes podrán incrementarse con la implementación de nuevos algoritmos de screening. En las últimas dos décadas los desarrollos tecnológicos, ya sea, de delineación de blancos, manejo de movimiento, planificación conformada e imagen guiada han permitido el desarrollo y la implementación de SBRT, una estrategia que emplea dosis ablativas de radioterapia sobre el blanco tumoral en una a cinco fracciones. El principio mayor de esta modalidad terapéutica es la pronunciada caída del gradiente de dosis por fuera del tumor, contribuyendo a que las estructuras vecinas sanas no estén expuestas a dosis ablativas de radiación. Estudios prospectivos fase I y II analizaron la eficacia y seguridad de la SBRT. El estudio fase II de la Universidad de Indiana introdujo el concepto de que la localización influye en los índices de toxicidad de estos tratamientos. Definieron como tumores centrales aquellos que están dentro de los primeros 2 cm del árbol tráqueo-bronquial (también denominada “No Fly Zone”) señalando que éstos poseen un riesgo de toxicidad aumentado respecto de los periféricos9, 10, 11. El ensayo clínico RTOG 023612, fase II, fue el primero multicéntrico en tumores periféricos pulmonares tratados con SBRT. Se aplicaron 54 Gy en tres fracciones realizadas entre 8 a 14 días, en pacientes con tumores con un diámetro máximo de 5 cm considerados no quirúrgicos por comorbilidad. Desde la publicación de este estudio, otros análisis prospectivos confirmaron el control tumoral en más del 90% a tres años para estadio temprano con enfermedad periférica y dosis biológica efectiva de 100Gy13. Esta modalidad terapéutica puede presentar infrecuentes, pero serias toxicidades potenciales. El daño a la pared torácica puede resultar en síntomas neurológicos, cutáneos, óseos y de tejidos blandos, como así también fístulas bronquiales y esofágicas, entre otros. Numerosos trabajos han concluido que la SBRT modifica mínimamente las pruebas de función pulmonar12 y que las pruebas basales anormales no se correlacionan con disminución de supervivencia de causa específica. Por ello, los resultados pobres de las pruebas funcionales respiratorias no deben excluir a estos pacientes de tratamiento12, 14.
Recomendaciones
- La evidencia acumulada en estudios prospectivos y retrospectivos señala a la SBRT como el estándar de oro para el manejo de pacientes médicamente inoperables con CaP localizado y aquellos con CaP y diseminación periférica
- En pacientes con riesgo operatorio estándar estadio I no se recomienda SBRT como alternativa a la cirugía, a excepción de ensayos clínicos.
- En pacientes con riesgo operatorio alto estadio I que no pueden tolerar la lobectomía, candidatos a una resección sublobar, se sugiere discutir el uso de SBRT como alternativa potencial al tratamiento quirúrgico, informando al paciente que los resultados a más de tres años con SBRT todavía no están bien establecidos. Un aspecto esencial respecto de la decisión de considerar SBRT en pacientes operables es que esta terapia nunca ha sido adecuadamente comparada con lobectomía o resección sublobar en estudios prospectivos randomizados, por lo tanto, similitudes o diferencias en supervivencia a más de tres años no puede establecirse adecuadamente. Estudios comparativos de efectividad no han mostrado diferencias de sobrevida global (SG) ni sobrevida libre de enfermedad (SLE) entre SBRT y cirugía. Por otro lado, es importante agregar que la omisión de estadificación mediastinal contribuye a la subestadificación de 5 a 15% en los pacientes un estadio IA15.
- En tumores centrales y/o en íntima proximidad o con compromiso de estructuras mediastinales (árbol bronquial, esófago, corazón, grandes vasos y pericardio) la SBRT debe ser aplicarse en 4-5 fracciones, optimizando las restricciones de dosis para que sea segura. Para tumores centrales considerados de muy alto riesgo se sugiere RT hipofraccionada usando de 6 a 15 sesiones. El estudio RTOG 0813 examinó el esquema de fraccionamiento de dosis para tumores centrales con el objetivo de establecer el perfil seguridad aceptable. Por otro lado, consideró “tumores centrales” tanto a los que están dentro de 2 cm de árbol traqueo-bronquial proximal como aquellos lindantes con el mediastino, pericardio o medula espinal16. Hasta que haya datos más robustos sobre dosis límites se indica utilizar las restricciones de este trabajo. Para minimizar las chances de estenosis y fístulas el punto de máxima dosis del árbol bronquial próxima no debe exceder el 105% de la dosis de prescripción del PTV (volumen de planificación de terapia radiante).
Recomendaciones condicionales para otros escenarios clinicos
- Hay pocos datos acerca de cuál sería la mejor decisión clínica en tumores > 5 cm no candidatos a resección quirúrgica. Los trabajos RTOG 0236, 0813 y 0915 sólo incluyeron tumores < 5 cm12, 16, 17. Actualmente están en curso estudios que exploran SBRT en tumores voluminosos (Netherlands Cancer Institute y MSKCC)18, 19.
- Siempre que sea posible debe obtenerse biopsia previa al tratamiento con SBRT. La SBRT puede aplicarse a pacientes que rechazan la biopsia, que tienen una biopsia no diagnóstica, o que no puede biopsiarse debido a riesgos prohibitivos. Debe discutirse de forma multidisciplinaria si la lesión es radiológica o clínicamente consistente con un tumor maligno. La mayoría de los estudios randomizados han requerido confirmación por biopsia, no obstante, trabajos prospectivos y retrospectivos no randomizados han incluido pacientes sin confirmación histológica, con excelentes resultados20- 22.
- En los tumores lindantes o invasores de la pared costal la SBRT es una opción. Es apropiada para tumores T1 y T2 lindantes con la pared torácica; aunque en esta localización es frecuente la toxicidad grado I y grado II que resuelve con manejo conservador; los pacientes deben ser advertidos de la posibilidad de dicha toxicidad5-11. La SBRT también puede utilizarse en pacientes con enfermedad clínica T3 por invasión de la pared torácica, no habiendo evidencia clara sobre disminución de eficacia o toxicidad aumentada comparada con tumores lindantes o próximos a pared costal23.
Conclusión: Si bien la cirugía es el tratamiento estándar para pacientes en estadio I y II. GR A (Figuras 4, 5 y 6), en pacientes inoperables en estadios I y II (N0) el control local es > 90% con SRBT. Si la dosis biológica efectiva (BED sigla en inglés) es > 100 Gy estos valores son similares a los de la cirugía y la supervivencia es comparable.
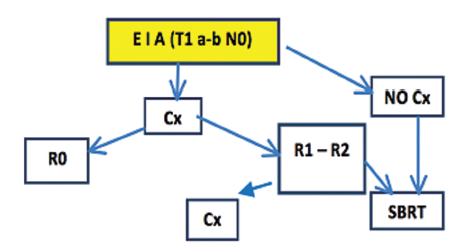
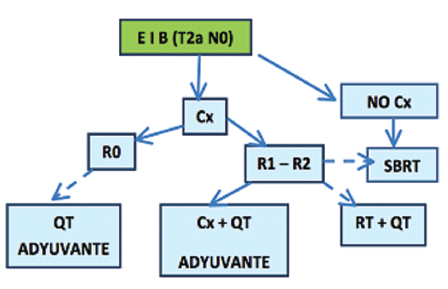
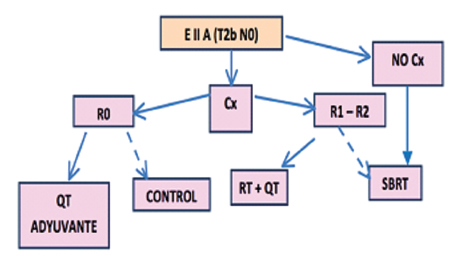
Referencias
1. Potters L y col. American Society for Therapeutic Radiology and Oncology and American College of Radiology practice guidelines for the performance of stereo-tactic body radiation therapy. IJROBP. 2004; 60: 1026-1032.
2. Baumann P, Nyman J, Hoyer M, et al. Outcome in a prospective phase II trial of medically inoperable stage I non small-cell lung cancer patients treated with stereotactic body radiotherapy. J Clin Oncol. 2009; 27(20): 3290-3296.
3. McGarry RC, Papiez L, Williams M, Whitford T, Timmerman RD. Stereotactic body radiation therapy of early-stage non-small-cell lung carcinoma: phase I study. Int J Radiat Oncol Biol Phys. 2005; 63(4): 1010-1015.
4. Onishi H y col. Stereotactic hypofractionated high dose irradiation for stage I Non Small Cell Lung Carcinoma clinical outcomes in 245 subjects in a Japanese Multi-institutional study. Cancer 2004; 101(7): 1623-31.
5. The Lung Cancer Study Group: Effects of postoperative mediastinal radiation therapy on complete resected stage II and stage III epidermoid cancer of the lung. NEJM. 1986; 315: 1377-1381.
6. Keller SM y col. A randomized trial of postoperative adjuvant therapy in patients with complete resected stage II or IIA non-small-cell lung cancer Eastern Cooperative Oncology Group. NEJM. 2000; 343: 1217-1222.
7. Douilard JY y col. Impact of postoperative radiation therapy on survival in patients with complete resection and stage I, II, or IIIA non-small-cell lung cancer with adjuvant chemotherapy: the adjuvant Navelvine International trial Association (ANITA) Randomized Trial. IJROBP. 2008; 72: 695-701.
8. Pantarotto J. y col “Radiotherapy for Locally Advanced Lung Cancer: EIIIA and IIIB” Pass H. y col. Principles & Practice of Lung Cancer “The Official Reference of the IASLC” Capítulo 42: 579-587 4a Ed. 2010 Lippincott Williams & Wilkins
9. Fakiris AJ, McGarry RC, Yiannoutsos CT, et al. Stereotactic body radiation therapy for early-stage non-small-cell lung carcinoma: four-year results of a prospective phase II study. Int J Radiat Oncol Biol Phys. 2009; 75(3): 677-682.
10. Timmerman R, McGarry R, Yiannoutsos C, et al. Excessive toxicity when treating central tumors in a phase II study of stereotactic body radiation therapy for medically inoperable early-stage lung cancer. J Clin Oncol. 2006; 24(30): 4833-4839.
11. Timmerman R, Paulus R, Galvin J, et al. Stereotactic body radiation therapy for inoperable early stage lung cancer. JAMA. 2010; 303(11): 1070-1076.
12. Stanic S, Paulus R, Timmerman RD, et al. No clinically significant changes in pulmonary function following stereotactic body radiation therapy for early- stage peripheral non-small cell lung cancer: an analysis of RTOG 0236. Int J Radiat Oncol Biol Phys. 2014; 88(5): 1092-1099.
13. Stephans KL, Djemil T, Reddy CA, et al. Comprehensive analysis of pulmonary function Test (PFT) changes after stereotactic body radiotherapy (SBRT) for stage I lung cancer in medically inoperable patients. J Thorac Oncol. 2009; 4(7): 838-844.
14. Zheng X, Schipper M, Kidwell K, et al. Survival outcome after stereotactic body radiation therapy and surgery for stage I non-small cell lung cancer: a meta-analysis. Int J Radiat Oncol Biol Phys. 2014; 90(3): 603-611.
15. Wang J, Welch K, Wang L, Kong FM. Negative predictive value of positron emission tomography and computed tomography for stage T1-2N0 non-small-cell lung cancer: a meta-analysis. Clin Lung Cancer. 2012; 13(2): 81-89.
16. Oncology. N. RTOG 0813: Seamless phase I/II study of stereotactic lung radiotherapy for early stage, centrally located, non-small cell lung cancer in medicallyinoperable patients. En: https://www.rtog.org/ClinicalTrials/ProtocolTable/StudyDetails.aspx
17. Videtic GM, Hu C, Singh AK, et al. A Randomized Phase 2 Study Comparing 2 Stereotactic Body Radiation Therapy Schedules for Medically Inoperable Patients With Stage I Peripheral Non-Small Cell Lung Cancer: NRG Oncology RTOG 0915 (NCCTG N0927). Int J Radiat Oncol Biol Phys. 2015; 93(4): 757-764.
18. Irradiation of Large Lung Tumors or Two or More Lung Metastases Simultaneously. En: https://clinicaltrials.gov/ct2/show/NCT01543672
19. Stereotactic Body Radiation Therapy for Inoperable Locally-advanced Non-small Cell Lung Cancer. En: https://clinicaltrials.gov/ct2/show/NCT01899989
20. Inoue T, Shimizu S, Onimaru R, et al. Clinical outcomes of stereotactic body radiotherapy for small lung lesions clinically diagnosed as primary lung cancer on radiologic examination. Int J Radiat Oncol Biol Phys. 2009; 75(3): 683-687.
21. Taremi M, Hope A, Dahele M, et al. Stereotactic body radiotherapy for medically inoperable lung cancer: prospective, single-center study of 108 consecutive patients. Int J Radiat Oncol Biol Phys. 2012; 82(2): 967-973.
22. Takeda A, Kunieda E, Sanuki N, et al. Stereotactic body radiotherapy (SBRT) for solitary pulmonary nodules clinically diagnosed as lung cancer with no pathological confirmation: comparison with non-small-cell lung cancer. Lung Cancer. 2012; 77(1): 77-82.
23. Xia T, Li H, Sun Q, et al. Promising clinical outcome of stereotactic body radiation therapy for patients with inoperable Stage I/II non-small-cell lung cancer. Int J Radiat Oncol Biol Phys. 2006; 66(1): 117-125.
c) Seguimiento del paciente intervenido quirúrgicamente con intenciones curativas
El seguimiento tiene como objetivos detectar recurrencias o segundos tumores primarios en pulmón y controlar los síntomas posoperatorios (toracoalgia, parestesias, afecciones cardiacas o respiratorias). En la bibliografía no hay acuerdo, algunos reportes están a favor de seguimiento intensivo1-4 y otros en contra5. Se postula que hay un alto porcentaje de pacientes en los que el diagnóstico se debe a la presencia de síntomas; en los asintomáticos el aumento de la supervivencia podría estar dado por sesgo de led-time bias6. Se ha comunicado un 19% de readmisiones dentro de los 90 días, en su mayoría relacionadas con infecciones o afecciones cardiacas7.
Recomendaciones de seguimiento
- Consultas ambulatorias semanales el 1° mes después del egreso.
- Consultas ambulatorias quincenales el 2° mes posterior a la cirugía.
- Consulta ambulatoria mensual por los seis meses siguientes.
- Régimen progresivo: 2 consultas bimestrales y luego cada seis meses hasta completar dos años.
- Una consulta anual hasta completar 10 años.
Se sugiere solicitar Rx de tórax y una TC entre el primer y tercer mes del postoperatorio para que sirva de patrón comparativo. Es conveniente repetir la TC cada 6 meses hasta los dos años de seguimiento, y luego anualmente. No hay evidencia aún de la utilidad de PET ni de la RM para pacientes asintomáticos8; ni tampoco de la utilidad de la fibrobroncoscopía, ni de la realización sistemática de citodiagnóstico en esputo9. El seguimiento debe ser multidisciplinario con participación activa del cirujano de tórax, oncológo y neumonólogo. Es fundamental insistir en la importancia de la cesación tabáquica10. Todo el equipo médico debe instruir a los pacientes sobre cuáles podrían ser los síntomas indicativos de recurrencia.
Referencias
1. Pairoleiro PC, Williams DE, Bergstralh EJ. Postsurgical stage I bronchogenic carcinoma. Ann Torac Surg. 1984; 38: 331-6.
2. Pautas en Oncología del Instituto de Oncología “Angel H. Roffo”. http://www. institutoroffo.com.ar/ pautasoncologia.shtml 2009
3. Rubins J, Unger M, Colice G, Follow-up and Surveillance of the Lung Cancer Patient Following Curative Intent Therapy- ACCAP Evidence-Based Clinical Practice Guideline (2nd Edition) CHEST. 2007; 132(3): 355S-367S.
4. Weder W, Hillinger S. Tumor surveillance after resection of lung cancer. Ther Umsch. 2008; 65(6): 315-8. RResumen en inglés del trabajo original en alemán)
5. Lamont JP, Kakuda JT, Smith D, et al. Systematic postoperative radiologyc follow-up in patients with non-small cell lung cancer for detecting second primary lung cancer in stage IA. Arch Surg. 2002; 137: 935-8.
6. Walsh GL, O’Connor M, Willis KM. Is follow-up of lung cancer patients alter resection medically indicated and cost-efective? Ann Thorac Surg. 1995; 60: 1563-72.
7. Handsy JR, Child AI, Grunkmeier GL. Hospital readmissions after pulmonary resection: prevalence: patterns and predisposing characteristics. Ann Thorac Surg. 2001; 72: 1855-60.
8. Takenaka D, Ohno Y, Koyama H, Nogami M, et al. Integrated FDG-PET/CT versus. standard radiological examinations: comparison of CaPability for assessment of postoperative recurrence in non-small cell lung cancer patients. Eur J Radiol. 2010; 74(3): 458-64.
9. Virgo K, McKirgan LW, Caputo M, et al. Post treatment management options for patients with lung cancer. Ann Surg. 1995; 222: 700-10.
10. Gritz ER, Neisenbaum R, Elashoff RE, et al. Smoking bahavior following diagnosis in patients with stage I non-small cell lung cancer. Cancer Causes Control. 1991; 2: 105-112.
Estadio III
Los pacientes diagnosticados con CaPCNP poseen, en 70-75% de los casos, un tumor irresecable por extensión locorregional o enfermedad avanzada. Hasta la década de los noventa, el tratamiento sintomático más comúnmente aceptado era la RT paliativa. En este grupo de pacientes es especialmente importante el abordaje multidisciplinario inicial con un equipo conformado por oncólogos, cirujanos de tórax, neumonólogos y radioterapeutas que tomen decisiones en forma conjunta, si es posible reunidos en ateneos, estableciendo la mejor estrategia de tratamiento para cada paciente.
a) Quimiorradioterapia
Varios estudios realizados en los últimos 20 años han establecido que realizar tratamiento combinado de quimioterapia (QT) más RT prolonga la supervivencia versus RT sola1, 2. Dos metaanálisis han comparado tratamientos de quimiorradioterapia (QRT) versus RT sola en CaPCNP3, 4. Rolland y cols3, en 2007, realizaron un metaanálisis, incluyendo 3839 pacientes enrolados en 22 estudios clínicos, informando un beneficio absoluto en supervivencia de 2.6% a los 3 años (p < 0.0001), con un HR de 0.88 (IC95% 0.92-0.94) a favor del abordaje combinado. Al agregar 16 estudios con 2910 pacientes adicionales el beneficio en supervivencia se incrementó a 3.2% a los 3 años (p = 0.0008), siempre a favor de la QRT.
a.1 ¿Modalidad secuencial o concurrente?
Aupérin y cols. presentaron en 2010 los resultados de su metaanálisis con 1199 pacientes incluidos en 6 estudios. Aquellos tratados con QRT concurrente tuvieron un beneficio absoluto en supervivencia del 6.6% a los 3 años (HR: 0.83; IC95% 0.73-0.94) versus la modalidad secuencial. También demostraron mayor toxicidad en la modalidad concurrente, siendo el efecto adverso más frecuente la esofagitis (Riesgo relativo: 5.7; IC95% 3.5-9.5; p < 0.0001)4. Aunque la QRT concurrente está actualmente aceptada como tratamiento estándar en CaPCNP estadio III irresecable, la secuencia óptima y la elección del régimen de QT todavía es controversial.
b) Quimioterapia
Existen muchos estudios al respecto, la combinación de cisplatino con etopósido tiene varios ensayos clínicosd fase II realizados por el Grupo Oncológico del Sudoeste (Southwest Oncology Group - SWOG). En el SWOG8805 los pacientes recibieron 2 ciclos de cisplatino/etopósido en forma concurrente con radioterapia (45Gy). Las tasas de respuesta fueron del 59% y de enfermedad estable del 29%5. El SWOG9019 exploró el rol de la QRT concurrente (cisplatino/etopósido y 61Gy de radioterapia) completando luego con 2 ciclos más del mismo esquema en pacientes estadio IIIB. La mediana de supervivencia fue de 15 meses (95%IC: 10-22) y 17% de tasa de supervivencia a los 3 años6. En el estudio fase II SWOG9504, al esquema del SWOG9019 le agregan 3 ciclos de quimioterapia de consolidación con docetaxel. Se observó una mediana de SG de 26 meses y una tasa de supervivencia a los 3 años del 17%7. Sin embargo, estos resultados no pudieron luego ser reproducidos por Hanna y colaboradores, y además se demostró una alta tasa de efectos adversos8. Debido a estos resultados, no queda aclarado el beneficio del uso de docetaxel como terapia de consolidación, y por lo tanto no se lo ha estandarizado.
Un estudio Fase II realizado por el Cancer and Leukemia Group B (CALBG), combinó cisplatino con paclitaxel, vinorelbine o gemcitabine. Las medianas de SG fueron 14, 18 y 17 meses respectivamente, y las tasas de supervivencia a los 3 años: 19%, 20% y 20%, similares al control histórico9. Un estudio presentado por Yamamoto en el año 2010 (WJTOG0105) con 456 pacientes, demostró similar eficacia, pero una tasa significativamente inferior de toxicidad hematológica y no hematológica con carboplatino/ paclitaxel semanal versus cisplatino/vindesina/mitomicina cada 28 días y cisplatino/docetaxel semanal, obteniendo una mediana de supervivencia de 22 meses10. Estos estudios demostraron que las drogas de QT tercera generación en combinación con RT resultaron tan buenas como las de segunda generación, con una mejor tolerancia.
Se han realizado ensayos clínicos con diferentes modos de administrar carboplatino /paclitaxel para poder encontrar la secuencia y dosis más eficaz y mejor tolerada, con menor esofagitis11, 12.
Existen pocos datos respecto al tratamiento más apropiado para pacientes con enfermedad localmente avanzada con mal performance estatus y/o edad avanzada. Un estudio fase II, presentado por Belani et al, incluyó pacientes entre 70 y 76 años, con puntuación 0-1 en la Scale of performance status (ECOG), los cuales recibieron inducción con carboplatino (AUC5)/paclitaxel (200 mg/m2) seguido de RT (63Gy) con aplicación de QT concurrente (carboplatino /paclitaxel). La mediana del tiempo de supervivencia fue de 16 meses (95%IC: 4.2-52.1) y 20% la tasa de supervivencia a 3 años, con toxicidades similares a las reportadas en los demás estudios (20% de esofagitis Grado 3)11.
El tratamiento en pacientes con pobre ECOG (≥ 2) no es claro. Debido a la alta tasa de toxicidad que presenta el tratamiento combinado, la RT sola o el tratamiento secuencial constituyen una opción para estos pacientes.
Referencias
1. Dillman RO, Seagren SL, et al. A randomized trial of induction chemotherapy plus high-dose radiation versus radiation alone in stage III NSCLC. 1990. N Engl J Med. 1990; 23(14): 940-5.
2. Sause W, et al. Final results of Phase III Trial in regionally advanced unresectable NSCLC: Radiation Therapy Oncology Group, Eastern Cooperative Oncology Group, and Southwest Oncology Group. CHEST. 2000; 117(2): 358-64.
3. Rolland E, Le Chevalier T, Aupérin A, et al. Sequential radio-chemotherapy (RT-CT) versus radiotherapy alone (RT) and concomitant RT-CT versus RT alone in locally advanced non-small cell lung cancer (NSCLC): two meta-analyses using individual patient data (IPD) from randomised clinical trials (RCTs): A1-04. J Thorac Oncol. 2007; 2: S309-S310.
4. Auperin A, Le Pechoux C, Rolland E, Curran WJ, et al. Meta-analysis of concomitant versus secuential radiochemotherapy in locally advanced non small cell lung cancer. J Clin Oncol. 2010; 28(13): 2181-90.
5. Albain KS, Rush VW, et al. Concurrent Cisplatin/Etoposide plus chest radiotherapy followed by surgery for stages IIIA (N2) and IIIB NSCLC: mature results of Southwest Oncology Group phase II study 8805. J Clin Oncol. 1995; 13(8): 1880-92.
6. Albain KS, Crowley JJ, et al. Concurrent cisplatin, etoposide, and chest radiotherapy in pathologic stage IIIB NSCLC: a Southwest Oncology Group phase II, SWOG9019. J Clin Oncol. 2002; 20(16): 3454-60.
7. Gandara DR, Chansly K, et al. Consolidation docetaxel after concurrent chemoradiotherapy in stage IIIB NSCLC: Phase II Southwest Oncology Group Study S9504. J Clin Oncol. 2003; 21(10): 2004-10.
8. Hanna N, Neubauer M, et al. Phase III study of Cisplatin, etoposide, and concurrent chest radiation with or without consolidation docetaxel in patients with inoperable stage III NSCLC: the Hoosier Oncology Group and US Oncology. J Clin Oncol. 2008; 26(35): 5755-60.
9. Vokes EE, Emdon JE, et al. Randomized phase II study of cisplatin with gemcitabine or paclitaxel or vinorelbine as induction chemotherapy followed by concomitant chemoradiotherapy for stage IIIB NSCLC: cancer and leukemia group B study 9431. J Clin Oncol. 2002; 20(20): 4191-8.
10. Satouchi M, Yamamoto N, Chiba Y, et al. Randomized, phase III study of mitomycin/vindesine/cisplatin (MVP) versus weekly irinotecan/carboplatin (IC) or weekly paclitaxel/carboplatin (PC) with concurrent thoracic radiotherapy (TRT) for unresectable stage III non-small cell lung cancer (NSCLC): WJTOG0105. Program and abstracts of the 45th Annual Meeting of the American Society of Clinical Oncology; 2009; Orlando, Florida. Abstract 7504.
11. Belani CAP, Choy H, et al. Combined chemoradiotherapy regimens of paclitaxel and carboplatin for locally advanced NSCLC: a randomized phase II. locally advanced multimodality protocol. 2005. J Clin Oncol. 2005; 23(25): 5883-91.
12. Moversusas B, Scott C, et al. Randomized trial of amifostine in locally advanced NSCLC patients receiving chemotherapy and hyperfractionated radiation: radiation therapy oncology group trial 98-01. J Clin Oncol. 2005; 23(10): 2145-54.
c) Quimioterapia asociada a cirugía
c.1 Neoadyuvancia
Varios estudios fase II sugieren que la QT neoadyuvante seguida de cirugía en pacientes en estadio IIIA puede ofrecer una mejor resecabilidad del tumor con una aceptable morbimortalidad quirúrgica con una mejor supervivencia en comparación con aquellos que han recibido una sola modalidad terapéutica1-6
Rosell y cols.7, 8 realizaron un estudio randomizado comparando QT (mitomicina/fosfamida/cisplatino) seguida de cirugía versus cirugía sola. Se incluyeron 60 pacientes; todos recibieron RT mediastinal luego de la intervención. Un análisis intermedio realizado a los dos años dio por terminado el estudio debido a la mayor supervivencia a favor del tratamiento combinado. La supervivencia a cinco años fue de 17% versus 0%. La mediana del tiempo de supervivencia fue de 22 meses versus 10 meses a favor de la QT. Al realizar un análisis retrospectivo, teniendo en cuenta factores de pronóstico biológicos, se observó un disbalance negativo en la rama con cirugía sola. Por su parte Roth y cols.9, 10 realizaron un estudio randomizado en pacientes en estadio IIIA aleatorizados a QT (cisplatino, ciclofosfamida y VP16) previa a la cirugía o cirugía sola. Los respondedores recibieron tres ciclos más luego de la intervención quirurgica en caso de resección completa y los pacientes con lesión irresecable o resección incompleta podían recibir RT. Se incluyeron 60 pacientes observándose una supervivencia a los tres años de 56% en la rama combinada versus 15% en la de cirugía sola. La mediana del tiempo de supervivencia fue de 64 meses en la rama combinada y 11 meses en la rama control, siendo esta diferencia altamente significativa. No obstante, luego de 82 meses de seguimiento, las medianas del tiempo de supervivencia fueron 21 versus 14 meses, con una diferencia significativa marginal a favor de la QT. Hay evidencias que el 60-75% de los pacientes responderán a estos regímenes de inducción, pero los no respondedores no deberían ser intervenidos quirúrgicamente.
Bueno y cols.11 enfatizaron la importancia de la permanencia de enfermedad residual ganglionar luego la neoadyuvancia en estadio IIIA. En su estudio, los pacientes con prolongada supervivencia fueron estratificados acorde al estado ganglionar posterior a la neoadyuvancia y cirugía. Encontró que un 28% de los pacientes disminuyeron su estadio inicial. Aquellos en quienes se obtuvo una respuesta completa patológica ganglionar (N0) tuvieron una supervivencia del 35.8% a los 5 años. Aquellos pacientes con enfermedad residual ganglionar en el momento de la cirugía obtuvieron una tasa de supervivencia a los 5 años del 9%. Éste y otros estudios sugieren que en aquellos pacientes que presentan ganglios mediastinales positivos luego de la neoadyuvancia no está indicada la resección quirúrgica. Si después de la toracotomía y resección en estadio IIIA se encuentra enfermedad residual ganglionar o la resección del tumor primario fue incompleta, deberá realizarse RT local para mejorar el control local.
Impacto de la neoadyuvancia en la morbilidad y mortalidad posterior a la resección pulmonar:
Varios estudios demuestran que en las intervenciones realizadas por cirujanos de tórax especializados, luego de neoadyuvancia no hay aumento de complicaciones perioperatorias12-16. En estos últimos años varios estudios randomizados han explorado la neoadyuvancia (Southwest Oncology Trial S990017, European Intergroup Trial MRC-LU22-EORTC-08012-NVALT-218 y estudio ChES.Trial de Scagliotti19) sugiriendo resultados a favor de la este abordaje; sin embargo, dichos estudios carecen de peso estadístico para confirmar una diferencia significativa ya que fueron cerrados prematuramente al ser publicados los resultados de los estudios de adyuvancia.
Conclusiones:
- Los datos actuales indican una tendencia a favor de la terapia neoadyuvante, pero hay que tener en cuenta que los estudios individuales no encontraron beneficio estadísticamente significativo
- Las revisiones sistemáticas mostraron una diferencia en supervivencia significativa a favor de la neoadyuvancia. El Hazard Ratio obtenido es similar al obtenido en los metaanálisis de adyuvancia. Pero en los estudios de adyuvancia contamos con mayor número de casos, y los pacientes presentan estadificación patológica, realizada con certeza luego de la cirugía.
- La quimioterapia neoadyuvante resulta en un downstaging clínico en alrededor del 40-60% de los pacientes, con una tasa de respuesta completa patológica entre 5-10%.
- Los pacientes en esquemas de neoadyuvancia tuvieron mejor compliance que los de adyuvancia: más del 90% de ellos completó los ciclos propuestos de quimioterapia a diferencia de los que realizaron adyuvancia que lo hicieron solamente en el 45 a 60% de los casos.
d) Combinacion de las tres modalidades
El tratamiento de QRT de inducción, en particular en los estadios IIIA, aumenta el índice de resecabilidad de estos tumores, pero no está claro cómo puede influir esto en la supervivencia de este grupo de pacientes. El estudio del CALGB observó que el sitio de progresión de la enfermedad más frecuente era a nivel local, lo cual justificaría la asociación de RT a la QT de inducción en este grupo de pacientes20. Varios estudios fase II que utilizaron la asociación de QRT de inducción con dosis de RT entre 40 a 45 Gy mostraron que el 60 a 80% de las lesiones pudieron ser resecadas completamente, con tasas de supervivencia a 3 años del 25% al 30%21-24. El ensayo clínico RTOG 89-01 comparó QT de inducción seguida de cirugía o RT torácica y no mostró diferencias en control de la enfermedad y supervivencia en favor de alguna de las dos modalidades25. El estudio fase III del Intergroup 013926 randomizó 492 pacientes con estadio IIIA-N2 documentado. Se los trató con QRT concurrente (2 ciclos de QT (cisplatino/etopósido) más 45 Gy de RT, seguida de cirugía o el mismo esquema de QRT completando una dosis de 61Gy de RT, y consolidación en las dos ramas con el mismo esquema de QT. No mejoró la SG pero se prolongó la SLP, y se redujo la tasa de recaídas locales.
Las tasas de morbilidad y mortalidad son mayores en las ramas con cirugía. Esto no significa que no sea factible realizar cirugía o que ésta sea inferior a la RT en pacientes EIIIA-N2 irresecables luego de terapia de inducción, dependiendo siempre de subgrupos. En ausencia de más evidencia, cada institución debe evaluar de acuerdo a sus expertos la modalidad que puede resultar mejor para el paciente. El rol de la cirugía en aquellos pacientes con N2 (estadio III A) confirmado por mediastinoscopía no está claro.
e) Tratamiento radiante en estadio locorregional avanzado
Ver Anexo 2: generalidades del tratamiento radiante; técnicas y dosis recomendadas para RT3D e IMRT y; generalidades del tratamiento radiante, indicaciones.
f) Estadio III imprevisto post cirugía
El tratamiento indicado para el Estadio III imprevisto post cirugía es la QT adyuvante (Figura 1).
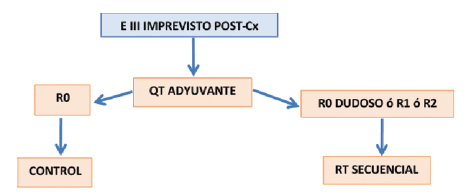
Cuando la evaluación de márgenes arroja R0 no estaría indicada la RT, salvo en casos de dudas y, de indicarse, la RT debe comenzar finalizada la QT adyuvante para poder aplicar dosis plenas. No se aconseja la RQT concomitante adyuvante. El protocolo Lung ART está evaluando este esquema terapéutico adyuvante: cirugía (Cx) + QT adyuvante versus Cx + QT adyuvante + RT 54Gy secuencial.
En caso de márgenes R1 – R2 puede evaluarse la RT secuencial a la QT en adyuvante o incluso la RQT concomitante, pero no hay resultados estadísticos que avalen esta última conducta.
g) Estadio III potencialmente resecable
En tumores estadio III potencialmente resecables el tratamiento estándar es la la RQT concomitante definitiva. En situaciones especiales de tumores muy voluminosos puede indicarse QT de inducción para reducir la masa tumoral y luego realizar la RQT concomitante definitiva, con menos radiotoxicidad al reducir el volumen a irradiar. La RQT concomitante neoadyuvante seguida de cirugía es un tratamiento con resultados aceptables cuando se realiza una lobectomía. Debe evitarse la neumonectomía por aumento de la mortalidad postoperatoria, especialmente si se trata de la neumonectomía derecha7-17. Otra opción es QT neoadyuvante y luego evaluar la cirugía18-24. Los resultados de estas diferentes modalidades de tratamiento tienen similares valores de SLP y SG. El Protocolo SAKK comparó los esquemas QT inducción + Cx versus QT inducción + RT secuencial – 4 semanas – Cx, obteniendo resultados similares en SLP y supervivencia total (ST)25- 27.
En la Figura 2 se describe el abordaje terapéutico del CaP estadio III potencialmente resecable
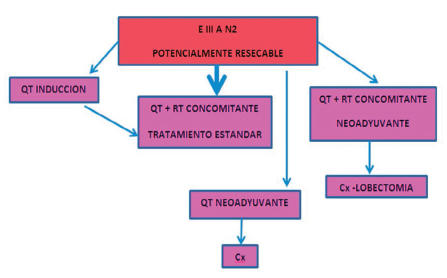
h) Estadio III A-B tumores centrales pasibles de cirugía
h.1 T3 N2 (Estadio III A NO “BULKY”) – T4 N0 -1 (Estadio III A)
Las estrategias terapéuticas son: 1°) RQT Concomitante de inducción – 4 semanas – Cx21; 2°) RQT Concomitante Adaptativa – Boost RQT concomitante definitiva [ESPATUE]9, 27, 28. No hay diferencias entre los anteriores en los valores de SLP y sobrevida total.
h.2 Tumores del vertice pulmonar – Pancoast22, 39
Se describen las siguientes opciones de tratamiento: 1°) RQT Concomitante Neoadyuvante (“Inducción”) - 4 semanas - Cx - QT “Adyuvante” 2 ciclos; 2°) Post Cx - R1-R2: PORT (Radioterapia postoperatoria); 3°) RQT Concomitante Neoadyuvante (“Inducción”) - RQT Concomitante Definitiva.
En pacientes no pasibles de RQT concomitante se sugiere RT inducción - Cx
En pacientes Inoperables y/o Irresecables la recomendación es RQT concomitante definitiva.
En la Figura 3 se describe el abordaje terapéutico del CaP estadio III A-B centrales pasibles de cirugía.
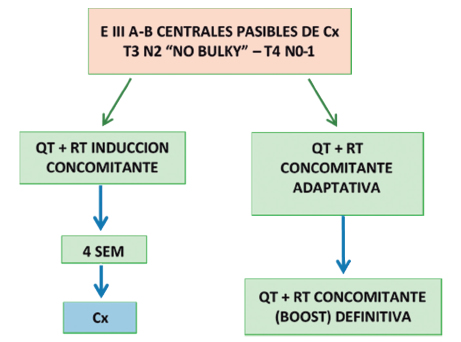
h.3 Estadio III A “Bulky” irresecables - Estadio III B6, 7, 18, 29, 30
El tratamiento de elección es RQT Concomitante Definitiva, es el tratamiento estándar. En pacientes que no toleren el tratamiento de RQT Concomitante puede indicarse QT + RT Secuencial Definitivo, este tratamiento tiene valores de ST inferiores al RQT Concomitante.
Otras opciones son QT Inducción + RT Secuencial Acelerada (INDAR)31-34.
En lesiones T1-3 N3 se recomienda QT + RT Inducción y evaluación en 2 brazos (ESPATUE): Boost RQT adaptativa concomitante definitiva hasta 65-71 Gy. Tambien se contempla la Cx. Se obtuvieron Iguales resultados para SG y SLP9, 27.
En la Figura 4 se describe el abordaje terapéutico del CaP estadio III A “Bulky” irresecable - Estadio III B
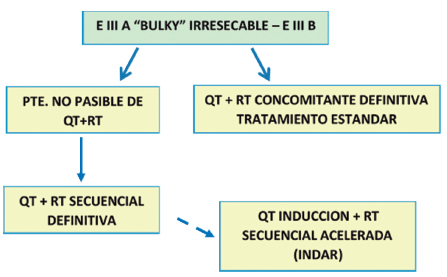
i) Especificaciones de los tratamientos radiantes CaPCNP Estadio III
i.1 Tratamiento RQT concomitante o QT + RT secuencial
Para la RQT Concomitante el fraccionamiento estándar es de 1.8-2Gy x Fx/d; dosis total 60-66Gy en 30-33 días31, 32. Los tratamientos acelerados no son práctica estándar en QT+RT concomitante. Hay que evitar la prolongación del tratamiento más allá de 7 semanas33-35, 36.
El esquema QT + RT Secuencial aplica a pacientes no pasibles del tratamiento QT+RT concomitante. En estos casos, sí puede intentarse un fraccionamiento Acelerado 66Gy en 2.75Gy x Fx/d (24Fx), que tendría mejores valores en OS. De acuerdo al metaanálisis de Oxford sobre 25 trabajos, los pacientes no candidatos a tratamientos sistémicos por edad o bajo PS se benefician con esquemas hiper o hipofraccionados al igual que los esquemas secuenciales31, 35, 37-40.
i.2 RT preoperatoria. Dosis total estándar
En tratamiento concomitante se usan 40-50 Gy -2Gy × Fx. En tratamiento Acelerado se aplican 40 a 45 Gy (1.5 Gy -2 Fx/d) como Definitivo o Secuencial post QT. El uso de mayores dosis en RT Preoperatoria (60-63Gy) no está estandarizado, sólo se utilizaría dentro de protocolos.
i.3 Extensión de la RT mediastinal
No se recomienda la RT Electiva mediastinal en protocolos de RQT Concomitante38. En cambio es conveniente la RT Selectiva de los grupos ganglionares afectados40, 41.
En casos de extensión “Bulky” determinada por PET se podría evaluar la RT Electiva mediastinal. En pacientes con extensión limitada “Light Bulky” conviene evaluar la RT mediastinal Electiva Selectiva (“Selective Elective”) de los grupos ganglionares.
Recomendaciones para el tratamiento del estadio III
Radioterapia
CaPNCP localmente avanzado irresecable; RT parte del tratamiento. GR A
Candidatos a RT torácica definitiva con intento curativo:
– Performance status 0-1-2
– Función pulmonar adecuada
– Enfermedad confinada al tórax
– Excluye derrame pleural maligno
Quimioterapia
QT en asociación con RT torácica definitiva es apropiada en pacientes con CaPCNP localmente avanzado irresecable y buen performance status. GR A
QT asocaiada a RT prolonga la supervivencia sobre la RT aislada. Aapropiada en pacientes con performance status 0-1. GR A.
La QT debe contener platino
Referencias
1. Pignon JP, Tribodet H, Scagliotti GV et al. Lung adjuvant cisplatin evaluation: a pooled analysis by the LACE Collaborative Group. J Clin Oncol. 2008; 26: 3552-3559.
2. Le Péchoux C. Role of postoperative radiotherapy in resected non-small cell lung cancer: a reassessment based on new data. Oncologist. 2011; 16: 672-681.
3. Eberhardt WE, Gauler TC, LePechoux C et al. 10-year long-term survival (LTS) of induction chemotherapy with three cycles cisplatin/paclitaxel followed by concurrent chemoradiation cisplatin/etoposide/45 Gy (1.5 Gy bid) plus surgery in locally advanced non-small-cell lung cancer (NSCLC)-a multicenter phase-II trial (CISTAXOL). Lung Cancer. 2013; 82: 83-89.
4. Albain KS, Crowley JJ, Turrisi AT, III et al. Concurrent cisplatin etoposide, andchest radiotherapy in pathologic stage IIIB non-small cell lung cancer: a Southwest Oncology Group phase II study, SWOG 9019. J Clin Oncol. 2002; 20: 3454-3460.
5. Douillard JY, Rosell R, De Lena M et al. Adjuvant vinorelbine plus cisplatin versus observation in patients with completely resected stage IB-IIIA non-small-cell lung cancer (Adjuvant Navelbine International Trialist Association [ANITA]): a randomised controlled trial. Lancet Oncol. 2006; 7: 719-727.
6. Pisters KM, Evans WK, Azzoli CG et al. Cancer Care Ontario and American Society of Clinical Oncology adjuvant chemotherapy and adjuvant radiation therapy for stages I-IIIA resectable non-small-cell lung cancer guideline. J Clin Oncol. 2007; 25: 5506-5518.
7. Curran WJ, Jr, Paulus R, Langer CJ et al. Sequential versus. concurrent chemoradiation for stage III non-small cell lung cancer: randomized phase III trial RTOG 9410. J Natl Cancer Inst .2011; 103: 1452-1460.
8. Eberhardt W, Wilke H, Stamatis G et al. Preoperative chemotherapy followed by concurrent chemoradiation therapy based on hyperfractionated accelerated radiotherapy and definitive surgery in locally advanced non-small-cell lung cancer: mature results of a phase II trial. J Clin Oncol. 1998; 16: 622-634.
9. Keller SM, Adak S, Wagner H et al. A randomized trial of postoperative adjuvant therapy in patients with completely resected stage II or IIIA non-small-cell lung cancer. Eastern Cooperative Oncology Group. N Engl J Med. 2000; 343: 1217-1222.
10. Albain KS, Swann RS, Rusch VW et al. Radiotherapy plus chemotherapy with or without surgical resection for stage III non-small-cell lung cancer: a phase III randomised controlled trial. Lancet. 2009; 374: 379-386.
11. Stamatis G, Eberhardt W, Stüben G et al. Preoperative chemoradiotherapy and surgery for selected non-small-cell lung cancer IIIB subgroups: long-term results. Ann Thorac Surg. 1999; 68: 1144-1149.
12. Stupp R, Mayer M, Kann R et al. Neoadjuvant chemotherapy and radiotherapy followed by surgery in selected patients with stage IIIB non-small-cell lung cancer: a multicentre phase II trial. Lancet Oncol. 2009; 10: 785-793.
13. Friedel G, Budach W, Dippon J et al. Phase II trial of a trimodality regimen for stage III non-small-cell lung cancer using chemotherapy as induction treatment with concurrent hyperfractionated chemoradiation with carboplatin and paclitaxel followed by subsequent resection: a single-center study. J Clin Oncol. 2010; 28: 942-948.
14. Kim AW, Liptay MJ, Bonomi P et al. Neoadjuvant chemoradiation for clinically advanced non-small cell lung cancer: an analysis of 233 patients. Ann Thorac Surg. 2011; 92: 233-241; discussion: 241-243.
15. Seder CW, Allen MS, Cassivi SD et al. Stage IIIA non-small cell lung cancer: morbidity and mortality of three distinct multimodality regimens. Ann Thorac Surg. 2013; 95: 1708-1716.
16. Thomas M, Rube C, Hoffknecht P et al. Effect of preoperative chemoradiation in addition to preoperative chemotherapy: a randomized trial in stage III non-small cell lung cancer. Lancet Oncol. 2008; 9: 636-648.
17. Katakami N, Tada H, Mitsudomi T et al. A phase 3 study of induction treatment with concurrent chemoradiotherapy versus chemotherapy before surgery in patients with pathologically confirmed N2 stage IIIA nonsmall cell lung cancer (WJTOG9903). Cancer. 2012; 118: 6126-6135.
18. Van Meerbeeck JP, Kramer GW, Van Schil PE et al. Randomized controlled trial of resection versus radiotherapy after induction chemotherapy in stage IIIA-N2 non-small-cell lung cancer. J Natl Cancer Inst. 2007 ;99: 442-450.
19. Roth JA, Fossella F, Komaki R et al. A randomized trial comparing perioperative chemotherapy and surgery with surgery alone in resectable stage IIIA non-smallcell lung cancer. J Natl Cancer Inst. 1994; 86: 673-680.
20. Rosell R, Gómez-Codina J, Camps C et al. A randomized trial comparing preoperative chemotherapy plus surgery with surgery alone in patients with nonsmall-cell lung cancer. N Engl J Med. 1994; 330: 153-158.
21. Roth JA, Atkinson EN, Fossella F et al. Long-term follow-up of patients enrolled in a randomized trial comparing perioperative chemotherapy and surgery with surgery alone in resectable stage IIIA non-small-cell lung cancer. Lung Cancer. 1998; 21: 1-6.
22. Rosell R, Gómez-Codina J, Camps C et al. Preresectional chemotherapy in stage IIIA non-small-cell lung cancer: a 7-year assessment of a randomized controlled trial. Lung Cancer. 1999; 26: 7-14.
23. Scagliotti GV, Pastorino U, Vansteenkiste JF et al. Randomized phase III study of surgery alone or surgery plus preoperative cisplatin and gemcitabine in stages IB to IIIA non-small-cell lung cancer. J Clin Oncol. 2012; 30: 172-178.
24. Lorent N, De Leyn P, Lievens Y et al. Long-term survival of surgically staged IIIAN2 non-small-cell lung cancer treated with surgical combined modality approach: analysis of a 7-year prospective experience. Ann Oncol. 2004; 15: 1645-1653.
25. Pless M, Stupp R, RIs H-B. Neoadjuvant chemotherapy with or without preoperative irradiation in stage IIIA/N2 non-small cell lung cancer (NSCLC): a Annals of Oncology randomized phase III trial by the Swiss Group for Clinical Cancer Research (SAKK trial 16/00). J Clin Oncol. 2013; 31(suppl): abstr 7503.
26. Pless M, Stupp R, Ris H et al. Final results of the SAKK 16/00 trial: a randomized phase III trial comparing neoadjuvant chemoradiation to chemotherapy alone in stage IIIA/N2 non-small cell lung cancer (NSCLC). Ann Oncol 2014; 25(suppl. 4): iv417.
27. Eberhardt W, Gauler T, Pöttgen C et al. Phase III study of surgery versus definitive concurrent hemoradiotherapy boost in patients with operable (OP+) stage IIIA (N2)/selected IIIb non-small cell lung cancer (NSCLC) following induction chemotherapy and concurrent CRTx (ESPATUE). J Clin Oncol. 2014; 32(5ssuppl): abstr 7510.
28. Robinson LA, Ruckdeschel JC, Wagner H, Jr et al. Treatment of non-small cell lung cancer-stage IIIA: ACCAP evidence-based clinical practice guidelines (2nd edition). CHEST. 2007; 132(Suppl 3): 243S-265S.
29. Furuse K, Fukuoka M, Kawahara M et al. Phase III study of concurrent versus sequential thoracic radiotherapy in combination with mitomycin, vindesine, and cisplatin in unresectable stage III non-small-cell lung cancer. J Clin Oncol. 1999; 17: 2692-2699.
30. Rami-Porta R, Wittekind C, Goldstraw P, International Association for the Study of Lung Cancer (IASLC) Staging Committee. Complete resection in lung cancer surgery: proposed definition. Lung Cancer. 2005; 49: 25-33.
31. Reymen B, van Baardwijk A, Wanders R et al. Long-term survival of stage T4N0-1 and single station IIIA-N2 NSCLC patients treated with definitive chemoradiotherapy using individualised isotoxic accelerated radiotherapy (INDAR). Radiother Oncol. 2014; 110: 482-487.
32. Salama JK, Vokes EE. New radiotherapy and chemoradiotherapy approaches for non-small-cell lung cancer. J Clin Oncol. 2013; 31: 1029-1038.
33. Mauguen A, Le Péchoux C, Saunders MI et al. Hyperfractionated or accelerated radiotherapy in lung cancer: an individual patient data meta-analysis. J Clin Oncol 2012; 30: 2788-2797.
34. Saunders M, Dische S, Barrett A et al. Continuous hyperfractionated accelerated radiotherapy (CHART) versus conventional radiotherapy in non-small-cell lung cancer: a randomised multicentre trial. CHART Steering Committee. Lancet. 1997; 350: 161-165.
35. Fournel P, Robinet G, Thomas P et al. Randomized phase III trial of sequential chemoradiotherapy compared with concurrent chemoradiotherapy in locally advanced non-small-cell lung cancer: Groupe Lyon-Saint-Etienne d’Oncologie Thoracique- Groupe Français de Pneumo-Cancérologie NPC 95-01 study. J Clin Oncol. 2005; 23: 5910-5917.
36. O’Rourke N, Roqué I Figuls M, Farré Barnabo N, Macbeth F. Concurrent chemoradiotherapy in non-small cell lung cancer. Cochrane Database Syst Rev. 2010; 6: CD002140
37. Zatloukal P, Petruzelka L, Zemanova M et al. Concurrent versus sequential chemoradiotherapy with cisplatin and vinorelbine in locally advanced non-small cell lung cancer: a randomized study. Lung Cancer. 2004; 46: 87-98.
38. Belderbos JS, Kepka L, Spring Kong FM et al. Report from the International Atomic Energy Agency (IAEA) consultants’ meeting on elective nodal irradiation in lung cancer: non-small-cell lung cancer (NSCLC). Int J Radiat Oncol Biol Phys. 2008; 72: 335-342.
39. Rusch VW, Giroux DJ, Kraut MJ et al. Induction chemoradiation and surgical resection for superior sulcus non-small-cell lung carcinomas: long-term results of Southwest Oncology Group Trial 9416 (Intergroup Trial 0160). J Clin Oncol. 2007; 25: 313-318.
40. Ramroth J, et al. University of Oxford. Dose and Fractionation in Radiation Therapy of Curative Intent for NSCLC: Meta- Analysis of Randomized Trials. IJROBP. 2016; 96 (4): 736-747
41. Evans W.K. et al. Cost of combined modality interventions for stage III NSCLC. JCO. 1997; 15: 3038-3048.
j) Quimioterapia adyuvante
Existe un grupo de pacientes que aún con CaPCNP completamente resecado presenta recaída de la enfermedad a distancia. Desde los años ‘70 se realizaron estudios con QT postoperatoria con el intento de mejorar la supervivencia libre de enfermedad1.
El Grupo cooperativo de CAPCNP presentó un metaanálisis sobre 52 estudios2 randomizados. En cinco de estos ensayos clínicos en que se usó QT con alquilantes, el riesgo relativo (RR) de muertes fue superior en el grupo al que se agregó QT en comparación con el de cirugía solamente. En los grupos que utilizaron cisplatino (8 estudios) hubo una reducción del riesgo de muerte del 13% (p = 0.08), lo que significa una ganancia en la supervivencia a 2 años del 3% y del 5% a 5 años con 95% IC entre 1% de detrimento y 10% de beneficio. Por su parte el grupo de Feld y cols. examinó pacientes con CaP postoperatorio y no demostró diferencias en tiempo transcurrido hasta las recurrencias ni en supervivencia3.
Niiranen y cols4 efectuaron un estudio randomizado en pacientes con tumores T1-T3 N0 que consistió en seis ciclos de un esquema CAP (cisplatino, adrimicina, ciclofosfamida) versus controles. El período de seguimiento se extendió a 10 años. Se evidenció una supervivencia mayor en los pacientes tratados con QT (61% versus 48%, p = 0.05); asi como un mayor tiempo libre de recaída 69% versus 48% (p = 0.01). Este estudio fue criticado por tener un disbalance entre las dos ramas en el número de neumonectomías. En tanto el ensayo clínico ALPI5 evaluó en forma prospectiva un esquema de MVP (mitomicina, vindesina, cisplatino) con 3 ciclos de QT postoperatoria. Con 1209 pacientes evaluados con estadios I-IIIA, no se observaron diferencias significativas en la SLP y SG. El Grupo Cooperativo del Este (ECOG 3590)6 analizó en 488 pacientes con estadio II y IIIA el posible beneficio de 4 ciclos de cisplatino/ etopósido versus control. No observaron beneficios en la supervivencia libre de enfermedad y SG entre los dos grupos de pacientes.
El estudio IALT7 presentó los resultados de un estudio con 1867 pacientes (estadio I: 36%, II: 25%, III: 39%) que evaluó el rol de la QT postoperatoria. Al no haber consenso sobre una combinación específica de drogas, cada centro decidió el tratamiento adyuvante (QT y RT) a utilizar. El estudio no fue patrocinado por la industria farmacéutica. Luego de la cirugía con intención curativa, los pacientes se randomizaron a QT posoperatoria 3-4 ciclos u observación. Los esquemas de tratamiento incluyeron cisplatino + etopósido (56%), cisplatino/ vinorelbine (23%), cisplatino vinblastina o vindesina. Con una mediana de seguimiento de 60 meses se obtuvo un 5% de beneficio absoluto en supervivencia libre de enfermedad y 4.1% de beneficio absoluto en supervivencia en favor de la quimioterapia adyuvante. En Mayo de 2008 Le Chevalier8, publicó una actualización de los datos del estudio IALT con un seguimiento de 7.5 años, en el cual se perdió significación estadística (HR = 0.9; p = 0.10).
En el 2005, el NCI-Canadá publica el JBR.109, estudio que randomizó 480 pacientes con estadio IB y II (45% Estadio II) a 4 ciclos de vinorelbine + cisplatino, demostrando un importante beneficio en supervivencia a 5 años (69% versus 54%; HR = 0.7; p = 0.009). Una actualización de datos realizada en el 200910 con un seguimiento superior a 9 años revalidó el beneficio en supervivencia de 94 versus 72 meses para la rama tratada (p = 0.04) principalmente en aquellos pacientes con N positivos y tumores > 4 cm.
Otro estudio publicado por Duilliard (ANITA trial)11 demostró beneficio en SG de 65.7% versus 43.7% (HR= 0.80 (0.66-0.96); p = 0.017) para un grupo de 840 pacientes intervenidos quirúrgicamente (Estadío I 36%, II 34%, III 39%) tratados con vinorelbine + cisplatino x 4 versus observación, respectivamente, con un seguimiento > 70 meses.
En el año 2008 Pignon JP y cols. publicaron el metaanálisis LACE12 que analizó 5 ensayos clínicos randomizados con un total de 4584 pacientes y un seguimiento promedio de 5.1 años. Se observó un beneficio absoluto del 5% a los 5 años. Al analizar los resultados en subgrupos según el estadio, se demostró beneficio claro en los estadios II y III, no así en los estadios IB y IA, con resultados detrimentales para este último.
Recomendaciones de quimioterapia Adyuvante
- Estadio I A, I B < 4 cm: sin evidencias de beneficio
- Estadio IB > 4 cm: considerar QT Adyuvante según el análisis retrospectivo de subgrupos JBR.109, CALGB 963313
- Estadio II y III de CaPCNP: se recomienda QT Adyuvante (nivel de evidencia A) los regímenes con los cuales ha sido publicada la evidencia se basan en platino con el agregado de vinorelbine, etopósido y vinblastina. No hay evidencia publicada para otros regímenes basados en platino.
Referencias
1. Shields TW, Humphrey EW, Eastridge CE, Keehn RJ. Adjuvant cancer chemotherapy after resection of carcinoma of the lung. Cancer. 1977; 40(5): 2057-2062.
2. Chemotherapy in non-small cell lung cancer: a meta-analysis using updated data on individual patients from 52 randomised clinical trials. Non-small Cell Lung Cancer Collaborative Group. BMJ. 1995; 311(7010): 899-909.
3. Feld R, Rubinstein L, Thomas PA. Adjuvant chemotherapy with cyclophosphamide, doxorubicin, and cisplatin in patients with completely resected stage I non-small-cell lung cancer. The Lung Cancer Study Group. J Natl Cancer Inst 1993; 85(4): 299-306.
4. Niiranen A, Niitamo-Korhonen S, Kouri M, Assendelft A, Mattson K, Pyrhönen S. Adjuvant chemotherapy after radical surgery for non-small-cell lung cancer: a randomized study. J Clin Oncol. 1992; 10(12): 1927-1932.
5. Scagliotti GV, Fossati R, Torri V. Randomized Study of Adjuvant Chemotherapy for Completely Resected Stage I, II, or IIIA Non–Small-Cell Lung Cancer. JNCI: Journal of the National Cancer Institute. 2003; 95(19): 1453-1456.
6. Wakelee HA, Stephenson P, Keller SM. Post-operative radiotherapy (PORT) or chemoradiotherapy (CPORT) following resection of stages II and IIIA non-small cell lung cancer (NSCLC) does not increase the expected risk of death from intercurrent disease (DID) in Eastern Cooperative Oncology Group (ECOG) trial E3590. Lung Cancer. 2005; 48(3): 389-97.
7. Cisplatin-Based Adjuvant Chemotherapy in Patients with Completely Resected Non-Small-Cell Lung Cancer. New Engl J Med. 2004; 350(4): 351-60.
8. Le Chevalier T, Dunant A, Arriagada R, et al. Long-term results of the International Adjuvant Lung Cancer Trial (IALT) evaluating adjuvant cisplatin-based chemotherapy in resected non-small cell lung cancer (NSCLC). ascopubs.org/doi/abs/10.1200/jco.2008.26.15 suppl.7507.
9. Winton T, Livingston R, Johnson D et al. Vinorelbine plus Cisplatin vs. Observation in Resected Non-Small-Cell Lung Cancer. NEJM. 2005; 352(25): 2589-2597.
10. Butts CA, Ding K, Seymour L. Randomized phase III trial of vinorelbine plus cisplatin compared with observation in completely resected stage IB and II non-small-cell lung cancer: updated survival analysis of JBR-10. J Clin Oncol. 2010; 28(1): 29-34.
11. Douillard JY, Rosell R, De Lena M et al. Adjuvant vinorelbine plus cisplatin versus observation in patients with completely resected stage IB-IIIA non-small-cell lung cancer (Adjuvant Navelbine International Trialist Association [ANITA]): a randomised controlled trial. Lancet Oncol. 2006; 7(9): 719-27.
12. Pignon JP, Tribodet H, Scagliotti GV et al. Lung adjuvant cisplatin evaluation: a pooled analysis by the LACE Collaborative Group. J Clin Oncol. 2008; 26(21): 3552-3559.
13. Strauss GM, Herndon JE, Maddaus MA et al. Adjuvant paclitaxel plus carboplatin compared with observation in stage IB non-small-cell lung cancer: CALGB 9633 with the Cancer and Leukemia Group B, Radiation Therapy Oncology Group, and North Central Cancer Treatment Group Study Groups. J Clin Oncol. 2008; 26(31): 5043-5051.
Para decidir el tratamiento de los pacientes portadores de CaPNPC en estadio avanzado es importante conocer, además del performance estatus valorado en la escala ECOG (PS ECOG) y comorbilidades, la estirpe histológica, si presenta o no mutación de EGFR y/o translocación ALK, y la presencia o no de expresión de PD-L1.
a) Primera línea de tratamiento
a.1 Pacientes EGFR y ALK negativos - Quimioterapia
El doblete de QT basado en platino es de elección en pacientes estadio IV EGFR y ALK negativos sin comorbilidad importante, con PS0-2 (IA). La literatura demuestra beneficio en la supervivencia y el control de síntomas (23% de reducción de riesgo de muerte, aumento absoluto de 1.5 meses en mediana de supervivencia y mejoría de la calidad de vida versus mejor soporte clínico)1-3. Se ha demostrado el beneficio en supervivencia con esquemas de dos drogas versus monoterapia en un metaanálisis del año 2004; habiéndose observado que agregar una droga al doblete sólo aumenta la toxicidad y no la supervivencia4. Otro dato relevante es que terapias basadas en platino asociado a paclitaxel, docetaxel, gemcitabine muestran resultados similares y no se ha demostrado beneficio de uno sobre otro5. La combinación con vinorelbine también está aprobada y la combinación con pemetrexed está aprobada en No Escamosos. El doblete de platino resulta en una disminución significativa del 22% del riesgo de muerte al año, sobre las combinaciones sin platino (IA)6.
Se ha visto que los tratamientos basados en cisplatino tienen mayor tasa de respuesta que los basados en carboplatino, pero mayor toxicidad. Un meta-análisis mostró una pequeña mejoría en supervivencia con doblete con cisplatino y drogas de tercera generación (IB)7. La combinación de nab-paclitaxel con carboplatino mostró versus carboplatino/paclitaxel mayor tasa de respuesta y menor neurotoxicidad (IB)8, con una mayor SG con nab-paclitaxel en pacientes con carcinoma epidermoide (12.1 versus 11.2 meses). Esta combinación es una opción de tratamiento en pacientes con mayor riesgo de neurotoxicidad, contraindicación a la premedicación del paclitaxel, hipersensibilidad al paclitaxel (IB). Cabe aclarar que la duración del tratamiento de primera línea es de cuatro ciclos, como máximo seis ciclos (IA)9, 10.
Los estudios clínicos no avalan el tratamiento de pacientes con PS ECOG 3-4.
Respecto de las excepciones se señala que los esquemas sin platino son aceptables en pacientes con contraindicaciones a los mismos y que, la monoterapia es una opción aceptable en pacientes con PS ECOG 2.
a.2 Carcinoma Escamoso - Quimioterapia
En pacientes con PS ECOG 0-2 están aprobados como tratamiento de primera línea los dobletes de platino con drogas de tercera generación como gemcitabine, vinorelbine o taxanos. Metaanálisis de estudios evaluando los distintos esquemas de QT no mostraron diferencia2 (IA). No debe indicarse pemetrexed en este tipo de pacientes11.
a.3 Carcinoma de Pulmón No Escamoso - Quimioterapia
Cualquier doblete a base de platino con drogas de tercera generación (gemcitabine, vinorelbine, taxanos) resulta apropiado. En pacientes con CaP No Escamoso el estudio Fase III de Scagliotti12 mostró beneficio de la combinación pemetrexed/cisplatino en supervivencia. significativo versus cisplatino más gemcitabine.
El gemcitabine es mejor en pacientes portadores de CaP escamoso. Un metaanálisis donde se evalúa esta combinación mostró un beneficio significativo en supervivencia versus combinaciones de platino con docetaxel o gemcitabine; siendo la primera combinación que mostró 12 meses de supervivencia mediana (IIA)11, 12.
Pemetrexed está indicado como terapia de primera línea, mantenimiento y segunda línea sólo en pacientes con CaP No Escamoso (IA)13, 14.
El bevacizumab se asoció a incremento significativo de la SG al combinarlo con carboplatino/paclitaxel en dos estudios randomizados, en pacientes con CaP No Escamoso avanzado, con PS ECOG 0 - 1 con criterios estrictos de exclusión; por lo cual es una opción de tratamiento ante la ausencia de contraindicaciones para su uso (IA)15-17. El estudio Fase III comparativo cisplatino/gemcitabine con o sin bevacizumab demostró mejor tasa de respuesta y una ventaja en SLP, sin diferencias significativas en la SG18. Dos metaanálisis evidenciaron beneficios en la respuesta global, SLP y SG al combinar bevacizumab con QT basada en platino versus esta QT sola19, 20.
a.4 Pacientes con performance status ECOG 2
Aún en los pacientes con PS ECOG 2 la QT versus el mejor soporte clínico prolonga la SG y mejora la calidad de vida (IB)21.
Un metaanálisis de Bronte presentado en 2015, evalúa la seguridad del doblete con platino versus monoterapia, reflejando un aumento de la tasa de respuesta global y un incremento de la probabilidad de estar vivo al año del 74%, destacándose que el beneficio se logró a expensas de mayor toxicidad22. Estudios Fase III demostraron la superioridad de la combinación con carboplatino versus monoterapia en pacientes con PS ECOG 2, con un perfil de seguridad aceptable23, 24. Es importante considerar los factores que influyen en el PS (comorbilidad asociada o relacionado con el tumor). Dobletes de platino (preferentemente carboplatino) pueden indicarse en pacientes seleccionados PS ECOG 2 (IIA)23, 25.
Los esquemas de monoterapia (gemcitabine, vinorelbine, docetaxel) también pueden ser una opción en determinados pacientes con PS ECOG 2 (IB)26, 27. En pacientes con PS ECOG 3 o más, sin mutaciones de sensibilidad (EGFR, ALK) no existe evidencia que sustente los beneficios de la quimioterapia (IIB).
a.5 Pacientes EGFR mutados
Gefitinib/Erlotinib no han mostrado beneficio como terapia de primera línea asociados a QT. Existen varios estudios fase II, Fase III y metaanálisis, que demuestran altas tasas de respuesta, prolongación de la SLP y mejoría de la calidad de vida, cuando se comparan Inhibidores de Tirosinquinasa del Factor de Crecimiento Epidérmico (EGFR TKI) como el gefitinib, erlotinib y afatinib como monoterapia, versus doblete de QT como terapia estándar de primera línea, en pacientes con mutaciones de sensibilidad del EGFR, con PS ECOG 0-228-34. Con los EGFR TKI de primera generación, no se ha demostrado beneficio en SG versus QT, pero las supervivencias medianas fueron entre 20 a 30 meses. En seis estudios randomizados Fase III comparativos entre gefitinib o erlotinib y QT, se obtuvieron tasas de respuesta entre 60 a 85% (31 a 47% con QT) y SLP entre 9 a 13 meses (4.6 a 6.3 meses con quimioterapia). En los pacientes con PS 3-4 también están indicadas estas drogas por haber mostrado beneficio (IIA)35. En el análisis combinado de los resultados de los ensayos clínicos LUX-LUNG 3 y 6, en pacientes con mutación de sensibilidad del EGFR, específicamente deleción del exón 19, afatinib mostró un beneficio en SG versus QT estándar (SG 27.3 versus 24.3 meses; HR = 0.81, IC 95%: 0.66-0.99; p = 0.0374) (IIA)36. El estudio Fase IIb LUX-LUNG 7, en pacientes con mutaciones comunes de sensibilidad, compararó en primera línea afatinib versus gefitinib. Afatinib mostró una modesta pero mayor tasa de respuesta global y una SLP estadísticamente significativa pero no clínicamente relevante (11 versus 10.9 meses; HR: IC95% 0.73 (0.57-0.95); p = 0.0165). Por el momento no se dispone de datos de SG y calidad de vida (IIB)37.
Osimertinib es un inhibidor irreversible del EGFR, de tercera generación, activo contra mutaciones de sensibilidad de los exones 19 y 21 y, también, contra mutaciones de resistencia del exón 20. Se realizó un estudio fase I38 en pacientes progresados a inhibidores de EGFR y con una expansión de la cohorte con requerimiento de biopsia al momento de la progresión y evaluación de mutaciones del exón 20. En 127 pacientes con mutaciones del EGFR T790M la tasa de respuestas fue de 66%38. Un estudio Fase 339 randomizado osimartinib versus pemetrexed más platino en pacientes progresados a un inhibidor de EGFR y con mutación EGFR T790M, constató una SLP de 10 versus 4.4 meses, respectivamente (HR 0.30; IC 95 % 0.23-0.42).
Recomendación
Gefitinib, Erlotinib o Afatinib son de elección como tratamiento de primera línea en pacientes con tumores que presentan mutación del EGFR.
a.6 Translocación EML4-ALK
Cerca de un 5% de los pacientes con ADC y CaCG de pulmón, presentan una translocación en el gen de fusión EML4-ALK. Crizotinib es un inhibidor de la tirosina quinasa de ALK y MET, con eficacia en pacientes demostrada en pacientes tratados en primera línea o en otros esquemas, que tuvieran presente el gen de fusión ALK- EML4. El ensayo clínico Profile 100140 incluyó 136 pacientes con gen de fusión ALK, 56% de ellos habían recibido al menos 2 líneas de QT previa. En este estudio se obtuvo 61% de respuestas objetiva. El Profile 100541 incluyó 119 pacientes, todos con al menos un régimen de QT, evidenciándose un 51% de respuestas objetivas. El PROFILE 1007, Fase III, demostró un beneficio superior de crizotinib versus pemetrexed o docetaxel, en segunda línea de tratamiento, en los pacientes ALK positivos. El beneficio se observó en tasa de respuesta global, SLP, mejoría de síntomas y calidad de vida42, 43. El ensayo clínico PROFILE 101444 incluyó pacientes ALK positivos vírgenes de tratamiento a quienes se administró crizotinib o cisplatino/pemetrexed como primera línea, sin mantenimiento de pemetrexed. Se observaron prolongación estadísticamente significativa de la SLP (10.9 versus 7 meses; HR para progresión de enfermedad o muerte del 0.45; IC 95% 0.35-0.60; p < 0.001) y aumento de la tasa de respuesta global (74 versus 45%; p < 0.001); la SG mediana no fue alcanzada por ninguna de las dos ramas.
Recomendación
En portadores de la translocación EML4-ALK, con CaPCNP avanzado, la primera línea de tratamiento recomendada es crizotinib (IA).
Alectinib está aprobado en Japón como primera línea en este tipo de tumores. Dos estudios Fase II demostraron su efectividad en metástasis cerebrales con tasas de respuesta entre el 45 a 50% y SLP de 8,9 meses45, 46. Un ensayo clínico Fase III comparativo alectinib versus crizotinib en primera línea de tratamiento obtuvo un HR para SLP de 0.34 (IC 95% 0.17-0.70, p < 0.0001) a favor del alectinib. La mediana de SLP no fue alcanzada en los pacientes que recibieron alectinib, y fue de 10.2 meses en la rama con crizotinib47.
El certinib también está mostrando buenos resultados en primera línea, y se están desarrollando otros inhibidores ALK. Ceritinib es un inhibidor de ALK que, in vitro, es 20 veces más potente que crizotinib. El estudio ASCEND 148, Fase I, incluyó 255 pacientes ALK positivos; 83/255 no habían recibido terapia previa con un inhibidor de ALK especialmente crizotinib y 163/255 pacientes nunca habían recibido un inhibidor de ALK previamente. La dosis recomendada fue de 750 mg diarios. Los objetivos secundarios fueron tasa de respuesta, duración de la respuesta y SLP y seguridad. Las tasa de respuestas global fue de 72% en pacientes sin tratamiento previo con inhibidores de ALK y de 56% en pacientes que habían recibido anteriormente estos agentes. La mediana de SLP fue de 18,4 meses en el primer grupo y de 6,9 en el segundo. Ceritinib mostró actividad en pacientes con metástasis cerebrales con una tasa de control de enfermedad intracraneal del 79% en pacientes sin tratamiento previo con ALK y 65% en aquellos previamente tratados con inhibidores de ALK. El 97% de los pacientes presentaron un evento adverso relacionado con el tratamiento y 51% calificaron como grado 3-4. Ceritinib está aprobado en pacientes con translocación presente de ALK que ya recibieron un inhibidor de ALK (Crizotinib).
a.7 Inmunoterapia (Anti PD-1)
Entre un 23 y un 30% de los pacientes con CaPCNP avanzado presentan niveles elevados de la expresión de PDL-1 (≥ 50%). Según puede observarse en los estudios Fase I (KEYNOTE 001)49 y Fase III (KEYNOTE-010)50 los pacientes que presentan una expresión de PDL-1 (≥ 50%) en sus tumores, obtienen mejores resultados al ser expuestos a pembrolizumab. El pembrolizumab es un anticuerpo monoclonal anti-PD-1, que impide que éste se una al PD-L1 y PD-L2. En el KEYNOTE-00149 los pacientes vírgenes de tratamiento con expresión PD-L1 ≥ 50% obtuvieron una tasa de respuesta del 58.3%, una mediana de SLP de 12.5 meses y, un 60.6% de los pacientes estaban vivos a los 2 años. El KEYNOTE-02451 incluyó pacientes portadores de CaPCNP, vírgenes de tratamiento, con expresión del PD-L1 ≥ 50%. Se comparó pembrolizumab a 200 mg/día cada 21 días, versus QT de primera línea a elección del investigador. El estudio debió ser suspendido por los resultados favorables del pembrolizumab versus QT, con tasas de respuesta del 45% versus el 28% (6 respuestas completas en el grupo pembrolizumab). Para la SLP se obtuvo un HR de 0.50; para la SG un HR del 0.60. Esta contundente mejoría en SG se observó a pesar que el 50% de los pacientes que habían ingresado a la rama de Qt fueron cruzados a pembrolizumab. Este estudio sustentó la aprobación de pembrolizumab como monodroga para primera línea en este subgrupo de pacientes.
Recomendaciones de tratamieto 1° línea tumores estadio IV
Seleccionar el tratamiento en función de la histología, estudios biomoleculares, comorbilidades, performance status.
El tratamiento estándar es la QT con dos drogas, basada en cisplatino o carboplatino. Las drogas que pueden combinarse con platino son docetaxel, paclitaxel, vinorelbine, pemetrexed y gemcitabine. La duración del tratamiento es de 4 a 6 ciclos. Esquemas sin platino son aceptables en pacientes con contraindicación de uso de platino o casos seleccionados por mal PS.
Pemetrexed asociado a platino es una muy buena elección CaPNPC No Escamoso. Pemetrexed no está indicado en pacientes con Carcinoma Escamoso
Bevacizumab asociado a QT basada en platino se usa en en CaPCNP No escamoso en pacientes con PS ECOG 0-1. Bevacizumab debería usarse hasta la progresión.
Gefinitib/Erlotinib/Afatinib son de elección en pacientes con tumores que presentan mutaciones de sensibilidad del EGFR
Crizotinib es de elección en pacientes con tumores ALK positivo.
Pembrolizumab es de elección en pacientes con PD-L1 positivo ≥ 50%
Referencias
1. Non-Small Cell Lung Cancer Collaborative Group Chemotherapy in Non-Small Cell Lung Cancer: A meta-analysis using updated data on individual patients from 52 randomized trials. BMJ. 1995; 311: 899-909.
2. NSCLC Meta-Analyses Collaborative Group. Chemotherapy in addition to supportive care improves survival in advanced non-small-cell lung cancer: a systematic review and meta-analysis of individual patient data for 16 randomized controlled trials. J Clin Oncol. 2008; 26: 4617-4625.
3. Novello S, Barlesi F, et al. Metastatic non-small cell lung cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and Follow-up. Annals of Oncology. 2016; 2 7(supl 5): v1-v2.
4. Delbaldo C, Michiels S, Syz N et al.Benefits of adding a drug to a single-agent or a 2-agent chemotherapy regimen in advanced non-small-cell lung cancer: a meta-analysis. JAMA. 2004; 292: 470-484.
5. Schiller JH, Harrington D, Belani CP, et al. Comparison of four chemotherapy regimens for advanced non-small cell lung cancer. N Engl J Med. 2002; 346: 92-98.
6. Pujol JL, Barlesi F, Daurès JP, et al. Should chemotherapy combinations for advanced non-small-cell lung cancer be platinum-based? A meta-analysis of phase III randomized trials. Lung cancer. 2006; 51: 335-345.
7. Ardizzoni A, Boni L, Tiseo M, et al. Cisplatin-versus carboplatin-based chemotherapy in first-line treatment of advanced non-small - cell lung cancer; an individual patient data meta-analysis. J Natl Cancer Inst 2007; 99: 847-857.
8. Socinski MA, Bondarenko I, Karaseva NA, et al. Weekly nab-paclitaxel in combination with carboplatin versus solvent-based paclitaxel plus carboplatin as first line therapying patient with advanced non-small cell lung cancer: final result of phase III trial. J Clin Oncol. 2012; 30: 2055-2062.
9. Park JO, Kim SW, Ahn JS, et al. Phase III trial of two versus four additional cycles in patients who are non-progressive after two cycles of platinum based chemotherapy in non-small-cell lung cancer. J Clin Oncol 2007; 25: 5233-5239.
10. Rossi A, Chiodini P, Sun JM, et al. Six versus fewer planned cycles of first-line platinum-based chemotherapy for non-small-cell lung cancer: a systematic review and meta-analysis of individual patient data. Lancet Oncol. 2014; 15: 1254-1262.
11. Scagliotti GV, Parikh P, von Pawel J, et al. Phase III study comparing cisplatin plus gemcitabine with cisplatin plus pemetrexed in chemotherapy-naïve patients with advanced-stage non-small-cell lung cancer. J Clin Oncol. 2008; 26: 3543-3551.
12. Ming L, Qian Z, Zhang J, et al. Pemetrexed plus platinum as the first-line treatment option for advanced non-small cell lung cancer: a meta-analysis of randomized controlled trials. PloS ONE. 2012; 7: e37229.
13. Scagliotti G, Hanna N, Fossella F, et al. The differential efficacy of pemetrexed according to NSCLC histology: a review of two phase III studies. Oncologist. 2009; 14: 253-263.
14. Ciuleanu T, Brodowicz T, Zielinski C, et al. Maintenance pemetrexed plus best supportive care versus placebo plus best supportive care for non-small-cell lung cancer: a randomised, double-blind, phase 3 study. Lancet. 2009; 374: 1432-1440.
15. TE Stinchcombe, MA Socinski. Bevacizumab in the treatment of non-small-cell lung cancer. Oncogene. 2007; 26: 3691–3698.
16. Alan Sandler, Robert Gray, Michael C. Perry et al. Paclitaxel–Carboplatin Alone or with Bevacizumab for Non–Small-Cell Lung Cancer. N Engl J Med. 2006; 355: 2542-50.
17. Sandler A, Yi J, Dahlberg S, Kolb MM, et al.Treatment Outcomes by Tumor Histology in Eastern Cooperative Group Study E4599 of Bevacizumab with Paclitaxel/Carboplatin for Advanced Non-small Cell Lung Cancer. JT O 2010; 5: 9.
18. Reck M, von Pawel J, Zatloukal P, et al. Phase III Trial of cisplatin plus gemcitabine with either placebo or bevacizumab as first line therapy for nonsquamous non-small-cell lung cancer: AVAIL. J Clin Oncol. 2009; 27: 1227-1234.
19. Lima AB, Macedo LT, Sasse AD, et al. Addition of bevacizumab to chemotherapy in advanced non-small cell lung cancer: a systematic review and meta-analysis. PloS ONE. 2011; 6: e22681.
20. Soria JC, Mauguen A, Reck M, et al. Systematic review and meta-analysis of randomised, phase II/III trials adding bevacizumab to platinum-based chemotherapy as first-line treatment in patients with advanced non-small-cell lung cancer. Ann Oncol. 2013; 24: 20-30.
21. Gridelli C, Ardizzoni A, Le Chevalier T, et al.Treatment of advanced non-small-cell lung cancer patients with ECOG performance status 2: results of an European experts panel. Ann Oncol. 2004; 15: 419-426.
22. Bronte G, Rolfo C, Passiglia F, et al. What can platinum offer yet in the treatment of PS2 NSCLC patients? A systematic review and meta-analysis. Crit Rev Oncol Hematol. 2015; 95: 306-317.
23. Quoix E, Zalcman G, Oster JP, et al. Carboplatin and weekly paclitaxel doublet chemotherapy compared with monotherapy in elderly patients with advanced non-small-cell lung cancer: IFCT-0501 randomised, phase 3 trial. Lancet. 2011; 378: 1079- 1088.
24. Lilenbaum R, Villaflor A, et al. Single-agent versus combination chemotherapy in patients with advanced non-small cell lung cancer and a performance status of 2: prognostic factors and treatment selection based on two large randomized clinical trials. J Thorac Oncol. 2009; 4: 869-874.
25. Zukin M, Barrios CH, Pereira JR, et al. Randomized phase III trial of single-agent pemetrexed versus carboplatin and pemetrexed in patients with advanced non-small-cell lung cancer and Eastern Cooperative Oncology Group performance status 2. J Clin Oncol. 2013; 31: 2849-2853.
26. Gridelli C, Perrone F, Gallo C, et al. Chemotherapy for elderly patients with advanced non-small-cell lung cancer: the Multicenter Italian Lung Cancer in the Elderly Study (MILES) phase III randomized trial. J Natl Cancer Inst. 2003; 95: 362-372.
27. Morère JF, Bréchot JM, Westeel V, et al. Randomized phase II trial of gefitinib or gemcitabine or docetaxel chemotherapy in patients with advanced non-small-cell lung cancer and performance status of 2 or 3 ( IFCT-0301 study) Lung cancer. 2010; 70: 301-307.
28. Tony S. Mok, Yi-Long Wu, Sumitra Thongprasert, et al.Gefitinib or Carboplatin-paclitaxel in pulmonary adenocarcinoma. N Engl J Med 2009; 361: 947-57.
29. Makoto Maemondo, Akira Inoue, Kunihiko Kobayashi et al. Gefitinib or Chemotherapy for Non-Small-Cell Lung Cancer with mutated EGFR. N Engl J Med. 2010; 362: 2380-8.
30. Maemondo M, inoue A, Kobayashi K, et al. Gefitinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor (WJTOG3405): an open label, randomised phase 3 trial. Lancet Oncol. 2010; 11: 121-128.
31. Han JY, Park K, Kim SW, et al. First-SIGNAL: first-line single-agent iressa versus gemcitabine and cisplatin trial in never-smokers with adenocarcinoma of the lung. J Clin Oncol. 2012; 30: 1122- 1128.
32. Inoue A, Kobayashi K, et al. Updated overall survival results from a randomized phase III trial comparing gefitinib with carboplatin-paclitaxel for chemo-naïve non-small cell lung cancer with sensitive EGFR gene mutations (NEJ002). Ann Oncol. 2013; 24: 54-59.
33. Zhou C, Wu YL, Chen G, Feng J, et al. Erlotinib versus Chemotherapy as first line treatment in patients with advanced EGFR mutation positive NSCLC. Phase III randomized trial. Lancet Oncology. 2011; 12 (8): 735-42.
34. Rosell R, Carcereny E, Gervais R, et al. Erlotinib versus Chemotherapy in advanced NSCLC patients with EGFR mutations. Interim results of (EURTAC) phase III randomized Trial. Rosell R.ASCO 2011 # 7503.
35. Inoue A, Kobayashi K, Usui K, et al. First-line gefitinib for patients with advanced non-small-cell lung cancer harboring epidermal growth factor receptor mutations without indication for chemotherapy. J Clin Oncol. 2009; 27: 1394-1400.
36. Yang JC, Wu YL, et al. Afatinib versus cisplatin-based chemotherapy for EGFR mutation-positive lung adenocarcinoma (LUX-Lung 3 and LUX-Lung 6): analysis of overall survival data from two randomised, phase 3 trials. Lancet Oncol.2015; 16: 141-151.
37. Park K, Tan EH, O’Byrne K, et al. Afatinib versus gefitinib as first-line treatment of patients with EGFR mutation-positive non-small-cell lung cancer (LUX-Lung 7): a phase 2B, open label, randomised controlled trial. Lancet Oncol. 2016; 17: 577-589.
38. Yang J, Ramalingam SS, Jänne PA et al. Osimertinib (AZD9291) in pre-treated pts with T790M-positive advanced NSCLC: updated Phase 1 (P1) and pooled Phase 2 (P2) results. Journal of Thoracic Oncology. 2016; 11 (Suppl. 4S): S152–S155
39. Tony S. Mok, Yi-Long Wu, Myung-Ju Ahn et al. Osimertinib or Platinum–Pemetrexed in EGFR T790M–Positive Lung Cancer. N Engl J Med. 2017; 376:629-640 DOI: 10.1056/NEJMoa1612674
40. Camidge DR, Bang YJ, Kwak EL et al. Activity and safety of crizotinib in patients with ALK-positive non-small-cell lung cancer: updated results from a phase 1 study. Lancer Oncol. 2012; 13: 1011-1019.
41. Shaw AT, Yeap BY, Solomon BJ et al. Effect of crizotinib on overall survival in patients with advanced non-small-cell lung cancer harbouring ALK gene rearrangement: a retrospective analysis. Lancet Oncol. 2011; 12: 1004-1012.
42. Shaw AT, Kim DW, Nakagawa K et al. Crizotinib versus chemotherapy in advanced ALK-positive lung cancer. N Engl J Med .2013; 368: 2385-2394.
43. Blackhall F, Kim DW, Besse D et al. Patient-reported outcomes and quality of life in PROFILE 1007: a randomized trial of crizotinib compared with chemotherapy in previously treated patients with ALK-positive advanced non-small-cell lung cancer. J Thorac Oncol. 2014; 9: 1625-1633.
44. Solomon BJ, Mok T, Kim DW et al. First-line crizotinib versus chemotherapy in ALK-positive lung cancer. N Engl J Med. 2014; 371: 2167-2177.
45. Alice Tsang Shaw, Solange Peters, Tony Mok et al. ALEX Study. A randomized, phase II study comparing alectinib with crizotinib in treatment-naïve anaplastic lymphoma Kinase-positive advanced non-small cell lung cancer participants. Journal of Clinical Oncology. 2017; 35(18 supp) DOI: 10.1200/JCO.2017.35.18_suppl.LBA9008
46. Katayama R, Lovly CM, Shaw A et al. Therapeutic targeting of anaplastic lymphoma kinase in lung cancer: a paradigm for precision cancer medicine. Clin Cancer Res. 2015; 21: 2227-2235.
47. Peters S, Camidge DR, Shaw AT et al. Alectinib versus Crizotinib in Untreated ALK-Positive Non–Small-Cell Lung Cancer. N Engl J Med 2017; 377:829-838. DOI: 10.1056/NEJMoa1704795
48. Dong-Wan Kim, Ranee Mehra, Daniel Shao-Weng Tan et al. Ceritinib in advanced anaplastic lymphoma kinase (ALK)- rearranged (ALK+) non-small cell lung cancer (NSCLC): Results of the ASCEND-1 trial. Journal of Clinical Oncology. 2014; 32(15): 8003.
49. Edward B. Garon, Naiyer A. Rizvi et al. KEYNOTE-001 Investigators. Pembrolizumab for the treatment of non-small-cell lung cancer. N Engl J Med. 2015; 372(21): 2018-2028.
50. Herbst RS, Baas P, Kim DW et al. Pembrolizumab versus docetaxel for previously treated , PD-L1 positive, advanced non-small-cell lung cancer (KEYNOTE-010) a randomized controlled trial. Lancet. 2015; 0140-6736(15): 1281-7.
51. Reck M, Rodríguez-Abreu D, Robinson AG et al. Pembrolizumab versus chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer. (KEYNOTE-024). N Engl J Med. 2016; 375(19): 1824-1833.
b) Terapia de mantenimiento
La terapia de mantenimiento se define como la prolongación del tratamiento anti tumoral más allá de 4 a 6 ciclos. Las directrices de la Asociación Americana de Oncología Clínica 2009 (American Society of Clinical Oncology-ASCO) no recomiendan el uso de QT más allá de 4 ciclos1 (Tabla 1).

b.1 Número predefinido de ciclos de QT más allá de los 4 iniciales
Cuatro ensayos clínicos randomizados han comparado un número determinado de ciclos de QT (3 o 4) versus más ciclos de QT. Ninguno mostró beneficio estadístico a favor de continuar con más ciclos de QT2- 5.
Recomendación
No hay datos que avalen prolongar las drogas de QT de primera línea más allá de 4 o 6 ciclos de quimioterapia.
b.2 Continuar únicamente con el componente no platino
Distintos estudios han comparado continuar con el componente no platino hasta la aparición de toxicidad o progresión luego de un número predefinido de ciclos.
Brodowicz y cols.6 compararon gemcitabine más cisplatino x 4 ciclos, luego de los cuales los pacientes (n = 354) se randomizaron a mantenimiento con gemcitabine versus soporte. La SG fue de 13 meses para la rama experimental versus 11 meses para los controles (p < 0.001). El ensayo clínico de Belani y cols.7 incluyó pacientes con estadios III-IV que realizaron 4 ciclos de QT con gemcitabine/cisplatino y continuaron aleatoriamente con gemcitabine o cuidados de soporte. El criterio primario de valoración fue la SG. El estudio fue negativo con una HR de 0,97 (95% IC 0.72-1.30).
Recomendación
La evidencia a favor de continuar con terapia de mantenimiento con el componente no platino es pobre. No se recomienda continuar con el agente no platino luego de 4 o 6 ciclos de quimioterapia.
b.3 Cambiar a un agente quimioterápico distinto
Estudios realizados en pacientes con CaPCNP en estadios IIIB/IV compararon iniciar un nuevo agente quimioterápico luego de un número determinado de ciclos de QT. Fidias y cols.8 examinaron pacientes que habían recibido cuatro ciclos de QT con gemcitabine/carboplatino y fueron luego asignados aleatoriamente a docetaxel en dos modalidades: 1°) al finalizar la QT de primera línea (temprano), 2°) al momento de detectarse la recidiva (tardío). De los pacientes randomizados a docetaxel temprano el 94.8% recibió al menos un ciclo de QT mientras que en el grupo docetaxel tardío sólo el 62,8% recibieron al menos un ciclo de docetaxel. La SLP fue significativamente mejor con terapia temprana (p = 0.0001) asi como la SG aunque la diferencia no resultó estadísticamente significativa (p = 0,08). En un análisis post hoc se compararon los resultados entre ambos grupos (temprano versus tardío) no encontrándose ninguna diferencia cuando, finalmente, hubiera recibido el fármaco (mediana del tiempo de supervivencia de 12.5 meses en ambas ramas). En el estudio JMEN9 pacientes con diagnóstico de CaPCNP estadios IIIB/ IV realizaron 4 ciclos con alguno de tres regímenes de QT basada en platino (sin incluir pemetrexed). Aquellos que no progresaron luego de 4 ciclos de QT se randomizaron en proporción 2:1 a pemetrexed o placebo cada 21 días. El criterio primario de valoración fue la SLP. Participaron 660 pacientes y se realizó un análisis pre-especificado por histología. El resultado fue positivo con un ventaja significativa para el agente activo en todos los pacientes (HR 0.6; p= 0.00001); y HR 0.47 (p = 0.00001) para el grupo de histología No escamosa. También hubo un beneficio en la SG para toda la población. Los pacientes con histología No escamosa tuvieron una ventaja en supervivencia de 5,2 meses (15.5 versus 10,3 meses). La toxicidad fue mayor con pemetrexed con efectos adversos grado 3 o más en un 16% versus 1% en la rama placebo. En relación a la calidad de vida hubo un significativo retraso en la aparición de dolor y hemoptisis en los tratados con pemetrexed. Para destacar, sólo el 19% de los pacientes recibieron pemetrexed posteriormente en la rama placebo por lo que en este estudio no se puede concluir que la terapia temprana es mejor que la terapia administrada como segunda línea a la recidiva, ya que la mayoría de los pacientes nunca recibieron el tratamiento a la recidiva. El estudio Paramount comparó mantenimiento versus placebo luego de una primera línea con pemetrexed/cisplatino. La SLP fue de 3.9 meses para pemetrexed versus 2.6 para placebo (HR 0.64 (0.51-0.81); p = 0.0002). Los datos de supervivencia no fueron presentados aún10.
b.4 Agentes contra blancos moleculares
Tanto bevacizumab11, 12 como cetuximab13 se han utilizado en primera línea asociados a QT con un número fijo de ciclos, pero los anticuerpos monoclonales (bevacizumab o cetuximab) se continuaron hasta la progresión (mantenimiento). No existen estudios comparando esta estrategia versus suspender el agente biológico al finalizar la QT por lo que en caso de usar alguno de ellos debería éste continuarse hasta progresión o toxicidad.
En el estudio SATURN14 se incluyeron 1949 pacientes tratados inicialmente con 4 ciclos de QT basada en platino. Aquellos que no evidenciaron progresión (n= 889) se randomizaron en proporcón 1:1 a erlotinib o placebo. El objetivo primario fue la SLP. El estudio fue positivo con una diferencia significativa a favor erlotinib (HR 0.71; p < 0.0001); obteniéndose también beneficios en la SG (HR 0.81; p = 0.0088). El mayor beneficio a favor de erlotinib se observó en pacientes con mutación de los exones 19 y 21 del gen del EGFR (HR 0.10; p < 0.0001). También se evidenció beneficio en la SG en toda la población (intención de tratar) a favor de erlotinib (mediana del tiempo de SG: 12 versus 11 meses; HR 0.81; IC 95% 0.70-0.95) y, en la población con tumores con inmunohistoquímica positiva para EGFR (HR 0.77; IC 95% 0.64-0.93; p= 0.006). En cambio no hubo diferencia en supervivencia con erlotinib versus placebo en la población con tumores con mutación del EGFR, probablemente asociada a que un 67% recibió TKI post estudio y no se había alcanzado la mediana de SG al momento de la publicación. Los pacientes con enfermedad estable luego de una primera línea de QT se beneficiaron en mayor grado: la mediana del tiempo de SG fue 11,9 meses para erlotinib versus 9,6 meses en la rama placebo (HR 0.72; IC 95% 0.59-0.89). Aquellos que presentaron respuesta parcial con la primera línea fueron los que recibieron mantenimiento con erlotinib (mediana del tiempo de SG: 12,5 versus 12 meses en la rama placebo; HR 0.94; IC 0.74-1.20; p= 0.618). La toxicidad fue mayor con erlotinib; con un porcentaje de pacientes con al menos un evento Grado 3 o mayor del 12% versus 1% para el placebo. No hubo diferencias en calidad de vida entre erlotinib y placebo (HR 0,96; IC 95% 0,79-1,16) relacionadas con el tiempo transcurrido hasta el deterioro. Al igual que en el estudio de mantenimiento con pemetrexed sólo el 21% de los pacientes en la rama placebo recibieron ITK luego de la progresión por lo que este trabajo no aclara si el tratamiento temprano con erlotinib resultó mejor que el tratamiento a la recidiva. Erlotinib fue analizado también como terapia de mantenimiento en el estudio ATLAS15 en el cual, luego de un tratamiento de primera línea con paclitaxel/carboplatino + bevacizumab, los pacientes se randomizaron a bevacizumab/placebo (rama control) versus bevacizumab/erlotinib (rama experimental). Participaron 743 pacientes estables o en respuesta luego de la inducción. La SLP fue estadísticamente significativa (HR 0,72; p = 0.001) pero la magnitud no fue clínicamente relevante (1 mes). La mediana de SG fue de 14,4 meses con bevacizumab/erlotinib versus 13.3 meses con bevacizumab/placebo (p = no significativa).
Recomendaciones: agentes contra blancos moleculares EGFR TKI
- Pemetrexed está aprobado por la Food and Drug Administration (FDA) y la Agencia Europea de Medicamentos (EMEA) para su uso en CaPCNP con histología no escamosa como terapia de mantenimiento.
- Erlotinib está aprobado por la FDA y la EMEA para su uso en CaPCNP como terapia de mantenimiento.
- Si bien erlotinib o pemetrexed15 como terapia de mantenimiento luego de una primera línea de tratamiento prolongan la supervivencia no hay estudios que comparen alguna de las dos drogas en mantenimiento al finalizar la primera línea versus controles y tratamiento cuando sea detectada la progresión.
- La terapia de mantenimiento es una opción en pacientes que no han progresado luego de una primera línea con platino aunque no puede considerarse un tratamiento estándar.
- Otra opción luego de una primera línea de quimioterapia es el seguimiento cercano y el tratamiento a la progresión.
- Pemetrexed sólo está indicado en tumores no escamosos.
- Erlotinib mostró beneficio, independientemente de la expresión del EGFR y el estado de las mutaciones, aunque el mayor beneficio se observó en pacientes con tumores con mutaciones del gen de EGFR.
Referencias
1. Azzoli C, Barker S, Temmin S. American Society of Cancer Oncology clinical practical guidelines update on chemotherapy on stage IV non-small cell lung cancer. J Cin Oncol. 2009; 27(36): 6251-66.
2. Socinski M, Schell MJ, Peterman A et al. Phase III trial comparing a defined duration of therapy versus continuous therapy followed by second –line therapy in advanced-stage IIIB/IV non-small cell lung cancer. JCO. 2002; 20: 1335-1343.
3. Smith IE, O ´Brien ME, Talbot DC. Duration of chemotherapy in advanced non-small cell lung cancer: a randomized trial of three versus six courses of mitomycin, vinblastine, and cisplatin. JCO. 2001; 19: 1336-1343.
4. von Plessen C Bergman B Andressen O et al. Palliative chemotherapy beyond three courses conveys no survivl or consistent quality of life benefits in advanced non small cell lung cancer. Br J Cancer. 2006; 95: 966-973.
5. Park JO, Kim SW, Ahn JS et al. Phase III trial of two versus additional cycles in patients who are non progressive after two cycles of platinum-based chemotherapy in non small cell lung cancer. JCO. 2007; 25: 5233-5239.
6. Brodowicz T, Krakowski M Zwitter M et al. Cisplatin and gemcitabine first line chemotherapy followed by manteinance gemcitabine or best supportive care in advanced non small cell lung cancer: a phase III trial. Lung Cance. 2006; 52: 155-163.
7. Belani CAP; Waterhouse DM, Ghazal H et al. Phase III study of manteinance gemcitabine and best supportive care versus best supportive care following standard combination therapy with Gemcitabine- Carboplatin for patients with non small cell lung cancer. ASCO 2010; abstract 7506.
8. Fidias PM, Dakhil SR, Lyss AP et al. Phase III study of immediate compared with delayed docetaxel after front line therapy with gemcitabine plus carboplatin in advanced non small cell lung cancer. JCO. 2009; 27: 591-598.
9. Ciuleanu T, Brodowicz T, Zielinski C et al. Manteinance pemetrexed plus best supportive care versus placebo plus best supportive care for non small cell lung cancer: a randomized double blind phase 3 study. Lancet. 2009; 374(9699): 1432-1440.
10. Paz Ares L. Phase III Study of Manteinance Pemetrexed plus Best Supportive Care Versus Placebo plus Best Supportive Care Immediately Following Induction Therapy with Pemetrexed plus Cisplatin for advanced NSCLC. WCLC (2011) O 01.05. Lancet Oncol. 2012; 13(3):247-55
11. Sandler A, Gray R, Perry M et al. Paclitaxel-carboplatin alone or with bevacizumab for non small cell lung cancer. NEJM. 2006;355: 2542- 2550.
12. Reck M; von Pawel J; Zatloukal P et al. Phase III trial of csiplatin-gemcitabine with wither placebo or bevacizumab as first line therapy for nonsquamous non small cell lung cancer. JCO. 2009; 27: 1227 -1234.
13. Pirker R, Pereira JR, Szczesna A et al. Cetuximab plus chemotherapy in patients with advanced non small cell lung cancer (FLEX) an open label randomized phase III trial. Lancet. 2009; 373: 1525-1531.
14. CaPuzzo F, Ciuleanu T, Stelmakh L et al. SATURN: a double- blind, randomized, Phase III study of manteinance erlotinib versus placebo following nonprogression with first line platinum- based chemotherapy in patients with advanced NSCLC. The Lancet Oncology. 2010; 11(6): 521-529.
15. Miller VA, O´Connor P, Soh C et al. A randomized, double blind, placebo controlled, phase IIIb trial (ATLAS) comparing bevacizumab therapy with or without erlotinib after completion of chemotherapy with bevacizumab for first line treatment of locally advanced recurrent or metastatic non small cell lung cancer. J Clin Oncol. 2009; 27(suppl): 18s. abstr. LBA 8002. 67.
c) Segunda línea de tratamiento
c.1 Inmunoterapia
Se considera a los Inhibidores checkpoint como terapia de elección en segunda línea por mejorar la SG, la duración de respuesta y mostrar mejor tolerancia comparados con los citotóxicos.
Nivolumab es un Anti-PD1, aprobado por la FDA en Octubre de 2015, para pacientes con CaPCNP No escamoso progresados a una primera línea de QT basada en platino, en base a los resultados del estudio CheckMate-0571. El CheckMate-0571, fase III, randomizó 582 pacientes con CaPCNP No escamoso a nivolumab 3 mg/kg cada dos semanas versus docetaxel 75 mg/m2 cada 21dias. La mediana de supervivencia fue superior con nivolumab (12.2 versus 9.4 meses; IC 95% 8.1-10.7) manifestándose el beneficio también en la tasa de mortalidad (HR 0.73; IC 95% 0.59-0.89; p= 0.002). La tasa de supervivencia al año fue del 51% versus 39%; y a los 18 meses del 39% y 23% y; la tasa de respuesta también resultó superior 19% y 12%, para cada uno de los grupos, respectivamente (p= 0.02). La mediana de duración de la respuesta fue de 17.2 versus 5.6 meses, respectivamente. La toxicidad grado 3-5 fue menor para nivolumab (10% versus 54%). Los tumores que marcaron PD-L1 entre 1-10% tuvieron una mediana de supervivencia mayor con el inhibidor (17 a19 versus 8 a 9 meses). En caso de no haber expresión, si bien la supervivencia fue la misma, nivolumab mostró mejor perfil de toxicidad y duración de respuesta versus docetaxel. La FDA aprobó, en Octubre de 2015, el test de DAKO IHC (28.8 PharmDX) para testeo; si bien no es requerido para prescribirlo, puede ser orientativo. Los pacientes fumadores serían mejores respondedores. Nivolumab también fue aprobado por la FDA en Marzo de 2015 como segunda línea en pacientes con CaPCNP escamoso en base a los resultados del estudio fase III (CheckMate 017)2. Participaron del mismo 272 pacientes con CaPCNP escamoso progresados a primera línea de QT en platino randomizados al mismo esquema. La mediana de supervivencia fue de 9.2 versus 6.0 meses; la tasa de respuesta 20% versus 9% (p= 0,008); con un HR para riesgo de muerte de 0.59 (IC 95% 0.44- 0.79; p < 0.001); una tasa de supervivencia al año del 42% versus 24%; y una SLP de 3.5 y 2.8 meses, respectivamente. La toxicidad grado 3-4 se manifestó en 7% de los tratados con nivolumab y 55% del grupo docetaxel. La expresión de PD-L1 no tuvo valor pronóstico ni predictivo de beneficio. ANMAT aprobó en febrero de 2016 el uso de nivolumab en progresados a platino o TKIs a una dosis de 3mg/kg en 60 minutos cada dos semanas.
Pembrolizumab es un agente anti-PD1 cuya aprobación, en Octubre de 2015, se basó en los resultados de los estudios fase II/III (KEYNOTE-010)3 y fase I (KEYNOTE -001)4. La FDA aprobó su indicación en pacientes con CaPNPC metastásico escamoso o no escamoso PD-L1 positivo (IHC: DAKO clon Ac. 22C3) progresados a una primera línea de QT basada en platino. El estudio KEYNOTE-0103 incluyó 1034 pacientes con CaPCNP previamente tratados, con mínimo 1% expresión de PD-L1. Se randomizaron a tres ramas: pembrolizumab 2 mg/kg cada 3 semanas; 10 mg/kg cada 3 semanas; y docetaxel 75 mg/m2 cada 21días. La mediana de supervivencia fue superior para ambas dosis de pembrolizumab: 10.4 y 12.7 versus 8.5 meses con docetaxel; más aún en los casos con PDL-1 ≥ 50 se registraron valores de 14.9 y 17.3 versus 8.2 meses. Los efectos adversos grado 3-4 fueron menos frecuentes en ambas dosis de pembrolizumab (13% y 16% versus 35%); sin embargo, se observaron 6 muertes (3 en cada rama) en los tratados con el inhibidor de PD-1 y 5 fallecimientos en el grupo docetaxel. El estudio fase I4 incluyó el mismo grupo de pacientes (n= 495) comparando pembrolizumab 2 o 10 mg/kg cada 3 semanas y 10 mg/kg cada 2 semanas. La mediana de supervivencia fue de 12 meses (en PDL-1 ≥ 50 no se alcanzó), la mediana de SLP fue de 3.7 meses y en pacientes PDL-1 ≥ 50% de 6.3 meses; la duración de respuesta fue de 12.5 meses y la tasa de respuesta de 19.5% y 45% en individuos PDL-1 ≥ 50%. No hubo diferencias en toxicidad y eficacia con las diferentes dosis. El estado de fumador (actual o pasado) se correlacionó con la respuesta.
Nota: la toxicidad inmunológica de los Inhibidores checkpoint es similar y se maneja con corticoides con dosis y vía de administración que dependen de la gravedad. En caso de presencia de eventos que comprometen la vida del paciente, como neumonitis severa, se deben discontinuar.
Atezolizumab (Anti-PDL1) fue aprobado por la FDA en Octubre de 2016 para tratar CaPCNP progresado a una primera línea de tratamiento. El estudio fase III (OAK)5 se efectuó en 1225 pacientes con CaPCNP tratados con una o dos líneas previas de QT basada en platino. Los participantes recibieron atezolizumab 1200 mg o docetaxel 75 mg/m2 cada 3 semanas. Atezolizumab mostró superioridad en términos de supervivencia independientemente de la expresión de PD-L1 y de la histología. La mediana de supervivencia global fue de 13.8 (IC 95% 11.8-15.78) versus 9.6 meses (8.6-11.28) (HR 0.73; IC 95% 0.62-0.87; p = 0.0003); con una mediana de supervivencia en PD-Ll1 positivos de 15.7 (IC 95% 12.6- 18.0) versus 10.3 meses (8.8-12.0) con docetaxel (HR 0.74; IC 95% 0.58.0.93; p= 0.0102). Los pacientes con PD-L1 bajo o no detectable tuvieron una mediana de supervivencia superior 12.6 versus 8.9 meses (HR 0.75; IC 95% 0.59–0.96). La toxicidad grado 3-4 fue del 15% versus 43%, respectivamente.
Referencias
1. Borghaei H, Paz-Ares L, HornL. Nivolumab versus Docetaxel in Advanced Nonsquamous Non–Small-Cell Lung Cancer. N Engl J Med. 2015; 373: 1627-1639.
2. Brahmer J, Reckamp KL, Baas P et al. Nivolumab versus Docetaxel in Advanced Squamous-Cell Non–Small-Cell Lung Cancer. N Engl J Med. 2015; 373: 123-135.
3. Herbst RS, Baas P, Dong-Wan K et al. Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE-010): a randomised controlled trial. The Lancet. 2016; 387(10027): 1540-1550.
4. Garon EB, Rizvi NA, Hui R et al. Pembrolizumab for the Treatment of Non–Small-Cell Lung Cancer. N Engl J Med. 2015; 372: 2018-2028.
5. Rittmeyer A, Barlesi F, Waterkamp D et al. Atezolizumab versus docetaxel in patients with previously treated non-small-cell lung cancer (OAK): a phase 3, open-label, multicentre randomised controlled trial. Lancet. 2017; 21(3899): 255-265.
c.2 No inmunoterapia
Docetaxel fue el primer fármaco que mostró beneficio en pacientes progresados a primera línea de tratamiento con sal de platino, en estudios de fase II. Ello dio origen al diseño de estudios fase III (TAX 3171 y TAX3202). El estudio TAX 3171, multicéntrico, randomizado, comparó docetaxel (a dos dosis en un principio y luego sólo a 75 mg/m2 por mayor toxicidad con 100 mg/m2) contra el mejor soporte clínico. Docetaxel mostró un beneficio significativo en supervivencia con la dosis de 75 mg/m2, no así con 100 mg/m2. La tasa de supervivencia al año combinando las ramas con las dos dosis fue de 29.9% versus 19% en soporte clínico versus 37% en la rama docetaxel 75 mg/m2. La mediana de supervivencia fue de 7.5 meses para docetaxel 75 mg/m2 comparada con 4.6 meses para el soporte clínico (p = 0.01). Los análisis de calidad de vida de este estudio mostraron una diferencia significativa a favor de docetaxel 75 mg/m2. El estudio TAX3202, multicéntrico, randomizado, comparó docetaxel (inicialmente dos dosis de 100 y 75 mg/m2 y luego a 75 mg/m2), versus vinorelbine o ifosfamida (V/I), siendo una u otra droga seleccionadas por el investigador. La tasa de supervivencia a 1 año mostró beneficio a favor de docetaxel 75 mg/m2 respecto a V/I (32% versus 19%; p = 0.025). La tasa de respuesta fue modesta pero significativamente mayor en las dos dosis de docetaxel. Los parámetros de eficacia se analizaron por subgrupos observándose que la exposición previa al paclitaxel no influyó en la respuesta ni en la supervivencia; en cambio sí influyeron el PS (0-1 versus 2) y la respuesta previa al platino. Se demostró una incidencia de neutropenia grado 4 del 54% en la rama docetaxel 75 mg/m2, y un 8% de neutropenia febril. Los resultados de ambos ensayos clínicos sustentaron la aprobación de docetaxel 75 mg/m2 cada 3 semanas como estándar de tratamiento para pacientes portadores de CaPCNP progresados o recaídos a una primera línea de QT basada en platino. En las guías ASCO 2004 ya se recomienda como esquema de segunda línea, en pacientes con PS 0-1.
El ensayo clínico Fase III, JMEI3, randomizado, multicéntrico, con un diseño de no inferioridad, comparó pemetrexed en segunda línea versus el estándar, docetaxel. Se estableció como criterio primario la SG. Los pacientes asignados a pemetrexed recibieron suplementación con ácido fólico y vitamina B12 comenzando como mínimo una semana antes, más dexametasona. Las tasas de respuesta global (respuesta parcial + respuesta completa) fueron similares (9.1% pemetrexed y 8.8% docetaxel); lo mismo sucedió con las tasas de enfermedad (45.8% y 46.4%, respectivamente). En cuanto a la mediana de tiempo de supervivencia y supervivencia al año tampoco hubo diferencia significativa (8.3 meses pemetrexed y 7.9 meses docetaxel); con una tasa de supervivencia al año del 29.7% para ambas ramas. Se encontraron diferencias en la toxicidad observándose neutropenia febril en el 2% del grupo pemetrexed y en el 13% del grupo docetaxel, con mayor uso de factores estimulantes y hospitalizaciones en la rama con docetaxel. Los resultados de este estudio fase III sustentaron a la aprobación del uso de pemetrexed en segunda línea de quimioterapia.
Erlotinib, un inhibidor de la EGFR TKI, fue la tercera droga que demostró utilidad en segunda y tercera línea de tratamiento. El estudio fase III BR.214 examinó a una población en la cual el 50% habían recibido una línea de QT, además estaba permitida la inclusión de pacientes con PS 0 a 3 y recaídos a 2 líneas de QT. Los participantes se randomizaron, en proporción 2:1, a erlotinib o placebo. La tasa de respuesta fue del 9% con una tasa de enfermedad estable del 35%. La mediana del tiempo de supervivencia fue 6.7 meses y la de supervivencia a 1 año del 31%. Estos datos fueron similares a los obtenidos con docetaxel y pemetrexed. La tasa de control de la enfermedad en la rama con erlotinib fue del 45%. La respuesta a la droga no fue alterada por el PS, el tratamiento previo, la respuesta al tratamiento previo, ni la edad. En el análisis multivariado se observó una mayor tasa de respuesta al erlotinib en mujeres (p = 0.006), no fumadores (p < 0.01), asiáticos (p = 0.02), adenocarcinoma (p < 0.01) y expresión de EGFR 10% (p = 0.10). Las toxicidades más frecuentes fueron erupción cutánea y diarrea, pero de grados moderados. Hubo un beneficio en calidad de vida en la rama activa.
Gefitinib se examinó en el estudio de fase III INTEREST5, comparativo con docetaxel en 2° línea de tratamiento en pacientes con CaPCNP. La supervivencia media y SG fueron similares en ambos grupos. La toxicidad cutánea y diarrea fueron mayores en el grupo gefitinib mientras que docetaxel se asoció a una mayor incidencia de neutropenia, astenia y alopecia. Los grupos más beneficiados con el tratamiento de inhibidores de EGFR fueron mujeres, no fumadores, pacientes con adenocarcinomas y asiáticos.
Nintedanib es un inhibidor de angioquinasa con potente actividad inhibidora de las vías proangiogénicas como el VEGFR 1-3, receptor de Factor de Crecimiento Fibroblástico (FGFR), y del Receptor del Factor de Crecimiento Derivado de Plaquetas (PDGFR). Un estudio Fase III6 randomizado comparó en segunda línea docetaxel/nintedanib (n = 655) versus nintedanib (n= 650) docetaxel más placebo. La SLP favoreció a la combinación con nintedanib: 3,4 versus 2.7 meses (HR 0.79; p = 0.019). La SG fue superior en el grupo docetaxel/nintedanib sólo en pacientes con adenocarcinoma: 12, 6 versus
10.3 meses (HR 0.83; IC 95% 0.70-0.99; p= 0.03). En aquellos pacientes de especial mal pronóstico (p. ej.: progresión antes de los 9 meses de haber iniciado la primera línea) la SG mejoró en el grupo tratado con la combinación docetaxel/nintedanib 10.9 versus 7.9 meses (HR 0.75). Nintedanib está aprobado en segunda línea en combinación con docetaxel en pacientes con adenocarcinoma.
Ramucirumab es un anticuerpo monoclonal IgG1 completamente humanizado que se une al dominio extracelular del VEGFR 2. Un estudio randomizado fase III7 comparó docetaxel/ramucirumab versus docetaxel/placebo en segunda línea en pacientes con CaPCNP. La SG fue mayor en el grupo docetaxel/ ramucirumab (10.5 meses versus 9.1; HR 0.86 0.75-0.98) La mediana de SLP también favoreció a la combinación con ramucirumab [4.5 versus 3 meses; HR 0.76 (0.68-0.86)]. El beneficio fue observado en tumores con histología escamosa y no escamosa. Ramucirumab más docetaxel está aprobado en segunda línea tanto para histología escamosa como adenocarcinoma.
Recomendación
- Los pacientes con recaída o progresión a la primera línea de QT podrán realizar un esquema de segunda línea.
- Docetaxel 75 mg/m2 cada 21 días.
- Pemetrexed 500 mg/m2 cada 21 días (con soporte de acido fólico, vitamina B12 y corticoides). En pacientes con tumores no escamosos.
- Erlotinib 150 mg/día.
- Gefitinib 250 mg/día en portadores de mutación activadora de EGFR
- Docetaxel más Nintedanib en pacientes con adenocarcinoma.
- Docetaxel más Ramucirumab en segunda línea para histología escamosa y adenocarcinoma.
Referencias
1. Roszkowski K1, Pluzanska A, Krzakowski M et al. A multicenter, randomized, phase III study of docetaxel plus best supportive care versus best supportive care in chemotherapy-naive patients with metastatic or non-resectable localized non-small cell lung cancer (NSCLC). Lung Cancer. 2000; 27(3): 145-57.
2. Fossella FV, DeVore R, Kerr RN et al. Randomized phase III trial of docetaxel versus vinorelbine or ifosfamide in patients with advanced non-small-cell lung cancer previously treated with platinum-containing chemotherapy regimens. The TAX 320 Non-Small Cell Lung Cancer Study Group. J Clin Oncol .2000;18(12): 2354-62.
3. Paz-Ares LG, Zimmermann A, Ciuleanu T et al. Meta-analysis examining impact of age on overall survival with pemetrexed for the treatment of advanced non-squamous non-small cell lung cancer. Lung Cancer. 2017; 104: 45-51.
4. Bezjak A, Tu D, Seymour L, Clark G et al. Symptom improvement in lung cancer patients treated with erlotinib: quality of life analysis of the National Cancer Institute of Canada Clinical Trials Group Study BR.21. J Clin Oncol. 2006; 24(24): 3831-7.
5. Kim ES, Hirsh V, Mok T et al. Gefitinib versus docetaxel in previously treated non-small-cell lung cancer (INTEREST): a randomised phase III trial. Lancet. 2008; 372(9652): 1809-18.
6. Reck M, Kaiser R, Mellemgaard A, Douillard JY et al. Docetaxel plus nintedanib versus docetaxel plus placebo in patients previously treated Non-Small Cell Lung Cancer (Lume Lung 1) A phase 3 double blind randomized controlled trial. Lancet Oncol. 2014; 15(2): 143-55.
7. Garon EB, Ciuleanu TE, Arrieta O et al. Ramucirumab plus docetaxel versus docetaxel placebo for second line Non- Small Cell Lung cancer after disease progression on platinum based therapy (REVEL). A multicenter double blind, phase 3 randomized trial. Lancet Oncology. 2014; 384(9944): 665-73.
Tumores de la pared costal, bronquios próximos a la carina y mediastino T3-4 N0-1
Vértice pulmonar
Nódulos satélites
SBRT en enfermedad avanzada
Tumores de la pared costal, bronquios próximos a la carina y mediastino T3-4 N0-1
La primera opción terapéutica es la cirugía. Son opciones la RQT neoadyuvante (ver técnicas y dosis en Generalidades del Tratamiento Radiante, Anexo 2)1-3, y la QT neoadyuvante, ambas tienen criterios prequirúrgicos.
Si luego de la cirugía se obtienen márgenes R0 se aconseja QT adyuvante, si no fue utilizada anteriormente. Con márgenes R1 o R2 se aconseja nueva resección para ampliar márgenes y QT si no se realizó como neoadyuvante, ó RQT si no se utilizó como neoadyuvancia previa (Figura 1).
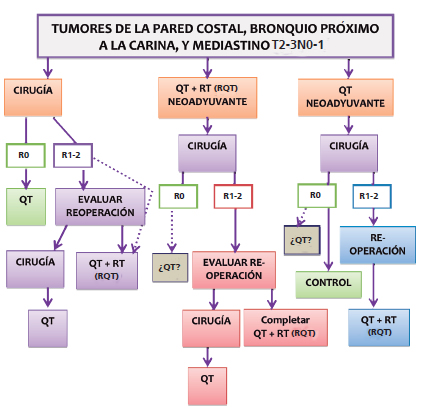
Referencias
1. Cerfolio RJ y col. Pulmonary resection after concurrent chemotherapy and high Dose (60Gy) radiation for non-small-cell lung cancer is safe and may provide increased survival. Eur J Cardiothorac Surg. 2009; 35: 718-723.
2. Sonett JR y col. Pulmonary resection after curative intent radiotherapy (>59Gy) and concurrent chemotherapy in non-small-cell lung cancer. Ann Thorac Surg. 2004; 78: 1200-1205.
3. Lally B y col. “Preoperative Chemotherapy /Radiation Therapy for Early Stage and Locally Advanced Non Small Cell Carcinoma” Pass H. y col. Principles & Practice of Lung Cancer “The Official Reference of the IASLC”. Capítulo 55: 799-820. 4a Ed. 2010 Lippincott Williams & Wilkins.
Vértice pulmonar
Se denomina tumor de Pancoast o del “surco superior” a los carcinomas broncogénicos del vértice pulmonar que invaden las estructuras de la pared torácica, entre ellas las costillas superiores o su periostio, las raíces podálicas del plexo braquial, la parte de la cadena simpática cercana al vértice torácico o los vasos subclavios. Para la clasificación TNM, corresponden a T3 o T4 según los casos. Los estudios indicados para el diagnóstico de compromiso de estructuras parietales y extratorácicas son la TC, angiotomografía y RM. Esta última es especialmente útil para estudiar el plexo braquial y raquis por lo cual se recomienda siempre que se sospeche invasión o muy estrecha proximidad a esas estructuras.
Los pacientes con buen PS (0-1) sin metástasis regionales ni distantes, candidatos a cirugía tienen siempre indicación de tratamiento de inducción con QT y RT precediendo a la resección quirúrgica1. Igual conducta sería aplicable a pacientes seleccionados con metástasis ganglionares en mediastino y respuesta completa a la RQT (por imágenes y confirmación histopatológica)2-5, 14. En casi todas las series publicadas no hubo ningún beneficio de la cirugía en los pacientes con evidencia de compromiso mediastinal, por lo cual la presencia de N2 se considera una contraindicación para la exéresis quirúrgica al igual que el compromiso de los vasos (especialmente la subclavia) o la invasión de la fosa supraclavicular3-4, 6.
Por lo general, están excluidos para tratamiento potencialmente curativo los casos con invasión de cuerpos vertebrales y vasos subclavios, quedando reservados solamente a pocos centros especializados que han adquirido cierta experiencia en intervenciones extendidas.
Si bien la presencia de síndrome de Claude Bernard-Horner no es una contraindicación absoluta ha sido un factor de muy mal pronóstico en casi todas las series estudiadas7-9.
En pacientes intervenidos quirúrgicamente el uso de QT adyuvante ha demostrado beneficios en los casos con T3 o T4-N0-M0, aunque solamente 42% pudieron completar la QT posoperatoria2.
El dolor causado por extensión local tiene buena respuesta a RT asociada a QT, si el estado general la permite.
Las cirugías recomendadas son aquellas que incluyen el lóbulo superior y las estructuras extrapulmonares comprometidas incorporadas a la pieza de resección. Las exéresis sublobares no están indicadas en esta localización de tumores. El muestreo de los ganglios mediastinales debe ser de rutina, de la misma manera que en todo CaP sometido a cirugía10-13.
En la Figura 2 se describe el abordaje terapéutico del CaP de Pancoast.
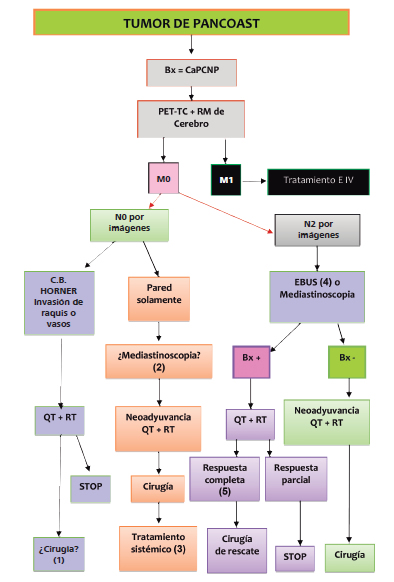
Referencias
1. Rusch V, Giroux DJ, Kraut M, Crowley J, et al. Induction Chemoradiation and Surgical Resection for Superior Sulcus Non- Small-Cell Lung Carcinomas: Long-Term Results of Southwest Oncology Group Trial 9416 (Intergroup Trial 0160). J Clin Oncol. 2007; 2 5: 313-318.
2. Rusch VW, Giroux DJ, Kraut MJ. Induction chemoradiation and surgical resection for non-small cell lung carcinomas of the superior sulcus: Initial results of Southwest Oncology Group Trial 9416 (Intergroup Trial 0160). J Thorac Cardiovasc Surg. 2001; 121 (3): 472-83.
3. Shen R. K, Meyers B. F, Larner J. M., Jones D. R. Special Treatment Issues in Lung Cancer ACCAP Evidence-Based Clinical Practice Guidelines (2nd Edition). CHEST. 2007; 132: 290S-305S.
4. Dartevelle P. G. Extended Operations for the Treatment of Lung Cancer. Ann Thorac Surg. 1997; 63: 12-19.
5. Ritsuko Komaki y col. “The lung, pleura and thymus” “Response of the trachea and Lung to irradiation” Radiation Oncology Cox-Ang 9ª Ed CaP 19: 425-451 Mosby-Elsevier 2010.
6. Cerfolio RJ y col. Pulmonary resection after concurrent chemotherapy and high Dose (60Gy) radiation for non-small-cell lung cancer is safe and may provide increased survival. Eur J Cardiothorac Surg. 2009; 35: 718-723.
7. Sonett JR y col. Pulmonary resection after curative intent radiotherapy (>59Gy) and concurrent chemotherapy in non-small-cell lung cancer. Ann Thorac Surg. 2004; 78: 1200-1205.
8. Rusch VW y col. Induction chemoradiation and surgical resection for superior sulcus non-small-cell lung carcinomas: long-term results of Southwest Oncology Group Trial 9416 (intergroup Trial 0160). J Clin Oncol. 2007; 25: 313-318.
9. Bradley J. y col. Toxicity and outcome results of RTOG 9311: a phase I-II dose - escalation study using three-dimensional conformal radiotherapy in patients with inoperable non - small - cell lung carcinoma. Int J Radiat Oncol Phys. 2005; 61: 318-328.
10. Wang L y col. The effect of radiation dose and chemotherapy on overall survival in 237 patients with Stage III non - small cell lung cancer. Int. Radiat Oncol Biol Phys. 2009; 73: 1383.
11. Rosenman JG y col. High-dose conformal radiotherapy for treatment of stage IIIA/IIIB non - small cell lung cancer thecnical issues and results of a phase I/II trial. Int J Radiat Oncol Biol Phys. 2002; 54: 348-356.
12. Schild SE y col. Results of a Phase I trial of concurrent chemotherapy and escalating doses of radiation for unresectable non – small cell lung cancer. Int Radiat Oncol Biol Phys. 2006; 65: 1106-1111.
13. Hernando FM y col. Radiation-induced pulmonary toxicity: a dose-volume histogram analysis in 201 patients with lung cancer. Int J Radiat Oncol Biol Phys. 2001; 51: 650-659.
14. Lally B. y col. “Preoperative Chemotherapy/Radiation Therapy for Early Stage and Locally Advanced Non Small Cell Carcinoma” Pass H. y col. Principles & Practice of Lung Cancer “The Official Reference of the IASLC”. Capítulo 55: 799-820 4ª Ed. 2010 Lippincott Williams & Wilkins.
Nódulos satélites
c.1 Tumores metacrónicos y sincrónicos
Se definen como tumores sincrónicos (de aparición simultánea) a aquellos separados físicamente y de histología diferente.
Sincrónico
Si la histología es similar para ser considerado tumor sincrónico debe cumplir al menos dos de los requisitos siguientes: localización anatómica diferente, sin metástasis a distancia, sin compromiso de ganglios linfáticos mediastinales, ploidía diferente. En pacientes candidatos para tratamiento curativo con un NPS dominante y uno o más nódulos adicionales menores se recomienda evaluar individualmente cada lesión, y no descartar el tratamiento curativo a menos que haya confirmación histopatológica de metástasis. En candidatos intervención quirúrgica con metástasis pulmonar solitaria se recomienda la resección de la metástasis, siempre que no haya evidencia de enfermedad maligna extrapulmonar y ni un mejor tratamiento disponible. En individuo con CaPCNP y un nódulo satélite en el mismo lóbulo (sin metástasis mediastinales ni a distancia) se recomienda la resección mediante lobectomía. Ante una CaP sospechado o probado y un nódulo satélite en el mismo lóbulo, se recomienda no realizar estudios adicionales del nódulo satélite. En tumores pulmonares sincrónicos candidatos a cirugía se recomienda la resección anatómica de ambas lesiones; el abordaje secuencial está indicado para los tumores contralaterales. Cuando se sospecha la existencia de dos CaPCNP primarios se recomienda buscar exhaustivamente un cáncer primario extratorácico para excluir que ambas lesiones pulmonares correspondan a metástasis. En pacientes en los que durante la cirugía se encuentra una lesión tumoral maligna en otro lóbulo, no sospechada previamente, se recomienda resecar cada lesión siempre y cuando la reserva funcional sea adecuada y no haya compromiso N2. En tumores primarios CaPCNP N0-1 sincrónicos resecables con una metástasis cerebral única, sin metástasis en otros sitios, se recomienda la resección o ablación radioquirúrgica de la metástasis y también la resección del tumor primario. La estadificación TNM de los tumores sincrónicos corresponde a la del tumor más avanzado colocando entre paréntesis el número de tumores observados. (p. ej: T1bN0M0 + T1aN0M0 = T1bN0M0 -estadio Ib).
Metacrónico
En pacientes con CaPCNP metacrónico candidatos a resección quirúrgica curativa se recomienda la misma modalidad de estadificación aconsejada para cualquier tumor de pulmón. Se recomienda la resección de la lesión aplicando criterios oncológicos. En los nódulos pulmonares ipsilaterales el tratamiento inicial de elcción es la cirugía. GR A. Posteriormente, se hará una evaluación de los márgenes y se decidirá la conducta a seguir (R0 QT adyuvante postoperatoria. R1 ó R2 RQT postoperatoria) (Ver Anexo 2: Técnicas y dosis en Generalidades del Tratamiento Radiante, Dosis Recomendadas para Tratamientos RT e IMRT, ítem b)5.
c.2 SBRT en tumores primarios múltiples sincrónicos o multifocales
La SBRT puede ser una opción de tratamiento curativa para pacientes con tumores múltiples sincrónicos o metacrónicos, ya que tienen índice de control tumoral equivalentes y toxicidad similar a tumores únicos, pero disminución de los índices de supervivencia total1-4 (Figura 1). También puede ser una opción curativa en pacientes con tumores pulmonares múltiples post-neumonectomía, obteniendo control tumoral equivalente a tumores únicos, pero a expensas de aumento de toxicidad pulmonar en pacientes con capacidad ventilatoria limitada5-7 (Figura 2).
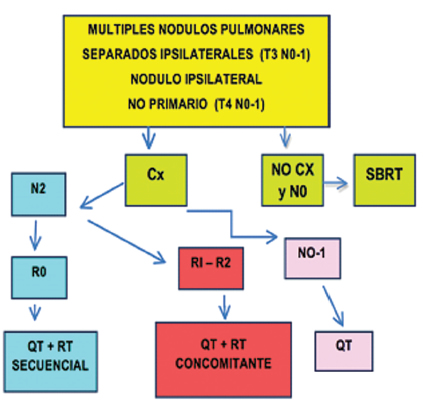
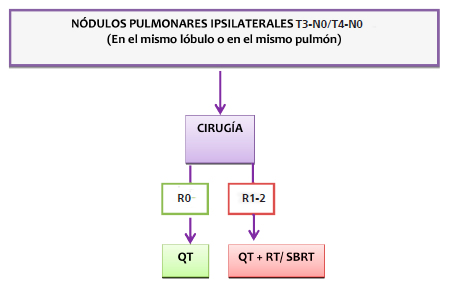
Referencias
1. Griffioen GH, Lagerwaard FJ, Haasbeek CJ, Smit EF, Slotman BJ, Senan S. Treatment of multiple primary lung cancers using stereotactic radiotherapy, either with or without surgery. Radiother Oncol. 2013; 107(3): 403-408.
2. Creach KM, Bradley JD, Mahasittiwat P, Robinson CG. Stereotactic body radiation therapy in the treatment of multiple primary lung cancers. Radiother Oncol. 2012; 104(1): 19-22.
3. Shintani T, Masago K, Takayama K, et al. Stereotactic Body Radiotherapy for Synchronous Primary Lung Cancer: Clinical Outcome of 18 Cases. Clin Lung Cancer. 2015; 16(5): e91-96.
4. Lou F, Huang J, Sima CS, Dycoco J, Rusch V, Bach PB. Patterns of recurrence and second primary lung cancer in early-stage lung cancer survivors followed with routine computed tomography surveillance. J Thorac Cardiovasc Surg. 2013; 145(1): 75-81; discussion: 81-82.
5. Thompson R, Giuliani M, Yap ML, et al. Stereotactic body radiotherapy in patients with previous pneumonectomy: safety and efficacy. J Thorac Oncol. 2014; 9(6): 843-847.
6. Simpson DR, Sanghvi P, Sandhu AP. Lung stereotactic body radiotherapy for earlystage NSCLC in patients with prior pneumonectomy: a case report. J Natl Compr Canc Netw. 2014; 12(11): 1513-1516.
7. Haasbeek CJ, Lagerwaard FJ, de Jaeger K, Slotman BJ, Senan S. Outcomes of stereotactic radiotherapy for a new clinical stage I lung cancer arising postpneumonectomy. Cancer. 2009; 115(3): 587-594.
c3) Nódulo pulmonar único contralateral- Estadio IV (T1-4 N0 M1A)
Cuando los nódulos son contralaterales y se los considera primarios simultáneos la opción aconsejada es la cirugía seguida de QT adyuvante si los márgenes son R0 ó QT+RT en caso de tumores R1-21 (Figura 1).
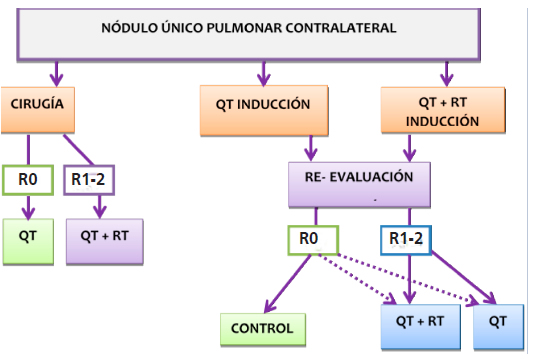
En caso de ser necesaria una inducción con: QT ó QT+RT, se deben evaluar después de la cirugía los márgenes. En caso de márgenes R0 se plantean las siguientes opciones: control; QT ó QT+RT. La elección se inclina hacia la opción que no se hubiera aplicado como inducción anteriormente1-2. En caso de márgenes R1-2 las alternativas son QT+RT ó QT, eligiéndose aquella que no hubiera recibido como inducción antes de la cirugía3-4 (Figura 2).
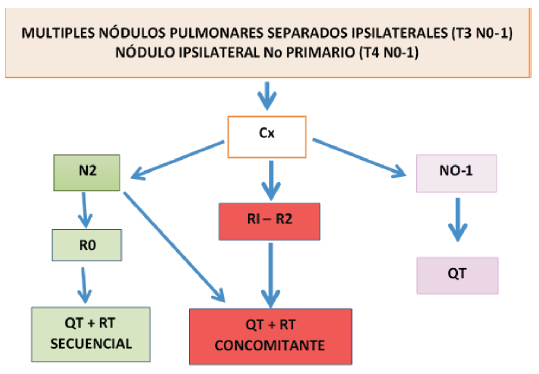
Referencias
1. Griffioen GH, Lagerwaard FJ, Haasbeek CJ, et al. Treatment of multiple primary lung cancers using stereotactic radiotherapy, either with or without surgery. Radiother Oncol. 2013; 107(3): 403-408.
2. Creach KM, Bradley JD, Mahasittiwat P, Robinson CG. Stereotactic body radiation therapy in the treatment of multiple primary lung cancers. Radiother Oncol. 2012; 104(1): 19-22.
3. Shintani T, Masago K, Takayama K, et al. Stereotactic Body Radiotherapy for Synchronous Primary Lung Cancer: Clinical Outcome of 18 Cases. Clin Lung Cancer. 2015; 16(5): e91-96.
4. Lou F, Huang J, Sima CS, Dycoco J, Rusch V, Bach PB. Patterns of recurrence and second primary lung cancer in early-stage lung cancer survivors followed with routine computed tomography surveillance. J Thorac Cardiovasc Surg .2013; 145 (1): 75-81; discussion: 81-72.
c4) Metástasis cerebrales aisladas
Los pacientes pueden ser considerados para resección con intenciones curativas de metástasis cerebrales aisladas siempre y cuando sea posible la resección del tumor pulmonar primario1, 2 (GR C). Las
posibilidades terapéuticas incluyen la resección quirúrgica o la ablación radioquirurgica (RCx). La supervivencia media a 5 años es del 15% aproximadamente. Se sugiere la radioterapia holocraneana “adyuvante” debido a la reducción en la tasa de recaída local, si bien no se ha demostrado mejoría en la supervivencia1- 4.
Referencias
1. Shen KR et al. Special treatment issues in lung cancer: ACCAP evidence-based clinical practice guidelines (2nd edition). CHEST. 2007; 132(3 Suppl): 290S-305S.
2. Hu C et al. Nonsmall cell lung cancer presenting with synchronous solitary brain metastasis. Cancer. 2006; 106(9): 1998- 2004.
3. Aoyama H et al. Stereotactic radiosurgery plus whole-brain radiation therapy versus stereotactic radiosurgery alone for treatment of brain metastases: a randomized controlled trial. JAMA. 2006; 295(21): 2483-91.
4. NCCN guidelines, Non Small Cell Lung Cancer, Version 1.2011. https://www.nccn.org/professionals/physician_gls/
c5) Metástasis adrenales aisladas
Las metástasis adrenales se presentan hasta en el 30% de los pacientes con CaP, debiendo ser confirmadas mediante biopsia para poder diferencialas de adenomas de la adrenal. Los pacientes con lesiones solitarias en las suprarrenales y tumores primarios pulmonares resecables podrían beneficiarse de la resección quirúrgica de ambas lesiones1-4 (Grado de recomendación 1C).
La SBRT es una opción viable en esta condición ya que cumple los criterios de enfermedad oligometastásica. A la fecha, 10 estudios han mostrado la utilidad de esta técnica evidenciando un control local a 2 años del 70%, la mayoría con dosis equivalentes mayores a 60 Gy5.
Referencias
1. Porte H, Siat J, Guibert B, et al. Resection of adrenal metastases from non-small cell lung cancer: a multicenter study. Ann Thorac Surg. 2001; 71: 981-985.
2. Mercier O, Fadel E, de Perrot M, et al. Surgical treatment of solitary adrenal metastasis from non-small cell lung cancer. J Thorac Cardiovasc Surg. 2005; 130: 136-140.
3. Shen KR et al. Special treatment issues in lung cancer: ACCAP evidence-based clinical practice guidelines (2nd edition). CHEST. 2007; 132(3 Suppl): 290S-305S.
4. NCCN guidelines, Non Small Cell Lung Cancer, Version 1.2011. https://www.nccn.org/professionals/physician_gls/
5. SBRT:A viable option for treating adrenal gland metastases Edy Ippolito, Rolando Maria D’Angelillo, Michele Fiore, Elisabetta Molfese, Lucio Trodella, and Sara Ramella. Rep Pract Oncol Radiother. 2015; 20(6): 484-490.
SBRT en enfermedad avanzada
a.1 Metástasis cerebrales 1 a 3
Un estudio randomizado evaluó la función cognitiva en 213 pacientes con una a tres metástasis cerebrales tratados con RCx sola o RCx más RT holocraneal. La mayoría de los pacientes tenían CaP. A tres meses la rama de RCx sola tuvo menos deterioro cognitivo en forma significativa respecto de la combinación RCx más RT cerebral, sin mejoría de supervivencia1-6. La RCx craneal se considera el tratamiento estándar en pacientes con enfermedad cerebral limitada, < 3 cm, sin efecto de masa y PS 0-1.
b.2 Enfermedad oligo-metastásica (Oligomts)
El tratamiento local definitivo para enfermedad metastásica limitada (1 a 5 sitios) o solitaria logra una supervivencia prolongada en un grupo de pacientes altamente seleccionados con excelente PS, con tratamiento radical de la enfermedad torácica primaria y oligo-progresión. El interés en este tipo de afección está fundado en el criterio de control de la enfermedad y eventualmente la curación.
Las categorias de riesgo según pronóstico son: 1) Bajo: Oligomts metacrónica, supervivencia 5 años 48%; 2) Intermedio: Oligomts sincrónica y N0, supervivencia 5 años 36%; 3) Alto: Oligomts sincrónica y N1-2, supervivencia 5 años 14%.
A la hora de optar por el tratamiento se tener en cuenta que las oligomts sincrónicas en el momento del diagnóstico, tienen mejoría de lA SLP con la QT del tratamiento de base + SBRT ó Cx. (Ver Anexo 2 Tabla 1 Dosis SBRT). Y, las oligomts metacrónicas con tratamientos radicales localizados (SBRT ó Cx), también mejoran la DFS. Las lesiones solitarias en el pulmón contralateral, que se consideren como Secundario Primario Sincrónico, se tratan radicalmente con Cx o SBRT. Un ensayo clinico comparativo de terapia consolidativa local versus mantenimiento u observación en pacientes CaPCNP sin progresión luego de tratamiento de primera linea, mostró que la RT con o sin tratamiento sistémico en pacientes con hasta 3 sitios metastásicos prolonga el período libre de enfermedad comparada con la terapia de mantenimiento7. El tratamiento definitivo con RT ablativa para el status oligomts es una opción apropiada, para entregar altas dosis en forma segura en sitios comprometidos8, 9.
c.3 Recaída local post radioterapia convencional
El uso de SBRT de rescate puede ser una opción en pacientes seleccionados. Ha habido reportes favorables de control local y supervivencia. Dichos pacientes requieren ser informados del aumento de toxicidad en forma significativa, principalmente a nivel pulmonar. Se han empleado varios esquemas (12 Gy x 4, 10 Gy × 5, 8 Gy × 5 y 20 Gy × 3). Los autores concluyen que, a pesar de tener un perfil de seguridad aceptable, se requiere mayor información y seguimiento para demostrar la eficacia a largo plazo1, 2.
d.4 Recaída local post SBRT
Los pacientes seleccionados para un nuevo tratamiento con SBRT requieren un proceso altamente individualizado. La recaída local post SBRT se presenta en aproximadamente 5- 20% de los pacientes, estando la literatura limitada a dos series retrospectivas3, 4.
e.5 Recaída luego de la resección sublobar
Al igual que el caso anterior la decisión comprende un proceso individualizado.
Hay datos ilimitados en pacientes con recaída luego de resección sublobar y braquiterapia5. Los pacientes recibieron rescate con SBRT con una prescripción de 48 Gy en 4 fracciones.
Referencias
1. De Ruysscher D, Faivre-Finn C, Le Pechoux C, Peeters S, Belderbos J. High-dose re-irradiation following radical radiotherapy for non-small-cell lung cancer. Lancet Oncol. 2014; 5(13): e620-624.
2. De Bari B, Filippi AR, Mazzola R, et al. Available evidence on re-irradiation with stereotactic ablative radiotherapy following high-dose previous thoracic radiotherapy for lung malignancies. Cancer Treat Rev. 2015; 41(6): 511-518.
3. Peulen H, Karlsson K, Lindberg K, et al. Toxicity after reirradiation of pulmonary tumours with stereotactic body radiotherapy. Radiother Oncol. 2011; 101(2): 260-266.
4. Hearn JW, Videtic GM, Djemil T, Stephans KL. Salvage stereotactic body radiation therapy (SBRT) for local failure after primary lung SBRT. Int J Radiat Oncol Biol Phys. 2014; 90 (2): 402-406.
5. Gill BS, Clump DA, Burton SA, Christie NA, Schuchert MJ, Heron DE. Salvage stereotactic body radiotherapy for locally recurrent non-small cell lung cancer after sublobar resection and i(125) vicryl mesh brachytherapy. Front Oncol. 2015; 5: 109.
6. Brown PD, Jaeckle K, Ballman KV et al. Effect of radiosurgery alone versus radiosurgery with whole brain radiation therapy on cognitive function in patients with 1 to 3 brain metastases: a randomized clinical trial. JAMA. 2016; 316: 401-409.
7. Gomez D, Blumenschein G, Lee J et al. Local consolidative therapy versus maitenance therapy or observation for patients with oligometastasic non-small-cell lung cáncer without progression after firts line systemic therapy: a multicentre, randomised, controlled, phase 2 sdudy. Lancet Oncology, published online october 2016: 1-11.
8. Salama JK, Chmira, Metha N et al. An initial report of a radiation dose-escalation trial in patients with one to five sites of metastatic disease. Clini Cancer Res. 2008; 14: 5255-5259.
9. Milano MT, Katz AW, Okunieff P. Patterns of recurrence after curative-intent radiation for oligometastatic confined to one organ. Am J Clinical Oncology. 2010; 33: 157-163.
- Obstrucción de la vía aérea central
- Derrame pleural
- Tos
- Disnea
- Síndrome de vena cava superior
- Hemoptisis
- Metástasis a distancia
Obstrucción de la vía aérea central
Los pacientes con CaP pueden tener obstruida la via aérea central por la lesión primaria o por la invasión locorregional. Los síntomas dominantes son disnea, hemoptisis y tos. En algunas situaciones su severidad puede requerir una intervención urgente. Factores dependientes del cuadro clínico general, la disponibilidad del equipamiento y del personal idóneo, así como la aceptación del paciente y de su familia de una intervención endoscópica de riesgo, dan lugar a una compleja situación ética. La evaluación clínica, el estudio por imágenes y la curva flujo volumen y flujos máximos, pueden orientar el diagnóstico de la gravedad del compromiso de la vía área principal.
a) Broncoscopía
La broncoscopía es fundamental para certificar el diagnóstico y establecer un plan de tratamiento adecuado acorde a la naturaleza del compromiso: invasión de la vía aérea por el tumor, compresión extrínseca, o una forma combinada. Es muy frecuente que el tratamiento endoscópico logre una mejoría de la disnea y la hemoptisis. El control de la tos es más complicado ya que suele tener múltiples causas.
En la urgencia es primordial estabilizar al paciente asegurando la permeabilidad de la vía aérea. Esto se puede obtener a través de la broncoscopía rígida y, de no ser posible, por intubación orotraqueal1. La broncoscopía rígida es el mejor método para resolver la obstrucción ya que es más rápido y seguro, permitiendo recuperar la vía aérea y el mejor control del sangrado. En la mayoría de los casos se consigue restablecer la permeabilidad de la vía aérea y extubar al paciente2, 3; además requiere de menos accesorios que la broncoscopía flexible. Cuando el crecimiento tumoral es endoluminal la resección mecánica con el broncoscopio así como la evaporación y reducción del tumor se pueden lograr más efectivamente con el auxilio del láser y del electrocauterio logrando la repermeabilización de la vía aérea4-6. Contando con la ayuda del láser, el electrocauterio y el balón de dilatación la broncoscopía flexible puede ser una alternativa a la broncoscopía rígida5, 6. La colocación de un stent, resulta imprescindible cuando la vía aérea central está comprometida por compresión extrínseca ya que permite recuperar la luz de la vía aérea y una efectiva hemostasia7; este procedimiento puede requerir previamente disminuir el grado de estenosis con dilatación. Cuando la obstrucción de la vía aérea no genera una situación de urgencia otros métodos como la crioterapia, el tratamiento fotodinámico, la braquiterapia o la radioterapia externa puede ser efectivos8-10.
Referencias
1. Ernst A, Feller-Kopman D, Becker HD, Mehta AC. Central airway obstruction. Am J Respir Crit Care Med. 2004; 169: 1278.
2. Seijo LM, Sterman DH. Interventional pulmonology. N Engl J Med. 2001; 344: 740.
3. Colt, HG, Harrell, JH. Therapeutic rigid bronchoscopy allows level of care changes in patients with acute respiratory failure from central airways obstruction. CHEST. 1997; 112: 202
4. Cavaliere S, Venuta F, Foccoli P et al. Endoscopic treatment of malignant airway obstructions in 2008 patients [published erratum of serious dosage error appears in Chest 1997; 111(5): 1476]. CHEST. 1996; 110: 1536.
5. Edell ES, Cortese DA. Photodynamic therapy: Its use in the management of bronchogenic carcinoma. Clin Chest Med. 1995; 16: 455.
6. Hetzel M, Hetzel J, Schumann C, et al. Cryorecanalization: A new approach for the immediate management of acute airway obstruction. J Thorac Cardiovasc Surg. 2004; 127: 1427.
7. Nori D, Allison R, Kaplan B et al. High dose-rate intraluminal irradiation in bronchogenic carcinomas: Technique and results. CHEST. 1993; 104: 1006.
8. Dumon JF. A dedicated tracheobronchial stent. CHEST. 1990; 97: 328.
9. Lee P, Kupeli E, Mehta AC. Therapeutic bronchoscopy in lung cancer: laser therapy, electrocautery, brachytherapy, stents, and photodynamic therapy. Clin Chest Med. 2002; 23: 241-256
10. Coulter TD, Mehta AC. The heat is on: impact of endobronchial electrosurgery on the need for Nd-YAG laser photoresection. CHEST. 2000; 118: 516–521.
b) Radioterapia
La radioterapia externa es un tratamiento no invasivo alternativo, factible siempre que el paciente no presente una obstrucción severa que ocasione una atelectasia, ya que los índices de respuesta sólo son del 20 al 50%1. Por otro lado, se debe tener en cuenta el tiempo transcurrido desde el comienzo de los síntomas y el inicio del tratamiento radiante; el 71% de los pacientes presentaron evidencia de re-expansión completa de atelectasia cuando iniciaron RT dentro de las dos primeras semanas versus el 23% en el grupo de inicio tardío2. Se utilizan distintos fraccionamientos (4 Gy × 5 fracciones, 3 Gy × 10 fracciones, 2.5 Gy × 15 fracciones) en función del estado general del paciente.
La braquiterapia endobronquial ofrece un tratamiento paliativo con índices de recanalización y mejoría de la sintomatología del 60% al 80%. Es un tratamiento de probada eficacia, aún en caso de tumores endo-luminales con presencia de componente extra bronquial. Como precaución para su indicación, se recomienda consignar la posibilidad de haber recibido RT en dicha localización en forma previa. Un metaanálisis de Cochrane comparó ambos tratamientos concluyendo que la braquiterapia fue menos efectiva que en los pacientes tratados con RT externa3.
En las Figuras 1 y 2 se resume el manejo de la obstrucción bronquial.
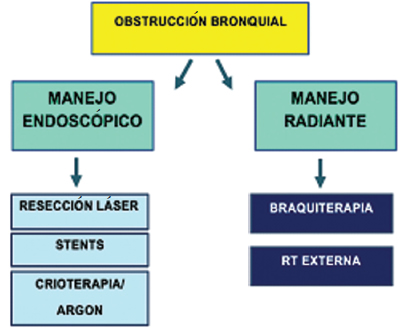
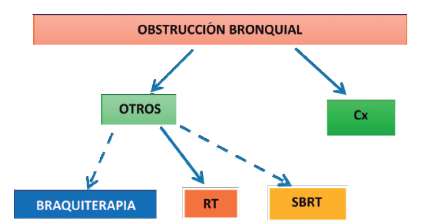
Recomendación
En todos los pacientes con CaP y disnea o hemoptisis dependientes del compromiso de la vía aérea central debe evaluarse una intervención endoscópica para aliviar el síntoma
Referencias
1. Slawson RG et al, Radiation Therapy in bronchogenic carcinoma. Radiology. 1979; 132(1): 175-176.
2. Reddy SP et al, Total atelectasis of the lung secondary to malignant airway obstruction. Response to radiation therapy. Am J Clinical Oncology. 1990; 13(5): 394-400.
3. Cardona AF et al, Palliative endobronchial brachytherapy for non small cell lung cancer. Cochrane database syst rev. 2008(2): CD004284.
El PS y el score de Karnofsky se asocian a mortalidad en pacientes con derrame pleural relacionado al CaP. La mediana de supervivencia media es de 6 meses. Si el índice de Karnofsky es < 30 la supervivencia es de aproximadamente 1 mes; pero si es > 70 alcanza los 13 meses1, 2.
El primer tratamiento es siempre la toracocentesis evacuadora, permite valorar la posibilidad de expansión del pulmón y el tiempo de recidiva. Es infrecuente ver edema por reexpansión en toracocentesis evacuadoras con aguja, por lo cual se recomienda drenar la mayor cantidad posible de líquido. El procedimiento debe suspenderse en caso de tos, dolor torácico o disnea1, 2.
La pleurodesis permite el sellamiento pleural y disminuye la posibilidad de reacumulación del derrame, siendo el talco es el agente esclerosante mas efectivo1, 2, 5. Aún en casos donde la aposición pleural es parcial la pleurodesis puede mejorar el cuadro1- 3. En casos de fallo de la pleurodesis inicial el tratamiento depende de la expectativa de vida, si la misma es < 3 meses sólo se recomienda el uso de toracocentesis a repetición1.
La toracoscopía está indicada para realizar la pleurodesis en pacientes con buen performance status5. Los catéteres intrapleurales conectados a una bolsa de evacuación o frasco de vacío son un buen recurso para pacientes con corta expectativa de vida y como alternativa a las punciones repetidas. Se prefieren catéteres finos1, 4, 5. La tasa de éxito es menor que el de la toracoscopía y requiere internación domiciliaria.
Referencias
1. Roberts M, Neville E, Berrisford R, et al. Management of a malignant pleural effusion: British Thoracic Society pleural disease guideline 2010. Thorax. 2010; 65: ii32-ii40.
2. Siyamek Neragi-Miandoab. Malignant pleural effusion, current and evolving approaches for its diagnosis and management. Lung Cancer. 2006; 54: 1-9.
3. Porcel Pérez JM. Manejo práctico del derrame pleural. An Med Interna (Madrid). 2002; 19 (4): 202-208.
4. Villena Garrido V, Ferrer Sancho J, Hernández Blasco L. NORMATIVA SEPAR Diagnóstico y tratamiento del derrame pleural. Arch Bronconeumol. 2006; 42(7): 349-72.
5. Tan C, Sedrakyan A, Browne J. The evidence on the effectiveness of management for malignant pleural effusion: a systematic review. Eur J of Card Thor Surg .2006; 29: 829-838.
Tos
La tos se encuentra hasta en el 65% de los pacientes con CaP como síntoma inicial1. Puede ser productiva o no productiva e indica, habitualmente, compromiso de la vía aérea debido a que allí se localizan los receptores tusígenos2, 3.
Los opioides constituyen la mejor terapia farmacológica de supresión de la tos2, 3, 5, siendo la codeína el más utilizado con esta finalidad2-5. Basados en conversiones equi-analgésicas no hay opioides que
resulten mejores que otros en el control sintomático4. El uso de broncodilatadores y corticoides para el tratamiento de patologías comórbidas (p. ej.: bronquitis crónica) generaría mejoría sintomática en los pacientes con CaP (Grado de recomendación 1B)2-5.
Referencias
1. Vaaler AK et al, Obstructive atelectasis in patients with small cell lung cancer: incidence and response to treatment. CHEST. 1997; 111: 115-120.
2. Kvale P et al, Chronic cough due to lung tumors: ACCAP evidence-based clinical practice guidelines. CHEST. 2006; 129 (1 Suppl): 147S-153S.
3. Kvale PA et al, Palliative Care in Lung Cancer: ACCAP Evidence-Based Clinical Practice Guidelines (2nd Edition) American College of Chest Physicians. CHEST. 2007; 132 (3 Suppl): 368S-403S.
4. Molassiotis A et al, Clinical expert guidelines for the management of cough in lung cancer: report of a UK Task Group on Cough. Cough. 2010; 6(1): 9.
5. Molassiotis A et al, Interventions for cough in cancer. Cochrane Database Syst Rev 2010; (9): CD007881. Review.
La disnea es uno de los síntomas más frecuentes de los pacientes portadores de CaP, habiéndose reportado hasta en el 46% de los pacientes con enfermedad avanzada1. Los opioides. Un metaanálisis de 18 estudios randomizados demostró la efectividad de los opiodes2-4, por lo que constituyen el pilar fundamental del tratamiento de la disnea2, 3. Los opioides son significativamente mejores que el oxígeno en la paliación de la disnea en pacientes hipoxémicos y no hipoxémicos (Grado de recomendación 1C)5. No hay evidencia que avale la efectividad del uso de benzodiacepinas en el tratamiento de la disnea aunque algunos datos indican que su uso suplementario al de los opioides podría ser de utilidad (Grado de recomendación 2C)6, 7.
Referencias
1. Vainio A et al, Symptom Prevalence Group. (1996) Prevalence of symptoms among patients with advanced cancer: an international collaborative study. J Pain Symptom Manage. 1996; 12: 3–10
2. Kvale PA et al, Palliative Care in Lung Cancer: ACCAP Evidence-Based Clinical Practice Guidelines (2nd Edition) American College of Chest Physicians. CHEST. 2007; 132(3 Suppl): 368S-403S.
3. Viola R. et al, The management of dyspnea in cancer patients: a systematic review. Support Care Cancer. 2008; 16: 329–337.
4. Jennings A et al. A systematic review of the use of opioids in the management of dyspnoea. Thorax. 2002; 57: 939–944.
5. Clemens K. et al, Use of oxygen and opioids in the palliation of dyspnoea in hypoxic and non-hypoxic palliative care patients: a prospective study. Support Care Cancer. 2009; 17: 367–377.
6. Simon ST et al, Benzodiazepines for the relief of breathlessness in advanced malignant and non-malignant diseases in adults. Cochrane Database of Systematic Reviews. 2010; 20(1): CD007354.
7. Navigante AH et al, Midazolam as adjunct therapy to morphine in the alleviation of severe dyspnea perception in patients with advanced cancer. J Pain Symptom Manage. 2006; 31(1): 38-47.
Síndrome de vena cava superior
La vena cava superior tiene una pared fina, flujo de baja presión y está rodeada de numerosos ganglios; puede sufrir compresión extrínseca, invasión o infiltración directa de su pared, trombosis intraluminal o una combinación de los mecanismos precedentes1, 2. El estudio por imágenes recomendado en caso de sospecha de sindrome de la vena cava superior (SVCS) es la angiotomografía. La venografía en general se realiza en el curso de la colocación de un stent endovascular1, 2. El diagnóstico histológico o citológico es un requisito antes de iniciar la terapia adecuada en pacientes con SVCS asociado a patología maligna, especialmente porque el 60% de los pacientes se presentan sin diagnóstico conocido de cáncer. El objetivo del tratamiento es doble, por un lado paliar la obstrucción al flujo venoso de la VCS y por otro tratar la neoplasia pulmonar subyacente (Figura 1).
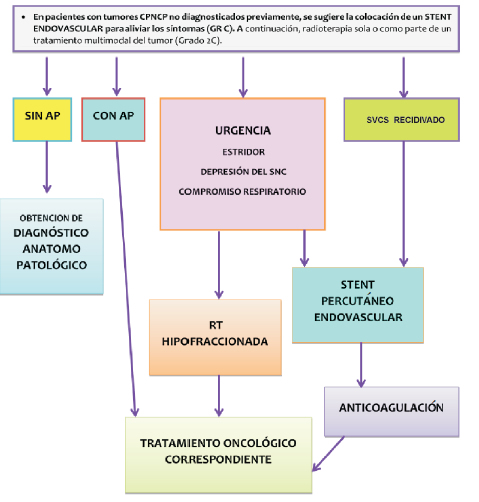
a) Situaciones clínicas
SVCS con estridor, compromiso respiratorio o depresión del sistema nervioso central. Se recomienda la urgente colocación de un stent endovascular seguido de RT. El stent percutáneo permite una rápida resolución de la obstrucción venosa con un mínimo disconfort y una rápida recuperación, ideal para pacientes en cuidados paliativos o estadios avanzados de CaP. También en pacientes con síntomas severos, la colocación de un stent endovascular puede usarse para lograr un rápido alivio.
CaPCNP no diagnosticados previamente. Se sugiere la colocación de un stent endovascular para aliviar los síntomas (GR C), seguido de RT sola o como parte de un tratamiento multimodal (Grado 2C).
Tratamiento previo con progresión o recidiva y SVCS sintomático. Se sugiere la colocación de un stent endovascular para aliviar los síntomas (Grado 2B). En caso de recidiva del SVCS la colocación de un nuevo stent es una opción válida.
Tumores quimiosensibles no diagnosticados previamente. Se recomienda la quimioterapia sistémica, tal como sería usada en ausencia de SVCS (GR C)1, 2.
RT de emergencia por compromiso severo de la vía aérea. Se sugiere un tratamiento hipofraccionado con altas dosis de corticoides para minimizar el riesgo de obstrucción de la vía aérea (GR C)3.
Otros casos. Si las imágenes son consistentes con malignidad, se requiere el diagnóstico histológico antes de iniciar la terapia oncológica.
Recomendaciones
- El tratamiento específico del tumor debe ser considerado en cada caso basándose en los tratamientos previos y el pronóstico general.
- Se sugiere anticoagulación a los pacientes con stent endovascular (Grado 2C).
- Se recomienda que los pacientes con CaPCNP T4 N0-1 (Estadio IIIA) con SVCS, sean evaluados por un grupo multidisciplinario que incluya un cirujano torácico con experiencia en CaP para determinar si el paciente es operable.
- La cirugía no se recomienda si hay compromiso N2 (Grado 1C).
Referencias
1. Friedman T, Quencer KB, Kishore SA et al. Malignant Venous Obstruction: Superior Vena Cava Syndrome and Beyond. Semin Intervent Radiol. 2017; 34(4): 398-408.
2. Seligson MT, Surowiec SM et al. Superior Vena Cava Syndrome StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing 2017.
3. Talapatra K, Panda S, Goyle S et al Superior vena cava syndrome: A radiation oncologist’s perspective. J Cancer Res Ther. 2016; 12(2): 515-9.
Hemoptisis
La hemoptisis aparece en el 7-10% de los pacientes con CaP, y es más frecuente en pacientes con lesiones centrales de la vía aérea que en lesiones periféricas del parénquima pulmonar. La hemoptisis leve no suele requerir ningún procedimiento broncoscópico, pero las de mayor cuantía pueden precisar tratamientos más específicos. La hemoptisis amenazante o severa en los pacientes con CaP tiene peor pronóstico que la producida por otras causas1. El manejo debe enfocarse en función del origen del sangrado teniendo como objetivo controlar el síntoma (Figura 1)1.
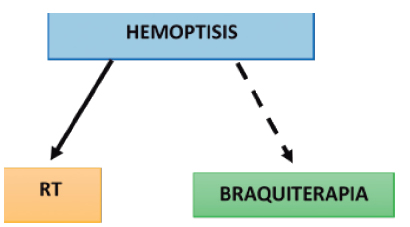
Cuando la hemoptisis no es amenazante y el tumor es resecable la resección quirúrgica es el mejor tratamiento, siempre que el paciente sea operable. La RT paliativa se reserva para los casos de tumor no resecable; tiene claras indicaciones en enfermos incurables y con enfermedad avanzada en quienes la cirugía no suele ser una alternativa y se han agotado el resto de opciones terapéuticas. El tratamiento se puede administrar mediante radioterapia externa o braquiterapia de alta dosis. Una opción es la bradioterapia externa en esquemas muy hipofraccionados (30 Gy en 10 fracciones, 5 Gy en 3 fracciones o 4 Gy en 5 fracciones) con los que se obtienen los mismos resultados que con un fraccionamiento estándar; tambien se puede indicar braquiterapia de altas dosis (2 fracciones de 8 Gy o 3 fracciones de 5-7 Gy).
Referencias
1. G. Rodrigues G. Videtic, R. Sur, A. Bezjak, J. Bradley, C.A. Hahn. Palliative thoracic radiotherapy in lung cancer: An American Society for Radiation Oncology evidence-based clinical practice guideline. Pract Radiat Oncol. 2011: 60-71.
Metástasis a distancia
a) Metástasis óseas
La incidencia de metástasis óseas secundarias a carcinomas y la grave repercusión funcional que provocan son motivos de constante atención en la práctica clínica habitual. El dolor es el síntoma más frecuente y suele aparecer como primer síntoma de forma progresiva, constante, no cede con el reposo, se exacerba con el descanso nocturno y tiene pobre respuesta a los analgésicos habituales, puede comenzar antes de que la metástasis sea evidente en los estudios diagnósticos1, 2. El tratamiento requiere un abordaje multidisciplinario teniendo como objetivo mejorar el dolor, recuperar la función de forma rápida y duradera para conseguir, si es posible, autonomía para las actividades cotidianas habituales1, 2 (Tabla 1).

Referencias
1. Manual Práctico de Oncología Radioterapia. SEOR
2. Guias Clinicas NCCN Cancer de pulmon. Version 1.2011. https://www.nccn.org/professionals/physician_ gls/pdf/nscl_blocks.pdf
b) Síndrome de compresion medular
La compresión medular constituye una de las principales urgencias en oncología puesto que el retraso en el diagnóstico y/o en el inicio del tratamiento puede dar lugar a déficit neurológicos irreversibles. El síndrome de compresión medular es el resultado de la compresión de la médula espinal o de las raíces nerviosas que forman la cola de caballo, debido a cualquier lesión relacionada con la enfermedad neoplásica de base. Las causas más frecuentes de compresión medular son las metástasis óseas vertebrales, aunque también puede estar provocada por metástasis intradurales, o incluso intramedulares, la invasión tumoral directa por neoplasias adyacentes, y tumores primarios medulares.
El cuadro clínico es muy característico en la mayoría de los casos, y se inicia con dolor progresivo de espalda que aumenta con los movimientos, paresia, pérdida sensitiva y de control de esfínteres hasta llegar a la compresión completa medular con parálisis. La velocidad de instauración de la sintomatología es lo que determina la urgencia del cuadro clínico. La clave para evitar llegar a la instauración de la compresión medular está en el diagnóstico y la instauración de tratamiento de forma precoz. La historia clínica y la exploración orientan la localización del nivel afectado. La técnica óptima de imagen que sirve para diagnóstico y planificación del tratamiento es la resonancia magnética1. El objetivo del tratamiento es conservar y/o recuperar la función neurológica, junto con la disminución y/o resolución de la sintomatología dolorosa, consiguiendo con ello mejorar la calidad de vida del paciente1- 3. El tratamiento médico se basa en el uso de corticoides. La “descompresión” se logra con cirugía seguida de RT postoperatoria en 2 semanas (30 Gy en 10 fracciones). La RT debe iniciarse de manera urgente; sin embargo, si la tetraplejia o paraplejia total presenta > 24 horas de evolución y dolor controlado la RT puede ser diferida. En pacientes con enfermedad metastásica diseminada, expectativa de vida de menos de 6 meses e histología desfavorable está indicada una única fracción de 8 Gy; en individuos con histologías favorables se aplican 30 Gy en 10 fracciones3. En pacientes con buen pronóstico el tratamiento de elección es la Cx siempre seguida de RT; si el pronóstico es desfavorable o el paciente no es candidato a cirugía la opción es la RT desde el inicio.
Referencias
1. Prasad D, Schiff D. Malignant spinal-cord compression. Lancet Oncol. 2005; 6: 15–24.
2. Rades D, Veninga T, et al. Outcome after radiotherapy alone for metastatic spinal cord compression in patients with oligometastases. J Clin Oncol. 2007; 25 (1): 50-56.
3. Manual Práctico de Oncología Radioterapica. (SEOR) Sociedad Española de Oncologia Radioterapica. www.seor.es/wp-content/uploads/Manual-Practico-de-Oncología-Radioterapica.pdf. Mayo 2014.
c) Metástasis cerebrales
El tratamiento radiante de los pacientes con metástasis cerebrales por CaPCNP sin mutación conductora (“driver mutation”) se enfoca en varios parámetros.
c.1 Pronóstico1 (Figura 1)
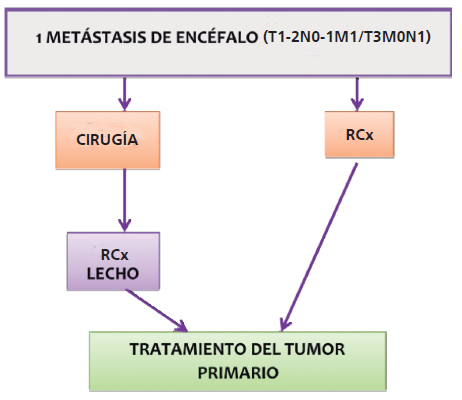
Clase I: ≤ 65 años con índice de Karnofsky (IK) ≥ 70%, sin metástasis en otros órganos y tumor primario controlado
-Clase II: Todos los pacientes con IK ≥ 70%, que no cumplimenten algunos requisitos de la Clase I
-Clase III: IK < 70%
En pacientes Clase I ó II se indica Cx o RCx2, para los Clase III es conveniente cuidados paliativos o radioterapia holoencefálica3 (RTHE) QUARTZ4, 5.
c.2 Número de metástasis
- Enfermedad cerebral limitada: ≤ 3 cm diámetro y ≤ 4 metástasis y buen PS, el tratamiento de RCx sola se considera estándar -Pacientes con 1 metástasis Cx o RCx, o Cx + RCx del lecho
- Hasta 4 metástasis RCx2. Hay trabajos que llegan a tratar hasta 10 lesiones con RCx4, 5
- No se demostró ventaja en sobrevida total con RTHE post Cx ó RCx6. La RTHE post SRS no está indicada y en los individuos ≤ 50 años, no mejora la sobrevida global y empeora la calidad de vida.
Recomendaciones
- Dosis de RCx 18 – 20Gy en 1Fx.
- Dosis de RTHE 30Gy-10 Fx 3Gy – 20Gy- 4Fx 5Gy3
- En pacientes con metástasis asintomáticas que no recibieron QT sistémica, puede indicarse la QT antes del tratamiento RTHE
- En estudios randomizados con pacientes con CaPCNP y metástasis cerebrales los tratados con RCx sola tuvieron menos deterioro cognitivo que los que recibieron RCx + RTHE, sin mejoría de la sobrevida total7
- En pacientes con mutación conductora (receptor del factor de crecimiento epidérmico, EGFR), translocación activadora (Kinasa de linfoma anaplásico, ALK) asintomáticos se puede comenzar tratamiento con TKIs (inhibidores tirosinkinasa, Gefitinib-Erlotinib) y retrasar la aplicación de RTHE6.
Referencias
1. Sperduto PW, Kased N, Roberge D et al. Summary report on the graded prognostic assessment: an accurate and facile diagnosis-specific tool to estimate survival for patients with brain metastases. J Clin Oncol. 2012; 30(4): 419–425.
2. Yamamoto M, Serizawa T, Shuto T et al. Stereotactic radiosurgery for patients with multiple brain metastases (JLGK0901): a multi-institutional prospective observational study. Lancet Oncol. 2014; 15: 387–395.
3. Tsao MN, Lloyd N, Wong RK et al. Whole brain radiotherapy for the treatment of newly diagnosed multiple brain metastases. Cochrane Database Syst Rev. 2012; 4: CD003869.
4. Mulvenna PM, Nankivell MG, Barton R et al. Whole brain radiotherapy for brain metastases from non-small lung cancer: quality of life (QoL) and overall survival (OS) results from the UK Medical Research Council QUARTZ randomised clinical trial (ISRCTN 3826061). J Clin Oncol. 2015; 33(20 Suppl); abstr 8005.
5. Robinet G, Thomas P, Breton JL et al. Results of a phase III study of early versus delayed whole brain radiotherapy with concurrent cisplatin and vinorelbine combination in inoperable brain metastasis of non-small-cell lung cancer: Groupe Français de Pneumo-Cancérologie (GFPC) Protocol 95-1. Ann Oncol. 2001; 12: 59–67.
6. Sahgal A, Aoyama H, Kocher M et al. Phase 3 trials of stereotactic radiosurgery with or without whole-brain radiation therapy for 1 to 4 brain metastases: individual patient data meta-analysis. Int J Radiat Oncol Biol Phys. 2015; 91: 710–717.
7. Pöttgen C, Eberhardt W, Grannass A et al. Prophylactic cranial irradiation in operable stage IIIA non-small-cell lung cancer treated with neoadjuvant chemoradiotherapy: results from a German multicenter randomized trial. J Clin Oncol. 2007; 25: 4987-4992.
ANEXOS
Anexo 1
a) Escalas de performance status
El estado general de un paciente oncológico, es un valioso elemento clínico que permite tomar decisiones en cuanto al manejo y clarificar en gran medida su pronóstico. Existen al menos 2 escalas, que a través de la objetivación del nivel de sintomatología y del grado de deambulación o postración determinan niveles o magnitud de compromiso de este estado general.
b) Escalas del East Cooperative Oncology Group (E.C.O.G.)1
Puntúa el estado funcional (Tabla 1)

c) Indice de Karnofsky2
La puntuación de Karnofsky es un método que mide el rendimiento de los pacientes en las actividades de la vida diaria. La calificación ha demostrado ser útil no sólo para seguir el curso de la enfermedad (déficit por lo general progresivo y finalmente la muerte), sino también un factor pronóstico: los pacientes con más alta puntuación de Karnofsky en el momento del diagnóstico del tumor tiene la mejor supervivencia y calidad de la vida en el transcurso de su enfermedad (Tabla 2).

Referencias
1. Oken M, Creech R, Tormey D, et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol. 1982; 5: 649-655
2. O’Toole DM; Golden AM. Evaluating cancer patients for rehabilitation potential. West J Med. 1991; 155(4): 384-7.
Anexo 2
a) Generalidades del tratamiento radiante1
a.1 Técnica
El mayor desafío de la RT es mejorar la relación terapéutica, lo que significa alcanzar una mayor probabilidad de curación con menor morbilidad. Un análisis de la National Cancer Data Base (NCDB) encontró que el uso de RT tridimensional (RT3D) o RT de Intensidad Modulada (IMRT sigla en inglés) mejoró la supervivencia en pacientes en estadio III, en comparación con los tratados con RT bidimensional (RT2D). Los tratamientos con técnica 3D conformados y/o la IMRT, son los aconsejados preferentemente para los estadios II y III. Sin embargo, cuando RT3D e IMRT se evaluaron por separado, no hubo mejor supervivencia con IMRT y los beneficios de la IMRT se limitaron a grupos específicos de pacientes. Otro análisis del NCDB sugirió una mejora a 5 años de la supervivencia media con IMRT para tumores T3 y T4.
La IMRT facilita una reducción de la dosis a los órganos sanos adyacentes, como el corazón, esófago, médula y pulmones. Estas tecnologías, requieren de una mayor precisión en su planificación, para ello se realiza una TC de simulación, colocando al paciente en posición supina con los brazos sobre la cabeza e inmovilizado con apoya brazos o alfa cradle (posicionamiento que será repetido a diario para su tratamiento, por lo cual debe ser cómodo y fácilmente reproducible para el paciente). Los cortes tomográficos deben realizarse cada 5 mm desde la glotis hasta por debajo del diafragma. Se debe determinar el PTV (planning tumor volumen, volumen tumoral planificado), teniendo en consideración el GTV (gross tumor volume, volumen tumoral visible y adenopatías) y el CTV (clinical tumor volume, volumen tumoral clínico incluyendo posible compromiso microscópico) y márgenes para el movimiento del blanco y errores del posicionamiento diario. Se aconseja la determinación del GTV por TC y/o PET-TC. La energía de fotones aconsejada para irradiar los blancos ubicados en parénquima pulmonar es de 6-10 MV (riesgo de infra-dosis del tumor con altas energías en la interfase tumor- parénquima pulmonar)
a.2 Dosis recomendada para tratamientos de RT3D conformada e IMRT
RT Pre-operatoria. 1) 40-50 Gy/2 Gy por Fracción (Fx) tratamiento concomitante. 2) 40-45 Gy/1.5 Gy-2Gy por Fx, tratamiento acelerado (Definitivo o Secuencial). El uso de mayores dosis en RT Preoperatoria (60-63Gy) no está estandarizado, sólo se utilizaría dentro de protocolos.
RT Post-operatoria. 1) 50-54 Gy/1.8-2 Gy por Fx, margen negativo. 2) 54-60 Gy/1.8-2 Gy por Fx, margen microscópico positivo o extensión extracapsular. El protocolo Lung ART está evaluando este esquema terapéutico adyuvante: Cx + QT adyuvante versus Cx + QT adyuvante + RT 54Gy secuencial.
RT definitiva (QT + RT Concomitante o Secuencial). 1) QT + RT Concomitante: Fraccionamiento Estándar 60-66 Gy /1.8-2 Gy por Fx/d en 30-33 días. Los tratamientos Acelerados no son práctica estándar en QT+RT concomitante. Hay que evitar la prolongación del tratamiento más allá de 7 semanas. 2) QT + RT Secuencial: Fraccionamiento Acelerado 66 Gy/2.75Gy por Fx/d en 24 días, que tendría mejores valores en sobrevida total. 3) QT+RT Concomitante de “Inducción”: Hiperfraccionamiento 45 Gy/1.5 Gy por 2Fx/d. Evaluación en dos brazos: QT+RT Concomitante Adaptativa “boost” hasta 65-71Gy, y Cx
RT situaciones especiales. 1) Metástasis en sistema nervioso central: RCx 18-20 Gy en una única fracción, 1 día. Holoencéfalo 30 Gy en 3 Gy por Fx/d o 20 Gy en 5Gy por Fx/d. Enfermedad oligo-metastásica: 105
(Ver Dosis – Anexo 2 Tabla 1). 2) Vértice pulmonar (Pancoast): RT pre-operatoria 45-46Gy/1.8-2Gy por Fx/d + QT
RT paliativa. 1) Enfermedad obstructiva (SVCS y/u obstrucción bronquial) 30-45Gy/3Gy por Fx/d, en 2-3 semanas. 2) Metástasis óseas con compromiso de partes blandas: 20Gy/4Gy por Fx/d o 30Gy/ 3Gy por Fx/d, en 1-2 semanas. 3) Metástasis óseas sin compromiso de partes blandas: 8Gy/8Gy por Fx/d (única fracción) o 30Gy/3Gy por Fx/d, en 2 semanas. 4) Cualquier metástasis en paciente con bajo PS 8Gy/8Gy por Fx/d (única fracción) o 20Gy/4Gy por Fx/d, en 1 semana.
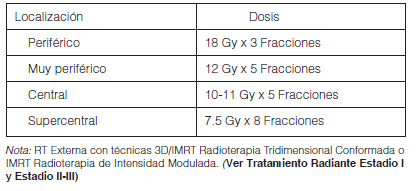
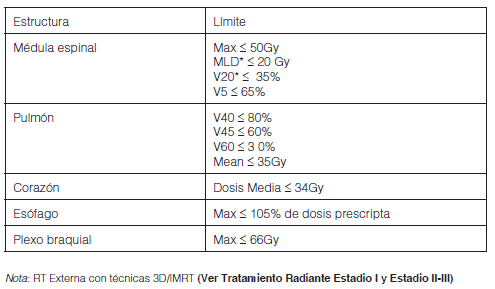
a.3 Radioterapia guiada por imágenes
La radioterapia guiada por imágenes (IGRT, sigla en inglés) consiste en el uso de imágenes durante el tratamiento radiante para mejorar la precisión y exactitud de su administración. En el caso del CaP la IGRT tiene indicación para tratar aquellos tumores que experimenten mayor movilidad, y/o estén próximos a estructuras críticas como las mediastinales. Los aceleradores lineales de radioterapia equipados con tecnologías de toma de imágenes le permiten al médico obtener imágenes del tumor antes y durante el tratamiento. Mediante la comparación de estas imágenes con las de referencia tomadas durante la simulación se pueden ajustar la posición del paciente y/o los haces de radiación para entregar una dosis de radiación adecuada al tumor.
En las últimas dos décadas los desarrollos tecnológicos de delineación de blancos, manejo de movimiento, planificación conformada e imagen guiada han permitido el desarrollo y la implementación de SBRT, una estrategia que emplea dosis ablativa de radioterapia sobre el target tumoral en 1 a 5 fracciones. El principio mayor de esta modalidad terapéutica es la pronunciada caída del gradiente de dosis por fuera del tumor, contribuyendo a que las estructuras vecinas sanas no estén expuestas a dosis ablativas de radiación. Con la evidencia proporcionada por estudios prospectivos y retrospectivos la SBRT se considera ahora el estándar de tratamiento para los pacientes médicamente inoperables con CaPCNP en estadio temprano periférico. La SBRT utiliza márgenes pequeños para el posicionamiento, facilitado por la tomografía computarizada de 4 dimensiones (TC4D).
Para preparar el tratamiento de RT en cuatro dimensiones (RT4D), a cada paciente se le realiza una TC de simulación en la posición en la que va a ser tratado. Uno de los principales problemas que presenta la irradiación de los tumores pulmonares es el movimiento provocado por la respiración y en menor medida por los latidos cardíacos, que hacen necesario irradiar el tumor con un margen de tejido pulmonar sano alrededor para asegurar que la lesión recibe la dosis necesaria. Para solucionar este problema la TC4D ofrece información precisa de la posición del tumor al estudiar su comportamiento lo largo de todo el ciclo respiratorio, existiendo unidades de tratamiento que administran la radiación de forma sincronizada con la respiración de cada paciente lo que permite reducir las dosis sobre los órganos sanos adyacentes. Las nuevas tecnologías ofrecen una alternativa en estos casos, como son el traking y el gating es decir, la sincronización del tratamiento con el movimiento respiratorio. En el gating se localizan el tumor y demás órganos de riesgo en un momento determinado del ciclo respiratorio, mientras que en el traking se realiza un «rastreo» del tumor y de los órganos de riesgo a lo largo del ciclo respiratorio, siendo entonces fundamental contar con buenas imágenes y correlacionarlas con cada fase del ciclo respiratorio. Para la SBRT la dosis recomendada por fracción es ≥ 5Gy (rango 5 Gy a 34 Gy por fracción) y el número de fracciones 5 (rango: 1 a 5). La entrega de dosis debe ser realizada en forma segura y precisa debido a altas dosis por fracción y escasas sesiones, mediante IGRT y RT4D.
Referencias
1. Potters L y col. American Society for Therapeutic Radiology and Oncology and American College of Radiology practice guidelines for the performance of stereo-tactic body radiation therapy. IJROBP. 2004; 60: 1026-1032.
Anexo 3
Recomendaciones para el manejo de muestras de tejido y citológicas, para equipos de cirugía, endoscopía, imágenes y patología1
Estas recomendaciones son válidas para el procesamiento habitual, pero indispensables para estudios de inmunohistoquímica y moleculares, porque de ellas depende la posibilidad de conservar la antigenicidad y recuperar ácidos nucleicos.
Colocar las muestras en formol en forma inmediata, cuidando de cubrir las muestras en forma completa, minimizando el tiempo desde la toma de la muestra a la fijación.
Anotar la fecha y hora en la que se colocó la pieza o biopsia en formol en la solicitud de estudio.
Remitir lo más rápido posible las muestras a los Servicios o Laboratorios de Patología, o establecer comunicación para que las muestras sean retiradas.
Fijación: Utilizar formol buffer al 10% (No usar Bouin ni otros fijadores) durante 6-12 horas las muestras pequeñas y 8-18 horas para muestras mayores. Es recomendable que el patólogo se asegure que el formol que se use está bien preparado cuando no lo provee. Usar descalcificadores basados en EDTA, no en ácido nítrico.
Punciones bajo control radioscópico o TC: Es recomendable que el patólogo esté presente durante el procedimiento, no sólo para evaluación de la representatividad de la muestra sino para adecuación del material, previendo posibles estudios moleculares. Se recomienda realización de extendidos y coágulos para inclusión.
No se recomienda tomar muestras que vayan directamente a estudios moleculares sin el diagnóstico y revisión del patólogo, porque se debe confirmar la presencia de tumor en la muestra antes de realizar otros análisis.
Referencias
1. Travis WD, Brambilla E, Burke AP, Marx A, Nicholson AG. WHO Classification of Tumours of the Lung, Pleura, Thymus and Heart. Lyon: International Agency for Research on Cancer; 2015
Anexo 4
Grados de recomendación
A. Extremadamente recomendable (buena evidencia de que la medida es eficaz y los beneficios superan ampliamente a los perjuicios).
B. Recomendable (al menos moderada evidencia de que la medida es eficaz y los beneficios superan a los perjuicios).
C. Ni recomendable ni desaconsejable (al menos moderada evidencia de que la medida es eficaz, pero los beneficios son muy similares a los perjuicios y no puede justificarse una recomendación general).
D. Desaconsejable (al menos moderada evidencia de que la medida es ineficaz o de que los perjuicios superan a los beneficios).
I. Evidencia insuficiente, de mala calidad o contradictoria, y el balance entre beneficios y perjuicios no puede ser determinado.
Todas las recomendaciones tienen grado B, excepto donde esté específicamente indicado.
CONCLUSIÓN
El Cáncer de Pulmón de Células No Pequeñas es una patología de gran impacto a nivel mundial. Consideramos que es de suma importancia desarrollar un espacio de discusión, análisis y revisión de esta afección, y este consenso es el paso inicial hacia este objetivo.
Este documento pretende destacar la importancia de la sospecha temprana mediante la detección de signos y síntomas de alarma. Además, se subraya la necesidad de abreviar al máximo los plazos del proceso diagnóstico y de inicio del tratamiento.
Proponemos que el manejo de un paciente con cáncer de pulmón de células no pequeñas debería ser discutido por un equipo multidisciplinario, en el contexto de un Comité Oncológico.
Respecto del tratamiento, revisamos evidencias que sustentan que las nuevas terapias conllevan beneficios, prolongando la sobrevida y mejorando la calidad de vida. Sin embargo, aún queda mucho camino por andar. La comunidad médica tiene el compromiso ineludible de facilitar el ingreso de estos pacientes a protocolos clínicos de investigación, particularmente de aquellos con enfermedad avanzada, con el objetivo de obtener a mediano plazo un cambio en el pronóstico.
Estamos esperanzados que las recomendaciones de este consenso serán de utilidad a la comunidad oncológica del país tanto como a los pacientes con esta enfermedad