Autor : Moreno, Pablo1, Luhning, Susana2, YÃĄÃąez, AnahÃ1, Stock, Ana2, Gattolin, Gabriel1, Mattarucco, Walter2, Maillo, Martino1, HernÃĄndez, Marcos2, SÃvori, MartÃn2
1 AsociaciÃģn Argentina de Alergia e InmunologÃa ClÃnica (AAAeIC) 2 AsociaciÃģn Argentina de Medicina Respiratoria (AAMR)
https://doi.org/10.56538/ramr.JTGE4865
Correspondencia : Pablo Moreno. E-mail: secreÂtaria@aaaeic.org.ar
RESUMEN
El
asma es una enfermedad crÃģnica de la vÃa aÃĐrea prevalente en nuestro paÃs, con
frecuente mal control. Algunos especialistas de la AsociaciÃģn de Alergia e
InmunologÃa ClÃnica y la AsociaciÃģn Argentina de Medicina Respiratoria han
realizado recomendaÂciones sobre el manejo y tratamiento del asma mediante la
metodologÃa de consenso RAND/UCLA Delphi modificada sobre la base de la
evidencia cientÃfica (GRADE).
Este
documento provee recomendaciones basadas en la opiniÃģn de especialistas y
fundamentada en evidencia cientÃfica seleccionada en cuanto a la importancia de
mejorar la adherencia al tratamiento y seguimiento a travÃĐs de diferentes
estrategias. Asà mismo, provee recomendaciones actualizadas en aspectos
crÃticos del tratamiento del asma leve al grave.
Se
recomienda, para mejorar la adherencia, el uso de planes personalizados de
manejo (1 °C), uso de herramientas a travÃĐs de telÃĐfonos mÃģviles (1B) y
educaciÃģn (1 °C). Con respecto a la inmunoterapia sublingual solo debe ser
indicada a pacientes con asociaÂciÃģn con rinitis alÃĐrgica, asociada a ÃĄcaros y
sÃntomas de asma a pesar del tratamiento adecuado con FEV1 > 70 % (1B). Se recomienda fuertemente en
el asma leve (escalÃģn 2 GINA) el uso de broncodilatadores de acciÃģn rÃĄpida
asociados a corticoides inhalados a demanda (1A). En asma grave, se recomienda
el uso de la triple terapia inhalada con anticolinÃĐrgicos de acciÃģn prolongada,
beta 2 de acciÃģn prolongada y corticoides inhaÂladas (1B). El uso de biolÃģgicos
en asma grave estÃĄ fuertemente indicado en fenotipo T2 con dupilumab
(1A), T2 alÃĐrgico con omalizumab (1A) y en el T2 eosinofÃlico con benralizumab, o mepolizumab, con sus caracterÃsticas distintivas (1A).
Palabras
clave: Asma,
Adherencia, Inmunoterapia, Triple terapia, BiolÃģgicos
ABSTRACT
Asthma is a common chronic airway
disease in our country, although with high poor conÂtrol. Some specialists
of the AsociaciÃģn de Alergia e InmunologÃa ClÃnica
and AsociaciÃģn
Argentina de Medicina
Respiratoria have made recommendations for management
and treatment of asthma, using a RAND/UCLA modified Delphi consensus
methodology, based on GRADE evidence.
This document provides
recommendations based on specialist opinions about different strategies to
improve adherence. Besides, it provides recommendations about critical issues
of mild to severe asthma treatment.
ItÂīs recommended to improve
adherence, personalized control-based management plan (1 °C), mobile devices
(1B) and education (1 °C). Sublingual immunotherapy must be prescribed only in
patients with allergic rhinitis, mite associated, and persistent symptoms
although appropriate treatment with FEV1>
70 % (1B). Use of fast action bronchodilators associated with inhaled
corticosteroids prn in mild asthma (GINA stage 2) has
strong recommendation (1A). Use of triple inhaled therapy (long acting anticholinergics, long acting beta 2 agonists and inhaled
corticosteroids) is recommended in severe asthma (1B). Biologics has strong
recommendations severe asthma: in phenotype T2 with duÂpilumab
(1A), in phenotype allergic T2 with omalizumab (1A)
and phenotype eosinophilic T2 with benralizumab or mepolizumab with
distinctive characteristic (1A).
Key word: Asthma, Adherence, Immunotherapy, Triple therapy, Biologics
Recibido: 07/08/2023
Aceptado: 21/10/2023
INTRODUCCIÃN
El
asma es una enfermedad heterogÃĐnea, inflamaÂtoria de la vÃa aÃĐrea caracterizada
por episodios recurrentes de broncoespasmo, hiperreactividad bronquial y
aumento de las secreciones bronÂquiales.1-3 Afecta aproximadamente a trescientos millones
de personas en todo el mundo. En LaÂtinoamÃĐrica existe una gran heterogeneidad
en cuanto a la prevalencia segÚn cada paÃs, con una fluctuaciÃģn del 5 % al 24 %
como ocurre en Costa Rica.4 En Argentina,
se estima que entre el 6,4 % y el 9,36 % de la poblaciÃģn tiene asma segÚn difeÂrentes
estudios.5,
6
El
conocimiento sobre la enfermedad, ha tenido grandes avances en los Últimos aÃąos
en todas sus ÃĄreas y en especial en relaciÃģn con el diagnÃģstico y tratamiento.
Pero, paradÃģjicamente, si bien se pudo disminuir su morbimortalidad al reducir
la mortalidad y hospitalizaciones con el tratamiento preventivo antinflamatorio, sigue habiendo indicaÂdores
epidemiolÃģgicos de mal control e, incluso en algunos paÃses, porcentajes de
hospitalizaciones y mortalidad, llamativamente elevados.1-3, 5, 7, 8
Este
nuevo conocimiento genera tambiÃĐn temas de discusiÃģn y puntos de interÃĐs que
requieren un posicionamiento local. Existen ya suficientes guÃas
internacionales de reciente publicaciÃģn y una local de hace algunos aÃąos, que
abarcan ampliamente el diagnÃģstico y tratamiento del asma. El objetivo es
responder preguntas claves con el mÃĄs alto nivel de evidencia
centrados en temas afines al manejo del asma de modo de producir una
herramienta prÃĄctica y de rÃĄpida lectura, con recomendaciones que permitan
realizar un aporte original orientado al interÃĐs de los mÃĐdicos dedicados al
asma.1-3, 9, 10
Este
documento fue elaborado por un panel de especialistas de la AsociaciÃģn de
Alergia e InmunoÂlogÃa ClÃnica (AAAeIC) y la
AsociaciÃģn Argentina de Medicina Respiratoria (AAMR), con especial ÃĐnfasis en
establecer recomendaciones basadas en evidencia cientÃfica, en relaciÃģn con el
diagnÃģstico y tratamiento del asma en adultos, adaptadas localmente.
MATERIAL Y MÃTODOS
La
convergencia de ambas sociedades permitiÃģ analizar las aÃĐreas comunes.
Eligieron representantes con amplia experiencia en el manejo del asma de cada
sociedad para seleccionar las preguntas que respondieran al comÚn denominador
de puntos de discusiÃģn y, a la vez, tuvieran relevancia clÃnica en nuestro paÃs
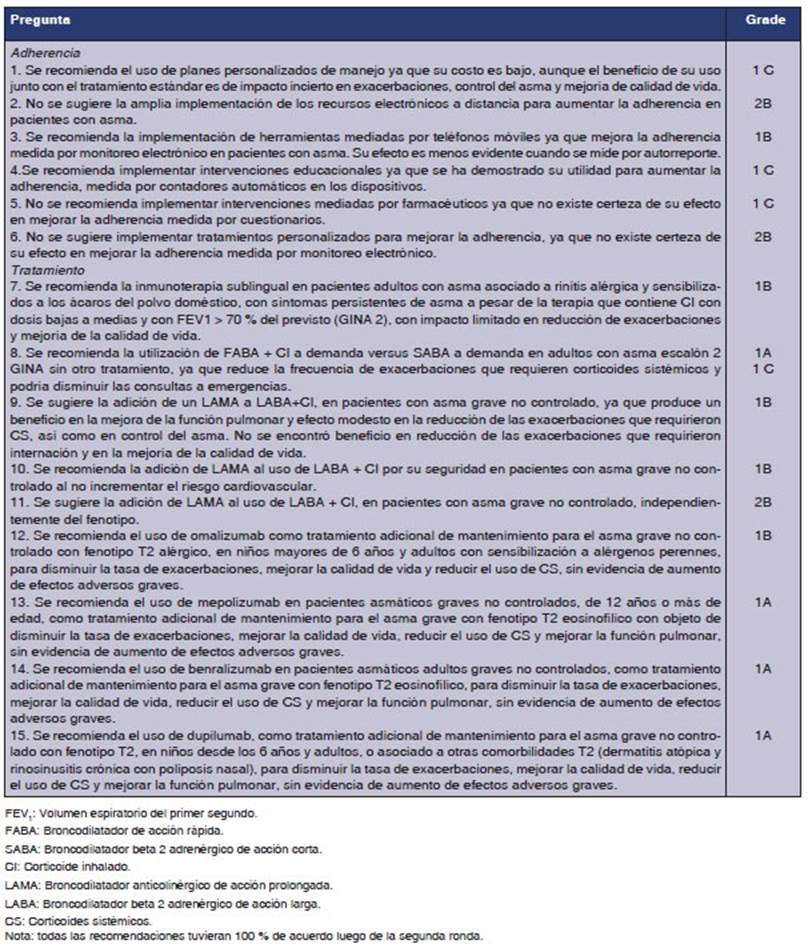
sobre el diagnÃģstico y tratamiento del asma en adultos. Veintiocho
especialistas propusieron veintidÃģs preguntas que responder, y asignaban un
puntaje por ambas condiciones. Se ordenaron de mayor a menor puntaje y se
analizaron las 15 primeras (Tabla 1). A los fines de la redacciÃģn del artÃculo,
fueron agrupadas en razÃģn de los temas que abordaban (siete preguntas sobre
adherencia y ocho sobre tratamiento) para que se discutiera y analizara cada
pregunta, y se establecieran las recomendaciones correspondientes (Figura 1).

Se
realizaron bÚsquedas bibliogrÃĄficas en las bases de datos MEDLINE, EMBASE,
Cochrane, SciELO y Lilacs hasta 31 de octubre de
2022, usando como palabras buscaÂdoras las correspondientes a sus respectivas
preguntas. Se usÃģ el sistema de graduaciÃģn GRADE (Grading
of RecomÂmendations, Assessment,
Development, and Evaluation)
de nivel de evidencia cientÃfica de las publicaciones de la American College of Chest Physicians (ACCP), y el nivel de recomendaciÃģn
recientemente publicado.11 Los niveles de
evidencia cientÃfica fueron caracterizados como A (evidencia sÃģlida), B
(moderada) y C (baja o muy baja) segÚn el diseÃąo del estudio, consistencia de
los resultados y claridad de la evidencia para responder a las preguntas
clÃnicas. Este sisÂtema fue seleccionado por ser simple, transparente,
explÃcito y consistente con la aproximaciÃģn metodolÃģgica actual para el proceso
de desarrollo de buenas prÃĄcticas clÃnicas basada en evidencia. Las
recomendaciones fueron caratuladas de acuerdo con el balance entre riesgo,
beneficio, importancia social y epidemiolÃģgica, y, en ocasiones, el costo.
Pueden ser 1 de nivel obligatorio o 2 de nivel dudoso. Por ejemplo, una
recomendaciÃģn 1A es una recomendaciÃģn obligatoria de sÃģlida evidencia
cientÃfica, y una recomendaciÃģn 2 C es una de baja evidencia cientÃfica y
dudosa.11
Las
recomendaciones en respuesta a cada pregunta fueÂron sometidas al acuerdo de un
panel de nueve especialistas (cuatro alergistas y cinco neumonÃģlogos)
mediante la metodologÃa de Consenso Delphi modificado RAND/UCLA.12, 13 Se considerÃģ
como acuerdo de una recomendaciÃģn si se llegaba al 75 % de consenso. Cada
pregunta con su recomendaciÃģn fue discutida en reuniones virtuales por el panel
de especialistas. En caso de no llegar en una primera ronda a un acuerdo, se
realizaba una segunda ronda, luego de una revisiÃģn de la bibliografÃa y de las
propuestas, una semana despuÃĐs. Todas las recomendaciones llegaron a un acuerdo
que superÃģ el 75 % en el lapso de dos rondas.
PREGUNTAS Y
RECOMENDACIONES
Sobre adherencia
La
OrganizaciÃģn Mundial de la Salud (OMS) define a la adherencia como âel grado en
que el uso de la medicaciÃģn por parte del paciente se corresponde con el
rÃĐgimen prescritoâ.14 El
comportamiento del paciente en la adhesiÃģn al tratamiento es complejo y
diverso. Es claramente reconocido que la falta de adherencia es muy frecuente
en los pacientes con asma (30 %-70 %) y motivada por muchos factores.1, 3, 9, 10 El concepto
de pobre adherencia se aplica sobre todo a la subutilizaciÃģn del tratamienÂto
diario preventivo.15-21 Es evidente
que la pobre adherencia genera aumento de la morbimortalidad y del consumo de
recursos de salud. Los factores psicosociales del paciente, inherentes a la
propia enfermedad, la relaciÃģn mÃĐdico-paciente hasta el acceso a los
medicamentos han sido ampliamente determinados en los estudios.15-21 En las varias deÂfiniciones de ÂŦasma mal
controladaÂŧ, chequear los problemas de adherencia y actuar sobre ella antes de
caratular la afecciÃģn de un paciente como asma grave es un paso obligatorio en
las recomendacioÂnes de las diferentes guÃas internacionales y naÂcionales.1-3, 8-10 En los
estudios clÃnicos, se requiere garantizar una
adherencia al tratamiento mayor del 80 % del tiempo, y esto se logra no solo
con el autorreporte del paciente en cuanto a la toma
de la medicaciÃģn, sino tambiÃĐn con el conteo de dosis de las drogas en estudio
y dispositivos electrÃģnicos de dosis en cada visita o telemedicina. Por lo
tanto, es probable que el mejor control del asma se logre en estos pacientes
solo con mejorar la adherencia.21
La educaciÃģn del paciente con asma es esencial y recomendada en
todas las guÃas con evidencia A en cuanto al beneficio de disminuir la
morbilidad y mejorar la adherencia al seguimiento y trataÂmiento.1-3, 9,
22, 23
Debido a su relevancia, se agruparon las priÂmeras preguntas sobre
diferentes intervenciones para mejorar la adherencia y sus respectivas reÂcomendaciones.
1. Pregunta ÂŋCuÃĄl es la eficacia de agreÂgar un plan de
tratamiento por escrito a los cuidados habituales en pacientes adultos con asma
en tratamiento ambulatorio?
JustificaciÃģn:
Todas las guÃas internacionales y locales coinciÂden en la
necesidad de ofrecer al paciente asmÃĄtico un plan de tratamiento escrito, incluso
a pesar de su difÃcil implementaciÃģn1-3, 8, 9, 22, 23 y al hecho de
que la evidencia cientÃfica sobre los efectos posiÂtivos, en el manejo del
asma, de contar con este instrumento es bajo.
Por un lado, contar con un plan escrito contribuÂye a la inclusiÃģn
del paciente como un participante activo del tratamiento y como protagonista de
su propia dolencia. Es de esperar asà que el conociÂmiento del tratamiento y
del plan de acciÃģn le perÂmita al paciente un mejor control de la enfermedad,
dado que le proporcionan mÃĄs herramientas para, llegado el caso, solicitar
oportunamente una conÂsulta a tiempo. AdemÃĄs, un plan escrito favorece la toma
de conciencia sobre la enfermedad, por parte del paciente, lo que disminuye los
efectos indeseados causados por la baja percepciÃģn del riesgo que conlleva ser
asmÃĄtico. En este punto, es considerable la importancia de un plan de traÂtamiento
escrito, dado que las personas con diagÂnÃģstico de asma suelen subestimar sus
sÃntomas y los posibles desenlaces fatales, sobre todo en asma mal controlada.6-8
Por otro lado, la implementaciÃģn concreta de un plan de
tratamiento escrito se considera altamente factible, por su bajo costo, y
favorable tambiÃĐn para el personal sanitario vinculado al paciente asmÃĄtico y
los cuidadores de asmÃĄticos de grupos de riesgo.1-3, 8, 9, 22-24
Por Último, un instrumento como el plan de tratamiento escrito
puede contribuir a aumentar la adherencia a los tratamientos de asma,
adherencia que es, en general, baja y cuya mejora es prioridad.
RecomendaciÃģn
Se recomienda el uso de planes personaÂlizados de manejo ya que su
costo es bajo, aunque
el beneficio de su uso junto con el tratamiento estÃĄndar es de impacto incierto
en exacerbaciones, control del asma y mejoÂrÃa de calidad de vida (1 C).
2.
Pregunta. ÂŋDeberÃan usarse recursos electrÃģnicos a distancia versus control haÂbitual
en pacientes adultos con asma en tratamiento ambulatorio?
JustificaciÃģn
Existe
gran variabilidad en la evidencia cientÃfiÂca en torno a la utilidad de los
recursos electrÃģnicos a distancia a la hora de aumentar la adherencia al
tratamiento en pacientes con asma. La incerÂtidumbre se debe a heterogeneidad
metodolÃģgica proveniente de las poblaciones y a los mÃĐtodos de mediciÃģn, dos
factores que afectan la variabilidad del tamaÃąo del efecto.25
MÃĄs
precisamente, la certeza es alta para la adherencia al tratamiento evaluada por
monitoreo electrÃģnico; baja, para la evaluada por autorreporÂte;25 y muy baja, para la evaluada por reposiciÃģn
del aerosol por farmacia. Los resultados de la evidencia son entonces dispares
y poco concluyentes acerca de la real eficacia de la utilizaciÃģn de recursos
electrÃģnicos a distancia para mejorar la adherencia al tratamiento del asma.
RecomendaciÃģn
No
se sugiere la amplia implementaciÃģn de los recursos electrÃģnicos a distancia
para aumentar la adherencia en pacientes con asma (2 B).
3.
Pregunta. ÂŋDeberÃan usarse intervenÂciones basadas en telÃĐfonos mÃģviles versus
cuidado habitual en pacientes adultos con asma?
JustificaciÃģn
La
certeza sobre la relaciÃģn positiva entre el uso de las herramientas mediadas
por telÃĐfonos mÃģviÂles y la mejora de la adherencia es alta. En cambio, es
moderada para la evaluada por el autorreporte.26
RecomendaciÃģn
Se
recomienda la implementaciÃģn de heÂrramientas mediadas por telÃĐfonos mÃģviles ya
que mejoran la adherencia medida por monitoreo electrÃģnico en pacientes con
asma. Su efecto es menos evidente cuando se evalÚa por autorreporte
(1 B).
4.
Pregunta. ÂŋDeberÃa usarse la educaÂciÃģn como intervenciÃģn para promover la
adherencia versus el control habitual en pacientes adultos con asma en
tratamiento ambulatorio?
JustificaciÃģn
Como
ya se ha mencionado, la educaciÃģn es esencial en el seguimiento y tratamiento
del paÂciente asmÃĄtico.1-3, 9, 22, 23, 27 En efecto, el conjunto de
contenidos de dicha educaciÃģn favorece directa o indirectamente la adherencia.
Entre los contenidos relevantes que no se deben omitir se incluyen: el
diagnÃģstico correcto, las pautas de reconocimiento temprano de exacerbaciones y
de cÃģmo actuar ante ellas, las herramientas para reconocer los diferenÂtes
tipos de tratamiento farmacolÃģgico de control y de rescate, la importancia de
la adherencia, asà como tambiÃĐn la relevancia de las tÃĐcnicas adecuaÂdas de uso, de la reducciÃģn de eventos adversos, de realizar
consultas mÃĐdicas rÃĄpidamente y del correcto manejo de comorbilidades.1-3,
9, 22, 23, 27
RecomendaciÃģn
Se
recomienda implementar intervencioÂnes educacionales, ya que se ha demostrado
su utilidad para aumentar la adherencia, medida por contadores automÃĄticos en
los dispositivos (1 C).
5.
Pregunta. ÂŋDeberÃan usarse intervenÂciones lideradas por farmacÃĐuticos para
promover la adherencia versus el control habitual en pacientes adultos con
diagnÃģsÂtico de asma en tratamiento ambulatorio?
JustificaciÃģn
Los
problemas de adherencia al seguimiento y tratamiento son muy frecuentes en
pacientes con asma, y esto obedece a mÚltiples factores, como ya se ha
mencionado. Muchos estudios han investigaÂdo diferentes tipos de intervenciones
del personal farmacÃĐutico para evaluar el impacto beneficioso sobre la
adherencia, con resultados no concluyenÂtes. La certeza es muy baja sobre la
reposiciÃģn del aerosol por farmacia para mejorar la adherencia y baja para el
autorreporte.28
RecomendaciÃģn
No
se recomienda implementar intervenÂciones mediadas por farmacÃĐuticos ya que no
existe certeza de su efecto en mejorar la adherencia evaluada por cuestionarios
(1 C).
6.
Pregunta. ÂŋDeberÃa usarse el tratamienÂto personalizado como intervenciÃģn para
promover la adherencia versus el tratamienÂto habitual en pacientes adultos con
diagnÃģstico de asma en tratamiento ambulatorio?
JustificaciÃģn
Debido
a los datos contradictorios publicados en relaciÃģn con el uso de los planes de
acciÃģn personaÂlizados mÃģviles frente a los planes de acciÃģn escritos y al
riesgo de sesgo, no estÃĄ claro en este momento si un formato de plan de acciÃģn
es superior al otro tanto para los adolescentes como para los adultos.27
RecomendaciÃģn
No
se sugiere implementar tratamientos personalizados para mejorar la adherencia,
ya que no existe certeza de su efecto en meÂjorar la adherencia medida por
monitoreo electrÃģnico (2 B).
En
relaciÃģn al tratamiento
7.
Pregunta. ÂŋDeberÃa usarse tratamiento farmacolÃģgico + inmunoterapia sublingual
(SL) versus tratamiento farmacolÃģgico o placebo en pacientes adultos con
diagnÃģstico de asma alÃĐrgico?
JustificaciÃģn
En
la Última ediciÃģn de la Global Initiative for Asthma (GINA) se define que
la inmunoterapia especÃfica (ITE) para alÃĐrgenos puede ser una opciÃģn de
tratamiento donde la alergia desempeÃąa un papel destacado, incluido el asma con
rinoÂconjuntivitis alÃĐrgica.1 Hay dos formas
de ITE: sublingual (SLIT) y subcutÃĄnea (SCIT). Si bien se identificaron efectos
modestos en una revisiÃģn sistemÃĄtica de SLIT para el asma en adultos y niÃąos,
estos se limitan predominantemente a sÃntomas orales y gastrointestinales.29
Como con cualquier tratamiento, los beneficios potenciales de SLIT para
pacientes individuales deben sopesarse frente al riesgo de efectos adversos y
el costo para el paciente y el sistema de salud.1
Por
otro lado, en GEMA 2022, se hace refeÂrencia a la SCIT con extractos
alergÃĐnicos como un tratamiento eficaz para el asma alÃĐrgica bien controlada
con niveles bajos o medios de trataÂmiento (escalones terapÃĐuticos 2 a 4),
siempre que se haya demostrado una sensibilizaciÃģn mediada por IgE frente a aeroalÃĐrgenos
comunes que sea clÃnicamente relevante, se utilicen extractos bien
caracterizados y estandarizados y se evite el uso de mezclas complejas.1,
2, 30-33 No obstante, muchos pacientes con asma leve intermitente
(escalÃģn 1) padecen de forma concomitante rinitis alÃĐrgica moderada o grave,
que justificarÃa la prescripciÃģn de inmunoterapia.34 La SCIT no debe
prescribirse a pacientes con asma grave y no controlada, por no estar bien
documentada su eficacia y por el eleÂvado riesgo de reacciones adversas graves,
incluso mortales.33, 35 Por ello, deberÃa ser prescrita por mÃĐdicos
especialistas con experiencia en este tipo de tratamiento y administrada en
centros que disÂpongan de las medidas bÃĄsicas para el tratamiento inmediato de
una posible reacciÃģn adversa grave. La bÚsqueda de alternativas mÃĄs seguras y
conveÂnientes para el paciente, ha estimulado el estudio de la eficacia de la
SLIT. La mayorÃa de los ensayos clÃnicos que han demostrado eficacia clÃnica lo
han hecho con extractos bien caracterizados y a dosis muy superiores a las
habitualmente utilizadas en la SCIT. El perfil de tolerancia de la
inmunoterapia sublingual es Ãģptimo y no se han descrito reaccioÂnes mortales.34,
36 La SLIT en liofilizado oral de ÃĄcaÂros, cuando se aÃąade al tratamiento
farmacolÃģgico reglado de mantenimiento, es capaz de disminuir el nÚmero de
exacerbaciones moderadas a graves y mejorar el control de la enfermedad, con
muy buen perfil de seguridad.37 Por ello, es recomendable su uso en
pacientes adultos con asma moderada controlada o parcialmente controlada.34
Cuando existan diversas alternativas de inmunoterapia disÂponibles, se debe
priorizar el uso de las que tengan la consideraciÃģn de medicamentos registrados
con eficacia, seguridad y calidad bien establecidas. Por el momento, no existen
estudios comparativos soÂbre el costo-efectividad de la inmunoterapia frente a
la farmacoterapia convencional y, ademÃĄs, es preÂvisible que no los haya,
puesto que la complejidad de su diseÃąo los hace poco viables. No obstante, la
ITE, ademÃĄs del control de las manifestaciones de la enfermedad, aporta, como
ventajas adicionales sobre la farmacoterapia, el mantenimiento de los
beneficios clÃnicos obtenidos hasta varios aÃąos despuÃĐs de la retirada del
tratamiento, la dismiÂnuciÃģn del riesgo de desarrollar asma en pacientes con
rinitis alÃĐrgica, o la apariciÃģn de nuevas senÂsibilizaciones en pacientes
monosensibles.38-41 Por otro lado, la inmunoterapia con alÃĐrgenos
tiene una justificaciÃģn inmunolÃģgica Única, ya que el enfoque se adapta al
espectro de IgE especÃfico de un individuo y modifica
el curso natural de la enfermedad, ya que tiene una eficacia persistente
despuÃĐs de la finalizaciÃģn del tratamiento. En esta perspectiva, la
inmunoterapia con alÃĐrgenos (AIT) tiene que ser considerada actualmente como un
prototipo de medicina de precisiÃģn.42
RecomendaciÃģn
Se
recomienda la inmunoterapia sublinÂgual en pacientes adultos con asma asociaÂdo
a rinitis alÃĐrgica y sensibilizados a los ÃĄcaros del polvo domÃĐstico, con
sÃntomas persistentes de asma a pesar de la terapia que contiene CI con dosis
bajas a medias y con FEV1 > 70 % del previsto (GINA 2), con impacto limitado
en reducciÃģn de exacerbaciones y mejorÃa de la calidad de vida (1 B).
8.
Pregunta. ÂŋDeberÃa usarse broncodilaÂtador de acciÃģn rÃĄpida (FABA) + corticoides
inhalados (CI) a demanda versus broncoÂdilatador beta 2 de acciÃģn corta (SABA)
a demanda en adultos con asma escalÃģn 2 de GINA?
JustificaciÃģn
A
partir de la nueva informaciÃģn clÃnica, en 2021 las principales guÃas
internacionales realizaron cambios en las estrategias de tratamiento del asma.1,
2 La indicaciÃģn de corticoides inhalados en dosis fija en el escalÃģn 2 de
GINA sigue siendo la elecciÃģn, ya que permite mejor (o mayor) control de la
enfermedad, ademÃĄs de tener una accesibilidad uniforme en el sistema de salud.1
Es importante destacar que los estudios controlados prospectivos, doble ciego,
que fueron analizados, se realizaron con la combinaciÃģn budesonida-formoterol
en dosis fija.43-48 Esta estrategia de tratamiento ha demostrado con
alto nivel de evidencia en el caso de la reducciÃģn de exacerbaciones que
requieren uso de CS, pero no asà para el resto de las variables, como consultas
a guardia, mejorÃa de la calidad de vida, control del asma y mejorÃa de la
funciÃģn pulmonar.49
Si
bien la informaciÃģn analizada no aplica estricÂtamente a los pacientes
comprendidos en el escalÃģn 1 de GINA, entendemos que esta estrategia podrÃa ser
aplicada a estos pacientes con menor grado de evidencia. Pero como
recomendaciÃģn fuerte a favor para el uso de la combinaciÃģn budesonida-formoterol
a demanda, que es la combinaciÃģn disÂponible en nuestro paÃs, con el objetivo
de reducir la frecuencia de exacerbaciones que requieren corticoides sistÃĐmicos
con probable reducciÃģn de consultas a guardia.
RecomendaciÃģn
Se
recomienda la utilizaciÃģn de broncodiÂlatador de acciÃģn rÃĄpida + corticoides
inhaÂlados (FABA + CI) a demanda versus bronÂcodilatador beta 2 de acciÃģn corta
(SABA) a demanda en adultos con asma escalÃģn 2 de GINA sin otro tratamiento, ya
que reduce la frecuencia de exacerbaciones que requieren corticoides sistÃĐmicos
(1 A) y podrÃa dismiÂnuir las consultas a emergencias (1 C).
9.
Pregunta. ÂŋDeberÃan usarse broncodiÂlatadores anticolinÃĐrgicos de acciÃģn prolonÂgada
(LAMA) + CI + broncodilatador beta 2 adrenÃĐrgico de acciÃģn prolongada (LABA)
versus LABA + CI para pacientes adultos con asma grave no controlada?
JustificaciÃģn
Los
broncodilatadores anticolinÃĐrgicos fueron de los primeros grupos farmacolÃģgicos
para tratar el asma, como componente natural de la belladona. MÃĄs allÃĄ
de la acciÃģn broncodilatadora, los anticoliÂnÃĐrgicos de acciÃģn prolongada
presentan acciones antiinflamatorias por vÃa neuronal y no neuronal, que actÚan
sobre las cÃĐlulas inflamatorias y las molÃĐculas.50 El tiotropio es el LAMA con mayor cantidad de informaciÃģn
clÃnica y ha sido estudiado en niÃąos, adolescentes y adultos.51
Otros dos LAMA (glicopirronio y umeclidinio)
han sido investigados en los estudios CAPTAIN, IRIDIUM, TRIMERAN, TRIGGER,
ARGON, que evaluaron el impacto clÃnico de la triple terapia en un solo
inhalador de tres grupos farmacolÃģgicos (LAMA, LABA y cortiÂcoides inhalados)
en pacientes con asma moderada y grave no controlados con CI/LABA.52-55
Existen algunas diferencias en la evidencia relacionada con los tiempos de
vigencia de cada fÃĄrmaco, asà como la cantidad y calidad de estudios
disponibles y las combinaciones especÃficas de LABA + LAMA + CI.
En
una extensa revisiÃģn, que incluyÃģ estudios con los tres LAMA (11894 niÃąos y
adultos; edad media: 52 aÃąos [rango, 9-71 aÃąos]; 57,7 % mujeÂres), los
principales objetivos evaluados fueron exacerbaciones graves, control del asma
(medido mediante el cuestionario de control del asma ACQ- 7), calidad de vida
(medida con la herramienta calidad de vida relacionada con el asma AQLQ),
mortalidad y eventos adversos.56. Los resultados obtenidos
demostraron (evidencia de alta certeza) que la terapia triple versus la terapia
dual (LABA + CI) en un solo dispositivo una vez por dÃa, se asociÃģ
significativamente con mejorÃa de la funciÃģn pulmonar (certeza alta), una
reducciÃģn del riesgo de exacerbaciones que requirieron CS (certeza moderada) y
en las que requirieron internaciÃģn (certeza baja).56 No hubo
diferencias significativas en la calidad de vida relacionada (evidencia de
certeza alta) o mortalidad (evidencia de certeza alta) entre la terapia dual y
triple.56
La
terapia triple se asociÃģ significativamente con un aumento de la sequedad bucal
y disfonÃa. Para los eventos adversos graves no hubo diferencia entre los
grupos, incluido los eventos cardiovasÂculares (evidencia de certeza moderada).52-55,
57-61
Uno
de los beneficios de una triple terapia fija versus la abierta puede
deberse a una mejor adhesiÃģn al tratamiento, pues se disminuirÃa el nÚmero de
inhaladores que deberÃĄ utilizar el paciente, asà como el nÚmero de dosis. A
pesar de estos resultados, al igual que otros estudios anteriores con otra
triple terapia fija (TRIMAÂRAN y TRIGGER), se necesitan mÃĄs estudios que
confirmen estas mejoras, sobre todo respecto a las exacerbaciones.53-55
La
mayorÃa de los estudios de seguridad fueron realizados en pacientes con EPOC
(con mayor edad promedio y con mayor cantidad y gravedad de enfermedades
concomitantes). En asma solo un estudio de efectos cardiovasculares tiene
evidencia de certeza moderada.61, 62
Es
indicativo, segÚn todas las guÃas de manejo del asma, fenotipificar
a los pacientes con asma grave.63, 64 Para el caso del abordaje
terapÃĐutico en este escalÃģn, la evidencia de eficacia de los LAMA es
independiente del fenotipo del asma (indepenÂdientemente del grado de eosinofilia y fracciÃģn espirada de Ãģxido nÃtrico-FeNO-).65, 66 PodrÃa conÂsiderarse que la
adiciÃģn de los LAMA debiera ser considerada en pacientes con obstrucciÃģn bronÂquial
persistente y sintomÃĄticos y no exacerbadores
frecuentes (evidencia de certeza baja).52-55
La
guÃa GINA recomienda su uso en pacientes que permanecen con exacerbaciones a
pesar del tratamiento intensivo con dos controladores (corÂticoides inhalados y
LABA), en escalÃģn 4 o 5.1 En la guÃa GEMA, los LAMA estÃĄn indicados a partir
del escalÃģn 4 y 5 en asociaciÃģn a los CI y LABA.2. La guÃa de la
ATS/ERS los recomienda en niÃąos, adolescentes y adultos con asma grave no
controÂlada a pesar del tratamiento controlador del nivel GINA 4/5.63
RecomendaciÃģn
Se
recomienda la adiciÃģn de un LAMA a LABA + CI, en pacientes con asma grave no
controlado, ya que produce un beneficio en la mejora de la funciÃģn pulmonar y
efecto en la reducciÃģn de las exacerbaciones que reÂquirieron CS, asà como en
control del asma. No se encontrÃģ beneficio en reducciÃģn de las exacerbaciones
que requirieron internaciÃģn y en la mejorÃa de la calidad de vida (1 B).
10.
Pregunta. ÂŋEs seguro usar LAMA + CI + LABA en pacientes adultos con asma grave
no controlada?
JustificaciÃģn
La
fundamentaciÃģn a esta pregunta estÃĄ en la pregunta 9.
RecomendaciÃģn
Se
recomienda la adiciÃģn de LAMA al uso de LABA + CI por su seguridad en pacientes
con asma grave no controlado al no increÂmentar el riesgo cardiovascular (1 B).
11.
Pregunta. ÂŋDeberÃa usarse un LAMA + LABA + CI segÚn el fenotipo para pacientes
adultos con asma grave no controlada?
JustificaciÃģn
La
fundamentaciÃģn a esta pregunta estÃĄ en la pregunta 9.
RecomendaciÃģn
Se
sugiere la adiciÃģn de LAMA al uso de LABA + CI, en pacientes con asma grave no
controlado, independientemente del fenoÂtipo (2 B).
BiolÃģgicos
El
asma grave constituye del 3 % al 5 % de la poblaciÃģn con asma. Se caracteriza
por persistencia de sÃntomas, mayores consultas a la emergencia o consultorios
ambulatorios no programadas, mayores hospitalizaciones, aumento en el uso de
medicaciÃģn de rescate, corticoides sistÃĐmicos, anÂtibiÃģticos; con el
consiguiente impacto en el mayor uso de recursos en salud y aumento en la mortaÂlidad.63,
64 El asma grave constituye un sÃndrome heterogÃĐneo con mÚltiples
variantes clÃnicas. En las Últimas dos dÃĐcadas, se han estudiado intenÂsamente
y se han definido diferentes fenotipos.67, 69 Establecer el fenotipo
de asma en los pacientes con asma grave no controlada constituye parte de la
acciÃģn diagnÃģstica o evaluativa que se debe realizar en dichos enfermos, pues
puede conllevar un tratamiento diferencial y tener implicancias pronÃģsticas.63,
64, 67-69 Se han definido dos patrones fenotÃpicos inflamatorios: T2 alto
(presente en el asma alÃĐrgica y eosinofÃlica) y no
T2, o tambiÃĐn llamado ÂŦT2 bajoÂŧ. Ambos fenotipos T2 alto, suelen mostrar cierto
grado de superposiciÃģn. La fracciÃģn de Ãģxido nÃtrico exhalado, la eosinofilia y la IgE son buenos biomarcadores del fenotipo T2 alto. El asma T2 alÃĐrgica
representa el 40 %-50 % del asma grave y tiene una base atÃģpica, orquestada por
la activaciÃģn de las cÃĐlulas T colaboradoras tipo 2 (Th2), la producciÃģn de interleuquinas (IL) 4, IL-5 e IL-13 y el cambio de isotipo en los linfocitos B hacia la producciÃģn de IgE. El asma T2 eosinofÃÂlica
representa mÃĄs del 25 % del asma grave y se caracteriza por la presencia de eosinÃģfilos en las biopsias bronquiales y en el esputo,
incluso en los que reciben tratamiento con altas dosis de gluÂcocorticoides.
Pueden asociarse con rinosinusitis crÃģnica y pÃģlipos
nasales.63-64, 67-69
Las
siguientes preguntas y sus respectivas recoÂmendaciones, estÃĄn referidas al uso
de biolÃģgicos en el asma grave.
12.
Pregunta. ÂŋDeberÃa usarse omalizumab versus placebo
en pacientes asmÃĄticos graÂves no controlados con fenotipo T2?
JustificaciÃģn
El
omalizumab es un anticuerpo monoclonal (Mab) anti-IgE humanizado que se
une a la IgE libre, evita la uniÃģn a los receptores
de mastocitos y basÃģfilos, y que, a su vez, tambiÃĐn
puede disminuir los receptores de IgE en las cÃĐlulas
efectoras.63, 64
El
omalizumab estÃĄ indicado en el asma tipo 2 alÃĐrgica,
con valores de IgE total entre 30 -1500 UI. La dosis
varÃa en funciÃģn del nivel de IgE y del peso
corporal.63, 64
La
calidad de la evidencia es alta y la magnitud de los efectos beneficiosos
moderada, asà como de los eventos adversos (EA) pequeÃąa. Por ello, la relaciÃģn
beneficio/riesgo es favorable a su indicaciÃģn.63, 64, 71-76
La
evidencia es moderada en cuanto a la reÂducciÃģn de las exacerbaciones que
requieren CS y en la mejorÃa del FEV1.63, 64, 71-76 La evidencia es
baja para la reducciÃģn de las exacerbaciones que requieren atenciÃģn en
emergencias o internaciÃģn, y en la mejorÃa de la ACQ.63, 64, 71-76
No
hay estudios de costo-efectividad en nuestro paÃs, si bien el costo de la droga
es alto, probableÂmente la relaciÃģn sea favorable a su uso.
RecomendaciÃģn
Se
recomienda el uso de omalizumab como tratamiento
adicional de mantenimiento para el asma grave no controlado con fenoÂtipo T2
alÃĐrgico, en niÃąos mayores de 6 aÃąos y adultos con sensibilizaciÃģn a alÃĐrgenos
peÂrennes, para disminuir la tasa de exacerbaÂciones, mejorar la calidad de
vida y reducir el uso de CS, sin evidencia de aumento de efectos adversos
graves (1 B).
13.
Pregunta. ÂŋDeberÃa usarse mepolizuÂmab versus placebo
en pacientes asmÃĄticos adultos graves no controlados con fenotipo T2?
JustificaciÃģn
El
mepolizumab y reslizumab
son inhibidores de la IL 5, pero solo estÃĄ disponible comercialmente en nuestro
paÃs el mepolizumab.70
La
calidad de la evidencia es alta y la magnitud de los efectos beneficiosos,
moderada; asà como de los eventos adversos (EA), pequeÃąa. Por ello, la relaciÃģn
beneficio/riesgo es favorable a su indicaciÃģn.70, 77-81
La
evidencia es de grado alta en cuanto a la reÂducciÃģn de las exacerbaciones que
requieren CS y la reducciÃģn de las exacerbaciones que requieren atenciÃģn en
emergencias o internaciÃģn.70, 77-81 Es moderada en la mejorÃa de la
ACQ y en la mejorÃa del FEV1.70,77-81
No
hay estudios de costo-efectividad en nuestro paÃs, si bien el costo de la droga
es alto, probableÂmente la relaciÃģn sea favorable a su uso.
RecomendaciÃģn
Se
recomienda el uso de mepolizumab en pacientes
asmÃĄticos graves no controlados, de 12 aÃąos o mÃĄs de edad, como tratamiento
adicional de mantenimiento para el asma grave con fenotipo T2 eosinofÃlico para disÂminuir la tasa de exacerbaciones,
mejorar la calidad de vida, reducir el uso de CS y mejorar la funciÃģn pulmonar,
sin evidencia de aumento de efectos adversos graves (1 A).
14.
Pregunta. ÂŋDeberÃa usarse benralizumab versus placebo
en pacientes asmÃĄticos adultos graves no controlados con fenotipo T2?
JustificaciÃģn
El
benralizumab es un inhibidor del receptor α de
la IL 5.70 La calidad de la evidencia es alta y la magnitud de los
efectos beneficiosos, moderada; asà como de los eventos adversos (EA), pequeÃąa.82-87
Por ello la relaciÃģn beneficio/riesgo es favorable a su indicaciÃģn.82-87
La
evidencia es de grado alto en cuanto a la reÂducciÃģn de las exacerbaciones que
requieren cortiÂcoides sistÃĐmicos (CS) y en la mejorÃa del FEV1.82-87
Es moderada en la mejorÃa de la calidad de vida (ACQ) y la reducciÃģn de las
exacerbaciones que reÂquieren atenciÃģn en emergencias o internaciÃģn.82-87
No
hay estudios de costo-efectividad en nuestro paÃs, si bien el costo de la droga
es alto, probableÂmente la relaciÃģn sea favorable a su uso.
RecomendaciÃģn
Se
recomienda el uso de benralizumab en pacientes
asmÃĄticos adultos graves no controlados como tratamiento adicional de
mantenimiento para el asma grave con fenotipo T2 eosinofÃlico,
para disminuir la tasa de exacerbaciones, mejorar la calidad de vida, reducir
el uso de CS y mejorar la funciÃģn pulmonar, sin evidencia de aumento de efectos
adversos graves (1 A).
15.
Pregunta. ÂŋDeberÃa usarse dupilumab versus placebo en
pacientes asmÃĄticos graÂves no controlados con fenotipo T2?
JustificaciÃģn
El
dupilumab es un inhibidor de la subunidad α del
receptor de IL4 que interfiere la acciÃģn de las IL 4 y IL 13.88
La
calidad de la evidencia es alta y la magnitud de los efectos beneficiosos,
moderada; asà como de los eventos adversos (EA), pequeÃąa.88-93 Por
ello la relaciÃģn beneficio/riesgo es favorable a su indicaciÃģn.88-93
La
evidencia es de grado alto en cuanto a la reducciÃģn de las exacerbaciones que
requieren CS, la reducciÃģn de las exacerbaciones que requieren atenciÃģn en
emergencias o internaciÃģn, en la ACQ y en la mejorÃa del FEV1.88-93
No
hay estudios de costo-efectividad en nuestro paÃs, si bien el costo de la droga
es alto, probableÂmente la relaciÃģn sea favorable a su uso.
RecomendaciÃģn
Se
recomienda el uso de dupilumab, como tratamiento
adicional de mantenimiento para el asma grave no controlado con fenoÂtipo T2,
en niÃąos desde los 6 aÃąos y adultos, o asociado a otras comorbilidades T2 (derÂmatitis
atÃģpica y rinosinusitis crÃģnica con poliposis nasal RSCc/PN) para
disminuir la tasa de exacerbaciones, mejorar la calidad de vida, reducir el uso
de CS y mejorar la funciÃģn pulmonar, sin evidencia de aumento de efectos
adversos graves (1 A).
CONCLUSIÃN GENERAL
BIOLÃGICOS (TABLA 3)
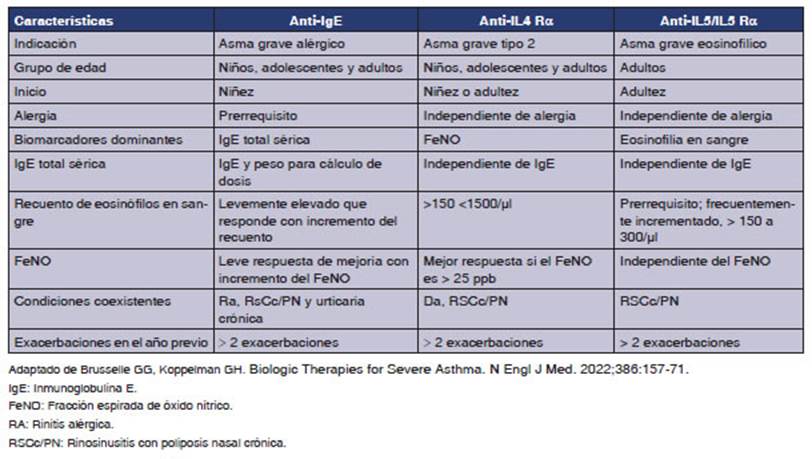
El
asma grave no controlada se asocia a dismiÂnuciÃģn de la calidad de vida,
aumento de las exaÂcerbaciones, ingresos hospitalarios con frecuente
utilizaciÃģn de corticoides sistÃĐmicos y aumento del riesgo de muerte.63,
64 Es necesario fenotipificar al paciente con
asma grave no contralada (AGNC) para indicar el biolÃģgico preciso para cada
fenotipo paciente.63, 64
Los
biolÃģgicos dirigidos a la inflamaciÃģn tipo 2 han demostrado mejorÃa en el
control de la enfermedad, siempre como terapia adicional al tratamiento de
mantenimiento en pacientes con AGNC (paso 5 GINA, paso 6 GEMA).1, 2, 63,
64, 94
CONCEPTOS FINALES
La
metodologÃa modificada Delphi es una tÃĐcnica bien definida para arribar a
consenso de especialisÂtas en ÃĄreas de incertidumbre, y es muy Útil en parÂticular
para la toma de decisiones en situaciones mÃĐdicas donde la evidencia cientÃfica
es pobre o no existe.13, 14 Una de sus fortalezas de este documento
es que se arribÃģ dentro de dos rondas a un acuerdo en el 100 % de los
participantes. Otra fortaleza es que los especialistas fueron seleccionados por
las dos sociedades cientÃficas por su experiencia en los temas por tratar. La
tÃĐcnica Delphi sugiere que hasta la participaciÃģn de doce especialistas es
suficiente y recomendable.13, 14 Todos los autores tuvieron la
oportunidad de votar libremente y expresar sus posturas en los momentos de
debate. Este manuscrito presenta tambiÃĐn algunas limitaÂciones. La ausencia de
la participaciÃģn de mÃĐdicos clÃnicos, podrÃa limitar, de alguna manera, la opiÂniÃģn
con respecto al tema de adherencia o manejo del asma, particularmente en las
formas mÃĄs leves de la enfermedad. Otra limitaciÃģn es que la opiniÃģn de los
especialistas demostrada en la selecciÃģn de bibliografÃa que la fundamentÃģ o la
experiencia propia en el tema, no refleja toda la evidencia puÂblicada en el
ÃĄrea. AdemÃĄs, es de validez temporal limitada, ya que puede cambiar con la
apariciÃģn de nueva informaciÃģn cientÃfica, y que debe ser interpretada
racionalmente y complementada en el futuro con mayores investigaciones,
especialmente en las ÃĄreas de mayor incertidumbre.
En
conclusiÃģn, este documento provee recoÂmendaciones basadas en opiniÃģn de
especialistas y fundamentada en evidencia cientÃfica en cuanto a la importancia
en el manejo del asma de mejoÂrar la adherencia al tratamiento y seguimiento
travÃĐs de diferentes estrategias, en especial por el frecuente mal control del
asma en nuestro paÃs.7, 8 Asà mismo, provee recomendaciones
actualizadas en algunos aspectos crÃticos del tratamiento desde el asma leve al
grave.
PUNTOS CLAVE
Conocimiento
actual
A
pesar de los avances en el manejo del asma y el tratamiento preventivo que
mejora la calidad de vida y disminuye la morbiÂmortalidad, sigue existiendo mal
control del asma en nuestro paÃs y una inaceptable tasa de hospitalizaciones y
mortalidad.
ContribuciÃģn
del artÃculo al conocimiento actual:
Especialistas de dos sociedades mÃĐdicas, que estÃĄn comÂprometidas
en generar acciones para mejorar el control del asma en nuestro paÃs,
realizaron recomendaciones adaptaÂdas localmente en diferentes aspectos
crÃticos del manejo de asma y su tratamiento.
Agradecimiento
Los
autores agradecen la colaboraciÃģn de los Dres. Alejandro Videla y, como
asesores metodolÃģgicos, a DamiÃĄn Silva y Vanesa Kirchuk.
Conflicto
de intereses:
Este
manuscrito no fue subvencionado por ninguna comÂpaÃąÃa farmacÃĐutica, sino que
fue un proyecto de educaciÃģn para pares originado en ambas sociedades
cientÃficas auspiciantes.
Pablo
Moreno: No tiene conflicto de interÃĐs.
Susana
Luhning: No tiene conflicto de interÃĐs.
AnahÃ
YÃĄÃąez: Investigadora de estudios clÃnicos de GSK, AstraZeneca,
Sanofi Chiessi, Novartis,
MDS, Roche, Faes, TEVA, Avillon,
Bayer, Sanofi Gynzene. AsesorÃa mÃĐdica de GSK, Astra Zeneca, Eurofarma,
Sanofi Genzyme, NovarÂtis. Actividades de educaciÃģn
mÃĐdica continua de Sanofi Genzyme, GSK.
Ana
Stock: Investigadora de estudios clÃnicos para AsÂtraZeneca,
Sanofi, GSK, Novartis, Chiesi,
ZambÃģn, Bristol, Bayer, MSD y Roche. Actividades de
educaciÃģn mÃĐdica continua de AstraZeneca,
Sanofi, GSK, ELEA Phenix, Novartis. AsesorÃa mÃĐdica
para GSK, AstraZeneca, Sanofi y ELEA Phoenix.
Gabriel
Gattolin: Disertante e Investigador de estudios
clÃnicos de AstraZeneca, Sanofi, Novartis,
GSK, Abbvie, RoÂche, Amgen, Lilly, Pfizer, TEVA Pharma, Chiessi y Takeda.
Walter
Mattarucco: Disertante en actividades de eduÂcaciÃģn
mÃĐdica continua de AstraZeneca.
Investigador en asma para Novartis, Sanofi, AstraZeneca.
MartÃn
Maillo: Investigador de estudios clÃnicos para GSK, Novartis, AstraZÃĐneca, Forrest, Pearl, Chiesi, Sanofi,
Roche, Janssen, TRI, Insmed
y Zambon. Ha recibido honoÂrarios como disertante o
consejero de GSK, AstraZÃĐneca, Novartis
y Sanofi/Genzine.
Marcos
HernÃĄndez: Actividades de educaciÃģn mÃĐdica continua de
ELEA, Boehringer Ingelheim,
AstraZeneca, GSK, Tuteur.
MartÃn
Sivori: Actividades de educaciÃģn mÃĐdica continua de ELEA, GSK, TEVA, AstraZeneca.
BIBLIOGRAFÃA
1. Global Initiative
for Asthma. Difficult to treat & Severe Asthma in adolescent and adult
patients: Diagnosis and Treatment. 2022. Acceso el 2 de febrero de
2023 en www.ginasthma.org.
2. Alobid I, Ãlvarez RodrÃguez C, Blanco
Aparicio M, et al. GEMA 5.2. GuÃa EspaÃąola para el
manejo del asma. ISBN: 978-84-19069-13-9. Acceso el 2 de febrero de 2023 en
www.gema.com.
3. British Thoracic
Society. Sign 158: British Guideline on the management of asthma. 2019.
4. Forno E, Gogna
M, Cepeda A, et al. Asthma in Latin
America. Thorax
2015;70:898-905.
https://doi.org/10.1136/thoraxjnl-2015-207199
5. Arias S, Neffen H, Bossio JC, et al.
Prevalence and features of asthma in young adults in urban areas of Argentina.
Arch Bronconeumol 2018;54:134-9.
https://doi.org/10.1016/j.arbres.2017.08.021
6. Neffen H, Fritscher C, Cuevas
Schacht F, et al. Asthma control in Latin America: the Asthma Insights and RealÂity
in Latin America (AIRLA) Survey. Rev Panam Salud Publica 2005;17:191-7.
https://doi.org/10.1590/S1020-49892005000300007
7. Maspero JF, Jardim
JR, Aranda A, et al. Insights,
attitudes and perceptions about asthma and its treatment: findings from a
multinational survey of patients from Latin America. World Aller
Org J 2013;6:19. https://doi.org/10.1186/1939-4551-6-19
8. Colodenco D, Neffen H, Baena-Cagnani C, et al. Recomendaciones para el
diagnÃģstico y tratamiento del asma de difÃcil control
(ADC). Rev Am Med Resp
2006:15-36.
9. Yang CL, Hicks EA,
Mitchell P, et al. Canadian Thoracic Society 2021 Guideline update: diagnosis
and management of asthma in preschoolers, children and adults. Can J Respir Crit Care Sleep Med 2021;5:348-61. https://doi.org/10.108 0/24745332.2021.1945887
10. Programa Nacional de prevenciÃģn y control de las enfermedades
respiratorias crÃģnicas. Protocolo de OrientaciÃģn para el diagnÃģstico y manejo
del asma en adultos. Ministerio de Salud de NaciÃģn. DirecciÃģn de PromociÃģn de
Salud y Enfermedades No Transmisibles. 2015.
11. Guyatt G, Gutterman D, Baumann
MH, et al. Grading strength of recommendations and quality of evidence in
clinical guidelines: report from an American College of Chest Physicians Task
Force. Chest. 2006;129:174-81.
https://doi.org/10.1378/chest.129.1.174
12. The Delphi
Method. Techniques and Applications Edited by Harold A. Linstone.
Portland State University Murray Turoff.
New Jersey Institute of Technology 2002 Murray Turoff and Harold A. Linstone.
13. Fitch K,
Bernstein SJ, Aguilar MD, et al. The RAND/UCLA appropriateness method userâs
manual. Acceso el 13 de julio de 2023 en:
https://www.rand.org/content/dam/rand/pubs/monograph_reports/2011/MR1269.pdf
14. Osterberg L, Blaschke T.
Adherence to medication. N Engl J Med 2005;
353:487-97. https://doi.org/10.1056/NEJMra050100
15. Gillissen A. Patientâs adherence in asthma. J Physiol Pharmacol 2007;58: 205-222.
16. Haynes RB, Ackloo E, Sahota N, McDonald HP,
Yao X. Interventions for enhancing medication adherence. CoÂchrane Database Syst Rev 2008:CD000011.
https://doi.org/10.1002/14651858.CD000011.pub3
17. Bosley CM, Parry DT, Cochrane GM. Patient compliance with
inhaled medication: does combining beta-agonists with corticosteroids improve
compliance? Eur Respir J
1994;7:504-9. https://doi.org/10.1183/09031936.94.07030504
18. Sackett DL, Snow JC. The magnitude of
compliance and non-compliance. In: Haynes RB, Taylor WD, Sackett DL, editors. Compliance in health
care. Baltimore: Johns HopÂkins University Press; 1979. pp. 11-22.
19. Gamble J,
Stevenson M, McClean E, Heaney LG. The
prevaÂlence of nonadherence in difficult asthma.
Am J Respir Crit Care Med
2009;180:817-22.
https://doi.org/10.1164/rccm.200902-0166OC
20. Boslev Barnes C, Suppli Ulrik C. Asthma and adherence to inhaled corticosteroids:
current status and future perspecÂtives. Respir Care
2015;60:455-68. https://doi.org/10.4187/respcare.03200
21. Costello RW, Cushen B. Looking back to go forward: adherence to inhaled
therapy before biologic therapy in severe asthma Eur Respir J 2020;55:20000954. https://doi.org/10.1183/13993003.00954-2020
22. Gibson PG, Powell
H, Coughlan J, et al. Limited (inforÂmation only) patient education programs
for adults with asthma. Cochrane Database Syst Rev
2002:CD001005. https://doi.org/10.1002/14651858.CD001005
23. Powell H, Gibson
PG, Options for self-management education for adults with asthma. Cochrane
Database Syst Rev 2003:CD004107.
https://doi.org/10.1002/14651858.CD004107
24. Gatheral TL, Rushton A, Evans DJ, Mulvaney
CA, Halcovitch NR, Whiteley
G, Eccles FJ, Spencer S. PersonalÂized asthma action
plans for adults with asthma. CoÂchrane Database Syst
Rev 2017:CD011859. https://doi.org/10.1002/14651858.CD011859.pub2
25. Jeminiwa R, Hohmann L, Qian J, Garza K, Hansen R, Fox BI. Impact of eHealth on medication adherence among patients with asthma:
A systematic review and meta-analysis. Respiratory Medicine 2019;149:59-68. https://doi.org/10.1016/j.rmed.2019.02.011
26. Murphy JA, Heisser JM, Montgomery M. Evidence-Based Review of
Smartphone Versus Paper Asthma Action Plans on Asthma
Control. J Pharm Technol 2019;35:126-34.
https://doi.org/10.1177/8755122519830446
27. Normansell R, Kew KM, Stovold E.
Interventions to imÂprove adherence to inhaled steroids for asthma (Review).
Cochrane Database of Systematic Reviews; 2017:CD012226.
https://doi.org/10.1002/14651858.CD012226.pub2
28. Jia X. Effect of pharmacist-led interventions on medication
adherence and inhalation technique in adult patients with asthma or COPD: A
systematic review and meta-analysis. J Clin
Pharm Ther. 2020;45:904-7.
https://doi.org/10.1111/jcpt.13126
29. Fortescue R, Kewk KM, Leung ST, Shiu T. Sublingual immunotherapy for asthma. Cochr Database Syst Rev 2020;9:CD011293. https://doi.org/10.1002/14651858.CD011293.pub3
30. Abramson MJ, Puy RM, Weiner JM. Injection allergen immunotherapy for asthma.
Cochrane Database Syst Rev. 2010;(8):CD001186.
https://doi.org/10.1002/14651858.CD001186.pub2
31. Dhami
S, Kakourou A, Asamoah F,
et al. Allergen immunoÂtherapy for allergic asthma: a systematic review and meta-analysis.
Allergy. 2017;72:1825-48.
https://doi.org/10.1111/all.13208
32. Adkinson
NF Jr, Eggleston PA, Eney
D, al. A controlled trial of immunotherapy for asthma in
allergic children. N Engl J Med. 1997;336:324-31. https://doi.org/10.1056/NEJM199701303360502
33. Pitsios
C, Demoly P, Bilo MB, et
al. Clinical contraindications to allergen immunotherapy: an EAACI position
paper. Allergy 2015;70:897-909.
https://doi.org/10.1111/all.12638
34. Agache
I, Lau S, Akdis CA, et al. EAACI Guidelines on
Allergen Immunotherapy: House dust mite-driven allergic asthma. Allergy 2019;74:855-73. https://doi.org/10.1111/all.13749
35. Bernstein DI, Wanner M, Borish L, Liss GM, Immunotherapy Committee, American Academy of
Allergy, Asthma and Immunology. Twelve-year survey of fatal reactions to
allergen injections and skin testing: 1990-2001. J Allergy Clin
Immunol 2004;113:1129-36.
https://doi.org/10.1016/j.jaci.2004.02.006
36. Lin SY, Erekosima
N, Kim JM, Ramanathan M, et al. Sublingual
immunotherapy for the treatment of allergic rhinoconjunctivitis
and asthma: A systematic review. JAMA 2013;309:1278-88.
https://doi.org/10.1001/jama.2013.2049
37. Virchow JC, Backer V, Kuna P,
et al. Efficacy of a house dust mite sublingual allergen immunotherapy tablet
in adults with allergic asthma: A randomized clinical trial. JAMA.
2016;315:1715-25.
https://doi.org/10.1001/jama.2016.3964
38. Durham SR, Walker SM, Varga EM, et al. Long-term clinical efficacy of
grass-pollen immunotherapy. N Engl J Med. 1999;341:468-75. https://doi.org/10.1056/NEJM199908123410702
39. Jacobsen L, Niggemann B, Dreborg S, et al. The PAT investigator group. Specific immunotherapy has
long-term preventive effect of seasonal and perennial asthma: 10-year follow-up
on the PAT study. Allergy. 2007;62:943-8.
https://doi.org/10.1111/j.1398-9995.2007.01451.x
40. Kristiansen M, Dhami S, Netuveli G, et al.
Allergen immunotherapy for the prevention of allergy: A systematic review and
meta-analysis. Pediatr Allergy Immunol. 2017;28:18- 29. https://doi.org/10.1111/pai.12661
41. Pajno
GB, Barberio G, de Luca F, Morabito
L, ParmÂiani S. Prevention of new sensitizations in
asthmatic children monosensitized to house dust mite
by speÂcific immunotherapy. A six-year follow-up study.
Clin Exp Allergy 2001;31:1392-7. https://doi.org/10.1046/j.1365-2222.2001.01161.x
42. Canonica
GW, Bachert C, Hellings P,
Ryan D, Valovirta E, Wickman
M, De Beaumont O, Bousquet J. Allergen ImÂmunotherapy
(AIT): a prototype of Precision Medicine. World Allergy Organ J. 2015;8:31. https://doi.org/10.1186/s40413-015-0079-7
43. OÂīByrne PM, FitzGerald JM,
Bateman ED, et al. Inhaled combined budesonide-formoterol
as needed in mild asthma. N Engl J Med 2018;378:1865-76. https://doi.org/10.1056/NEJMoa1715274
44. Bateman ED, Reddel HK, OÂīByre PM PM, et al. As-needed budesonide-formoterol
versus maintenance budesonide in mild asthma. N Engl
J Med 2018;378:1877-87.
https://doi.org/10.1056/NEJMoa1715275
45. Beasley R, Holliday M, Reddel HK, et al. Controlled trial of budesonide-formoterol as needed for mild asthma. N Engl
J Med 2019;380:2020-30.
https://doi.org/10.1056/NEJMoa1901963
46. Hardy J, Baggott
C, Fingleton J, et al. Budesonide-forÂmoterol
reliever therapy versus maintenance budesonide plus terbutaline
reliever therapy in adults with mild to moderate asthma (PRACTICAL): a 52-week,
open-label, multicenter, superiority, randomized controlled trial. Lancet 2019;394:919-28. https://doi.org/10.1016/S0140-6736(19)31948-8
47. Tanaka A, Ohta
S, Yamamoto M, et al. Tolerability of as-needed treatment with budesonide and formoterol combiÂnation in adult patients with mild asthma.
Am J Resp Crit Care Med
2017;195:A3199.
48. Haahtela
T, Tamminen K, Malmberg LP,
et al. Formoterol as needed with or without
budesonide in patients with intermittent asthma and raised NO levels in exhaled
air: A SOMA study. Eur Resp
J 2006;28:748-55.
https://doi.org/10.1183/09031936.06.00128005
49. Crossingham
I, Turner S, Ramakrishnan S, et al. Combination
fixed-dose beta agonist and steroid inhaler as required for adults or children
with mild asthma (Review). Cochrane Database of Systematic Reviews;
2021:CD13518. https://doi.org/10.1002/14651858.CD013518.pub2
50. Wessler
I, Kirkpatrick CJ. Acetylcholine beyond neurons: the non-neuronal cholinergic system
in humans. Brit J Pharmacol 2008; 154:1558-71.
https://doi.org/10.1038/bjp.2008.185
51. Halpin
D. Tiotropium in asthma: what is the evidence and how
does it fit in? World Allergy Org J 2016;9:29.
https://doi.org/10.1186/s40413-016-0119-y
52. Lee LA, Bailes
Z, Barnes N, et al. Efficacy and safety of once-daily single-inhaler triple
therapy (FF/UMEC/VI) versus FF/VI in patients with inadequately controlled
asthma (CAPTAIN): a double-blind, randomized, phase 3A trial. Lancet Respir Med 2021;9:69-84. https://doi.org/10.1016/S2213-2600(20)30389-1
53. Kerstjens
HAM, Maspero J, Chapman KR, et al. Once-daily,
single-inhaler mometasone-indacaterol-glycopyrronium
versus mometasone-indacaterol or twice-daily
fluticasone-salmeterol in patients with inadequately
controlled asthma (IRIDIUM): a randomized, double-blind, controlled phase 3
study. Lancet Respir Med 2020;8:1000-12.
https://doi.org/10.1016/S2213-2600(20)30190-9
54. Virchow JC, Kuna P, Paggiaro P, et al. Single inhaler extrafine
triple therapy in uncontrolled asthma (TRIMARAN and TRIGGER): two double-blind,
parallel-group, randomÂized, controlled phase 3 trials. Lancet 2019; 394:1737-49.
https://doi.org/10.1016/S0140-6736(19)32215-9
55.
Gessner C, Kornmann O, Maspero J, et al. Fixed dose
combiÂnation of indacaterol/glycopyrronium/mometasone furoate once-daily
versus salmeterol/fluticasone twice-daily plus tiotropium once-daily in patients with uncontrolled asthma:
A randomized, Phase IIIb, non-inferiority study
(ARGON). Respir Med 2020;170:106021.
https://doi.org/10.1016/j.rmed.2020.106021
56. Oba Y, Anwer
S, Maduke T, Patel T, Dias S. Effectiveness and
tolerability of dual and triple combination inhaler therapies compared with
each other and varying doses of inhaled corticosteroids in adolescents and adults
with asthma: a systematic review and network meta-analysis. Cochrane Database Syst Rev 2022:CD013799.
https://doi.org/10.1002/14651858.CD013799.pub2
57. Peters SP, Kunselman SJ, Icitovic N, et al. Tiotropium bromide step-up therapy for adults with uncontrolled
asthma. N Engl J Med 2010;363:1715-26.
https://doi.org/10.1056/NEJMoa1008770
58. Tan LD, Alismail
A, Ariue B. Asthma guidelines: comparison of the
National Heart, Lung, and Blood Institute Expert Panel Report 4 with Global
Initiative for Asthma 2021. Curr Op Pulm Med 2022;28:234-44.
https://doi.org/10.1097/MCP.0000000000000867
59. Kew KM, Dahri
K. Long-acting muscarinic antagonists (LAMA) added to combination long acting
beta2-agonists and inhaled corticosteroids (LABA/ICS) versus LABA/ ICS for
adults with asthma. Cochrane Database Sys Rev 2016:CD
011721. https://doi.org/10.1002/14651858.CD011721
60. Tian
JW, Chen JW, Chen R, Chen X. Tiotropium versus
placebo for inadequately controlled asthma: A meta-analysis. Respir Care 2014;59:654-66. https://doi.org/10.4187/respcare.02703
61. Kerstjens
HA, Engel M, Dahl R, et al. Tiotropium in asthma
poorly controlled with standard combination therapy. N Engl
J Med 2012;367:1198-207.
https://doi.org/10.1056/NEJMoa1208606
62. Scosyrev
E, van Zyl-Smit R, Kerstjens H, et al. CardioÂvascular safety of mometasone/indacaterol and mometasone/indacaterol/glycopyrronium once-daily fixed-dose combinations in
asthma: pooled analysis of phase 3 trials. Respir Med
2021;180:106311. https://doi.org/10.1016/j.rmed.2021.106311
63. Holguin F, Cardet JC, Chung KF, et al. Management of severe asthma: an European Respiratory Society/American Thoracic Society
guideline. Eur Respir J
2020;55:1900588.
https://doi.org/10.1183/13993003.00588-2019
64. Global Initiative for Asthma.
Difficult to treat & severe asthma in adolescent and adult patients:
diagnosis and management. 2018. Acceso el 14 de febrero de 2023 en
www.ginasthma.org.
65.
Iwamoto H, Yokoyama A, Shiota N, et al. Tiotropium bromide is effective
for severe asthma with noneosinoÂphilic phenotype. Eur Respir J 2008;31:1379-82. https://doi.org/10.1183/09031936.00014108
66. Szefler
SJ, Vogelber C, Bernstein JA et al. Tiotropium Is Efficacious in 6-to 17-Year-Olds with Asthma.
Independent of T2 Phenotype. J Allergy Clin Immunol Pract
2019;7:2286- 95.
https://doi.org/10.1016/j.jaip.2019.03.019
67. Wenzel S. Asthma phenotypes:
the evolution from clinical to molecular approaches. Nat Med 2012;18:716-25. https://doi.org/10.1038/nm.2678
68. Agache
IO. From phenotypes to endotypes to
asthma treatÂment. Curr Opin
Allergy Clin Immunol 2013;13: 249-56. https://doi.org/10.1097/ACI.0b013e32836093dd
69. Fitzpatrick AM, Moore WC.
Severe asthma phenotypes - How should they guide evaluation and treatment? J
Allergy Clin Immunol
Practice 2017;5:901-8.
https://doi.org/10.1016/j.jaip.2017.05.015
70. Farne
HA, Wilson A, Powell C, et al. Anti-IL5 therapies for asthma. Cochr Database Syst Rev 2017;9:CD010834. https://doi.org/10.1002/14651858.CD010834.pub3
71. Normansell
R, Walker S, Milan SJ, et al. Omalizumab for asthma
in adults and children (Review). Cochrane Database Syst
Rev 2014:CD003559. https://doi.org/10.1002/14651858.CD003559.pub4
72. SolÃĻr
M, Matz J, Townley R, et
al. The anti-IgE antibody omalizumab
reduces exacerbations and steroid requirement in allergic asthmatics. Eur Respir J. 2001;18:254-61. https://doi.org/10.1183/09031936.01.00092101
73. Busse
W, Corren J, Lanier BQ, et al. Omalizumab,
anti-IgE recombinant humanized monoclonal antibody,
for the treatÂment of severe allergic asthma. J Allergy Clin Immunol. 2001;108:184-90. https://doi.org/10.1067/mai.2001.117880
74.
Hanania NA, Alpan O, Hamilos DL, et al. Omalizumab in severe allergic
asthma inadequately controlled with standard therapy: A randomized trial. Ann Int Med 2011;154:573-82.
https://doi.org/10.7326/0003-4819-154-9-201105030-00002
75. Humbert
M, TaillÃĐ C, Mala L, Le Gros
V, Just J, Molimard M. Omalizumab
effectiveness in patients with severe alÂlergic asthma according to blood eosinophilic count: The STELLAIR study Eur
Respir J. 2018;51:1702523.
https://doi.org/10.1183/13993003.02523-2017
76. Casale
TB, Luskin AT, Busse W, et
al. Omalizumab effectiveness by biomarker status in
patients with asthma: Evidence from PROSPERO, a prospective rea-world
study. J Allergy Clin Immunol Pract. 2019;7:156-64. https://doi.org/10.1016/j.jaip.2018.04.043
77. Pavord
ID, Korn S, Howarth P, et
al. Mepolizumab for severe eosinophilic
asthma (DREAM): a multicentre, double-blind,
placebo-controlled trial. Lancet 2012;380:651-59.
https://doi.org/10.1016/S0140-6736(12)60988-X
78. Ortega HG, Liu MC, Pavord ID, et al. Mepolizumab
TreatÂment in Patients with Severe Eosinophilic
Asthma. N Engl J Med 2014;371:1198-207.
https://doi.org/10.1056/NEJMoa1403290
79. Bel
EH, Wenzel SE, Thompson PJ, et al. Oral GlucocorÂticoid-Sparing Effect of Mepolizumab in Eosinophilic
Asthma. N Engl J Med 2014;371:1189-97.
https://doi.org/10.1056/NEJMoa1403291
80. Khurana
S, Brusselle GG, Bel EH, et al. Long-term Safety and Clinical Benefit
of Mepolizumab in Patients With the Most Severe Eosinophilic Asthma: The COSMEX Study. Clinical
Therapeutics; 2019;41:2041-56.
https://doi.org/10.1016/j.clinthera.2019.07.007
81. Harrison T, Canonica GW, Chupp G, et al.
Real-world mepolizumab in the prospective severe asthma
REALITI-A study: initial analysis. Eur Respir J 2020; 56: 2000151.
https://doi.org/10.1183/13993003.00151-2020
82. FitzGerald JM, Bleecker ER, Nair P, et al. Benralizumab,
an anti-interleukin-5 receptor amonoclonal antibody,
as add-on treatment for patients with severe, uncontrolled, eoÂsinophilic
asthma (CALIMA): a randomized, double-blind, placebo-controlled phase 3 trial.
Lancet 2016;388:2128â41.
https://doi.org/10.1016/S0140-6736(16)31322-8
83. Bleecker
ER, FitzGerald JM, Chanez P, et al. Efficacy and
safety of benralizumab for patients with severe
asthma uncontrolled with high-dosage inhaled corticosteroids and long-acting
à2-agonists (SIROCCO): a randomized, multicentre,
placebo-controlled phase 3 trial. Lancet Respir Med
2016;388:2115-27. https://doi.org/10.1016/S0140-6736(16)31324-1
84. FitzGerald JM, Bleecker ER, Menzies-Gow A, et
al. Predictors of enhanced response with benralizumab
for patients with severe asthma: pooled analysis of the SIROCCO and CALIMA
studies. Lancet Respir Med 2018;6:51-64.
https://doi.org/10.1016/S2213-2600(17)30344-2
85. Busse
WW, Bleecker ER, FitzGerald JM, et al. Long-term
safety and efficacy of benralizumab in patients with
severe, uncontrolled asthma: 1-year results from the BORA phase 3 extension trial. Lancet Respir Med 2019;7:46-59. https://doi.org/10.1016/S2213-2600(18)30406-5
86. Nair P, Wenzel S, Rabe KF et al. Oral Glucocorticoid-SparÂing Effect of Benralizumab in Severe Asthma. N Engl
J Med 2017;376:2448-58.
https://doi.org/10.1056/NEJMoa1703501
87. Korn
S, MDa, Bourdin A, Chupp G, et al. Integrated Safety and Efficacy Among
Patients Receiving Benralizumab for Up to 5 Years. J
Allergy Clin Immunol Pract 2021;9:4381- 92.
https://doi.org/10.1016/j.jaip.2021.07.058
88. Wenzel S, Ford L, Pearlman D,
et al. Dupilumab in persisÂtent asthma with elevated
eosinophil levels. N Engl J Med 2013;368:2455-66. https://doi.org/10.1056/NEJMoa1304048
89. Wenzel S, Castro M, Corren J, et al. Dupilumab
efficacy and safety in adults with uncontrolled persistent asthma despite use
of medium-to-high-dose inhaled corticosteroids plus a long-acting B2 agonist: a
randomized double-blind placebo-controlled pivotal pase
2b dose-ranging trial. Lancet 2016;388:31-44.
https://doi.org/10.1016/S0140-6736(16)30307-5
90. Castro M, Corren
J, Pavord ID, et al. Dupilumab
Efficacy and Safety in Moderate-to-Severe Uncontrolled Asthma N Engl J Med. 2018;378:2486-96.
https://doi.org/10.1056/NEJMoa1804092
91. Rabe
KF, Nair P, Brusselle G, et al. Efficacy and Safety
of Dupilumab in Glucocorticoid-Dependent Severe
Asthma. N Engl J Med. 2018;378:2475-85.
https://doi.org/10.1056/NEJMoa1804093
92. Zayed
Y, Kheiri B, Banifadel M,
et al. Dupilumab safety and efficacy in uncontrolled
asthma: a systematic reÂview and meta-analysis of randomized clinical trials. J Asthma. 2018;1:1-10.
https://doi.org/10.1056/NEJMoa1804093
93. Bacharier
LB, Maspero JF, Katelaris
CH, Fiocchi AG, GaÂgnon R, de Mir I. Dupilumab in Children with Uncontrolled Moderate-to-Severe
Asthma. N Engl J Med 2021;385:2230-
40. https://doi.org/10.1056/NEJMoa2106567
94. Agache
I, Beltran J, Akdis C, Akdis
M, Canelo-Aybar C. Efficacy and safety of treatment
with biologicals (benraliÂzumab,
dupilumab, mepolizumab, omalizumab and resliÂzumab) for
severe eosinophilic asthma. A
systematic review for the EAACI Guidelines - recommendations on the use of biologicals in severe asthma. Allergy. 2020;75:1023-42. https://doi.org/10.1111/all.14221