Autor : Garza-BeltrĂĄn, Marco Antonio1, Flores-HernĂĄndez, Karen HerĂŠndira1, Belalcazar, VĂctor Manuel2, PĂŠrez de LeĂłn VĂĄzquez, Martha Patricia3, GonzĂĄlez de la Parra, Mario4, Delgado-Roche, Livan5
1Instituto de Investigaciones Aplicadas a la Neurociencia, A. C., InvestigaciĂłn ClĂnica, Durango, Durango, MĂŠxico.
2Ăcaro Investigaciones en Medicina, S. A. de C. V., InvestigaciĂłn ClĂnica, Chihuahua, Chihuahua, MĂŠxico.
3Hospital MĂŠdica Sur, Servicio de OtorrinolaringologĂa, Ciudad de MĂŠxico, MĂŠxico.
4Biokinetics S. A. de C. V.
5Laboratorios Liomont, S.A. de C.V.
https://doi.org/10.56538/ramr.UPCE5356
Correspondencia : Livan Delgado-Roche E-mail: ldelgado@liomont.com.mx
RESUMEN
Objetivo: El objetivo del presente estudio fue evaluar la eficacia y seguridad de la
combinación de dosis fija montelukast/desloratadina 10mg/5mg
cápsula versus la combinación de montelukast/loratadina 10 mg/10
mg tableta en adultos con diagnóstico de rinitis alérgica
persistente.
Material y métodos: El presente fue un estudio clínico aleatorizado, controlado, doble
ciego, prospectivo, longitudinal, multicéntrico, con brazos paralelos.
Sujetos con diagÂnóstico de rinitis alérgica persistente que
cumplieran criterios de elegibilidad y firmaran consentimiento informado fueron
enrolados para recibir uno de los dos tratamientos cada 24 horas vía
oral durante 6 semanas. La eficacia se estableció mediante la
evaluación clínica a través de escalas clínicas
validadas en idioma español, siendo la variable primaria de eficacia la
diferencia de puntuación del cuestionario SNOT-20 al final del
tratamiento, mientras que la frecuencia y características de los eventos
adversos fue considerada la variable de seguridad.
Resultados: Se aleatorizaron 86 pacientes, 74 de ellos fueron analizados por protocolo.
Los cuestionarios sobre síntomas de la enfermedad e indicadores de
calidad de vida con ambos tratamientos mostraron que más del 90% de los
pacientes no presentaron síntomas o solo fueron leves al final del
estudio, por lo que ambos tratamientos meÂjoraron significativamente (p <
0.05) la sintomatología de la enfermedad. Los eventos adversos
presentados fueron leves a moderados.
Conclusiones: El presente estudio demostró que la eficacia de montelukast/desloraÂtadina
10mg/5mg no es inferior al medicamento comparador. Por tanto, el tratamiento de
prueba representa una alternativa eficaz y segura para el tratamiento de
segunda línea de la rinitis alérgica persistente en pacientes que
las monoterapias o primeras líneas de tratamiento no ofrecen mejoría
clínicamente relevante.
Palabras clave: Montelukast, Desloratadina, Loratadina, Rinitis alérgica
ABSTRACT
Objective: The objective of the present study was to evaluate the efficacy and
safety of the fixed dose combination of montelukast/desloratadine 10 mg/5 mg
capsule versus the combination of montelukast/loratadine 10 mg/10 mg tablet in
adults diagnosed with persistent allergic rhinitis.
Materials and methods: The present study was a multicenter, controlled, prospective,
longitudinal, randomized, double-blind clinical trial with parallel arms.
Patients diagnosed with persistent allergic rhinitis who met eligibility
criteria and signed informed consent were enrolled in the study to receive one
of the two treatments every 24 hours orally for 6 weeks. Efficacy was
established by clinical evaluation through clinical scales valiÂdated in
Spanish, being the primary efficacy variable the difference in the score of the
SNOT-20 (Sino-Nasal Outcome Test) questionnaire at the end of treatment; and
the frequency and characteristics of adverse events were considered the safety
variable.
Results: 86 patients were randomized, 74 of which were analyzed per protocol.
QuesÂtionnaires about the symptoms of the disease and quality of life
indicators with both treatments showed that more than 90% of patients had mild
symptoms or no symptoms at all at the end of the study. So, both treatments
significantly improved (p < 0.05) the symptoms of the disease. Adverse
events were mild to moderate.
Conclusions: The present study showed that the efficacy of montelukast/desloratadine
10 mg/5 mg is not inferior to the comparator. Therefore, the study treatment
represents an effecÂtive and safe alternative for the second-line treatment of
persistent allergic rhinitis in patients in whom monotherapies or first-line
treatments donât offer clinically relevant improvement.
Key words: Montelukast, Desloratadine, Loratadine, Allergic rhinitis
Recibido: 28/07/2022
Aceptado: 07/12/2022
INTRODUCCIÓN
La rinitis alérgica (RA) es una patología
que afecta alrededor del 40% de la población mundial, mienÂtras que en
México se reporta una prevalencia estimada total del 15%.1, 2 Los dos
síntomas más frecuentes y que más afectan la calidad de
vida del paciente son la rinorrea y la congestión nasal. La mitad de los
pacientes con RA en México sufre rinitis persistente y el componente
congestivo está presente en casi el 90% de los pacientes.3
La RA puede ser clasificada en persistente cuando los
síntomas se presentan 4 o más días a la semana o durante 4
o más semanas.4 Cuando estos
son de moderados a graves, afectan la realización de actividades diarias
y se asocia con fatiga, cambios en el estado de ánimo, trastornos
cognitivos, depresión y ansiedad.5
El tratamiento de la RA requiere de medidas preventivas como
evitar el contacto con el alérgeno en la medida posible, o lo más
común que puede ser la farmacoterapia.6
En tal sentido, las guías ARIA recomiendan el uso de
corticoesteroides intranasales y antihistamínicos de segunda
generación como primeras líneas de tratamiento, así como
el uso de antileucotrienos o inmunoterapia cuando los síntomas de la
rinitis alérgica persistente (RAP) no ceden al tratamiento primario.4, 7, 8
El montelukast es un fármaco antileucotrienos que
se une con gran afinidad y selectividad al receptor 1 de cisteinil-leucotrienos
(CysLTR-1), por lo que inhibe las acciones fisiológicas de los
leucotrienos C4, D4 y E4, directamente vinculados con los síntomas de la
RA.9, 10 Por su parte,
desloratadina es un antihistamínico de segunda generación
antagonista selectivo de los receptores de histamina H1, no penetra a sistema
nervioso central, tiene una alta afinidad por dicho receptor comparado con
cetirizina, ebastina, loratadina y fexofenadina, además, la
desloratadina tiene una vida media más larga (27 h), lo que produce un
beneficio sustancial en los síntomas nasales y oculares en pacientes con
RA moderada en comparación con otros antihistamínicos de segunda
generación.11-13
La combinación de estos dos fármacos
representa un tratamiento integral ante el proceso alérgico que se
dirige a dianas moleculares diferentes dentro del proceso
fisiopatológico de la RAP. Los efectos terapéuticos de la
desloratadina teóricamente tienen ventajas sobre la loratadina, ya que
es considerado el metabolito activo del fármaco. Además, por la
comodidad del tratamiento (1 sola vez al día) puede contribuir al apego
del paciente, y con ello al éxito de la terapia farmacológica.9
Aunque existen evidencias sobre la eficacia y seguridad
de esta combinación en RAP,14,
15, 22, 23
esta no está disponible en el mercado mexicano, por lo que
se requiere demostrar la eficacia y seguridad antes de la solicitud del
registro sanitario ante la autoridad regulatoria. Por tanto, el objetivo del
presente estudio fue evaluar la eficacia y seguridad de la combinación
de dosis fija montelukast/ desloratadina 10 mg/5 mg en comparación con
montelukast/loratadina 10 mg/10 mg cuando se administran una vez al día
por 6 semanas.
MATERIAL Y MÉTODOS
Diseño del estudio y población
Estudio clínico controlado, aleatorizado, doble
ciego, teraÂpéutico confirmatorio, prospectivo, longitudinal, de grupos
paralelos, multicéntrico en el que se incluyeron pacientes adultos
mexicanos con diagnóstico de RAP de, al menos, un año de
evolución, que presentaran signos y síntomas de moderado-grave
según la clasificación de ARIA, con un SNOT-20 basal de, al
menos, 3 puntos. Se excluyeron pacientes con antecedentes de asma, de
hipersensibilidad a alguno de los fármacos del estudio o excipientes de
las formulaciones, infecciones respiratorias recientes, anteceÂdentes de
rinosinusitis, problemas estructurales nasales, que incluyen pólipos
nasales, desviación del septum (alÂrededor del 70%) que impacten
significativamente en el flujo aéreo nasal, pacientes con dependencia a
esteroides o descongestionantes inhalados, mujeres embarazadas o en
período de lactancia, uso de ácido acetil salicílico, o uso
concomitante de inmunoterapias o antihistamínicos que no pudieran
cumplir con un período de lavado de, al menos, 7 vidas medias de
eliminación antes del enrolamiento.
Los pacientes fueron enrolados luego de obtener el
consentimiento informado. El protocolo, así como todos los documentos
entregados o aplicados a los pacientes fueron aprobados previamente por
comités de ética en investiÂgación y comités de
investigación en consonancia con la normatividad local. Todos los
procedimientos fueron realiÂzados con apego a la Declaración de Helsinki
y las Buenas Prácticas Clínicas (ICH E6R2).
Los centros de investigación estuvieron
distribuidos en diferentes estados de la República Mexicana, incluidos
el Servicio de Otorrinolaringología del Hospital Médica Sur (Ciudad
de México, México), el Instituto de Investigaciones Aplicadas a
la Neurociencia, A. C. (Durango, México), e Ícaro Investigaciones
en Medicina, S. A. de C. V. (ChihuaÂhua, México).
Tratamientos
Los sujetos de investigación fueron aleatorizados
en una proporción 1:1 al brazo de tratamiento con el medicamento de
prueba montelukast/desloratadina 10 mg/5 mg cápsulas o al brazo
comparador montelukast/loratadina 10 mg/10 mg tabletas (MontaclarÂŽ),
ambos tratamientos administrados cada 24 h (toma vespertina) por vía
oral durante 6 semanas.
Variables del estudio
La eficacia del tratamiento se determinó a
través de la puntuación global del cuestionario SNOT-20
(Sino-Nasal Outcome Test),16 además
se evaluó la información recoÂlectada mediante la historia
clínica, la exploración física con rinoscopia anterior, la
puntuación del cuestionario T5SS (Total 5-Symptom Score),17 y el
cuestionario sobre la satisfacción con el medicamento (TSQM, Treatment
SatisÂfaction Questionnaire for Medication).18
Las evaluaciones se llevaron a cabo durante la valoración
basal (día -7), al inicio del tratamiento (día 1), al día
21 (seguimiento) y al final del tratamiento (día 42).
La variable de eficacia primaria se estableció
como la diferencia entre la puntuación global basal del cuestionario
SNOT-20 y la puntuación global obtenida en la semana 6. Si la diferencia
entre la puntuación basal y la final tiene valor mayor que cero
(positivo) se interpreta como un reÂsultado favorable, mientras que el valor
menor que cero se interpreta como un resultado desfavorable. Se
consideró que el cambio mayor de 3 puntos en la puntuación global
SNOT-20 se consideró como mejoría de relevancia clínica.
Las variables de eficacia secundaria corresponden al
área bajo la curva (ABC) de SNOT-20 de cada visita, los indicadores de
SNOT-20 por tratamiento y por visita, la clasificación de gravedad de
las puntuaciones SNOT-20, el cuestionario T5SS, los indicadores de T5SS por
tratamiento y por visita (21 d y 42 d), la clasificación de gravedad de
las puntuaciones T5SS, uso del medicamento de rescate (mometasona inhalada,
prohibido en los primeros 10 d y uso permitido como máximo de 2
semanas), así como los puntajes del cuestionario TSQM.
Análisis estadístico
El tamaño de muestra se calculó
considerando la desviación estándar (DE) de 1 punto en el
cuestionario SNOT-20 reporÂtada por Piccirillo y cols., 200219
y una delta de 0,8 que es considerada como clínicamente
significativa por este mismo autor. La muestra fue calculada con el programa
PASS 13, y se consideró, además, un nivel de significancia del
2,5% y una potencia del 90% para la hipótesis de no inferioridad. Debido
a que se estimó un 20% de abandonos, la muestra fue establecida en 86
pacientes.
En el análisis estadístico, se
empleó la prueba t de StuÂdent o la prueba U de Mann-Whitney para
comparación de medias. Para el análisis de las variables en
escala categóÂrica (nominal u ordinal) se usó la prueba exacta de
Fisher. Las características demográficas y basales se presentan
con estadística descriptiva. El análisis estadístico se
reaÂlizó mediante el programa StataÂŽ
versión 15 (StataCorp, Texas, Estados Unidos) y los
programas NCSSÂŽ 11 (NCSS,
LLC. Kaysville, Utah, Estados Unidos) y EastÂŽ
versión 6 (Cytel Inc, Estados Unidos). El nivel de
significancia para el análisis de variables fue establecido al 5% (error
tipo I, α = 0,05), excepto para la prueba de no-inferioridad que, por ser
unilateral, su nivel de significancia fue establecido al 2,5% (error tipo I,
α = 0,025).
RESULTADOS
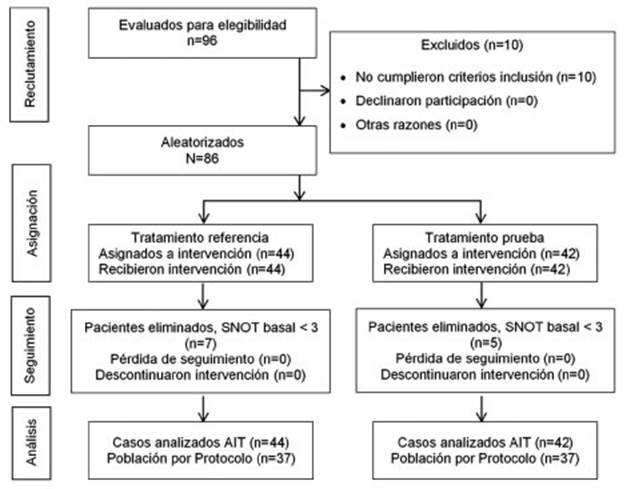
En el presente estudio se enrolaron 44 pacientes en el
grupo que recibió tratamiento con el compaÂrador activo
Montelukast-Loratadina, MKLOR y 42 pacientes en el grupo de prueba
Montelukast-desloratadina. MKDES para un total de 86 pacienÂtes aleatorizados
en la población por intención de tratar (AIT). Durante la
revisión de base de datos, en condiciones de doble ciego, se descartaron
los sujetos con puntuaciones SNOT-20 basales < 3 (visitas del día â7
y el día 1) de acuerdo con los criterios de elegibilidad, quedando 37
pacientes en cada grupo para un total de 74 individuos en la población
por protocolo (Figura 1).
El impacto potencial de las variables demográficas
se evaluó por regresión lineal, y se consideró como
variable dependiente el cambio de puntuación global de SNOT-20 y
variables independientes el tratamiento, sitio de investigación, edad,
género e índice de masa corporal. Únicamente el sitio de
investigación tuvo un efecto significativo sobre la variable de eficacia
primaria (p < 0,0001). Los individuos de un centro tuvieron un cambio
menor de la puntuación respecto a los otros centros. Como esto
ocurrió solo en 10 pacientes no se consideró que tuviera un
impacto significativo sobre la conclusión de la prueba de
no-inferioridad, y se consideró como un hallazgo común en los
estudios multicéntricos.
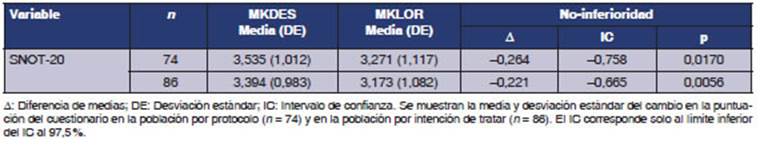
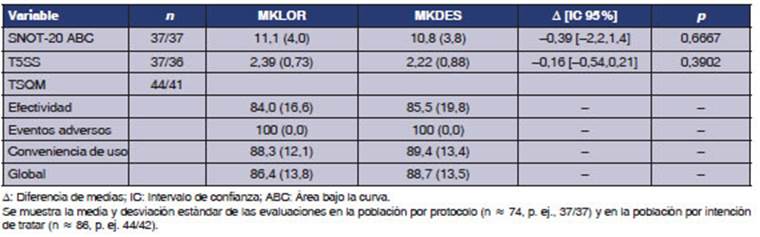
En el análisis de eficacia secundaria, las
puntuaciones globales desde la medición basal hasta la última
semana mostraron una diferencia de medias de â0,393 unidades de área
bajo la curva, sin diferencia significativa entre ambos grupos (p =
0,6667). No se encontró diferencia significativa para el cambio global
del T5SS (p = 0,3902), lo que es consistente con la conclusión de
no-inferioridad de la variable de eficacia primaria. La puntuación
global de TSQM fue mayor del 80% en ambos grupos, lo mismo que las dimensiones
de efectividad y conveniencia de uso; la dimensión de eventos adversos
sugirió un alto grado de tolerabilidad (Tabla 3).
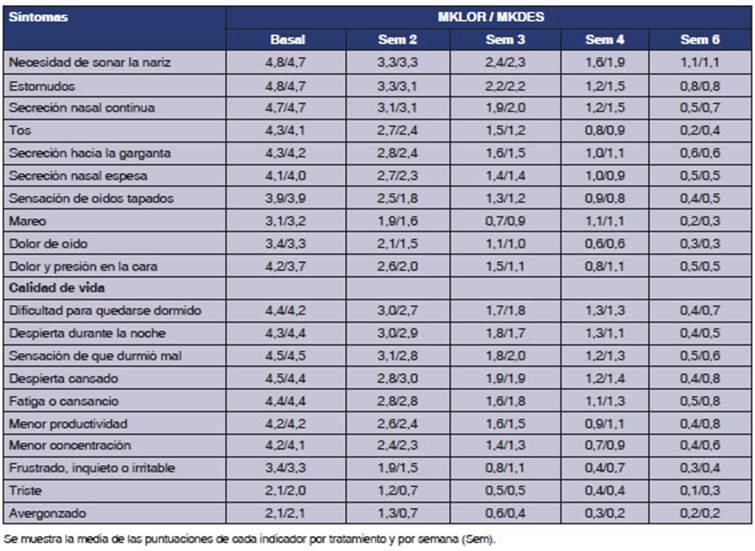
Los indicadores del cuestionario SNOT-20
fueron evaluados por grupo y por semana, ambos tratamientos redujeron las
puntuaciones de los indicadores sin diferencias entre los indicadores de
síntomas, ni en los de calidad de vida (Tabla 4). En tanto, los
indicadores de T5SS evaluados por grupo y por semana demostraron que ambos
tratamientos redujeron la puntuación, sin diferencias entre grupos
(Tabla 4).
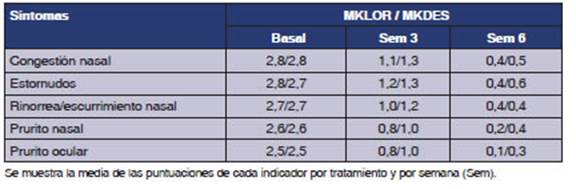
Los niveles de gravedad de los indicadores
SNOT-20 en condiciones basales clasificaron alrededor del 75% de los pacientes
en los niveles de â4 graveâ o â5 no puede ser peorâ para ambos grupos. A la
sexta semana de tratamiento, más del 90% (91,9% MKLOR y 91,7% MKDES) de
los pacientes fueron clasificados en los niveles â1 muy leveâ o â0
ningún problemaâ. Los niveles de gravedad de los indicadores T5SS en
condiciones basales clasificaron más del 70% de los pacientes en el
nivel máximo â3 graveâ para ambos grupos. En la sexta semana de
tratamiento más del 90% (91,9% MKLOR y 91,7% MKDES) de los pacientes
fueron clasificados en los niveles â1 leveâ o â0 ningunaâ, lo cual indica que
ambos tratamientos mejoraron de manera global los cinco síntomas
evaluados (Tabla 5).
El uso de medicación de rescate se
presentó soÂlamente en 5 de los 86 pacientes por intención de
tratar. Cuatro pacientes fueron reclutados en un mismo centro, correspondientes
al grupo MKDES. De los 5 pacientes, 2 usaron la medicación de resÂcate
en la tercera semana, 3 pacientes durante la sexta semana; y la duración
del uso varió desde 1 d hasta 18 d. El bajo número de pacientes
que empleó la medicación de rescate no permitió inferir si
su uso y duración se relacionó con el desenlace de las variables
en los diferentes grupos de tratamiento.
Los eventos adversos (EA) se presentaron en 4
de los 86 pacientes. Se reportaron un total de 12 EA. Tres pacientes del grupo
MKLOR reportaron 8 EA y un paciente de MKDES reportó 4 EA. Un caso
presentó elevación de aminotransferasas (> 2 veces el valor de
referencia), sin medicación concomitante y atribuido por el investigador
al medicamento MKLOR. El evento fue cerrado luego de que el sujeto
mostró mejoría tras la suspensión del tratamiento. En
ninguno de los grupos de traÂtamiento se presentaron EA serios.
DISCUSIÓN
Durante algún tiempo los antagonistas
de recepÂtores de leucotrienos (ARL) fueron considerados tratamiento secundario
para la RAP en pacientes con asma. La información disponible para RAP
sin asma en la revisión 2010 de ARIA mostraba a los ARL con un beneficio
discreto en niños preÂescolares, eficacia limitada en adultos y un alto
costo, por ello las recomendaciones apuntaban a los antihistamínicos
orales con un valor clínico más alto que los ARL.20Un gran número de
pacientes con RA no acuden a la consulta médica porque creen que sus
síntomas son ânormalesâ, otros usan medicamentos de libre venta,
mientras que solo una pequeña parte acude a consulta donde son
diagnosticados con RAP moderada o grave.21En el presente estudio, el
perfil de pacientes seleccionados presentaba un mínimo de 3 en la
puntuación de SNOT-20, los cuales podían beneficiarse de una
combinación con potencia adecuada y acción sostenida.
Se ha descrito que el uso combinado de
antihistamínicos y antileucotrienos tiene ventajas de eficacia sobre la
monoterapia en pacientes con RAP. Por ejemplo, la combinación
montelukast con desloratadina o levocetirizina disminuyó los
síntomas nasales y los niveles de proteína catiónica
eosinofílica por encima de lo observado para los fármacos por
separado.22 También se ha
comprobado la ventaja de la combinación terapéutica en la calidad
de vida relacionada con la salud y la escala de síntomas nocturnos,
obtenidos del cuestionario de calidad de vida para rinoconjuntivitis
(Rhinoconjunctivitis Quality of Life Questionnaire, RQLQ), además, la
presencia de eventos adversos fue similar para placebo, montelukast,
levocetirizina o la combinación de montelukast y antihistamínico.23
En el presente estudio, el tratamiento con
montelukast más loratadina o desloratadina alcanzaron una diferencia
mayor de 3 puntos globales del cuestionario SNOT-20 en los pacientes con RAP a
la semana seis, dicho cambio es relevante clínicamente y demuestra la
utilidad terapéutica de la combinación. La delta de 0,8 en la
puntuación de SNOT-20 es considerada como clínicamente
significativa,16, 19por lo que la diferencia de
medias que aquí se reportan con intervalo de confianza dentro de un
margen menor a ese corte nos permite afirmar que el tratamiento de prueba MKDES
no es inferior al comparador activo MKLOR. El tiempo de seguimiento empleado en
este estudio fue comparable a estudios previos que evaluaron los efectos
clínicos del tratamiento con montelukast y antihistamínicos,22
aunque menor a otros,23no obstante, el diseño
del presente estudio y los instrumentos SNOT-20 y T5SS han demostrado cambios
clínicamente relevantes con la adecuada cobertura del objetivo
propuesto, tanto en la población por protocolo como en la población
por intención de tratar. El tiempo de evaluación de seis semanas
de tratamiento y de evaluación total está justificado
según criterios de otros autores;24además, el
período de evaluación es apropiado para el instrumento de
eficacia primaria SNOT-20 de acuerdo con los antecedentes de validación,16, 19
así como para el cuestionario TSQM. Las puntuaciones de
TSQM reportadas de 84% al 100% son indicativas de alta satisfacción y
excelente tolerabilidad del paciente al tratamiento combinado.
Una limitación de este estudio es que
la ventana de evaluación no permite comprobar cómo se comportan
los síntomas con el tratamiento a largo plazo, por ejemplo, el estudio
XPERT para RAP tratada con levocetirizina evaluó los síntomas
nasales y oculares con T5SS desde las 4 semanas hasta los 6 meses de
tratamiento para reportar a partir de cuándo mejoraron los
síntomas y cuáles continuaron estables durante todo el
tratamiento. En dicho estudio, levocetirizina mejoró significativamente
la congestión nasal después del primer mes de tratamiento y
continuó así por más de 6 meses.18 La ventana
de evaluación aquí fue suficiente para comprobar que los
síntomas mejoraron a partir de la semana 3 con indicadores en la
puntuación media de â1 leveâ, y en la semana 6 con la puntuación
media cerca de â0 ningunaâ. La evaluación de Ciebiada y cols. durante 32
semanas demostró el efecto a largo plazo del tratamiento combinado de
montelukast y desloratadina o levocetirizina. No obstante, su evaluación
utilizó un instrumento diferente enfocado en síntomas nocturnos.23
En estudios futuros se podría evaluar el efecto a largo plazo del
tratamiento combinado de antileucotrieno y antihistamínico en RAP en
población mexicana.
Los niveles de gravedad de los indicadores en
los cuestionarios SNOT-20 y T5SS demostraron que las condiciones de la calidad
de vida y los síntomas tenían puntuaciones muy altas en la
evaluación basal, 7 a 8 de cada 10 pacientes estaban en los niveles
más altos de gravedad, y a las seis semanas del estudio los puntajes
disminuyeron al mínimo en 9 de cada 10 pacientes, mejoría
alcanzada en ambos grupos de tratamientos.
Los EA esperados y observados en los
pacientes con los tratamientos en estudio fueron cefalea, dispepsia y malestar
gastrointestinal, relacionados con el uso de montelukast o desloratadina,24,
25 loratadina no parece relacionarse con estos síntomas, sin
embargo, observamos estos EA en ambos grupos de tratamiento con
características clínicas que no dejaron una clara relación
de causalidad. Un paciente del grupo MKDES presentó EA descritos como
âgastritisâ, âcolitisâ y âdiarreaâ, mientras que un paciente del grupo MKLOR
presentó âgastritis agudaâ, en ambos casos la causalidad fue reportada
como âinclasificableâ. La cefalea se presentó en un paciente del grupo
MKLOR, con causalidad reportada como âcondicionalâ por el consumo concomitante
de alcohol, aunque estuvo prohibido. En la mayoría, se emplearon
medicamentos concomitantes para la resolución de las manifestaciones.
Conforme a lo reportado en la bibliografía, la combinación de los
fármacos en evaluación fue segura considerando que durante el
estudio no se reportó ningún EA serio, todos los EA reportados
fueron leves o moderados, solo uno de ellos fue del grupo MKDES, mientras que
un EA relacionado con el medicamento en el grupo MKLOR se autolimitó al
terminar el tratamiento. Dicho lo anterior, es posible concluir que el
medicamento de prueba montelukast/desloratadina tuvo adecuada tolerabilidad.
CONCLUSIONES
La combinación de desloratadina con
montelukast mejora significativamente los síntomas en paÂcientes con
diagnóstico de RAP. La evaluación del tratamiento demostró
un eficacia y seguridad clíÂnicamente relevantes, no inferior a la
combinación de montelukast con loratadina. Estos resultados sugieren a
la combinación oral de montelukast + desloratadina 10 mg/5 mg como una
opción de tratamiento en pacientes adultos que requieren un
fármaco con mecanismo de acción diferente al
antihistamínico para el control de los síntomas y signos de la
enfermedad.
Conflicto de intereses
Livan Delgado-Roche es empleado de
Laboratorios Liomont, S. A. de C. V. El resto de los autores declaran no tener
conflicto de interés.
Agradecimientos
Los autores desean agradecer el apoyo de la
CRO Infinite Clinical Research International por la administración y
monitoreo del estudio clínico.
BIBLIOGRAFÍA
1. Ciprandi G, Natoli V, Puccinelli P, et al.
Allergic rhinitis: the eligible candidate
to mite immunotherapy in the real world. Allergy
Asthma Clin Immunol 2017;13:11. https://doi.org/10.1186/s13223-017-0185-x
2. Mancilla-Hernandez E, Medina-Avalos MA,
Barnica- Alvarado RH, et al. Prevalencia de rinitis alérgica en
poblaciones de varios estados de México. Rev Alerg Mex 2015;62:196-201.
https://doi.org/10.29262/ram.v62i3.10715
3. Instituto Mexicano del Seguro Social.
Guía de Práctica Clínica. Diagnóstico y Tratamiento
de la Rinitis Alérgica. Actualización 2017. Disponible en:
http://www.imss.gob.mx/profesionales-salud/gpc. Consultado: 28-Jun-2022.
4. Brozek JL,
Bousquet J, Agache I, et al. Allergic Rhinitis and its Impact on Asthma (ARIA)
guidelines-2016 reviÂsion. J Allergy Clin Immunol 2017;140:950-8.
https://doi.org/10.1016/j.jaci.2017.03.050
5. SIIC. Rinitis alérgica. In:
Sociedad Iberoamericana de Información Científica, editor.
Guías Distinguidas. EnferÂmedades Respiratorias. Vol 1 (No 1). Buenos
Aires: SIIC; 2012. p. 3-26.
6. Negro Álvarez JM, Rodríguez
Pacheco R. Rinitis alérgica. In: AEM, editor. Actualizaciones El
Médico. España: AEM; 2011. p. 1-30.
7. Bousquet J,
Schünemann HJ, Togias A, et al., Next-generÂation Allergic Rhinitis and
Its Impact on Asthma (ARIA) guidelines for allergic rhinitis based on Grading
of RecomÂmendations Assessment, Development and Evaluation (GRADE) and
real-world evidence. J Allergy Clin Immunol.
2020;145:70-80.e3.
8. Aristizabal MS, Martínez FM, Ropero
J, et al. Rinitis alérÂgica en el mundo moderno. S&EMJ. 2021;2:5-17.
9. Schering-Plough
S.A. de C.V. Montaclar. Información
para prescribir amplia [Internet] 2016. Disponible en:
https://com-epublishmerck-content.s3.amazonaws.com/tridion-deployer/us-live-epublish/profesionales.msd.com.mx/secure/pdf/MONTACLAR%20IPP.pdf.
10. Velázquez de Campos O.
Combinación montelukast-desloÂratadina en las enfermedades
alérgicas en los niños. Arch Venez Farmacol Ter 2013;32:34-8.
11. Gorena Antezana S, Imaña C,
Mendoza Amatller A. FármaÂcos antitusivos y antihistamínicos. Rev
Bol Ped 2005;44(2).
12. Church MK, Church
DS. Pharmacology of antihistamines. Indian journal of dermatology
2013;58:219-24. https://doi.org/10.4103/0019-5154.110832
13. Anthes JC,
Gilchrest H, Richard C, et al. Biochemical characterization of desloratadine, a
potent antagonist of the human histamine H(1) receptor. Eur J PharÂmacol 2002;449:229-37.
https://doi.org/10.1016/S0014-2999(02)02049-6
14. Cingi C, Oghan F, Eskiizmir G, et al. Desloratadine-monteÂlukast combination improves
quality of life and decreases nasal obstruction in patients with perennial
allergic rhinitis. International forum of allergy & rhinology 2013;3:801-6.
https://doi.org/10.1002/alr.21185
15. Wilson A.
Antihistamines alone and in combination with leukotriene antagonists in nasal
congestion. Clin Exp AlÂlergy Rev 2002;2(3):95-100.
https://doi.org/10.1046/j.1472- 9725.2002.00045.x
16. Breinbauer H, Varela C,
Núñez M, et al. Encuesta de sínÂtomas SNOT-20 para rinitis
alérgica y rinosinusitis: valiÂdación en Chile. Rev Med Chile 2011;139:886-95.
https://doi.org/10.4067/S0034-98872011000700009
17. Rogkakou A, Villa
E, Garelli V, et al. Persistent Allergic Rhinitis and the XPERT Study. The World
Allergy OrÂganization journal 2011;4(3 Suppl):S32-6.
https://doi.org/10.1097/1939-4551-4-S3-S32
18. Atkinson MJ,
Sinha A, Hass SL, et al. Validation of a genÂeral measure of treatment
satisfaction, the Treatment Satisfaction Questionnaire for Medication (TSQM),
using a national panel study of chronic disease. Health Qual Life Outcomes
2004;2:12. https://doi.org/10.1186/1477- 7525-2-12
19. Piccirillo JF,
Merritt MG, Jr., Richards ML. PsychometÂric and clinimetric validity of the
20-Item Sino-Nasal Outcome Test (SNOT-20). Otolaryngol Head Neck Surg 2002;126(1):41-7.
https://doi.org/10.1067/mhn.2002.121022
20. Brozek JL, Bousquet J, Baena-Cagnani CE,
et al. Allergic Rhinitis and its Impact on Asthma
(ARIA) guidelines: 2010 revision. J Allergy Clin Immunol 2010;126:466-76.
https://doi.org/10.1016/j.jaci.2010.06.047
21. Bousquet J,
Hellings PW, Agache I, et al. ARIA 2016: Care pathways implementing emerging
technologies for predicÂtive medicine in rhinitis and asthma across the life
cycle. Clin Transl Allergy 2016;6:47.
https://doi.org/10.1186/s13601-016-0137-4
22. Ciebiada M, Gorska-Ciebiada M, DuBuske
LM, et al. Montelukast with desloratadine or
levocetirizine for the treatment of persistent allergic rhinitis. Ann Allergy Asthma Immunol 2006;97:664-71.
https://doi.org/10.1016/S1081-1206(10)61098-8
23. Ciebiada M, Ciebiada MG, Kmiecik T, et
al. Quality of life in patients with
persistent allergic rhinitis treated with montelukast alone or in combination
with levocetiÂrizine or desloratadine. J
Investig Allergol Clin Immunol 2008;18:343-9.
24. Villar López J, Lizán
Tudela L, Soto Álvarez J, et al. La satisfacción con el
tratamiento. Aten Primaria 2009;41:637- 45.
https://doi.org/10.1016/j.aprim.2008.10.021
25. European Medicines Agency. Aerius.
Informe Público EuÂropeo de Evaluación (EPAR) EMA/376282/2015
Spanish [Internet] 2015. Disponible en:
https://www.ema.europa.eu/en/medicines/human/EPAR/aerius.