Autor : Tomicic, Vinko1-2, Catalioti, Frank1, Mendoza, Sheyla3
1 Unidad de Cuidados Intensivos Hospital ClĂnico Regional de Antofagasta. 2Facultad de Medicina y OdontologĂa Universidad de Antofagasta. 3Instituto Regional de Enfermedades Neoplásicas Norte, Trujillo, PerĂş.
https://doi.org./10.56538/ramr.OFSX8871
Correspondencia : Vinko Tomicic E-mail: vtomicic@gmail.com
RESUMEN
Paciente
varón de 20 años, con diagnóstico de asma conocida,
llegó al departamento de emergencias de un hospital de su localidad con historia
de disnea 1 d antes de la admisión. Posteriormente, se torna taquicárdico, taquipneico
y cianótico, por lo que fue intubado de emergencia. En la UCI del
hospital general de tercer nivel, presentó bronÂcoespasmo grave,
presiones de vía aérea elevadas durante la ventilación
mecánica e hipoperfusión grave. Recibió cristaloides y
norepinefrina como resucitación. Al tercer día, presentó
enfisema subcutáneo, neumotórax e hipercapnia con acidosis mixta.
Se decidió utilizar ventilación mecánica ultraprotectora asociada con Novalung®. Con
esta estrategia, logramos reducir las presiones de la vía aérea,
la PEEPi, la potencia mecánica (PM) resistiva
y mejorar la hipercapnia y la acidosis. El paciente permaneció 10 d en Novalung® y mostró
buena evolución posterior. Finalmente, es extubado,
dado de alta de la UCI y salió del hospital en buenas condiciones.
Palabras
clave: Estado
asmático; Lesión pulmonar inducida por ventilación
mecánica; CircuÂlación extracorpórea; Barotrauma
ABSTRACT
A
20-year-old male with known asthma arrived
at the emergency department in the first hospital with story of shortness of breath 1 day before
admission. He suddenly became tachycardic, tachypneic and cyanotic, for which he was
intubated. In the tertiary care general hospital
ICU, he showed severe bronchospasm, high airway pressures during mechanical ventilation (MV) and severe hypoperfusion. He received crystalloids and norepinephrine. On the third
day, he developed subcutaneous emphysema, pneumoÂthorax and hypercapnia with mixed acidosis. We decided to use ultra-protective meÂchanical ventilation concomitant with Novalung®. With this strategy, we could reduce airway pressures, PEEPi, resistive mechanical power and improve hypercapnia and acidosis.
The patient stayed for 10 days
in Novalung®
and showed good
evolution. He was later extubated and discharged of ICU, leaving the hospital in good conditions.
Key
words: Status Asthmaticus; Ventilator-Induced Lung Injury; Extracorporeal circulation; Barotrauma
Recibido: 23/05/2022
Aceptado: 01/09/2022
INTRODUCCIÓN
Se
conoce que la ventilación mecánica (VM) proÂduce lesión per
se en el fibroesqueleto pulmonar.1
Este daño está relacionado con las características
de distensibilidad y resistencia pulmonar, y por el ajuste del volumen
corriente (VT), flujo
inspiÂratorio, nivel de PEEP y frecuencia respiratoria (RR); esto último
está relacionado con el número de veces que el pulmón
está sometido a un patrón ventilatorio anormal por unidad de
tiempo,2 lo que genera
un proceso inflamatorio con una vía de retroalimentación positiva
(vórtice de lesión pulmonar inducida por ventilador, [VILI Vortex]).3,
4
El
estado asmático (EA) cursa con presiones de la vía aérea elevada,
donde el componente de resistencia es el más importante. Aunque la preÂsión
de conducción (DP, driving pressure) no es un problema, también se
desarrolla barotrauma. En un intento por controlar
las consecuencias de la reÂducción del VT y de la frecuencia respiratoria (FR)
(hipercapnia y acidosis respiratoria), se agrega un removedor
extracorpóreo de CO2 (ECCO2R), el cual
consigue la descarboxilación utilizando bajo
flujo sanguíneo y bajo flujo de barrido (sweep
flow).5, 7
Se
divide la potencia mecánica (PM) en sus tres componentes y se describe
la magnitud de la “poÂtencia resistiva” como principal responsable de la PM. La
reducción de la FR y del VT
interrumpe el ciclo de hiperinsuflación
dinámica lo que reduce la presión intratorácica,
corrige la acidosis, permite atenuar la vasoconstricción pulmonar hipóxica (VPH) y reducir la poscarga
del ventrículo derecho.
Presentamos
un paciente asmático con riesgo vital que evolucionó con
hipercapnia refractaÂria, acidosis mixta con hipertensión arterial y barotrauma, tratado con ECCO2R arteriovenoso (Novalung®).
REPORTE DE CASO
Varón
de 20 años con asma conocida que llegó al Servicio de Urgencias
(SU) del Hospital Regional de Antofagasta, trasladado desde Tocopilla. Se
quejaba de dificultad para respirar un día antes del ingreso.
Posteriormente presentó taquipnea (30 rpm), con cianosis peribucal y fatiga de músÂculos respiratorios. En
esta condición, recibió intubación orotraqueal
y fue sometido a VM con sedación profunda y bloqueo neuromuscular.
Recibió norepinefrina por compromiso hemodiÂnámico.
Ingresa
al servicio de urgencia con APACHE II de 11 puntos. Se inicia VM en modo voluÂmen
control con VT 350 mL, RR 24, I:E = 1:3, PEEP 3 cmH2O (PEEP
intrínseca = 18 cmH2O)
y FiO2 50 %.
Presentó presión inspiratoria alta (90 cmH2O), por lo que se intensificaron las
nebuliÂzaciones con salbutamol y Berodual®️ (fenoterol 0,25mg/mL + bromuro de ipratropio 0,5 mg/mL). La
auscultación reveló disminución bilateral del murmullo
vesicular con sibilancias generalizadas. La monitorización pulmonar
mostró una preÂsión meseta (Pm) de 17 cmH2O y distensibilidad estática de
30 mL/cmH2O.
Los gases arteriales iniciales fueron pH = 7,18, PCO2 = 50,5 mm/Hg, PaO2
= 89,3 mmHg, HCO3
= 18,2 mEq/L. La PCR para COVID-19 fue
negativa.
En
UCI evoluciona con broncoespasmo grave, desaturación
hasta el 63 % con dosis crecientes de noradrenalina (de 0,06 μg/kg/min a 0,2 μg/kg/min)
y tendencia a la hipotermia. En los exámenes de control, se
detectó acidosis láctica (10,2 mMol/L)
con pH 7,17 y HCO3 de
18 mEq/L. Al tercer día, se palparon
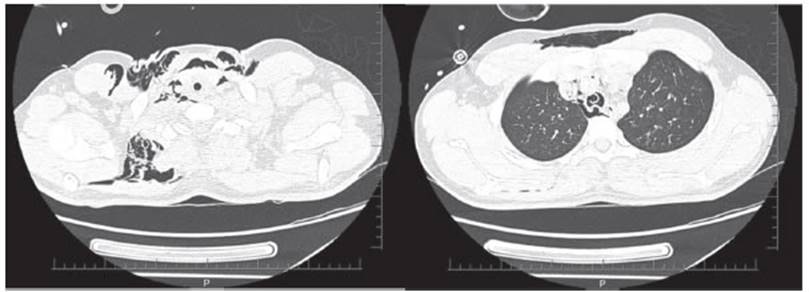
crepitaciones cervicales y el escáner de tórax reveló
enfisema subcutáneo cervical y neuÂmotórax (Figura 1), por lo que
se instaló un tubo pleural y se modificó la programación
ventilatoria. Se incluyeron bolos de metilprednisolona
(500 mg por tres veces). El VT
se redujo a 3,4 mL/kg de peso corporal
predicho, la FR a 10 rpm, el tiempo inspiÂratorio 0,72 s, la ventilación
minuto (VE) 2,6
L/min y la relación I:E = 1:7, sin PEEP. Con
este patrón, la Pmáx bajó a 48
cmH2O
y la PEEPi alcanzó los 6 cmH2O. Debido a la hipercapnia, se
asoció con ECCO2R
arteriovenoso (Novalung®️).
Se incluyó aminofilina. No se detectó
fiebre ni evidencia de foco séptico.
Una
vez en Novalung®️, se aplicó el modo conÂtrol
por volumen con VT 300
ml y FR 10 rpm. El flujo sanguíneo del Novalung® se mantuvo
entre 1,2 L/min y 1,6 L/min y el flujo de barrido se ajustó entre 6
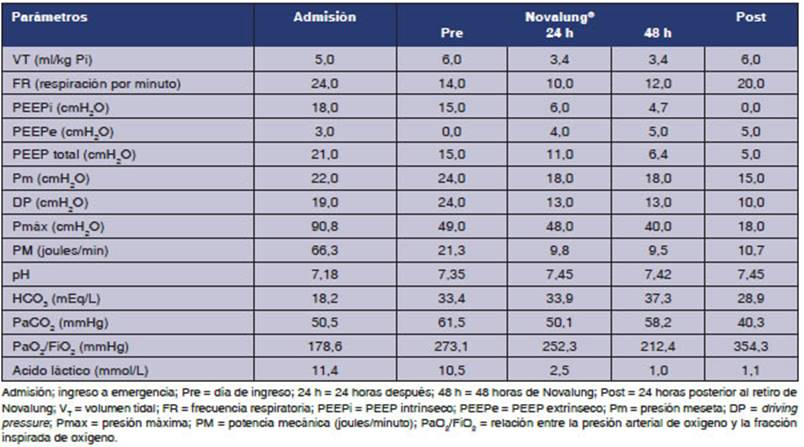
L/min y 7 L/min. El día de la conexión, la relación PaO2/FiO2, la PaCO2 y el pH se
muestran en la Tabla 1. Veinticuatro horas después de la conexión
a Novalung®️,
la presión máxima (Pmáx) de las
vías respiratorias se redujo y la oxigenación permaneció
sin cambios. Las modificaciones más importantes fueron la caída
de la PEEPi y de la Pmáx
(Figura 1).
El
paciente permaneció 10 d en Novalung®️ y mostró
buena evolución. A las 72 h de la retirada del Novalung®, se extubó. Sus parámetros ventiÂlatorios previos
a la extubación fueron: Pmeseta
= 15 cmH2O;
DP = 10 cmH2O;
Pmáx = 18 cmH2O y PM de 10 J/min, sin PEEPi. Los parámetros gasométricos fueron pH
= 7,44, PaCO2 = 39,6 mmHg, PaO2 = 71,9 mmHg. Dada su estabilidad, el paciente fue dado de alta de
la UCI a las 120 h de la extubación,
habiéndose revertido el broncoÂespasmo.
DISCUSIÓN
El
principal hallazgo fue identificar la potencia mecánica resistiva como
el principal responsable del brotrauma en un paciente
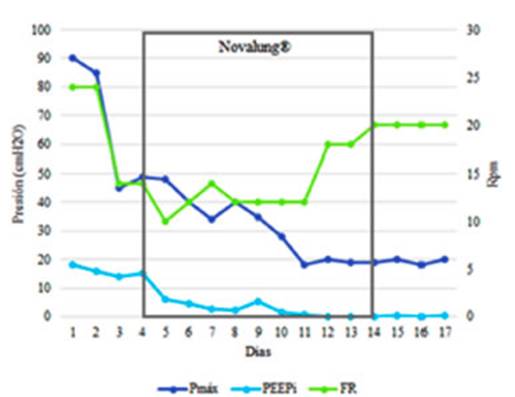
con EA. Se observó una notable correlación entre el PEEPi y la Pmáx de la
vía aérea, las que disminuyeron drásticamenÂte cuando
logramos bajar la FR, reducir el VT
y prolongar el tiempo espiratorio (relación I:E = 1:7) después de instalar el Novalung®.
Luego de introducir este dispositivo se pudo reducir la FR de 24
rpm a 10 rpm, con lo cual la PEEPi se redujo de 15
cmH2O a 6 cmH2O.
Este cambio atenuó la hiperinsuflación
pulmonar y probablemente redujo la presión intratorácica,
lo que mejoró el retorno venoso y el gasto cardíaco; esto se vio
reflejado en la mejoría de la perfusión clínica, la
diuresis y la corrección del ácido láctico. El control de
la acidosis debería reducir la VPH y la poscarga
del ventrículo derecho8 (Tabla 1).
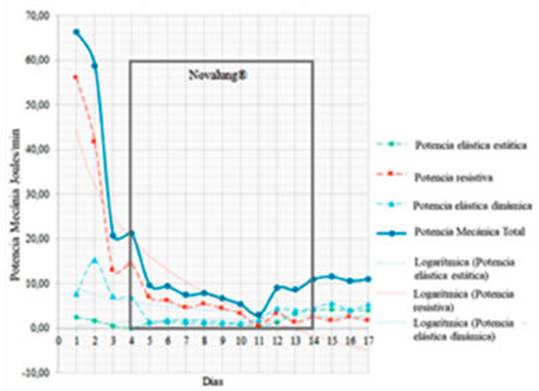
Al analizar la PM en sus componentes específiÂcos: potencia
elástica estática (asociada a la PEEP), potencia elástica
dinámica (asociada al VT)
y “poÂtencia resistiva” (vía aérea nativa), observamos que la
caída de la PM se debió principalmente a la reducción del
componente resistivo, que en el estaÂtus asmático sería
teóricamente el más importante. En nuestro caso, este componente
alcanzó más del 80% de la PM total en el primer día
(Figura 2).
Cuando la exhalación del gas es incompleta porque la
siguiente inspiración se inicia antes de que el pulmón se haya vaciado
por completo, se produce atrapamiento aéreo y la constante de tiempo
espiratorio (τ) puede alcanzar valores cerÂcanos a 0,9 s.9
Por lo anterior, se debe prolongar el tiempo espiratorio. La
reducción del VT y de
la FR disminuye la ventilación minuto (VE), princiÂpal responsable de la hiperinsuflación dinámica.9 Veinticuatro horas
después de la instalación del Novalung®
se observó el impacto de la reducción de FR y del VT en la “potencia resistiva”, la
cual disminuyó de 58 J/min a 14,6 J/min.
Estos pacientes, a menudo, tienen un trabajo respiratorio
aumentado, están deshidratados y desarrollan acidosis láctica, lo
que agrava la aciÂdosis respiratoria. Todos estos elementos estaban presentes
en nuestro paciente al ingreso, por lo que recibió cristaloides,
norepinefrina y niveles bajos de PEEP (Tabla 1).
La PM considera todos los elementos incluidos en la
ecuación de Otis; la DP y la FR son los comÂponentes más
agresivos sobre el fibroesqueleto pulmonar.10
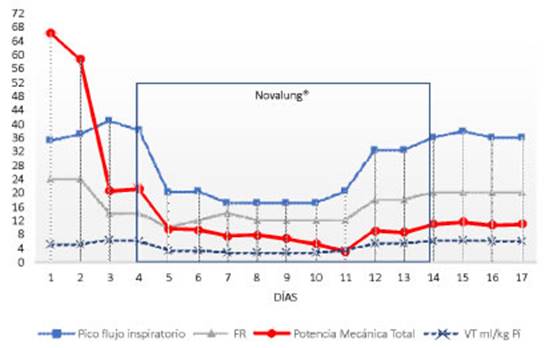
Por otra parte, el flujo pico también es una variable
importante en el desarrollo del daño epitelial alveolar (Figura 3), en
consecuencia, la reducción del flujo inspiratorio evita la
disrupción del epitelio respiratorio. Este fenómeno ha sido
demostrado en un modelo in vitro por TschumÂperlin.11 En nuestro paciente, la
disminución de la FR permitió prolongar el tiempo espiratorio,
con lo que se pudo prolongar simultáneamente el tiempo inspiratorio y
reducir así el flujo pico.
El impacto de la PM se ha estudiado en el sínÂdrome de
dificultad respiratoria aguda (SDRA), pero no lo suficiente en la
descompensación asmáÂtica.12-14 No obstante, independientemente
de los parámetros específicos de daño, ya sea potencia
elástica dinámica (SDRA) o potencia resistiva (esÂtado
asmático), la energía mecánica se transfiere
inevitablemente al fibroesqueleto pulmonar en cada
ciclo mecánico.
El componente resistivo de la PM debe ser analizado siempre en
pacientes con obstrucción de la vía aérea. Al analizar los
componentes por separado, el componente resistivo (línea roja) se
destaca claramente como el principal generador de PM en este tipo de pacientes
(Figura 2).
CONCLUSIÓN
En resumen, cuando los pacientes evolucionan con presiones de la
vía aérea elevadas, a pesar de que exista una presión
meseta adecuada, debemos considerar el componente resistivo de la PM como el origen del barotrauma (obstrucción bronquial). A través
de fórmulas simples, podemos predecir el impacto de las variables del
ventilador mecánico en pacientes asmáticos.10 Los sistemas ECCO2R son una herramienta segura
para asociar a la VM ultraprotectora en pacientes
asmáticos graves.
Conflicto
de intereses
Los
autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1.
Ranieri VM, Suter PM, Tortorella
C et al. Effect of mechanical
ventilation on inflammatory mediators in patients with acute
respiratory distress syndrome: a randomized controlled trial. JAMA 1999;282:54-61.
https://doi.org/10.1001/jama.282.1.54
2.
Marini JJ, Rocco PR. Which component
of mechanical power is most important
in causing VILI? Crit Care 2020;24:39.
https://doi.org/10.1186/s13054-020-2747-4
3.
Marini JJ. How I optimize power to avoid VILI. Crit Care 2019;23:326.
https://doi.org/10.1186/s13054-019-2638-8
4.
Marini JJ, Gattinoni L. Time Course
of Evolving VentiÂlator-Induced
Lung Injury: The “Shrinking Baby Lung”. Crit
Care Med. 2020;48:1203-9. https://doi.org/10.1097/CCM.0000000000004416
5.
Kukita I, Okamoto K, Sato,
T et al. Emergency extraÂcorporeal
life support for patients with
near-fatal status asthmaticus.
Am J Emerg Med 1997;15:566-9. https://doi.org/10.1016/S0735-6757(97)90158-3
6.
Lobaz S, Carey M. Rescue of
acute refractory hyperÂcapnia and acidosis secondary
to life-threatening asthÂma
with extracorporeal carbon dioxide removal (ECÂCO2R). J Intens Care Soc 2011;12:140-2.
https://doi.org/10.1177/175114371101200210
7.
Augy JL, Aissaoui N,
Richards C et al. Two years
multiÂcenter multicenter observational prospective, chort study on
extracorporeal CO2 removal in a large metropolis area. J Intens Care Soc 2019;7:45.
https://doi.org/10.1186/s40560-019-0399-8
8.
Peinado VI, Santos S, Ramirez J, Rodriguez-Roisin
R and Barberá JA. Response to hypoxia of pulmonary arteries in chronic obstructive pulmonary disease: an in vitro study. Eur Respir
J. 2002;20:332.
https://doi.org/10.1183/09031936.02.00282002
9.
Tuxen DV, Lane S. The effects of ventilatory pattern on hyperinflation, airway pressures, and circulation in mechanical ventilation of patients with severe air-flow obstruction. Am Rev Respir Dis
1987;136:872-9.
https://doi.org/10.1164/ajrccm/136.4.872
10.
Costa ELV, Slutsky A, Brochard
LJ, et al. Ventilatory Variables and Mechanical Power in Patients with Acute
Respiratory Distress Syndrome. Am J Respir Crit Care Med
2021;204:303-11.
https://doi.org/10.1164/rccm.202009-3467OC
11.
Tschumperlin DJ, Margulies
SS. Equibiaxial deformation-induced
injury of alveolar epithelial
cells in vitro. Am J Physiol.
1998; 275:L1173-83.
https://doi.org/10.1152/ajplung.1998.275.6.L1173
12.
Scharffenberg M, Wittenstein
J, Ran X, et al. Mechanical
Power Correlates with Lung Inflammation
Assessed by Positron-Emission Tomography in
Experimental Acute Lung Injury in Pigs. Front Physiol. 2021;12:717266.
https://doi.org/10.3389/fphys.2021.717266
13.
Demoule A, Brochard L, Dres M et al. How to ventilate obstructive and asthmatic patients. Intens Care Med
2020;46:2436-49.
https://doi.org/10.1007/s00134-020-06291-0
14.
Marini JJ (2011) Dynamic hyperinflation
and auto-positive end-expiratory pressure:
lessons learned over 30 years. Am J Respir Crit Care
Med 184:756–62.
https://doi.org/10.1164/rccm.201102-0226PP