Autor Osejo-Betancourt, Miguel1, Moreno-RamĂrez, Carlos Ernesto2, Chaparro-Mutiz, Pedro3
1Especialista en Medicina Interna de Universidad Nacional AutĂłnoma de Honduras y NeumologĂa en Hospital Santa Clara, Bogotá, Colombia 2Especialista en EpidemiologĂa y Residente de Medicina Interna en Hospital Santa Clara, Bogotá, Colombia 3Especialista en Medicina Interna y NeumologĂa en Hospital Santa Clara, Bogotá, Colombia
https://doi.org./10.56538/ramr.LNRD6464
Correspondencia : Miguel Osejo Betancourt E-mail: mosejob@unbosque.edu.co
RESUMEN
La proteinosis alveolar
pulmonar es una entidad clínica caracterizada por la acumulaÂción
de material proteináceo, con alta riqueza en
surfactante, mediado por una menor aclaración por parte de los
macrófagos alveolares. En pacientes adultos, comúnmente se asocia
a fenómenos autoinmunes que tienen como resultado una deficiencia del
factor estimulante de colonias de granulocitos y macrófagos, lo que
implica alteracioÂnes en la maduración y disfunción celular, lo
que provoca disminución de la degradaÂción del surfactante y su
acumulación en el espacio alveolar. Su diagnóstico corresÂponde a
un reto para el clínico, sobre la base de los hallazgos en pruebas de
función pulmonar, el patrón en “empedrado” (crazy
paving) en la tomografía computarizada de
tórax de alta resolución y que se confirma al obtener el material
proteináceo en el lavaÂdo broncoalveolar.
Dada su rareza, el tratamiento ideal permanece por ser elucidado y en la
actualidad el pilar del tratamiento es el lavado pulmonar total. Reportamos un
caso anecdótico de una paciente de 41 años con proteinosis alveolar pulmonar desde 2011, que ha requerido
múltiples lavados pulmonares totales, con pobre respuesta a estos,
persistencia de disnea y necesidad de oxígeno suplementario a pesar de
realizar el procedimiento, pero con tendencia progresiva a la mejoría en
los últimos 2 años. La técnica del lavado no está
completamente estandarizada y su uso en AméÂrica Latina es aún
limitado, por lo que publicamos el protocolo utilizado en el Hospital Santa
Clara de Bogotá, Colombia.
Palabras clave: Proteinosis alveolar
pulmonar; Neumonología; Protocolo; Lavado
pulmonar total; Enfermedades raras
ABSTRACT
Pulmonary alveolar proteinosis is a clinical entity characterized by the
accumulation of proteinaceous material, rich in
surfactant, mediated by reduced clearance by alveolar macrophages. In adult
patients, it is commonly associated with autoimmune phenomÂena resulting in a
deficiency of the granulocyte-macrophage colony stimulating factor, which
implies alterations in cell maturation and dysfunction, causing a decrease in
surfactant degradation and its accumulation in the alveolar space. Its
diagnosis poses a challenge to the clinician, based on the findings of
pulmonary function tests and the crazy paving pattern of the high-resolution
computed tomography of the chest, and is confirmed by obtaining the proteinaceous material in the bronchoalveolar
laÂvage. Given its rarity, the ideal treatment remains to be elucidated, with
whole lung lavage currently being the cornerstone of treatment. We report an
anecdotal case of a 41-year-old female patient suffering from pulmonary alveolar
proteinosis since 2011, who has required multiple
whole lung lavages, with poor response to these, with persistent dyspnea and
supplemental oxygen requirement even though she has performed the procedure,
but with a progressive tendency towards improvement in the last 2 years. The
lavage technique is not completely standardized and its use in Latin America is
still limited, which is why we publish the protocol used in the Hospital Santa
Clara of Bogotá, Colombia.
Key words: Pulmonary alveolar proteinosis; Pulmonary
medicine; Protocol; Whole lung laÂvage; Rare disease
Recibido: 20/12/2021
Aceptado: 05/08/2022
INTRODUCCIÓN
La proteinosis alveolar
pulmonar (PAP) en una enfermedad pulmonar causada por la acumulación de
surfactante en el espacio alveolar mediada por un menor aclaramiento por parte
de los macrófagos alveolares, descrita por primera vez en 1958 por Rosen
y cols.1, 2
La alteración en la función del
macrófago es efecto de la menor disponibilidad del factor estiÂmulante
de colonias de granulocitos y macrófagos (GM-CSF) mediada por la
producción de autoantiÂcuerpos contra esta
proteína hasta en el 90% de los casos de pacientes adultos; otras causas
incluyen mutaciones en los receptores del GM-CSF, desórÂdenes
hematológicos, infecciones, medicamentos y factores exposicionales
(sílice, celulosa, metales pesados y algunos materiales
orgánicos).1
El cuadro clínico de la PAP es inespecífico
y la disnea progresiva es el síntoma principal. Las pruebas de
función pulmonar evidencian reducÂción en la capacidad de
difusión de monóxido de carbono (DLCO) y en espirometría
puede mostrar un patrón restrictivo.3
En la tomografía de tórax de alta resolución
(TCAR), se observa el característico patrón en “empedrado” (crazy paving), que
presenÂta opacidades en “vidrio esmerilado” sobrepuestas a engrosamiento septal interlobulillar, aunque se
puede presentar en otras enfermedades y, en los casos de etiología
autoinmune, la presencia de anticuerpos contra el GM-CSF confirma el diagnóstico.4-6
El diagnóstico se debe confirmar mediante lavaÂdo broncoalveolar con la recolección del material proteináceo blanco lechoso con detritus amorfos
que se precipitan, que en la microscopia se obserÂvan cuerpos ovales, acelulares, basofílicos en
la tinción de May-Grünwald-Giemsa y son
positivos a la tinción de PAS (Periodic
acid Schiff).1, 7
El tratamiento incluye el cese del tabaquismo, la
vacunación contra influenza y neumococo para la prevención de
infecciones respiratorias. Para los paÂcientes sintomáticos, con
reducción en la capacidad vital forzada (CVF), reducción en la
DLCO o hipoxeÂmia, el pilar del tratamiento es el lavado pulmonar total.
Actualmente, contamos con otras terapias, como el uso de GM-CSF inhalado o
subcutáneo y, para los pacientes refractarios al tratamiento, se pueden
utilizar intervenciones adicionales, como el uso de rituximab,
plasmaféresis o el trasplante pulmonar, con
resultados muy variables en los estudios.1, 8-10
Al ser una enfermedad rara, no existen estudios clínicos
aleatorizados que estandaricen la técnica del lavado pulmonar total, con
algunas descripcioÂnes en idiomas diferentes del español y con modifiÂcaciones
de acuerdo con la experiencia del centro, sin protocolos establecidos en
América Latina. Teniendo en cuenta lo anterior, el objetivo de esta
revisión es describir el protocolo del procedimiento del lavado pulmonar
total que se ha practicado en el Hospital Santa Clara de Bogotá, el cual
se ha usado para el tratamiento de varios pacientes con PAP en la
institución y en comparación con las técnicas descritas en
la bibliografía revisada, describiremos brevemente la experiencia de un
caso que se mostró refractario al procedimiento.
RESUMEN DEL CASO
Se trata de una paciente femenina de 41 años,
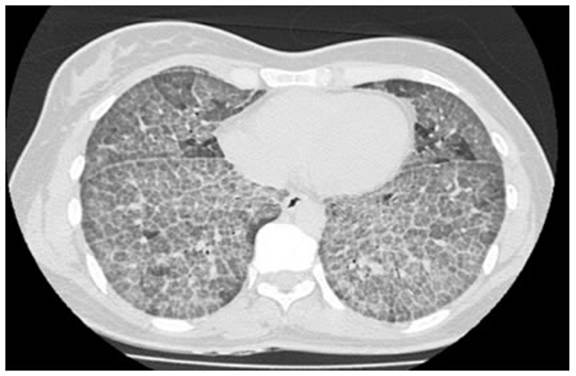
quien consulta en 2011 por disnea crónica. La tomografía de
tórax evidencia patrón en «empedrado» (Figura 1). Se
realizó broncoscopia y se recolectó el
material proteináceo. Se realizaron tinciones
de Gram, Ziehl Neelsen, Grocott, así como cultivos para bacterias, micobacterias y hongos, todos con resultados neÂgativos,
pero con tinción positiva al PAS. Con la clínica,
tomografía, hallazgos del lavado, tinción de PAS positiva, se
hace diagnóstico de PAP, sin necesidad de biopsia. Desde entonces en
manejo por neumología con lavado pulmonar total, pero con
evolución no satisfactoria a pesar de múltiples procedimientos.
Ha presentado respuesta parcial, habiendo requerido lavado pulmonar cada 6
meses en promedio, 26 lavados pulmonares en total (13 derechos y 13 izquierdos)
desde que se trata en nuestra institución y siempre se realizó el
protoÂcolo descrito en la Tabla 1. No se han presentado complicaciones durante
el procedimiento y en el posoperatorio solo algunos picos aislados de fiebre.
La paciente presenta hipertensión pulmonar con ecocardiograma de 2018
con presión sistólica de la arteria pulmonar (PSAP) calculada en
70 mmHg. En septiembre de 2020, acude a urgencias con
exaÂcerbación de los síntomas respiratorios, sin fiebre, con
saturación de oxígeno al ingreso de 65%, con último lavado
pulmonar en agosto 2019; una vez descartada una infección por
SARS-CoV-2, se proÂgrama para nuevo lavado pulmonar. Al realizarla se obtiene
material proteináceo espeso amarillento
(Figura 2) y se lava con 25 L. No hubo complicacioÂnes y se programa para el
otro lavado una semana después, sin complicaciones. La paciente
egresó con mejoría clínica, saturaba el 90% con
oxígeno suplementario. Refirió mejoría notable, con pocos
síntomas. Se realiza un nuevo ecocardiograma de control en abril del
2021; se reportó PSAP 20 mmHg con
función sistólica normal. Mejoró de la disnea y la
limitación funcional dejó de requerir oxígeno para
realizar sus actividades diarias, solamente lo usa por las noches.
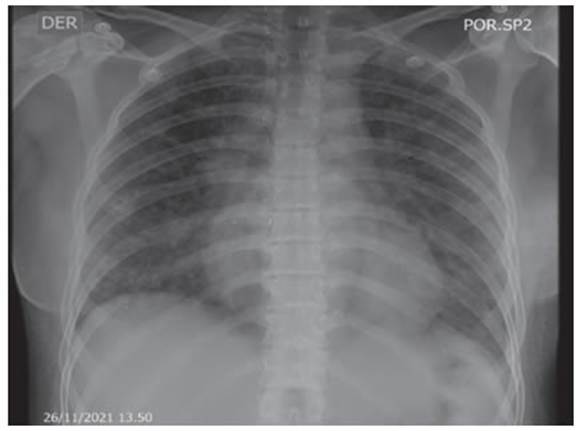
Ingresó en noviembre 2021 con disnea clase 2 mMRC,
saturaba el 88% aire ambienÂte. Se tomó radiografía de
tórax control (Figura 3) que evidenció opacidades alveolares bibasales, pero con notoria mejoría comparada con
las anteriores. Se programó para nuevo lavado pulmonar total. Se
realizó en dos sesiones; en el segundo, se lavó con 20 L. El
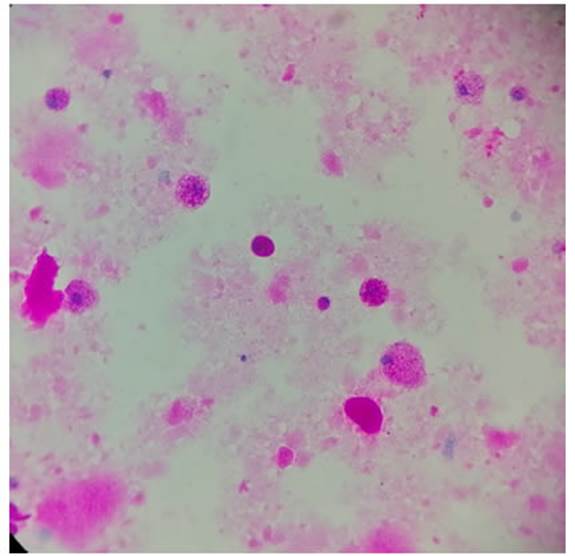
líquido aclaró completamente (Figura 4) por primera vez en el
caso de la paciente. Se le solicitó tinción de PAS (Figura 5) en
el último lavado. No hubo complicaciones y la paciente egresó
asintomática, con saturación del 91% sin oxígeno
suplementario, con plan de seguimiento en consulta externa, con control tomográfico y nuevo ecocardiograma para confirmar
los hallazÂgos en el previo.



METODOLOGÍA
Se realizó una revisión narrativa de la
bibliografía en la que se utilizaron las bases de datos PubMed, Google Scholar
y ScienceDirect entre el 01 de enero de 2014 y el
30 de septiembre de 2021. Además, se complementó la
búsqueda de bibliografía releÂvante a través de la
revisión de referencias de los artículos seleccionados por los
autores. Para la búsqueda de la bibliografía, se empleó el
uso de términos MeSH y se seleccionaron como
palabras claves “lavado pulmonar total” (whole lung lavaÂge) y “proteinosis alveolar pulmonar” (pulmonary
alveolar proteinosis) con combinaciones
utilizando como operadores booleanos AND y OR.
RESULTADOS
En la búsqueda y síntesis de la
bibliografía, se seleccionaron los artículos de acuerdo con las
preferencias del tema que se va a tratar, incluidos artículos de
revisión, reportes de caso, guías y protocolos, estudios
observacionales y ensayos clínicos.
DISCUSIÓN
En 1953, el Dr. Benjamin Castle describe un paÂciente con llenado alveolar de
material proteináceo que se tiñe con
tinción de PAS y en los siguientes 5 años acumula 27 pacientes
con los mismos haÂllazgos y se hace el primer reporte de esta nueva enfermedad
posteriormente recibiendo el nombre de proteinosis
alveolar pulmonar. Es progresiva y fatal sin tratamiento adecuado, en la que se
proÂbaron muchas terapias sin resultados favorables.11
En 1963, el Dr. José Ramírez Rivera, quien
utilizó un catéter transtraqueal
posicionado en un pulmón a la vez, e instiló alícuotas de
100 ml de solución salina a 50-60 gotas por minuto, cuatro veces al
día por 2 a 3 veces por semana, que, a pesar de ser estresante y
tardado, mejoraba las opacidades en las imágenes radiológicas, la
oxigenación y el DLCO.11 En 1964,
utilizó un tubo de doble lumen para instilar 3 L de solución
salina a un pulmón aisÂlado a la vez junto con heparina o N-acetilcisteína, y mostró que instilar grandes
volúmenes es un procedimiento seguro. En las siguientes décadas,
el procedimiento se ha perfeccionado y el lavado pulmonar total ejecutado
actualmente fue descrito por primera vez en 1994.12
Indicaciones y contraindicaciones
Se considera que la principal indicación es disnea
con limitación funcional, empeoramiento en las imágenes
radiológicas e hipoxemia.9,
11 El
uso de otros parámetros clínicos y paraclínicos para deÂfinir
la realización del lavado es variable según la experiencia de
cada centro y se deben descartar otras causas de hipoxemia como
infección o emÂbolismo pulmonar.12
Las principales contraindicaciones para el proceÂdimiento
incluyen enfermedad cardíaca grave, haÂllazgos de fibrosis pulmonar o
sepsis.13 Se sugiere no
realizar en pacientes con coagulopatía no
trataÂda, particularmente cuando se documente tromÂbocitopenia con recuento
plaquetario menor de 50 000 /mmÂł o un INR mayor de 1,5; sin embargo, debido a
lo raro de esta condición, no hay estudios aleatorizados que
guíen el procedimiento, lo que explica la alta variabilidad entre
instituciones.11
En la mayor parte de centros, se prefiere realiÂzar el
lavado pulmonar en dos sesiones (una para cada pulmón) con una distancia
temporal de 1-3 semanas entre sesiones, aunque se reportan casos de la
realización del lavado pulmonar bilateral en una sola sesión.11 La mayor
parte de los pacientes requerirá lavados pulmonares aislados, e incluso
una proporción considerable requerirá un único
procedimiento y alcanzará remisión espontánea, motivo por
el que se prefiere como terapia de elección antes que la
administración de GM-CSF que tiene un mayor costo y la poca
disponibilidad del medicamento en la mayoría de los países latiÂnoamericano.9, 12
El objetivo del lavado es remover la mayor cantidad de
material proteináceo, habiendo instilado la
menor cantidad de solución posible, mientras se reducen las
complicaciones relaÂcionadas con la anestesia y la hospitalización posprocedimiento.
Preparación
Se sugiere una evaluación preanestésica
adecuaÂda, que incluyan pruebas de función pulmonar y control
radiográfico, y durante la visita asesorar cualquier
consideración sobre el manejo de vía aérea y el manejo del
tubo endotraqueal de doble lumen.9, 12
La inducción anestésica y el mantenimiento
se realizan con anestésicos intravenosos para evitar pérdida
durante el lavado y contaminación del área con estos, con
restricción hídrica para evitar la sobrecarga de volumen,
mantenimiento del registro hemodinámico continuo, gasometría
arterial y disponibilidad de un equipo para calenÂtar al paciente con el fin de
evitar el desarrollo de hipotermia, particularmente en los pacientes con
enfermedad cardiovascular inestable.14, 15 En los pacientes con policitemia
importante, se puede considerar la realización de una flebotomía
antes del procedimiento para reducir el riesgo de comÂplicaciones
tromboembólicas.12
Descripción del protocolo
El procedimiento se realiza en sala de cirugía con
personal capacitado que incluye neumólogo, teraÂpia respiratoria y
anestesiólogo.11,
12 Se
realiza bajo anestesia general con bloqueo neuromuscular, se coloca tubo de
doble lumen izquierdo (dado que la colocación del tubo derecho es
más complicada y se puede obstruir el bronquio del lóbulo
superior). Se debe observar columna de aire en ambos lúmenes y
generalmente el anestesiólogo hace pruebas de resistencia para verificar
la posición del tubo que, luego, se confirma con broncoscopia;
este es un paso fundamental para el procedimiento.8, 11, 12, 14, 16
El procedimiento se realiza en posición supina por
la mayor comodidad y evitar el desplazamiento del tubo de doble lumen y esto es
una complicación común durante el procedimiento. Algunos autores
reportan la realización del procedimiento en deÂcúbito lateral en
la dirección del pulmón a lavar para reducir la probabilidad de
fuga al pulmón contralateral.11, 12
El pulmón por lavar se selecciona mediante el
apoyo con imágenes radiológicas y se confirma durante el
procedimiento con la evaluación de la distensibilidad
pulmonar; el pulmón más afectado es el menos distensible. Una vez
realizada la intuÂbación, se practica la desnitrogenización
de ambos pulmones para evitar la formación de burbujas durante el
procedimiento mediante la administración de una fracción
inspirada de oxígeno (FiO2)
del 100% por 5-15 min, tiempo en el que se calienta la solución salina a
37 °C para reducir la hipotermia, y se preparan entre 20 L y 40 L para el
procedimiento.8,
11, 12, 14, 16
Se prepara un sistema cerrado con el adaptador en “Y” (Y de Turk), con un extremo unido a las bolsas de solución
salina, otro hacia el tubo de doble lumen en el extremo del pulmón que
se va a lavar y el otro, al sistema de drenaje.14
Al estar listo se inicia la instilación de la primera
alícuota de forma lenta para evitar formación de burbujas y barotrauma, hasta que se igualen las presiones y deje de
entrar líquido al sistema.14 Se cierra la
llave de entrada y se abre la llave de drenaje (que puede o no, estar conectado
a un sistema de succión). El momento de apertura de la llave de drenaje
puede ser inmediato tras terÂminar la instilación de la solución,
ya que, parece ser igual de eficaz que mantenerlo algunos minuÂtos, y parece
reducir la absorción a la circulación sistémica y la hipervolemia secundaria.12
Tras iniciar el drenaje se procede a iniciar la
percusión del tórax para facilitar la mezcla del material proteináceo con la solución instilada. La
percusión se puede realizar a través de equipos de kinesioterapia
o percusión, como el que utilizamos en nuestro centro; pero puede ser
administrada de forma manual, sin embargo, esta última proÂduce un mayor
desgaste del personal que realiza el procedimiento y el paciente se queja de
mayor dolor posprocedimiento.11,
12 El
primer drenaje será blanco lechoso, o amarillento a rojizo en caso de
presentar microhemorragias, e irá aclarando
conforme se instilan las alícuotas.
El procedimiento se repite con alícuotas de 1000
ml en promedio, ya con la velocidad que permita el sistema de infusión,
manteniendo la percusión solo cuando se realiza el drenaje. Se debe
llevar conteo y monitoreo estricto de la cantidad de líquido que entra y
sale, porque pérdidas maÂyores de 1000 cmÂł pueden indicar que hay fuga
del sistema, ya sea hacia el pulmón contralateral o al espacio pleural.8, 14 Esto
puede deberse al desplazaÂmiento del tubo de doble lumen y puede requerir
reposicionar y confirmar con nueva broncoscopia, por
lo que hay que estar atentos a la salida de burÂbujas a través del lumen
contralateral.8,
14
Los ciclos se repetirán hasta obtener el drenaje
de líquido más claro posible. En promedio, la maÂyoría
necesita 20 L por procedimiento y pueden requerir hasta 40 L.17
Cambios fisiológicos durante el lavado pulmonar total
Durante la fase de llenado, la sangre es fisiológiÂcamente
enviada del pulmón no ventilado hacia el ventilado debido a
vasoconstricción pulmonar hipóxica y
por los cambios de presión inducidos por la instilación de la
solución. Este cambio del shunt fisiológico
tiene como resultado una mayor oxigenación, dado que aumenta la
saturación de hemoglobina, y así mismo cuando se completa el
drenaje, la saturación de oxígeno vuelve a descender debido a la
reducción de la presión de la vía aérea y la
perfusión pulmonar al pulmón no instilado.17
Además, la sobrecarga de líquido durante la fase de
llenado puede causar aumento de la resistencia vascular pulmonar, lo que causa
sobrecarga del ventrículo derecho, especialmente en pacientes con
hipertensión pulmonar o disfunÂción ventricular izquierda.14
Cuidados posprocedimiento
Una vez terminado el procedimiento, se succiona el
líquido remanente en el pulmón. Luego, se realiza
ventilación y reclutamiento de ambos pulmones, y, si se evidencia salida
de líquido a través del tubo, se vuelve a succionar.
Posteriormente, se practica reclutamiento del pulmón al que se le
realizó lavaÂdo pulmonar y succión a necesidad.12, 14, 16
Es importante recordar que el material proteiÂnáceo drenado es surfactante pulmonar y
durante el lavado se pierde este, incluso el necesario para mantener la
tensión superficial, lo que facilita el colapso alveolar, motivo por el
que el reclutamiento poslavado es rutinario.11, 12
Según las condiciones del paciente se puede
considerar la extubación y pasar a vigilancia
a la unidad de cuidados intensivos durante 12 h a 24 h, o en pacientes con
serio compromiso de la oxigenación o inestabilidad hemodinámica, posÂprocedimiento se sugiere realizar cambio de tubo de
doble lumen a tubo orotraqueal convencional y
continuar el manejo posoperatorio en la unidad de cuidados intensivos con
ventilación mecánica protectora, con diuréticos de asa o sin
estos, utiliÂzando estrategias terapéuticas indicadas en otras causas de
edema pulmonar.12
Variaciones en la técnica
Algunos centros reportan la realización del proÂcedimiento
de forma bilateral, que se inicia con el pulmón más afectado y,
al obtener el líquido claro, comienzan con el otro pulmón. Se
trata de un procedimiento mucho más largo, con duracioÂnes hasta de 8 h,
con posterior cambio del tubo orotraqueal a uno
convencional y posterior manejo en la unidad de cuidados intensivos.11 Este
método tiene la ventaja de reducir los costos hospitalarios, el tiempo
requerido para el egreso y mejorar el confort del paciente más
tempranamente. Silva y cols., en 2014, publicaron una serie de 3 casos de
lavado pulmonar bilateral, de forma con su protoÂcolo particular establecido.16
También existen reportes de paciente con PAP en
falla respiratoria, los cuales no toleran la venÂtilación unipulmonar, por lo que se ha realizado el procedimiento
con oxigenación de membrana extracorpórea.9, 11, 15, 16
Se pueden realizar estudios microbiológicos del
material drenado para estudio de Nocardia, ActiÂnomyces, micobacterias y
hongos, como Aspergillus y Cryptococcus,
ya que, debido a la disfunción de los macrófagos alveolares,
existe predisposición a estas infecciones.17
También se ha reportado el uso de ultrasonograÂfía
dinámica para guiar el procedimiento y observar cómo cambia la ecogenicidad del pulmón de estar aireado a un
patrón de consolidación tras instilar la solución o
evidencia atelectasia completa con el drenaje. La guía ecográfica
podría reducir el estrés pulmonar y ayuda a prevenir volutrauma y barotrauma,
así como investigar fugas de líquido.18
Desde 1988, Bingisser y cols.
describieron el uso de ventilación manual durante el procedimiento y en
2012, Bonella y cols. agregaron percusiones
intermitentes (tanto en instilación como drenaje) como estrategia para
reclutar mayor cantidad de material proteínico en el procedimiento con
la menor cantidad de solución.19
En 2021, Grutters y cols. modificaron
la técnica de Bonella y realizaron
hiperinflación manual después de cada 3 alícuotas, con
percusiones intermitentes. Así encontraron que se redujo la cantidad de
solución necesaria para el lavado con un promedio de 15 L con la mayor
cantidad de material drenado (91%) después de 3 ciclos de esta maniobra.19
En el trabajo de Akasaka y
cols. en 2014, se diseÂñó un modelo matemático para
predecir la cantidad de proteínas que iban a ser eliminadas durante el
lavado pulmonar, con el fin de predecir o modificar el tiempo de llenado y
drenaje. Sin embargo, el cálÂculo no modificó el número de
ciclos ni el tiempo de retención de líquido en comparación
con la terapia estándar, y las mediciones de diferentes proteínas
aumentarían los costos del procedimiento.20
Un reporte de un paciente con mala respuesta al lavado,
similar a nuestra paciente, utilizan la combinación de terapias, lavado
pulmonar con ciclos de GM-CSF inhalado posterior al procediÂmiento por hasta 6
meses, con lo que presenta mejoría evidente; sin embargo, esta
intervención farmacológica no es fácilmente accesible y
sus costos limitan notoriamente su administración, tal como en el caso
que se reporta en este documento.21
También se realiza lavados segmentarios a traÂvés
de broncoscopia flexible en pacientes que no toleran
la ventilación unipulmonar o en pacientes
pediátricos, pero con volúmenes de líquido menoÂres, y con
una menor eficacia.13,
22
Seguimiento y eficacia
Dada la alta heterogeneidad de esta enfermedad, la
mejoría entre los diversos parámetros clínicos es
diferente y variable. En 2015, se realizó un estudio retrospectivo de
120 pacientes adultos con PAP en China; de estos, 80 requirieron lavado
pulmonar, se les realizó seguimiento por 8 años, y se
encontró que, luego del procedimiento, mejoró la presión
arterial de oxígeno (PaO2),
la CVF, la capacidad pulmonar total, la DLCO y la distancia recorrida en la
caminata de 6 min (6MWT), con los cambios más significativos en la DLCO
con un aumento promedio de 10 puntos, y en la 6MWT se mejoró un promedio
de 100 m, con ningún paciente que falleciera en el período de
seguimiento.23
En 2016, se publicó un metaanálisis
que evaluó la eficacia del lavado, incluidos doce estudios, que
informaba sobre una mejora significativa de la DLCO, CVF, PaO2 y el volumen espiratorio forÂzado en el
primer segundo (VEF1), sin cambios en la presión arterial del
dióxido de carbono ni la saturación arterial de oxígeno.24
En otro reporte de 10 pacientes en la India en 2020, se
evidenció una mejoría franca de la oxigeÂnación, pero solo
estabilización o leve mejoría de los otros parámetros de
función pulmonar.25 Otro reporte
de cincuenta lavados pulmonares realizado en un centro de referencia en
Tailandia, reportó mejoría de oxigenación, DLCO,
así como de los hallazgos radiográficos, con un 42% de los pacienÂtes
que presentaron mejoría parcial y un 47% con mejoría completa
posterior al procedimiento.26
También se ha encontrado relación en la
eficacia del procedimiento con respecto al tabaquismo, por lo que
aumentó el número de lavados necesarios para lograr
remisión o estabilización de la enferÂmedad.17 La sobrevida posterior al procedimiento
ronda entre el 63% al 94%, por lo que es parte del pilar del tratamiento de los
pacientes con PAP.17,
26
Complicaciones
Las complicaciones más frecuentes reportadas son
fiebre (18%), hipoxemia (14%), sibilancias (6%), neumonía (5%), fuga de
líquido (4%), derraÂme pleural (3,1%) y neumotórax (0,8%).9, 11, 13, 27 Entre estos,
resulta particularmente relevante la hipoxemia, la cual está relacionada
con reingreso al hospital en los siguientes 30 d luego del proceÂdimiento hasta
en el 5% de los casos y requirieron tratamiento con FiO2 alta y reclutamiento con presión
positiva al final de la espiración (PEEP), pero tratando de evitar el barotrauma (neumotóÂrax).11, 28 También se ha documentado
exacerbación de los síntomas en los primeros 30 d después
del procedimiento junto con infecciones respiratorias, aunque no se ha asociado
a infecciones oportuÂnistas.17,
28 Puede
haber mal posicionamiento del tubo de doble lumen, lo que causa fuga del
líquido al otro pulmón, pero en manos experimentadas y tras la
confirmación con broncoscopia es raro que
suceda. Instilar rápidamente grandes volúmenes puede causar barotrauma con hidroneumotórax
o derrame pleural importante, que puede requerir manejo con tubo de
tórax o toracentesis.8,
11
Otro efecto importante es la hipotermia, que se reduce a
monitorizar la temperatura corporal usando medios físicos y calentando
las alícuotas antes de la instilación, con lo que se evita la apaÂrición
de arritmias intraoperatorias y otras comÂplicaciones
derivadas de la hipotermia.8
Se ha descrito que hasta el 10% de los pacientes resisten
el lavado pulmonar total, no presentan mejoría notoria y requieren mayor
cantidad de lavados, así como la necesidad de requerir las otras
terapias.23 Nuestra
paciente cabe en este grupo, aunque ha presentado mejoría clínica
evidente en los últimos 2 años de tratamiento.
CONCLUSIONES
La proteinosis alveolar
pulmonar es una enfermeÂdad poco frecuente, que, por lo general, es poco
conocida por los médicos de atención primaria, lo que puede
retrasar el diagnóstico y, aunque tiene varias alternativas de
tratamiento, son costosas y poco accesibles en la mayor parte de América
Latina. Se han descrito casos en los que responden a tratamiento con factores
estimulantes, pero el lavado pulmonar total sigue siendo el estándar del
tratamiento y, a pesar de que el procedimiento es costoso, debido a la rapidez
de la mejoría del paciente y al mantenimiento a largo plazo, sigue
siendo costo efectivo. A pesar de esto, es un proceÂdimiento poco conocido y
muchos médicos tienen temor de realizarlo dadas las implicaciones menÂcionadas,
la necesidad de insumos específicos, como el tubo de doble lumen, y de
personal entrenado en el procedimiento y el manejo perioperatorio,
lo que indica que es preciso estandarizar algunas estrateÂgias
terapéuticas por lo que decidimos escribir este protocolo con objeto de
simplificar la información disponible para el procedimiento, con un
enfoque fácilmente replicable en la mayoría del territorio
latinoamericano.
Conflicto de interés
No existe ningún conflicto de interés para
la realización o publicación de este articulo por parte de los
autores.
BIBLIOGRAFÍA
1. Kumar A, Abdelmalak
B, Inoue Y, Culver DA. Pulmonary alveolar proteinosis in adults:
pathophysiology and clinical approach. Lancet Respir
Med [Internet]. 2018;6:554-65. https://doi.org/10.1016/S2213-2600(18)30043-2
2. Rosen SH, Castleman
B, Liebow AA, Enzinger FM,
Hunt RTN. Pulmonary Alveolar Proteinosis. N Engl J Med [Internet]. 1958:258:1123-42.
https://doi.org/10.1056/NEJM195806052582301
3. Inoue Y, Trapnell
BC, Tazawa R, et al. Characteristics of a Large
Cohort of Patients with Autoimmune Pulmonary Alveolar Proteinosis
in Japan. Am J Respir Crit
Care Med [Internet]. 2008;177:752-62.
https://doi.org/10.1164/rccm.200708-1271OC
4. Ishii H, Trapnell
BC, Tazawa R, et al. Comparative Study of
High-Resolution CT Findings Between Autoimmune and Secondary Pulmonary Alveolar
Proteinosis. CHEST [Internet]. 2009;136:1348-55.
https://doi.org/10.1378/chest.09-0097
5. Villar
A, Rojo R. Alveolar Proteinosis:
The Role of Anti- GM-CSF Antibodies. Arch Bronconeumol
[Internet]. 2018;54:601-2. https://doi.org/10.1016/j.arbres.2018.03.017
6. Fisser
C, Hamer OW, Eiber R,
Pfeifer M, Lerzer C. Pflastersteine
in der Lunge [Crazy Paving Pattern of the Lung]. Pneumologie
[Internet]. 2019;73:49-53. https://doi.org/10.1055/a-0767-7960
7. Burkhalter
A, Silverman JF, Hopkins III MB, Geisinger KR. Bronchoalveolar Lavage Cytology in Pulmonary Alveolar Proteinosis. Am J Clin Pathol [Internet]. 1996;106:504-10.
https://doi.org/10.1093/ajcp/106.4.504
8. Misra
S, Das PK, Bal SK, et al. Therapeutic Whole Lung
Lavage for Alveolar Proteinosis. J Cardiothorac Vasc Anesth [Internet]. 2020;34:250-7. Available from:
https://doi.org/10.1053/j.jvca.2019.07.001
9. Iftikhar
H, Nair GB, Kumar A. Update on Diagnosis and Treatment of Adult Pulmonary
Alveolar Proteinosis. Ther Clin Risk Manag [Internet].
2021;17:701-10. https://doi.org/10.2147/TCRM.S193884
10. Soyez
B, Borie R, Menard C, et al. Rituximab for
auto-immune alveolar proteinosis, a real life cohort
study. Respir Res [Internet]. 2018;19:74. https://doi.org/10.1186/s12931-018-0780-5
11. Awab
A, Khan MS, Youness HA. Whole lung lavage-technical
details, challenges and management of complicaÂtions. J Thorac
Dis [Internet]. 2017;9:1697-706.
https://jtd.amegroups.com/article/view/13803/11597
12. Abdelmalak
BB, Khanna AK, Culver DA, Popovich
MJ. Therapeutic Whole-Lung Lavage for Pulmonary Alveolar Proteinosis:
A Procedural Update. J Bronchology Interv Pulmonol [Internet].
2015;22. https://doi.org/10.1097/LBR.0000000000000180
13. Campo I, Luisetti
M, Griese M, et al. Whole lung lavage therapy for
pulmonary alveolar proteinosis: a global surÂvey of
current practices and procedures. Orphanet J Rare Dis
[Internet]. 2016;11:115. Available from:
https://doi.org/10.1186/s13023-016-0497-9
14. Mata-Suarez SM, Castro-Lalín
A, Mc Loughlin S, de Domini
J, Bianco JC. Whole-Lung Lavage- a
Narrative Review of Anesthetic Management. J Cardiothorac Vasc
AnesÂth [Internet]. 2022;36:587-93.
https://doi.org/10.1053/j.jvca.2020.12.002
15. Tempe DK, Sharma A. Insights into
Anesthetic ChalÂlenges of Whole Lung Lavage. J Cardiothorac
Vasc AnesÂth [Internet].
2019;33:2462-4.
https://doi.org/10.1053/j.jvca.2019.04.033
16. Silva A, Moreto
A, Pinho C, Magalhães
A, Morais A, Fiuza C.
Bilateral whole lung lavage in pulmonary alveolar proteinoÂsis
- A retrospective study. Rev Port Pneumol [Internet].
2014;20:254-9.
https://doi.org/10.1016/j.rppneu.2014.04.004
17. Jouneau
S, Ménard C, Lederlin
M. Pulmonary alveolar proteinosis. Respirology [Internet]. 2020;25:816-26.
https://doi.org/10.1111/resp.13831
18. Sigakis MJG, de Cardenas JL. Lung Ultrasound Scans DurÂing Whole Lung Lavage. CHEST
[Internet]. 2021;159:e433- 6.
https://doi.org/10.1016/j.chest.2020.06.089
19. Grutters
LA, Smith EC, Casteleijn CW, et al. Increased
Efficacy of Whole Lung Lavage Treatment in Alveolar Proteinosis
Using a New Modified Lavage Technique. J Bronchology Interv Pulmonol [Internet]. 2021;28(3). https://doi.org/10.1097/LBR.0000000000000741
20. Akasaka
K, Tanaka T, Maruyama T, et al. A mathematiÂcal model to
predict protein wash out kinetics during whole-lung lavage in autoimmune
pulmonary alveolar proteinosis. Am J Physiol - Lung Cell Mol Physiol [InÂternet]. 2014;308:L105-17. https://doi.org/10.1152/ajÂplung.00239.2014
21. Yu HY, Sun XF, Wang YX, Xu ZJ, Huang H. Whole lung lavage combined with
Granulocyte-macrophage colony stimulating factor inhalation for an adult case
of refractory pulmonary alveolar proteinosis. BMC Pulm med [Internet]. 2014;14:87. https://doi.org/10.1186/1471-2466-14-87
22. Gay P, Wallaert
B, Nowak S, et al. Efficacy of Whole-Lung Lavage in Pulmonary Alveolar Proteinosis: A Multicenter International Study of GELF. Respiration [Internet]. 2017;93:198-206.
https://doi.org/10.1159/000455179
23. Zhao YY, Huang H, Liu YZ,
Song XY, Li S, Xu ZJ. Whole Lung Lavage Treatment of
Chinese Patients with AutoimÂmune Pulmonary Alveolar Proteinosis:
A Retrospective Long-term Follow-up Study. Chin Med J (Engl)
[Internet]. 2015;128:2714-9.
https://doi.org/10.4103/0366-6999.167295
24. Zhang HT, Wang C, Wang CY,
Fang SC, Xu B, Zhang YM. Efficacy
of Whole-Lung Lavage in Treatment of Pulmonary Alveolar Proteinosis.
Am J Ther [Internet]. 2016;23:e1671- 9. https://doi.org/10.1097/MJT.0000000000000239.
25. Marwah
V, Katoch CDS, Singh S, et al. Management of primary
pulmonary alveolar proteinosis: A multicentric
experience. Lung India [Internet]. 2020;37:304-9.
https://doi.org/10.4103/lungindia.lungindia_401_19.
26. Kaenmuang
P, Navasakulpong A. Efficacy of whole lung lavage in
pulmonary alveolar proteinosis: a 20-year exÂperience
at a reference center in Thailand. J Thorac Dis
[Internet]. 2021;13:3539-48.
https://doi.org/10.21037/jtd-20-3308
27. Hunter Guevara
LR, Gillespie SM, Klompas AM, Torres NE, Barbara DW. Whole-lung lavage in a patient with pulÂmonary
alveolar proteinosis. Ann
Card Anaesth [Internet]. 2018;21:215-7. https://doi.org/10.4103/aca.ACA_184_17.
28. Smith BB, Torres NE, Hyder JA, et al. Whole-lung Lavage and Pulmonary Alveolar Proteinosis: Review of Clinical and Patient-centered
Outcomes. J Cardiothorac Vasc Anesth [Internet].
2019;33:2453-61. https://doi.org/10.1053/j.jvca.2019.03.047