Autor : Osejo Betancourt, Miguel1, Saavedra, Alfredo2, Sánchez, Edgar A.3, Milena Callejas, Ana4, DĂaz Santos, Germán5
1Especialista en Medicina Interna de Universidad Nacional AutĂłnoma de Honduras y NeumologĂa, Universidad El Bosque, Bogotá, Colombia. 2Especialista en Medicina Interna y NeumologĂa, Instituto Nacional de CancerologĂa de Bogotá, Colombia, Profesor Titular de Medicina, Universidad Nacional de Colombia. 3 Especialista en Medicina Interna y NeumologĂa, Instituto Nacional de CancerologĂa de Bogotá, Colombia, Profesor Asociado Medicina, Universidad Nacional de Colombia. 4Especialista en Medicina Interna y NeumologĂa, Instituto Nacional de CancerologĂa de Bogotá, Colombia. 5 Especialista en Medicina Interna y NeumologĂa, Instituto Nacional de CancerologĂa de Bogotá, Colombia.
https://doi.org/10.56538/ramr.AYZJ1070
Correspondencia : Miguel Osejo Betancourt. Correo electrĂłnico: mosejob@unbosque.edu.co
RESUMEN
El síndrome de Birt-Hogg-Dubé
es una rara enfermedad autosómica dominante cauÂsada por la
mutación patogénica del gen de la foliculina,
que se expresa principalÂmente en tres órganos que incluyen el
pulmón, la piel y el riñón, y produce quisÂtes pulmonares,
tumores renales y cutáneos. Desde el punto de vista respiratorio es poco
sintomática, pero los quistes presentan alto riesgo de
neumotórax, por lo que es imprescindible realizar una adecuada semiología
radiológica de los quistes para un diagnóstico oportuno. Los
tumores más importantes son los renales porque incluyen varios tipos de
carcinomas renales; debido a esto requieren seguimiento estricto y, en muchos,
casos cirugía. Presentamos dos casos de pacientes con este
síndrome; uno confirmado por la mutación genética y el
otro, por la confirmación histológica de fibrofoliculoma,
ambos criterios mayores para el diagnóstico de esta enfermedad. Es
fundamental el diagnóstico temprano de esta entidad de acuerdo con lo
expuesto anÂteriormente, por lo que hacemos esta revisión con una amplia
discusión sobre la afecÂtación pulmonar, la semiología
radiológica de los quistes y los criterios diagnósticos.
Palabras clave: Síndrome de Birt-Hogg-Dubé;
Neumotórax; Carcinoma de células renales; Tomografía
ABSTRACT
The Birt-Hogg-Dubé syndrome is a rare autosomal dominant disease
caused by the pathogenic mutation of the folliculin
gene, which is mainly expressed in three organs that include the lung, the skin
and the kidney, and produces lung cysts, and renal and skin tumors. From the
respiratory point of view, it doesn’t have many symptoms, but cysts have high
risk of pneumothorax, so it is indispensable to carry out the correct
radiological semiology of the cysts for a timely diagnosis. The most important
tumors are the renal, because they include several types of renal carcinomas;
that is why they require strict follow-up and, in many cases, surgery. We
present two cases of patients with this syndrome: one confirmed by the genetic
mutation, and the other one by the histological confirmation of fibrofolliculoma, both major criteria for the diagnosis of
this disease. The early diagnosis of this entity is of fundamental importance,
according to what has been previously presented, so we conduct this review with
a broad discusÂsion about lung involvement, the radiological semiology of the
cysts, and diagnostic criteria.
Key words: Birt>-Hogg-Dube Syndrome; Pneumothorax; Carcinoma Renal Cell;
Tomography
Recibido: 21/12/2021
Aceptado: 14/06/2022
INTRODUCCIÓN
El Síndrome de Birt-Hogg-Dubé
(BHD) es una rara entidad clínico-patológica de herencia
autosómica dominante, descrita en 1977 por Birt
y colaboÂradores, caracterizada por neoplasias cutáneas, generalmente
pápulas suaves de color piel en la cara, el cuello y las orejas, con
quistes pulmonares y neoplasias renales.1, 2
Hasta la fecha, se han descrito más de 140 muÂtaciones
en el gen relacionado con esta entidad clínica, conocido como “FLCN”,
localizado en el cromosoma 17p11.2, que codifica la foliculina,
proÂteína expresada en múltiples tejidos, que incluyen piel, neumocitos tipo 1 y en la nefrona distal, cuya
función exacta es desconocida, pero parece actuar como supresor de
tumores al interactuar con la vía de la proteína mTOR, el factor de crecimiento tisular beta y la
proteína DENN.1-3 En este
artículo reportamos dos casos de BHD.
CASO NÚMERO 1
Paciente femenina de 68 años, con antecedente de
histerectomía por cáncer de cérvix 20 años
atrás. Trece años después, requiere una nefrectomía
por carcinoma renal de células claras; posteriormente, a los 2
años, aparecen pápulas amarillentas pigÂmentadas en la cara, el
tórax y los antebrazos, por lo que es valorada por dermatología
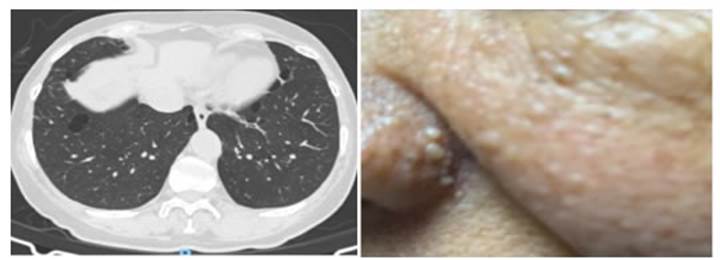
un año después (Figura 1). Se realizan biopsias de las
pápulas en el ala nasal izquierda y el en tronco anterior, con hallazgos
histopatológicos compatibles con angiofibromas,
y continúa por urología y dermaÂtología sin nuevos
hallazgos o síntomas. Dada la presencia de múltiples tumores es
evaluada por genética y se hace una tomografía de tórax de
alta resolución (TACAR) que identifica algunos nódulos pulmonares
menores de 1 cm y múltiples quistes pulmonares bilaterales de
tamaño variable, con forma de lente (lenticular) o redondeados, bien
definidos, algunos subpleurales y otros septados, así que se efectúa estudio para
mutación del gen FLCN y se encuentra mutación del exón
11/18, variante c. 1285 del, patogénica, lo que confirma el
diagnóstico del síndrome de Birt-Hogg-Dubé
(FiÂgura 1). Es remitida a neumología para evaluación
complementaria. La paciente se encontró en buen estado general, sin
dificultad respiratoria u otro síntoma asociado.
CASO NÚMERO 2
Paciente masculino de 72 años, fumador ligero con
índice paquete año de 5 durante 10 años, antecedente de
cáncer de próstata, tratado con radioterapia y prostatectomía 9 años atrás. Tres
años después, presenta un cuadro de tos y disnea de grandes
esfuerzos de un mes de evolución, por lo que es remitido a
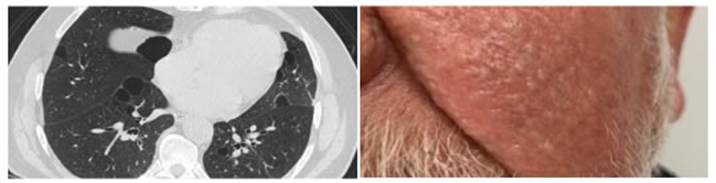
neumología. En el examen físico destacan múltiples
lesiones papulares, de superficie lisa en la cara,
pápulas hiperpigmentaÂdas pardas,
pedunculadas, de superficie lisa en el cuello y canto externo del ojo derecho y
placa pigÂmentada bien definida, grasosa al tacto en el tórax (Figura
2). El resto del examen físico fue normal, incluso la
auscultación pulmonar. Se realizó espiroÂmetría
con resultado normal y TACAR, en la que se observan dos bulas y
múltiples quistes pulmonares de diferente tamaño, algunos
redondeados y con forma de lente (lenticular), que aumentan en núÂmero
hacia las bases, con patrón de “alvéolo en el alvéolo” que
son quistes con septos en su interior, así que fue remitido a
dermatología para biopsia de las lesiones en piel (Figura 2). Las
biopsias toÂmadas de las lesiones en la frente, oreja y mejilla izquierda son
compatibles con tricofoliculoma. Dos años
después, se hace una ecografía renal que evidenció quiste
renal complejo en el polo inferior del riñón izquierdo y
múltiples quistes simples bilaterales, con estudio tomográfico
que presentó hallazgos similares. Un nuevo control ecográfico
efectuado a los 2 años identifica lesión estable al comparar con
el estudio previo. En este caso, se confirmó el diagnóstico de
BHD de acuerdo con los hallazgos clínicos e histopatológicos de
la biopsia en piel. En la actualidad, el servicio de neumología realiza
seguimiento clínico; el paciente no presenta síntomas agudos y
padece tos ocasional.
DISCUSIÓN
El BHD es un desorden autosómico dominante raro,
ocasionado por la mutación en el cromosoma 17 en el gen de la foliculina, sin embargo, aún se desconoce el mecanismo
fisiopatológico implicado.4 En algunos
estudios, se sugiere que provoca hiÂperactividad de la vía mTor, que aumenta la proÂducción de factores de
crecimiento y aminoácidos, lo que se considera la causa de los
carcinomas y quistes pulmonares.5
Las mutaciones genéticas más comunes coÂrresponden
a c.1285dup/ c.1285dup + c.1285del (como la identificada en el caso 1), c.1300G
> C, y c.250– 2A > G. Las mutaciones en c.1285delC o la c.1285dupC
corresponden al 50% de los casos de BHD, mientras las otras mutaciones se
asocian con un aumento en el riesgo de neumotórax, presente hasta en el
77% de los casos.4,
6
Las lesiones cutáneas aparecen entre la tercera y
cuarta década de vida, se presenta con la tríada clásiÂca
de fibrofoliculoma, tricodiscomas
y acrocordones en el 90% de los casos, estas miden de
1 mm a 5 mm, generalmente se presentan en la nariz, el pliegue naso labial, las
mejillas, la frente, el tronco superior, el pabellón auricular y el
área retroauricular.1,
7
El 80% de los pacientes presentan quistes pulÂmonares.2 En la TACAR
se observan bien definidos, con pared delgada, que suelen ser múltiples
y biÂlaterales, de predominio basal (lóbulos inferiores), paramediastinal o subpleural, de
tamaño variable, pero predominan los menores de 1 cm, que pueden ser
redondos o lentiformes, pero la morfología
cambia según el tamaño, cuanto mayor sea este, es menor la
probabilidad de que sean redondos y mayor probabilidad de ver el patrón
conocido como “alvéolo en el alvéolo”, que son quistes con septos
en su interior.8
Se desconoce la causa real de los quistes. Se plantea la
hipótesis del estiramiento que sugiere que hay defectos de
adhesión y por hiperinsuflación
repetida, se expande el espacio alveolar.2, 4 No hay predilección por el sexo, estos
tienden a aparecer desde la tercera década de la vida. Se pueden
complicar con neumotórax en el 20%-30% de los casos, aunque varía
entre cohortes familiares y se considera que tienen cincuenta veces más
de riesgo de neumotórax que la población general, pero es mucho
menor que otras entidades como la linfangioleiomiomatosis,
donde el riesgo es mil veces mayor.1-4,
7, 9, 10
En el BHD, aumenta la incidencia de cáncer renal
siete veces más que en personas no afectaÂdas, y los tumores aparecen,
por lo general, en la quinta década de la vida. Se ha descrito
variación en su aparición del 6,5%-34%, pueden ser unilateÂrales
o bilaterales y el síndrome tiende a ser más común en el
sexo masculino. Los tumores más frecuentes son formas híbridas de
oncocitoma y carcinoma cromófobo (50%-80%).1, 2, 4 También
se han documentado quistes renales simples, pero al ser usuales en la
población general no se ha demostrado asociación clara.4
El diagnóstico suele retrasarse incluso por
años, es pasado por alto o se realiza de manera errónea, ya que
puede confundirse con otras causas de neumotórax espontáneo;
resulta retador dada la alta variabilidad genética y clínica:
hasta un 25% de pacientes portadores asintomáticos, mayores de 20
años, que no presentan lesiones dermatológicas o subgrupos que presentan
algunos fibrofolicuÂlomas muy discretos.12 El principal
diagnóstico diferencial corresponde a linfangioleiomiomatosis
asociada a esclerosis tuberosa, debido a similitudes en cuanto a quistes
pulmonares, tumores cutáneos y renales.4, 13
Los pacientes sospechosos de padecer BHD deben ser
evaluados con TACAR para el análisis de los quistes pulmonares y
neumotórax, y con TC abdominal o ecografía renal al momento del
diagnóstico y se debe realizar un seguimiento tomográfico
por lo menos cada tres a cinco años. Se recomienda tamizar a los
familiares de primer grado de los individuos afectados a partir de los 20
años, y, a partir de los 40 años, debe iniciarse un cribado de
rutina para patología renal en busca de tumores.1, 14
El curso clínico de la evolución pulmonar
no está bien dilucidado y la función pulmonar suele mantenerse
preservada.3,
4 En
algunos casos, hay disminución de la capacidad de difusión al
monóxiÂdo de carbono, particularmente cuando los quistes son
múltiples y grandes, por lo que, al encontrar cambios importantes en
estos, se sugiere realizar pruebas de función pulmonar. Hasta la fecha
no hay tratamiento específico conocido y no se ha evidenciado respuesta
adecuada con los inhibidores de mTor.3, 4
Como parte del manejo complementario se recoÂmienda
empezar el programa de cesación de tabaco y vacunación contra
neumococo e influenza.3,
4, 7, 9, 10, 13-15
Se debe dar un plan de manejo del neumotórax que incluya
recomendaciones y signos de alarma. Se recomienda pleurodesis
después del primer episodio de neumotórax por su alta frecuencia
y recurrencia; y, cuando el neumotórax es reciente, se recomienda no
realizar vuelos no presurizados o practicar buceo, ya que puede precipitar o emÂpeorar
el neumotórax.3,
4, 7, 9, 10, 13-15
CONCLUSIÓN
El síndrome de Birt-Hogg-Dubé
es una rara enÂfermedad que requiere alta sospecha clínica para iniciar
su abordaje diagnóstico. Se debe sospechar en pacientes con neoplasias
cutáneas, renales y quistes pulmonares, particularmente cuando hay
antecedentes familiares de estas afecciones. Su estudio forma parte del
diagnóstico diferencial de la enfermedad quística pulmonar y
corresponde a la tercera causa de esta, que, en comparación con otras
etiologías, es poco sintomática desde el punto de vista
respiratorio, con poca alteración de la función pulmonar. A su
vez, resulta imprescinÂdible el tamizaje de los familiares de primer grado y el
seguimiento de las lesiones documentadas. Su abordaje requiere manejo
multidisciplinario junto con dermatólogos, urólogos, nefrólogos,
genetistas y neumólogos.
Conflicto de intereses
Los autores declaran que no tienen conflicto de intereses
BIBLIOGRAFÍA
1. Samayoa MA, María H, Garzaro
DP. Birt-Hogg-Dubé synÂdrome.> Med Cutan Iber Lat Am. 2017; 45: 68-71.
2. Fibla Alfara JJ, Molins López-Rodó L, Hernández FerÂrández J, Guirao
Montes A. Neumotórax espontáneos de repetición como
presentación del síndrome de Birt-Hogg-
Dubé. Arch Bronconeumol.> 2018; 54: 396-7.
https://doi.org/10.1016/j.arbres.2017.11.017
3. Park S, Lee EJ. Diagnosis and treatment of cystic lung disease. Korean J Intern Med. 2017; 32: 229-38.
4. Daccord
C, Good JM, Morren MA, Bonny O, Hohl
D, Lazor R. Birt-Hogg-Dubé syndrome. Eur> Resp Rev. 2020; 29: 200042.
5. Napolitano G, di Malta C, Esposito A, et al. >A substrate-specific mTORC1 pathway underlies Birt-Hogg-Dubé synÂdrome. Nature>. 2020; 585: 597-602.
https://doi.org/10.1038/s41586-020-2444-0
6. O’Carroll O, Cullen J, Fabre A, et al. >Phenotypic VariaÂtion of Birt-Hogg-Dube Syndrome Within a Single FamÂily.
CHEST. 2020; 158: 1790-1.
https://doi.org/10.1016/j.chest.2020.04.065
7. Obaidat
B, Yazdani D, Wikenheiser-Brokamp
KA, Gupta N. Diffuse Cystic Lung Diseases. Respir> Care. 2020; 65: 111.
https://doi.org/10.4187/respcare.07117
8. Prat Matifoll JA, Andreu
Soriano J, Prats Uribe A, Pallisa Núñez
E, Persiva Morenza O,
Varona Porres D. Caracterización en el TC de tórax del
síndrome de Birt- Hogg-Dubé:
hallazgos para su diagnóstico diferencial. Seram. 2018
9. Cooley J, Lee YCG, Gupta N.
Spontaneous pneumothorax in diffuse cystic lung diseases. Curr Opin
Pulm Med. 2017; 23: 323-33.
https://doi.org/10.1097/MCP.0000000000000391
10. Ferreira Francisco FA, Soares Souza A, Zanetti G, Marchiori E. Multiple cystic lung disease. Eur Resp Rev. 2015; 24: 552-64.
https://doi.org/10.1183/16000617.0046-2015
11. Sattler EC, Syunyaeva Z, Mansmann U, Steinlein OK.> Genetic Risk Factors for Spontaneous Pneumothorax in Birt-Hogg-Dube Syndrome. CHEST. 2020;1 57: 1199-206.
https://doi.org/10.1016/j.chest.2019.12.019
12. Menko
FH, van Steensel MAM, Giraud S, Friis-Hansen
L, Richard S, Ungari S, et al. Birt-Hogg-Dube syndrome: diagnosis and management. Lancet
Oncol. 2009; 10: 1199- 206.
https://doi.org/10.1016/S1470-2045(09)70188-3
13. Gupta N, Seyama
K, McCormack FX. Pulmonary manifestaÂtions of Birt-Hogg-Dubé syndrome.
Fam Cancer. 2013; 12: 387-96.
https://doi.org/10.1007/s10689-013-9660-9
14. Ennis S, Silverstone EJ,
Yates DH. Investigating cystic lung disease: a respiratory
detective approach. Breathe (Sheff). 2020; 16: 200041. https://doi.org/10.1183/20734735.0041-
2020
15. Godden D, Currie G, Denison
D, Farrell P, Ross J, SteÂphenson R, et al. British Thoracic Society guidelines
on respiratory aspects of fitness for diving. 2003; 58: 3-13. https://doi.org/10.1136/thorax.58.1.3234