Autor : SĂmboli, Norberto FabiĂĄn1, GonzĂĄlez, Claudio Daniel2 Grupo de Estudio DiagnĂłstico de TB Amiano, NicolĂĄs Oscar3; Armitano, Rita InĂŠs4; Bisero, Elsa Delia5; Cerqueiro, MarĂa Cristina6; DurĂŠ, Roberto Miguel7; Fruhwald, Gladys Esther8; GarcĂa, VerĂłnica Edith3; GonzĂĄlez, Claudio Daniel2; GonzĂĄlez, Norma Edith9; Lombardero, Lorena Andrea10; Luque, Graciela Fabiana5; Melillo, Karina Claudia5; SĂmboli, Norberto FabiĂĄn1
1 Servicio de Micobacterias del Instituto Nacional de Enfermedades Infecciosas-ANLIS Dr. Carlos G. MalbrĂĄn, Ciudad de Buenos Aires, Argentina. 2Unidad NeumotisiologĂa, Hospital General de Agudos JosĂŠ M. Ramos MejĂa, Ciudad de Buenos Aires. Argentina. 3Investigador/a del CONICET. Laboratorio de Inmunidad y Tuberculosis del Instituto de QuĂmica BiolĂłgica, Facultad de Ciencias Exactas y Naturales (IQUIBIÂCEN), Universidad de Buenos Aires (UBA) Ciudad de Buenos Aires. Argentina. 4Laboratorio de Micobacterias. Hospital General de Agudos Parmenio PiĂąero. Ciudad de Buenos Aires. Argentina. 5Servicio de PediatrĂa. SecciĂłn NeumonologĂa Infantil, Hospital Nacional Prof. Dr. Alejandro Posadas. El Palomar, Provincia de Buenos Aires. Argentina. 6Consultora de la SecciĂłn TisiologĂa. Hospital de NiĂąos Dr. Ricardo GutiĂŠrrez. Ciudad de Buenos Aires. Argentina. 7Unidad de Broncoscopia Hospital de Infecciosas âFrancisco J. MuĂąizâ. Ciudad de Buenos Aires. Argentina. 8Servicio de NeumonologĂa de la Obra Social del Personal de Edificios de Renta y Horizontal (OSPERYH). 9Unidad NeumotisiologĂa, Hospital General de NiĂąos Pedro de Elizalde. Ciudad de Buenos Aires. Argentina.
https://doi.org/10.56538/ramr.NNBE9983
Correspondencia : Claudio Daniel GonzĂĄlez (claudiodgonzalez57@gmail.com)
Recibido:
17/11/2021
Aceptado:
17/03/2022
DIAGNĂSTICO DE LA TUBERCULOSIS
Claudio D. GonzĂĄlez
Uno
de los principales desafĂos para los Programas de Control de TuberÂculosis
(PCT) lo constituye la detecciĂłn temprana de formas abiertas de la enfermedad.
La OrganizaciĂłn Mundial de la Salud (OMS) ha estimado que el desarrollo de un
mĂŠtodo de diagnĂłstico de tuberculosis (TB) que ofreciera un 85% de sensibilidad
y un 95% de especificidad sobre muestras de esputo permitirĂa salvar unas 400
000 vidas al aĂąo.1 En
condiciones ideales, serĂa necesario, ademĂĄs, que un mĂŠtodo accesible y
preciso, aplicado en colectivos de mayor vulnerabilidad, pudiera aportar tanto
a la identificaciĂłn de especie como a su perfil de resistencia, en especial si
este implicara un mayor riesgo de fracaso terapĂŠutico.1
En la Ăşltima dĂŠcada, el desarrollo del sistema de diagÂnĂłstico GeneXpert MTB/RIF ha significado un gran avance en ese
sentido. A un costo de USD 9,98 por determinaciĂłn (en los 145 paĂses subsidiados),
el mĂŠtodo permitiĂł acercarse a los objetivos mencionados, es decir, la detecÂciĂłn
precoz de la TB y la detecciĂłn de resistencia a rifampicina,
usualmente tomada como un indicador de fracaso terapĂŠutico.2-4
Desafortunadamente,
la emergencia de la pandemia por el SARS-CoV-2 impactĂł negativamente sobre los
logros obtenidos. Dos aspectos de la atenciĂłn de pacientes con TB fueron
afectados: uno, la provisiĂłn regular y completa de insumos para el diagnĂłstico
y tratamiento de la enfermedad; el otro aspecto se refiriĂł a las demoras y
postergaciones en las consultas generadas por las medidas de confinamiento y
distanciamiento social, adoptadas por la mayorĂa de los paĂses.
Algunos
estudios, a travĂŠs de modelos matemĂĄticos, han estimado el impacto directo e
indirecto de la pandemia sobre el funcionamiento de los PCT.5
El
objetivo de este trabajo es el de revisar el estado del conocimiento actual
sobre los mĂŠtoÂdos vigentes de diagnĂłstico de TB. Con el fin de agilizar la
lectura, se divide este documento de actualizaciĂłn en tres publicaciones. Esta
primera publicaciĂłn incluye los mĂŠtodos de diagnĂłstico diÂrigidos a identificar
el agente causal y su perfil de sensibilidad, es decir, el diagnĂłstico
bacteriolĂłgico o de certeza. La segunda entrega abordarĂĄ los mĂŠÂtodos que
evalĂşan las respuestas del huĂŠsped ante el bacilo, esto es, el diagnĂłstico no
bacteriolĂłgico o presuntivo, donde se incluyen algunos mĂŠtodos aĂşn bajo
investigaciĂłn. La tercera publicaciĂłn se reservarĂĄ al diagnĂłstico de TB en
niĂąos.
DIAGNĂSTICO BACTERIOLĂGICO DE TUBERCULOSIS
Norberto SĂmboli
La
Red Nacional de Laboratorios de DiagnĂłstico de Tuberculosis estĂĄ organizada en
una estructura piramidal donde cada nivel tiene requerimientos especĂficos de
infraestructura y bioseguridad, las cuales son definidas por las actividades y
mĂŠtodos diagnĂłsticos que se realizan en cada laboratorio. A medida que aumenta
el nivel del laboratorio (1 a 3), las tecnologĂas se vuelven mĂĄs avanzadas y,
como resultado, las habilidades, la competencia y los requisitos de
capacitaciĂłn necesarios para el personal aumentan.6
Los
mĂŠtodos de diagnĂłstico se estratifican en los tres niveles de laboratorio, de
acuerdo con el nivel de riesgo de cada procedimiento, la situaciĂłn epidemioÂlĂłgica
de la enfermedad y los recursos disponibles.6 Siguiendo dicho ordenamiento, este documento
tiene como propĂłsito revisar el estado del conocimiento actual sobre las
tĂŠcnicas disponibles y ofrecer un abordaje inicial hacia mĂŠtodos de diagnĂłstico
bacteÂriolĂłgico aĂşn en desarrollo. Los niveles mencionados de complejidad son
los siguientes:
1.
PRIMER NIVEL DE COMPLEJIDAD
Corresponde
a los laboratorios perifĂŠricos ubicaÂdos, en algunos casos, en centros de
salud, que ofrecen examen directo de esputo (ED) por la tĂŠcnica de Ziehl Neelsen (ZN) y cultivo en
medio Kudoh-Ogawa (KO).
Actualmente
se estĂĄ incorporando el sistema de diagnĂłstico GeneXpert
MTB-RIF, TB-LAMP (loop-mediated isothermal amplification) y
el LF-LAM (lateral flow lipoarabinomannan
assay).6
2.
SEGUNDO NIVEL DE COMPLEJIDAD
Se
incluyen aquĂ laboratorios de hospitales locales o regionales con capacidad
para realizar todas las actividades del nivel 1 mencionadas, mĂĄs cultivo en
medios sĂłlidos o lĂquidos, identificaciĂłn del omplejo
Mycobacterium tuberculosis (M.
tubercuÂlosis) y pruebas de sensibilidad (PS) a drogas de primera lĂnea (isoniacida y rifampicina), a los
que se suman aquellos con capacidad para realizar FL-LPA (line probe assay para drogas de
primera lĂnea) y SL-LPA (line probe assay para drogas de segunda lĂnea), siempre a partir
de muestras de esputo con baciloscopia positiva.6
3.
TERCER NIVEL DE COMPLEJIDAD
EstĂĄ
integrado por laboratorios de referencia nacional, provincial o laboratorios
especializados que cuentan con los recursos para realizar, ademĂĄs de los estudios
citados en los otros dos niveles, PS a drogas de segunda lĂnea y tĂŠcnicas
moleculares complejas.
1.
PRIMER NIVEL DE COMPLEJIDAD
Examen directo (ED)
Desde
hace tiempo los paĂses con recursos liÂmitados se han basado en la microscopia como
mĂŠtodo principal para detectar el M. tuberculosis. Si bien es econĂłmico
y requiere unas condicioÂnes mĂnimas de bioseguridad, el ED posee una limitada
sensibilidad, especialmente en pacientes que viven con VIH/sida y en niĂąos
menores de 5 aĂąos, y no proporciona informaciĂłn sobre el perfil de resistencia
a drogas de los bacilos.7 A pesar de
que la microscopia no es capaz de diferenciar M. tuberculosis de otras micobacterias, en los paĂses con alta endemia de TB, una baciloscopia positiva de una muestra respiratoria de un
paciente inmuÂnocompetente tiene muy alto valor
predictivo para el diagnĂłstico de TB.7
La
coloraciĂłn de ZN ha sido la tĂŠcnica mĂĄs emÂpleada para el diagnĂłstico de TB en
los paĂses de AmĂŠrica Latina.7 Comparada con
la microscopia de fluorescencia (MF), la microscopia convencional tiene como
ventaja que requiere un entrenamiento mĂĄs sencillo, ya que la capacidad de
identificar el bacilo por esta metodologĂa es mĂĄs fĂĄcil de adquiÂrir. AdemĂĄs,
el ED a travĂŠs de la coloraciĂłn de ZN continĂşa siendo, en nuestro paĂs, un
recurso Ăştil en la pesquisa de TB entre sintomĂĄticos respiratorios (SR), esto
es, personas con tos y expectoraciĂłn por mĂĄs de dos semanas.7
En
2011, la OMS recomendĂł el uso de la MF con lĂĄmpara LED. La MF es, al menos, 10%
mĂĄs sensible que la microscopia convencional de ZN.8
Dado que reduce el tiempo necesario para la realiÂzaciĂłn de la
lectura y requiere personal adiestrado, estĂĄ especialmente recomendada para
laboratorios con alta carga de trabajo. Comparado con la MF convencional (con
lĂĄmpara de mercurio), la MF con lĂĄmpara LED ofrece considerables ventajas operaÂtivas
porque tiene una elevada vida Ăştil, no genera calor y no tiene los riesgos de
contaminaciĂłn del ambiente en caso de rotura. De ser adoptado este mĂŠtodo en
lugar de ZN, el centro deberĂa cumpliÂmentar los requisitos tĂŠcnicos exigidos
por la OMS y el correspondiente monitoreo externo de calidad.8
En los Ăşltimos aĂąos, estĂĄn disponibles pruebas rĂĄÂpidas y
sensibles basadas en mĂŠtodos moleculares para reemplazar o complementar la
microscopia.
Cultivo por el mĂŠtodo de Kudoh-Ogawa
Los
laboratorios sin condiciones adecuadas para cultivar con mĂŠtodos que requieren
centrifugaciĂłn y que se encuentran alejados de un laboratorio de referencia o que
no cuentan con un sistema de transporte frecuente de muestras pueden sembrar
las muestras empleando el mĂŠtodo de Kudoh- Ogawa y enviar los tubos sembrados al laboratorio de
referencia.9
MĂŠtodo GeneXpert
MTB/RIF- MTB/ULTRA- Xpert XDR
El
desarrollo del ensayo XpertÂŽ
MTB/RIF para la plataforma GeneXpert se
completĂł en 2009 y se considera un avance importante en la lucha contra la TB.
Por primera vez, una prueba molecular es lo suficientemente simple y robusta
como para ser introducida y utilizada fuera de los entornos de los laboratorios
convencionales.10
Detecta
el Complejo Mycobacterium tuberculosis (CMTB)
y tambiĂŠn las mutaciones mĂĄs frecuentes, que confieren resistencia a la rifampicina usando tres cebadores especĂficos y cinco
sondas molecuÂlares Ăşnicas para asegurar un alto grado de espeÂcificidad. Es un
sistema automatizado cerrado de extracciĂłn y amplificaciĂłn en tiempo real.
Permite detectar CMTB en un gran nĂşmero de muestras clĂnicas en 2 h con un
lĂmite de detecciĂłn de 114 ufc/mL,
y razonables condiciones de accesibilidad, costo y seguridad.2, 3, 10
Es
una prueba rĂĄpida y sencilla que puede ser utilizada en laboratorios con
infraestructura mĂÂnima y permite incrementar la detecciĂłn de casos de TB en
comparaciĂłn con la microscopia. Esto reÂsulta ventajoso a la hora de disminuir
la inversiĂłn en infraestructura y equipamiento en los servicios de salud. Se
suman otros beneficios para la salud pĂşblica, como la posible reducciĂłn en la
transmiÂsiĂłn secundaria de cepas resistentes, aspecto que adquiere especial
relevancia en el contexto de la epidemiologia de tuberculosis multirresistente (TB-MR) en nuestro paĂs, en el cual el
mayor impulso generador de TB-MR estĂĄ asociado a la transmisiĂłn de cepas en la
comunidad.11
En
muestras pulmonares, cuando se considera entre distintos estudios su
sensibilidad y su esÂpecificidad agrupadas (overall
pooled sensitivity-specificity)
frente al ED, su rendimiento alcanzĂł 88% y 99%, respectivamente.2-4
Sobre muestras de esputo ED/cultivo positivas, la sensibilidad fue
del 98%, mientras que sobre aquellas ED negativas/ cultivo positivo, la
sensibilidad agrupada fue del 80%. Este desempeĂąo, tanto reemplazando al ED
como prueba inicial o frente a muestras ED negaÂtivas, permitirĂa mejorar en un
30% la detecciĂłn por baciloscopia con respecto a la
tĂŠcnica de ZN, y reducirĂa considerablemente el tiempo de inicio del
tratamiento.12 Este
rendimiento se extiende tambiĂŠn al colectivo de pacientes que conviven con VIH,
duplicando la tasa de detecciĂłn de TB en esa poblaciĂłn, donde el rendimiento
global alcanzĂł al 79%.2,
3
Con
el mismo cartucho el sistema ofrece una segunda utilidad, la de realizar la
prueba de senÂsibilidad (PS) a la rifampicina, que
alcanza una sensibilidad y especificidad agrupadas del 95% y el 99%,
respectivamente.2,
3
Por
otra parte, sobre muestras extrapulmonares de adultos
y niĂąos, la sensibilidad y especificidad agrupadas mĂĄs altas del Gene-Xpert frente al cultivo se alcanzaron en muestras
ganglionares (84,9% y 94,2%, respectivamente), seguidas por las de lavado
gĂĄstrico y aspirado (83,8% y 98,1%, resÂpectivamente), de lĂquido
cefalorraquĂdeo (79,5% y 98,6%), y por Ăşltimo de lĂquido pleural (43,7% de
sensibilidad y 98,1% de especificidad agrupadas, respectivamente).2, 3
El
XpertÂŽ MTB/RIF Ultra
ha sido desarrollado como ensayo de nueva generaciĂłn para superar las
limitaciones del Xpert MTB/RIF y utiliza la misma
plataforma GeneXpertÂŽ.13
Para
mejorar la sensibilidad para la detecciĂłn de CMTB, el Xpert
Ultra incorpora dos blancos multicopia diferentes de amplificaciĂłn (IS6110 e
IS1081) y una cĂĄmara de reacciĂłn de ADN mĂĄs grande que Xpert
MTB/RIF (reacciĂłn de PCR de 50 μL en Ultra
versus 25 μL en Xpert
MTB/RIF.13
TambiĂŠn
incorpora una amplificaciĂłn anidada de ĂĄcido nucleico, ciclos tĂŠrmicos mĂĄs rĂĄpidos
y fluidos y enzimas mejorados. Esto ha resultado que el Xpert
Ultra tenga un lĂmite de detecciĂłn de 16 ufc/mL (comparado a 114 ufc/mL del Xpert MTB/ RIF). Para
mejorar la precisiĂłn de la detecciĂłn de resistencia a rifampicina,
el Ultra incorpora anĂĄliÂsis basado en la temperatura de fusiĂłn en lugar de una
PCR en tiempo real. EspecĂficamente, cuatro sondas identifican mutaciones de
resistencia a riÂfampicina en la regiĂłn determinante
del gen rpoB, las que cambian su temperatura de
fusiĂłn respecto de la temperatura de referencia del tipo salvaje.13
La
investigaciĂłn de TB con cartuchos MTB/RIF ha demostrado consistentemente ser
mĂĄs sensible que la baciloscopia. La versiĂłn Ultra de
los carÂtuchos de Xpert MTB/RIF es aĂşn mĂĄs sensible,
especialmente en muestras ED negativas cultivo positivo y en muestras de
pacientes con VIH, pero menos especĂfica que la versiĂłn anterior, sobre todo
entre pacientes con antecedentes de tratamiento para TB.9
Entre
las personas con TB y TB resistente a la rifampicina
(TBRR), se deben realizar con prontiÂtud pruebas adicionales de resistencia al
menos a la isoniacida y las fluoroquinolonas,
respectivamente, para guiar las decisiones de tratamiento.
En
2020, la OMS encargĂł una revisiĂłn sistemĂĄÂtica de los datos publicados y no
publicados sobre tres clases de pruebas de amplificaciĂłn de ĂĄcidos nucleicos
que no habĂan sido revisadas previaÂmente por esa organizaciĂłn.14
Una de ellas fue el nuevo cartucho MTB/XDR, en el que se observĂł
una excelente sensibilidad y especificidad para detectar rĂĄpidamente la
resistencia a isoniacida, fluoroquinolonas
y aminoglucĂłsidos.
Recientemente
la OMS recomendĂł el uso del cartucho para la detecciĂłn rĂĄpida de mutaciones que
confieren resistencia a estas drogas.14
Esta reÂcomendaciĂłn se basĂł en el anĂĄlisis de tres estudios que
incluyeron muestras de esputos de 1605 partiÂcipantes. De este anĂĄlisis,
resultĂł que la sensibilidad combinada general de este cartucho (IC del 95%)
para la detecciĂłn de resistencia a la isoniacida fue
del 94,2% (89,3% al 97,0%) y la especificidad fue del 98,0% (95,2% al 99,2%).
La sensibilidad combinada general (IC del 95%) para la detecciĂłn de resistenÂcia
a las fluoroquinolonas fue del 93,1% (88,0% al 96,1%)
y la especificidad fue del 98,3% (94,5% al 99,5). La sensibilidad global
combinada (IC del 95%) para la detecciĂłn de resistencia a la amikacina fue del 89,1% (80,9% al 94,1%) y la especificidad
fue del 99,5% (96,9% al 99,9%). La PS fenotĂpica se utilizĂł como estĂĄndar de
referencia para las tres estimaÂciones mencionadas anteriormente. La
sensibilidad general (IC del 95%) para la detecciĂłn de resistencia a la etionamida fue del 96,4% (92,2% al 98,3%) y la
especificidad fue del 100,0% (82,5% al 100,0%). La secuenciaciĂłn gĂŠnica de la
regiĂłn promotora inhA se utilizĂł como
estĂĄndar de referencia para la detecciĂłn de resistencia a la etionamida.14
El
sistema Xpert en todas sus formas de presenÂtaciĂłn
puede ser implementado en laboratorios de baja complejidad, con las mismas
condiciones que se requieren para realizar la baciloscopia.
Recomendaciones
sobre la utilizaciĂłn del Xpert MTB/Rif y ULTRA:
La
OMS recomienda el uso del Xpert MTB/RIF y Xpert Ultra como pruebas iniciales en adultos y niĂąos con
signos y sĂntomas de TB pulmonar y extraÂpulmonar
basado en la evidencia cientĂfica actual.15
Como
al momento de la realizaciĂłn de este conÂsenso en nuestro paĂs existe un
limitado acceso a pruebas rĂĄpidas moleculares debido a la escasa disponibilidad
de equipos Gene-Xpert, esta prueba estĂĄ recomendada
principalmente para su uso en los siguientes colectivos:
I.
Pacientes adultos o pediĂĄtricos con alta sospeÂcha clĂnica y epidemiolĂłgica de
TB y con riesgo de multirresistencia (recomendaciĂłn
fuerte).
II.
Pacientes adultos o pediĂĄtricos con alta sospecha clĂnica y epidemiolĂłgica de
TB o TBMR y que conviven con el VIH (recomendaciĂłn fuerte).
III.
Pacientes adultos o pediĂĄtricos con alta sospeÂcha clĂnica y epidemiolĂłgica de
TB menĂngea (recomendaciĂłn fuerte).
IV.
Pacientes adultos o pediĂĄtricos con alta sospeÂcha clĂnica de TB extrapulmonar (recomendaÂciĂłn condicional).15
Como
indicaciĂłn se plantea su uso en los siÂguientes casos:
a)
Muestras respiratorias de pacientes (adultos o pediĂĄtricos) que presentan
signos y sĂntomas compatibles con TB y con mayor riesgo de teÂner TB
resistente: personas que conviven con el VIH, inmunosuprimidos,
personal de salud, contacto de paciente con TB-RR o TBMR, paÂcientes con
antecedentes de tratamiento con drogas antituberculosas con mĂĄs de 1 aĂąo de
finalizado el tratamiento.
b)
Muestras de lĂquido cefalorraquĂdeo, aspirado de nĂłdulo linfĂĄtico, lĂquido
sinovial, lĂquido pleural, lĂquido peritoneal, lĂquido pericĂĄrdico, orina y
biopsias provenientes de pacientes (adultos o pediĂĄtricos) con alta sospecha
clĂnica o epideÂmiolĂłgica de TB extrapulmonar.15
Estas
recomendaciones son sometidas a reviÂsiones periĂłdicas, en la medida en que
progrese el desarrollo tecnolĂłgico y se produzca evidencia cientĂfica que lo
justifique.
Se
recomienda el uso del cartucho Xpert MTB / XDR en muestras
de esputo de personas con TBRR.
Truenat MTB, MTB Plus y MTB-Rif DX
Este
es un nuevo mĂŠtodo molecular desarrollado en India que puede ser utilizado en
el mismo nivel de laboratorio que el Gene-Xpert. Se
basan en una micro-PCR en tiempo real que permite la detecciĂłn del CMT y su
resistencia a la rifampicina a partir de una muestra
de esputo en menos de 1 h. El Truenat MTB y el MTB
Plus pueden ser usados como prueba diagnĂłstica inicial en adultos y niĂąos con
signos y sĂntomas de TB pulmonar, mientras que el MTB-RIF Dx
es usado como una prueba para detectar resistencia a la rifampicina
en aquellas muestras con resultados positivos en la prueba inicial.16
TB-LAMP (Loop-mediated
isothermal amplification/
amplificaciĂłn isotĂŠrmica mediada por enlace de ĂĄcidos nucleicos)
El
TB-LAMP es un ensayo molecular comercial baÂsado en amplificaciĂłn isotĂŠrmica
mediada por bucle y requiere una mĂnima infraestructura de laboratorio y
requisitos de bioseguridad.17 Ha sido
evaluado como una prueba rĂĄpida (<2 h) en el punto de atenciĂłn como una
alternativa al ED de esputo, que sigue siendo la prueba de diagnĂłstico primaria
para TB pulmonar en entornos con recursos limitados.
En
enero de 2016, la OMS convocĂł una reuniĂłn al Grupo de Desarrollo de Directrices
(GDG), para revisar la evidencia de los estudios publicados desde el 2012 hasta
ese momento.17 La revisiĂłn
incluyĂł toÂdos los estudios prospectivos que evaluaron el ensayo TB-LAMP en
muestras de esputo de adultos con sigÂnos y sĂntomas compatibles con TB pulmonar
que se realizaron en un entorno de carga de TB intermedia o alta. De esta
revisiĂłn, la cual incluyĂł veinte estuÂdios (4760 pacientes adultos), el TB-LAMP
resultĂł con una sensibilidad combinada 15% mayor que el ED para detectar TB
pulmonar en adultos (el 78% en comparaciĂłn con el 63%), aunque la especificidad
combinada fue un 2% mĂĄs baja (el 98% en comparaÂciĂłn con el 100%). Esto puede
explicarse en parte por la identificaciĂłn de casos de TB que se clasificaron
errĂłneamente como TB negativos mediante el uso de cultivos de referencia. Entre
adultos que viven con VIH y signos y sĂntomas de TB pulmonar, la evaluaciĂłn de
la precisiĂłn de TB-LAMP demostrĂł una sensibilidad y especificidad similar al ED
de esÂputo (64% y 62%) y (99% y 99%), respectivamente.17
De
acuerdo con esta evaluaciĂłn de la evidencia y considerando los costos y
beneficios asociados con el uso de TB-LAMP, la OMS lo recomienda para ser
utilizado solo en muestras de esputo en alguna de las dos formas siguientes:
a)
Como prueba de reemplazo de la baciloscopia para el
diagnĂłstico de TB pulmonar en adultos con sigÂnos y sĂntomas compatibles con TB
(condicional recomendaciĂłn, evidencia de muy baja calidad).
b)
Como prueba adicional al ED en adultos con sigÂnos y sĂntomas consistentes con
TB pulmonar, especialmente cuando los ED de esputo son neÂgativas
(recomendaciĂłn condicional, evidencia de muy baja calidad).
En
nuestro paĂs, aĂşn este mĂŠtodo no se encuentra disponible.
LF-LAM (lateral flow
lipoarabinomannan assay/inmunocromatografĂa de flujo lateral de lipoarabinomananos)
Las
pruebas basadas en la detecciĂłn del antĂgeno micobacteriano
lipoarabinomanano (LAM) en la orina han surgido como
posibles pruebas rĂĄpidas en el punto de atenciĂłn para el diagnĂłstico de la TB.18 El antĂgeno
LAM es un lipopolisacĂĄrido presente en las paredes
celulares de las micobacÂterias, que se libera de
cĂŠlulas bacterianas metaÂbĂłlicamente activas o en degeneraciĂłn y parece estar
presente solo en personas con TB activa. Esta prueba tendrĂa ventajas sobre las
basadas en esputo porque la orina es fĂĄcil de recolectar y almacenar, y carece
de los riesgos de control de infecciones asociados con la recolecciĂłn de
esputo.18
El
ensayo de detecciĂłn de LAM en orina a travĂŠs de una inmunocromatografĂa
de flujo lateral se encuentra comercialmente disponible. La prueba se realiza
manualmente aplicando 60 μL de orina a la tira
reactiva e incubando a temperatura ambienÂte durante 25 min. Luego, la tira se
inspecciona visualmente. La intensidad de cualquier banda visible en la tira reactiva
se clasifica comparĂĄndola con las intensidades de las bandas en una tarjeta de
referencia proporcionada por el fabricante.18
Varios
estudios y metaanĂĄlisis de una prueba de una
generaciĂłn anterior (LAM-ELISA), han demosÂtrado una buena sensibilidad de la
detecciĂłn del LAM urinario en presencia de coinfecciĂłn
VIH-TB, la cual aumenta aĂşn mĂĄs cuando los recuentos de LTCD4+ son mĂĄs bajos. Este hallazgo contrasta con
los mĂŠtodos de diagnĂłstico tradicionales para la TB en pacientes con VIH.
Varias hipĂłtesis pueden explicar la mayor sensibilidad de la detecciĂłn de LAM
en orina en paÂcientes con inmunosupresiĂłn relacionada con el VIH: una mayor
carga bacilar y de antĂgeno, una mayor probabilidad de TB en el tracto
genitourinario y una mayor permeabilidad glomerular para permitir un aumento de
niveles de antĂgeno en la orina.18
Estudios
publicados han informado tasas de mortalidad mucho mĂĄs altas en pacientes con
VIH con recuentos bajos de LTCD4+
que tienen LAM urinario detectable en comparaciĂłn con individuos
LF-LAM negativos.18
Dado el potencial del ensayo para ayudar a reducir la mortalidad
en personas que viven con el VIH, que la prueba es fĂĄcil de realizar y que
requiere una infraestructura mĂnima de bioseÂguridad, la OMS encargĂł una
revisiĂłn sistemĂĄtica del uso del ensayo LF-LAM para el diagnĂłstico y detecciĂłn
de TB activa en personas que viven con el VIH. Luego de esa revisiĂłn la
organizaciĂłn realizĂł las siguientes recomendaciones de uso:15 , 18
a)
Excepto para las personas con infecciĂłn por VIH con bajo recuento de LTCD4+ o que estĂĄn
gravemente enfermos, LF-LAM NO DEBE utilizarse para el diagnĂłstico de TB
(fuerte recomendaciĂłn, evidencia de baja calidad).
b)
LF-LAM se puede utilizar para ayudar en el diagnĂłstico de TB en pacientes con VIH
y con signos y sĂntomas de TB (pulmonar o extraÂpulmonar)
que tienen un recuento de cĂŠlulas LTCD4+
menor o igual o superior a 100 cĂŠlulas/ μL,
o pacientes VIH positivos que estĂĄn graveÂmente enfermos independientemente del
reÂcuento de LTCD4+ o
con recuento desconocido (recomendaciĂłn condicional; evidencia de baja
calidad).
En
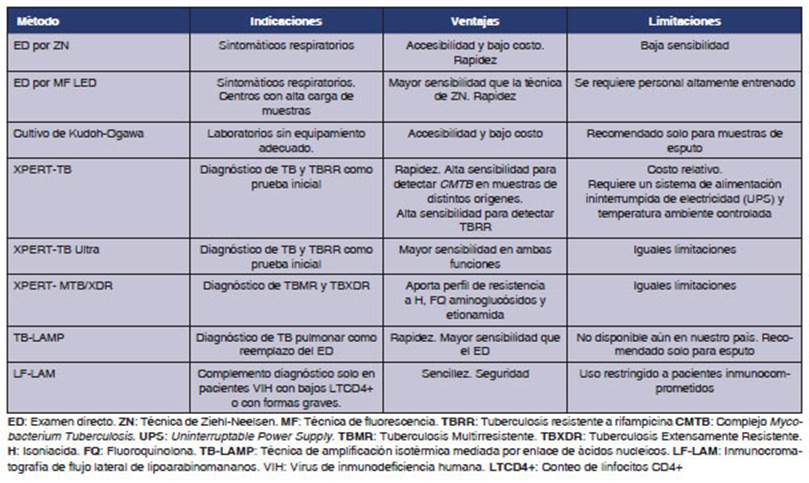
la Tabla 1 se resumen los mĂŠtodos de diagÂnĂłsticos correspondientes a este
nivel.
2.
SEGUNDO NIVEL DE COMPLEJIDAD
Cultivo
Como
se expresĂł con anterioridad, el ED sigue siendo la prueba de diagnĂłstico
primaria para TB pulmonar en entornos con recursos limitados.
El
cultivo complementa al ED, ya que permite evidenciar bacilos viables presentes en
escasa cantidad en una muestra de lesiĂłn, caracterizarlos y conocer si es
sensible o resistente a las drogas antituberculosas. El rol del cultivo es mĂĄs
imporÂtante en escenarios con mediana o baja incidencia de TB, con alta coinfecciĂłn del bacilo de la TB y VIH y con carga mediana o
alta de TBMR.19
Mediante
el cultivo es posible incrementar la confirmaciĂłn del diagnĂłstico de TB en
aproximaÂdamente 15%-20% del total de casos y en 20%-30% de los casos de TB
pulmonar. Si se considera el total de casos con diagnĂłstico de TB pulmonar
confirÂmado bacteriolĂłgicamente, la baciloscopia
detecta el 70%-80% y el cultivo, el restante 20-30%.19
El
cultivo en medio sĂłlido continĂşa usĂĄndose como testigo frente a los medios de
cultivos lĂquiÂdos y automatizados mĂĄs modernos y mantiene su condiciĂłn de
mĂŠtodo de referencia frente a otros sistemas de diagnĂłstico. El medio sĂłlido
tiene la ventaja de ser econĂłmico pero la detecciĂłn del desarrollo es mĂĄs
tardĂa.
MĂŠtodos de cultivo en medio lĂquido
La
principal ventaja de estos sistemas frente al culÂtivo tradicional sigue
midiĂŠndose en la rapidez de los resultados. Estos mĂŠtodos utilizan, o bien, un
sistema colorimĂŠtrico para informar del crecimienÂto bacteriano (MB Bact Alert), o bien, la detecciĂłn
de oxĂgeno consumido detectado por fluorescencia (MGIT 960). Para muestras de
sangre y mĂŠdula Ăłsea, se realiza la tĂŠcnica de lisis-centrifugaciĂłn para
hemocultivos.7
La
utilizaciĂłn de estos medios exige condiciones de bioseguridad diferentes
respecto a los medios sĂłlidos, aunque pueden ser utilizados en este nivel de
complejidad si se cuenta con esas condiciones.
Indicaciones del cultivo
a)
Dado que las lesiones en niĂąos suelen ser pauÂcibacilares,
como recomendaciĂłn de fortaleza se sugiere que todas las muestras pediĂĄtricas
deben cultivarse, ya que aportan un 20% de rendimiento sobre el ED.3
Se incluyen en la indicaciĂłn, las siguientes muestras respiratorias por orden
de preferencia: esputo, aspirado gĂĄstrico en niĂąos SR con radiografĂa (Rx) de tĂłrax patolĂłgica, esputo inducido, lavado broncoalveolar y bronÂcoaspirado;
entre las muestras no respiratorias, el contenido de cavidades serosas y el de
biopsias.3
b)
Muestras de pacientes sintomĂĄticos, con signos clĂnicos o Rx
u otras imĂĄgenes compatibles con TB y alguna de las siguientes caracterĂsticas:
â˘
Baciloscopia negativa de tres muestras respiraÂtorias.
â˘
LocalizaciĂłn extrapulmonar de la enfermedad.
â˘
Pacientes inmunosuprimidos, particularmente VIH
positivos.
â˘
Baciloscopia positiva en lavado gĂĄstrico, lavado
bronquial o hisopados.
â˘
Antecedentes de tratamiento antituberculoso, especialmente si se registrĂł
pĂŠrdida de seguiÂmiento o fracaso.
â˘
ExposiciĂłn a infecciĂłn por bacilos resistentes a las drogas (contactos de casos
con TB resistente, internados o trabajadores de instituciones de salud o de
prisiones donde se registran casos con TB-MR).7, 19
â˘
Como complemento de las pruebas rĂĄpidas diagÂnĂłsticas cuando son utilizadas
como primera prueba diagnĂłstica.
Pruebas
de sensibilidad a drogas de primera lĂnea (H y R). Pruebas fenotĂpicas
En
este nivel de complejidad, el mĂŠtodo de las proÂporciones en medio de LĂśwenstein-Jensen (mĂŠtodo de Canetti,
Rist y Grosset) continĂşa
aportando la reconocida sencillez y confiabilidad que le ha vaÂlido su
consideraciĂłn como mĂŠtodo de referencia frente a los mĂŠtodos genotĂpicos de
base molecular. Es un mĂŠtodo econĂłmico, pero tiene la desventaja que para
obtener un resultado de sensibilidad se demora entre 30 a 40 d.
Una
alternativa econĂłmica para acelerar los resultados es el ensayo de nitrato reductasa (NRA). Idealmente, el mĂŠtodo debe ser realizado
directamente con muestras ED positivo reciĂŠn recolectadas o en cuanto se
obtiene desarrollo en el primocultivo. Esta prueba
cuenta con el aval de la OMS por considerarse una PS accesible y eficaz para la
determinaciĂłn de resistencia a las drogas isoniacida
y rifampicina.19
Otra
alternativa, aunque mĂĄs costosa, es la utilizaciĂłn de medios de cultivos
lĂquidos (MGIT) que permiten acelerar los resultados, ya que emÂplean equipos semiautomatizados que detectan el desarrollo antes que sea
visible.19
Indicaciones de PS
Idealmente,
todos los casos con diagnĂłstico de TB confirmado bacteriolĂłgicamente deben
tener acceso a la PS, al menos para los fĂĄrmacos que son claves para el ĂŠxito
del tratamiento (H y R). Esto requiere garantizar el acceso universal a las
pruebas rĂĄpidas recomendadas (Xpert, LPAS, etc.). En
el proceso que lleva a alcanzar este objetivo, se deberĂa priorizar la
realizaciĂłn de la PS para los casos con las siguientes caracterĂsticas que
elevan el riesgo de resistencia a los fĂĄrmacos.7
a)
Falla de tratamiento.
b)
Antecedentes de tratamiento previo, irregulaÂridad en el cumplimiento de un
tratamiento o prescripciĂłn de un esquema incompleto o inadecuado.
c)
ExposiciĂłn a infecciĂłn por TB resistente a los fĂĄrmacos.
d)
NiĂąos.
e)
Pacientes inmunosuprimidos (personas que viven con
VIH y o diabetes, etcĂŠtera).
f)
Residencia anterior en paĂses con alto nivel de resistencia a fĂĄrmacos
(Ecuador, PerĂş, algunos paĂses asiĂĄticos y de Europa del Este).
g)
Personas que abusan del alcohol o drogas.
Nuevas plataformas
Las
nuevas tecnologĂas de detecciĂłn rĂĄpida de la TB y la resistencia a la rifampicina estĂĄn cada vez mĂĄs disponibles y adoptadas por
los paĂses. Son varios los fabricantes que han desarrollado plataÂformas
automatizadas para la detecciĂłn de TB y la resistencia a isoniacida
y rifampicina (Abbott, BecÂton
Dickinson, Roche, Hain Lifescience/Bruker) basadas en la
amplificaciĂłn de ĂĄcidos nucleicos.20
Las
pruebas que pertenecen a esta clase son mĂĄs rĂĄpidas y menos complejas de
realizar que las pruebas de sensibilidad fenotĂpicas a fĂĄrmacos basadas en
cultivos y los ensayos de sonda de lĂnea (LPA). Tienen la ventaja de ser en
gran parte autoÂmatizadas y se pueden utilizar como prueba inicial para la
detecciĂłn de TB y la resistencia a ambos medicamentos de primera lĂnea
simultĂĄneamente (rifampicina e isoniacida).
Ofrecen resultados preÂcisos en forma rĂĄpida y porque pueden procesar un gran
nĂşmero de muestras son adecuados para laboratorios de mediana y alta carga de
pruebas de sensibilidad. Por tanto, estas tecnologĂas son adecuadas para ĂĄreas
con una alta densidad de poblaciĂłn y sistemas rĂĄpidos de referencia de
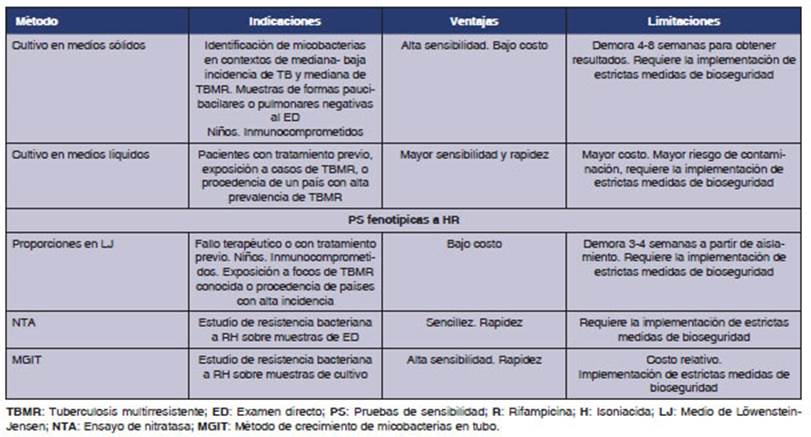
muestras.20 En la Tabla 2, se resumen los mĂŠtodos de diagnĂłsticos
correspondientes a este nivel.
3.
TERCER NIVEL DE COMPLEJIDAD
IdentificaciĂłn
de especie. Pruebas de sensibilidad a drogas de primera y segunda lĂnea
Pruebas fenotĂpicas para identificaciĂłn de
especie
AdemĂĄs
del sistema tradicional de identificaciĂłn de especie en cultivos de medios
sĂłlidos, existe una inmunocromatografĂa de flujo
lateral que identifiÂca cualitativamente el Complejo M. tuberculosis a
partir de los cultivos lĂquidos positivos. Este sisteÂma detecta una
proteĂna (MPT64) segregada por las bacterias al medio de cultivo. Es una
tĂŠcnica simple, rĂĄpida, de bajo costo y alta sensibilidad y especificidad; como
desventajas, no permite diferenÂciar entre especies de ese complejo y sus
resultados deben contextualizarse con la informaciĂłn clĂnica.19
TambiĂŠn pueden emplearse para la identificaciĂłn del CMTB en cultivos de medios
sĂłlidos positivos.
Prueba de sensibilidad fenotĂpica a drogas de
primera y segunda lĂnea
La
PS indirecta a travĂŠs del mĂŠtodo de las proÂporciones utilizando medios sĂłlidos
es el mĂŠtodo mĂĄs comĂşn para probar la sensibilidad de los aislamientos de M.
tuberculosis.
La
utilizaciĂłn el sistema BACTEC-MGIT es el mĂŠtodo preferido para realizar la PS a
muchos agentes antibacilares, dada la estandarizaciĂłn
de los medios e instrumentos MGIT. Este sistema de lectura automatizada es el
mĂĄs ampliamente utiÂlizado en este nivel de complejidad, ya que acorta
sensiblemente los tiempos de detecciĂłn de resistenÂcias a rifampicina
e isoniacida, con sensibilidad del 95%-98%.2
La desventaja de este sistema para la detecciĂłn de resistencia a etambutol, pirazinamida y
estreptomicina (esta droga ya no se utiliza en el traÂtamiento, pero, en ciertas
ocasiones, es necesaria su incorporaciĂłn) radica en su baja reproductibilidad,
por lo que se reserva su uso para los laboratorios de referencia nacional que
posean otros mĂŠtodos para confirmar los resultados a estas drogas. Las
indicaciones ya fueron enumeradas anteriormente.
Pruebas de sensibilidad genotĂpicas (Line Probe Assay, LPAs)
La
amplificaciĂłn y detecciĂłn de ĂĄcidos nucleicos del Complejo M. tuberculosis es
una tecnologĂa que ha demostrado ser muy sensible y especĂfica. Algunas
tecnologĂas de amplificaciĂłn tienen la gran ventaja de poder detectar tambiĂŠn
resistencias a determinados fĂĄrmacos antituberculosos.21
La
PCR en tiempo real aplicada en algunas herramientas es la tecnologĂa mĂĄs
utilizada en la actualidad. Estas herramientas detectan el ADN de Complejo Mycobacterium tuberculosis y pueden
distinguir mutaciones en genes relacionadas con la resistencia a los fĂĄrmacos.
Por lo general, poÂseen un costo considerable y exigen capacitaciĂłn de personal
para dar adecuadas respuestas a los requerimientos en materia de estĂĄndares
internaÂcionales y de auditorĂa externa.19, 21
Los
LPA son una familia de pruebas basadas en PCR multiplex e hibridaciĂłn reversa
en tiras. Amplifican segmentos de los genes donde se proÂducen las mutaciones
mĂĄs frecuentes que originan resistencia.21
AdemĂĄs,
amplifican un segmento especĂfico del Complejo M. tuberculosis, por lo
que tambiĂŠn permiten detectar al complejo. Entre los aislamienÂtos de M.
tuberculosis resistentes a rifampicina e isoniacida, la resistencia de hasta un 5% y 15%,
respectivamente, podrĂan no ser detectadas por estos sistemas porque tienen
alteraciones genĂŠticas en regiones no investigadas por ellos.
Los
LPA son tĂŠcnicamente mĂĄs complejos de realizar que el ensayo Xpert MTB / RIF-ULTRA o XDR; sin embargo, tambiĂŠn pueden
detectar resistencia a una gama de agentes de primera y segunda lĂnea (por
ejemplo, isoniacida, fluoroquiÂnolonas
e inyectables) y sus resultados se pueden obtener en 24 h.
Hay
dos grandes grupos de ensayos:21
â˘
Los que detectan CMT y resistencia a los agentes antituberculosis
de primera lĂnea (coÂnocidos como LPA de primera lĂnea [FL-LPA]) por ejemplo, GenoType MTBDRplus v1 y v2, Genoscholar NTM + MDRTB II.
â˘
Los que detectan resistencia a los agentes antiÂtuberculosis
de segunda lĂnea (conocidos como LPA de segunda lĂnea [SL-LPA]), por ejemplo, GenoType MTBDRsl
La
implementaciĂłn de LPA para detectar la resistencia no elimina la necesidad de
realizar el cultivo convencional y la PS fenotĂpica, ya que desempeĂąan un papel
crĂtico en el seguimiento de las respuestas de los pacientes al tratamiento y
la detecciĂłn de resistencia adicional a otras drogas.7
En
general, los LPA no pueden ser empleados como prueba diagnĂłstica inicial en
reemplazo del ED, porque tienen sensibilidad limitada y requieÂren ser
realizados en laboratorios con cierto nivel de complejidad.21
Dada
la creciente incidencia de TBMR, el sisteÂma LPA ha sido evaluado para detectar
o descartar TBMR y tuberculosis extensamente resistente (TBXDR).
Otras tĂŠcnicas moleculares para
identificaciĂłn de especie o su clonalidad
La
secuenciaciĂłn de nueva generaciĂłn (NGS) tiene un gran potencial como mĂŠtodo
para diagnosticar rĂĄpidamente la TB resistente a medicamentos (TB-DR) en
diversos entornos de laboratorios clĂnicos de referencia en todo el mundo.22
El
enfoque NGS supera muchos de los desafĂos importantes asociados con las pruebas
fenotĂpicas convencionales, asĂ como las limitaciones de otras pruebas
moleculares menos completas, al proporÂcionar informaciĂłn rĂĄpida y detallada de
secuenÂcias para mĂşltiples regiones de genes o genomas completos de interĂŠs.
Sin embargo, la adopciĂłn de estas tecnologĂas para el diagnĂłstico de TB-DR se
ha visto obstaculizada debido a los altos costos, la integraciĂłn dentro de los
flujos de trabajo del laboÂratorio, los requerimientos de capacitaciĂłn tĂŠcnica
para la utilizaciĂłn de la tecnologĂa y la necesidad de una orientaciĂłn experta
respecto al manejo y la interpretaciĂłn clĂnica de los datos.22
Otros
mĂŠtodos de diagnĂłstico complejos estĂĄn dirigidos a conocer la transmisiĂłn de la
enfermedad en la comunidad; esto se logra mediante la idenÂtificaciĂłn de la clonalidad de especies por tĂŠcnicas moleculares, como ser
RFLP (polimorfismo de la longitud de los fragmentos de restricciĂłn) o por tĂŠcnicas
de secuenciaciĂłn de genoma completo (SGC). En todos los casos, su uso queda
restringido a laboratorios centrales de referencia.22
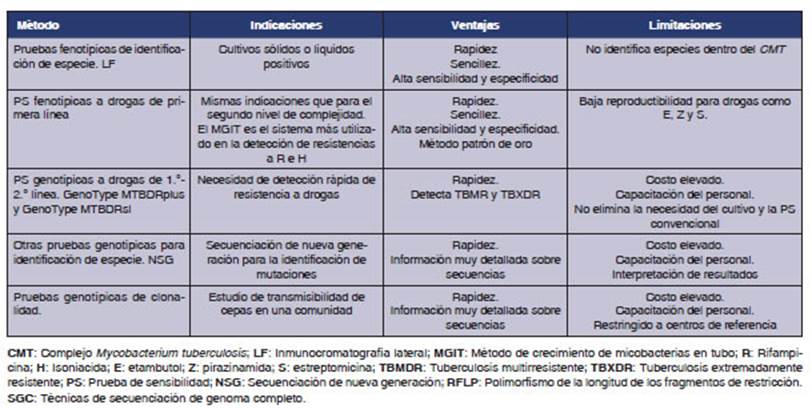
En
la Tabla 3, se resumen los mĂŠtodos de diagÂnĂłstico de este nivel de
complejidad.
CONCLUSIONES
La
estrategia y metas para la prevenciĂłn, la atenÂciĂłn y el control de la
tuberculosis despuĂŠs del 2015, que en forma abreviada es llamada âFin a la TBâ,
aprobada por la 67.° Asamblea Mundial de la Salud en
mayo del 2014 a travĂŠs de la ResoluÂciĂłn WHA 67.1 y lanzada por la OMS, propone
un abordaje del control de la TB que va mĂĄs allĂĄ del sector de salud. Toma en
consideraciĂłn los factores biolĂłgicos, las condiciones socioeconĂłmicas que
define a las poblaciones en mayor riesgo de padecer de TB, asĂ como el
fortalecimiento de la investigaciĂłn de nuevas vacunas, los mĂŠtodos diagnĂłsticos
y medicamentos que trazarĂĄn el camino para llegar a la eliminaciĂłn de esta
enfermedad.
Los
recientes avances en el diagnĂłstico de TB proveen una oportunidad para mejorar
la capaciÂdad de los laboratorios hacia un diagnĂłstico certero y precoz de la
TB sensible y resistente. Uno de los elementos centrales para la adopciĂłn de
estas
Conflicto de
intereses
Los
autores de este trabajo no declaran conflicto de interĂŠs alguno.
BIBLIOGRAFĂA
1. McNerney
R, Maeurer M, Abubakar I,
et al. Tuberculosis Diagnostics and Biomarkers: Needs, Challenges, Recent
Advances, and Opportunities. J Infect Dis 2012; 205 (Suppl
2): S147-58. https://doi.org/10.1093/infdis/jir860.
2. World Health Organization
(WHO). Automated-real time nuclei acid amplification technology for rapid and
simultaÂneous detection of tuberculosis and rifampicin resistance: X-pert
MTB/RIF assay for the diagnosis of pulmonary and extrapulmonary
tuberculosis in adults and children. WHO/ HTM/TB/2013.16 World Health
Organization https://apps.who.int/iris/handle/10665/112472
3. World Health Organization
(WHO). Using the Xpert MTB/ RIF assay to detect
pulmonary and extrapulmonary tuberÂculosis and
rifampicin resistance in adults and children. Expert Group
Meeting Report 2013. World Health OrgaÂnization.
https://apps.who.int/iris/handle/10665/112659
4. FIND [Internet]. GeneXpert negotiated prices. (date
unÂknown) (Cited 2020 June 23). En: https://www.finddx.org/ pricing/genexpert/.
5. Hogan AB, Jewell BL, Sherrard-Smith D et al. Potential impact of the COVID-19
pandemic on HIV, tuberculosis, and malaria in low-income and middle-income
countries: a modelling study. Lancet Glob Health
2020; 8(9): e1132- e1141. https://doi.org/10.1016/S2214-109X(20)30288-6.
6. GLI Practical Guide to TB
Laboratory Strengthening, March 2017. En:
https://www.stoptb.org/wg/gli/assets/documents/GLI_practical_guide.pdf
7.
Programa Nacional de Control de la Tuberculosis. Normas TĂŠcnicas 2013, 4ta
EdiciĂłn Argentina.
https://bancos.salud.gob.ar/sites/default/files/2018-10/0000000278cnt-normas-tecnicas-2013-tuberculosis.pdf
8. World Health Organization.
Fluorescent light-emitÂting diode (LED) microscopy for diagnosis of tuberculoÂsis:
policy statement. World Health Organization 2011
WHO/HTM/TB/2011.8. En: https://apps.who.int/iris/handle/10665/44602
9.
OrganizaciĂłn Panamericana de la Salud 2008. GuĂa TĂŠcnica para el diagnĂłstico
bacteriolĂłgico de la Tuberculosis, Parte 2: Cultivo.
https://iris.paho.org/handle/10665.2/18616
10. World Health Organization. Xpert MTB/RIF impleÂmentation manual: technical and
operational âhow-toâ; practical considerations. World Health
Organization 2014. WHO/HTM/TB/2014.1 En:
https://apps.who.int/iris/handle/10665/112469
11. Eldholm
V, Monteserin J, Rieux A,
Lopez B, Sobkowiak B, Ritacco
V, Balloux F. Four decades of transmission of a
multidrug resistant Mycobacterium tuberculosis outÂbreak strain. Nat Commun 2015; 11-6: 7119. https://doi.org/10.1038/ncomms8119
12. Zifodya JS, Kreniske JS, Schiller
I et al. Xpert Ultra versus Xpert
MTB/RIF for pulmonary tuberculosis and rifampicin resistance in adults with
presumptive pulmonary tubercuÂlosis. Cochrane Database of Systematic Reviews 2021, Issue 2. Art. No.:
CD009593. https://doi.org/10.1002/14651858.CD009593.pub5.
13. FIND. A multicentre
non-inferiority diagnostic accuracy study of the Ultra assay compared to the Xpert MTB/RIF assay. Version 1.8, February 2017. En:
https://www.finddx. org/wp-content/uploads/2019/12/Multicentre-noninferioriÂty-study-Ultra-Xpert-FEB2017-FINAL.pdf
14. World Health Organization.
Update on the use of nucleic acid amplification tests to detect TB and
drug-resistant TB: rapid communication. Geneva: World Health Organization;
2021.
https://www.who.int/publications/i/item/update-on-the-use-of-nucleic-acid-amplification-tests-to-detect-tb-and-drug-resistant-tb-rapid-communication.
15. WHO consolidated guidelines
on tuberculosis. Module 3: diagnosisârapid diagnostics
for tuberculosis detection. World Health Organization 2020.
https://apps.who.int/iris/bitstream/handle/10665/332862/9789240007307-eng.pdf?sequence=1&isAllowed=y
16. Stop TB / USAID / GLI
Practical Guide to Implementation of Truenat Tests
for the Detection of TB and Rifampicin Resistance. Version 2: March 2021.
https://www.stoptb.org/assets/documents/resources/publications/sd/Truenat_Implementation_Guide.pdf.
17. World Health Organization The
use of loop-mediated isothermal amplification (TB-LAMP) for the diagnosis of
pulmonary tuberculosis: policy guidance. World Health
Organization 2016. WHO/HTM/TB/2016.11
https://www.who.int/publications/i/item/9789241511186
18. World Health Organization. The use of lateral flow urine lipoarabinomannan
assay (LF-LAM) for the diagnosis and screening of active tuberculosis in people
living with HIV. Policy guidance. World Health Organization 2015. WHO/
HTM/TB/2015.25. https://www.who.int/publications/i/item/9789241509633
19.
OrganizaciĂłn Panamericana de la Salud 2018. GuĂa TĂŠcnica para el diagnĂłstico
bacteriolĂłgico de la Tuberculosis, Parte 3: Pruebas de Sensibilidad. Programa
âFortalecimiento de la Red de Laboratorios de Tuberculosis en la RegiĂłn de las
AmĂŠricasâ - Lima: ORAS - CONHU; 2017). https://www.paho.org/en/documents/technical-guide-bacteriological-diagnosis-tuberculosis-part-3-susceptibility-tests-2018
20. WHO consolidated guidelines
on tuberculosis. Module 3: diagnosis - rapid
diagnostics for tuberculosis detection, 2021 update. Geneva: World Health
Organization; 2021. https://www.who.int/publications/i/item/9789240030589
21. World Health Organization. The use of molecular Line Probe Assay for the detection of
resistance to second line anti-tuberculosis drugs. World
Health OrganizaÂtion 2016. WHO/HTM/TB/2016.07.
https://www.who.int/publications/i/item/9789241510561
22. World Health Organization.
The use of next-generation sequencing technologies for the detection of
mutations associated with drug resistance in Mycobacterium tuberÂculosis
complex: Technical guide. Geneva: World Health Organization 2018
(WHO/CDS/TB/2018.19). https://apps.who.int/iris/handle/10665/274443 Licence: CC BY-NCSA 3.0 IGO.