Autor : BalcÃĄzar Torres Jonathan1,OssÃĐs Juan Manuel1, CalderÃģn Juan1, Vicente Luis1, Nazzo Viviana1, Carrasco Gladys1, Ahumada RosalÃa1, IbÃĄÃąez Teresa1, Favaloro Roberto1, Candiotti Mariano1, Bertolotti Alejandro1, CÃĄneva Jorge Osvaldo1
1Hospital Universitario FundaciÃģn Favaloro, CABA, Argentina
Correspondencia : Jonathan BalcÃĄzar Torres: jtorres@ffavaloro.org; drjmbt2012@gmail.com
Resumen
La complicación infecciosa es la más frecuente
posterior a un trasplante. Existe una limitada descripción respecto a la
prevalencia de infecciones asociadas al donante (IAD) en receptores de
trasplante de pulmón (TxP). Hay reportes de
dicha situación de un 7,6%, con documentación de fracaso
profiláctico de 5,6%.
Objetivo: estimar la frecuencia de infecciones asociadas
al donante tras el TxP y su desenlace en
términos de supervivencia global (SG).
Materiales y métodos: estudio observacional,
descriptivo, llevado a cabo en un centro trasplante de Argentina entre los
meses de enero 2018 a junio 2020. Se incluyó a todos los pacientes
trasplantados en dicho intervalo, y se contabilizaron a todos aquellos con IAD
definida/probada.
Resultados: en el periodo antedicho se realizaron 65 TxP en 64 individuos (un caso se realizó trasplante
y posterior retrasplante en el mismo periodo de estudio). La mediana de edad
fue de 39 (12 â 72) años. La fibrosis quística constituyó
el principal motivo de TxP (26,2%). En 61/65 (94%) se
aislaron gérmenes de muestras biológicas procedentes del donante:
en el líquido de conservación 78,6%, secreciones del donante
73,7%, muestras quirúrgicas 21,3% y en hemocultivos 4,9%. Se
identificaron IAD en 2/61 casos (prevalencia de 3,1%; IC 95% 0,4-10,7%), con
una mediana de SG postrasplante de 12 meses, y una SG
del 98,4% (IC 95% 91,7 â 99,9%). Conclusión: la prevalencia de IAD en
receptores de TxP en la presente serie fue del 3,1%,
superior a lo documentado en trasplantes de órganos sólidos en
general (< 1%), aunque menor a la encontrada en los pocos reportes
publicados (7,6%).
Palabras claves: Infección; Donante;
Trasplante; Pulmón
Recibido: 13/04/2021
Aceptado: 14/10/2021
Introducción
El trasplante de pulmón (TxP) se
ha convertido en una opción de tratamiento aceptada para enfermeÂdades
vasculares y parenquimatosas pulmonares en etapa avanzada. La evaluación
previa del donante representa una actuación muy importante que se debe
efectuar con sumo rigor, para minimizar al máximo, el riesgo de transmisión
de ciertos procesos infecciosos.
El presente estudio tiene como objetivos estimar la frecuencia de
infecciones asociadas al donante tras el TxP y su
desenlace en términos de supervivencia global. Las complicaciones
ocurren con freÂcuencia y pueden conducir a una disfunción del injerto a
mediano o largo plazo y una disminución de la supervivencia.
Según el registro de la International Society
of Heart and Lung Transplantation (ISHLT), las tasas de supervivencia para TxP en el primer, segundo y quinto año son del 80%,
65% y 53%, respectivamente1.
Las transmisiones de enfermedades derivadas del donante se definen como cualquier enfermedad presente en el donante de órganos que se transmite a al menos uno de los receptores1. Las bacterias u hongos se pueden transferir al injerto donante por contaminación durante la recuperación, conservación o manipulación, o en el trasplante. Las complicaciones infecciosas son una causa frecuente de morbilidad y mortalidad y la causa más importante de muerte durante el primer año. Más de dos tercios de ellos afectan el tracto respiratorio1. El pronóstico de los receptores de TxP ha mejorado considerablemente en los últimos años, gracias a la cuidadosa selección de donantes y receptores, los avances en las técnicas quirúrgicas, cuidados posoperatorios, y mejores métodos de conservación del injerto.
En este trabajo se aborda aspectos específicos de las IAD,
que es uno de los principales problemas a enfrentar dentro de los primeros
días posteriores al TxP. Por lo tanto, se
necesitan más estudios para responder a las preguntas sobre las IAD en
receptores de TxP.
Materiales
y métodos
Diseño
de estudio
El presente es un estudio observacional, descriptivo, del tipo
prevalencia. Su diseño se adhirió a los lineamientos de la
declaración Strengthening the
Reporting of Observational studies in Epidemiology (STROBE).
Se llevó a cabo en pacientes en quienes se realizó TxP en el Hospital Universitario FundaÂción Favaloro (HUFF) entre enero del 2018 y junio del 2020.
Población
y muestra
Criterios de inclusión. Pacientes en quienes se
realizó TxP en base a los criterios de la
ISHLT, según criterios de priorización para distribución
de órganos para trasplante del INCUCAI, independientemente del grupo etario,
condición, tipo.
Los eventos de transmisión informados en esta
revisión se refieren a casos probados /definidos, acorÂde a las
definiciones de imputabilidad para el origen del donante de la
transmisión de la enfermedad (según literatura de Estados Unidos
y de Europa)2.
IAD probada (según criterio americano) cuando hay evidencia clara de la
misma enfermedad infecciosa en el donante y al menos uno de los receptores,
deben cumplirse todas las condiciones siguientes como evento de
transmisión sospechoso, evidencia de laboratorio del organismo
sospechoso (o malignidad) en un receptor, evidencia de laboratorio del mismo
organismo (o malignidad) en otros receptores (si son múltiples),
evidencia de laboratorio del mismo organismo o malignidad en el donante y si
hay evidencia de laboratorio previa al trasplante, debe indicar que el mismo
receptor fue negativo para este organismo antes del trasplante, mientras IAD
definida o cierta (según criterio europeo) se considera cuando hay
evidencia concluyente más allá de toda duda razonable para la
atribución al proceso o al órgano trasplantado2.
Criterios de exclusión. No se consideró en
esta revisión aquellos casos en donde no haya sido posible el
seguimiento clínico ulterior.
Recuperación de datos. Los datos fueron recuperados
en una hoja electrónica, encriptada y en línea, de Microsoft
Excel 365.
Análisis
estadístico
Consideraciones técnicas. Se
consideró un valor p < 0.05 como estadísticamente
significativo. El análisis estadístico fue realizado en el
programa R v.3.6.3 (R Foundation for
Statistical Computing; Vienna,
Austria).
Cálculo de la muestra. Considerando un intervalo de
confianza (IC) del 95%, un margen de error del 5%, y una tasa de IAD entre
trasplantes en general del 1% (Theodoropoulos N &
Ison M, Transplant Infections, 2016), se estimó una muestra requerida
de 16 casos.
Estadística descriptiva. Las variables
numéricas fueron descritas en media (desviación estánÂdar)
o mediana (rango intercuartil, RIC), según
correspondiese su distribución estadística (prueba de Kolmogórov-Smirnov). Las variables descriptivas
fueron descritas en frecuencias (porcentajes), con su respectivo intervalo de
confianza (IC 95%) de corresponder.
Consideraciones
éticas
El protocolo de investigación fue aprobado por el
comité de ética del HUFF. Todos los pacientes firmaron el
correspondiente consentimiento informado con fines asistenciales. En todo
momento se precauteló la custodia de datos en apego a la Ley N° 25.326
de Protección de Datos Personales (Ministerio de JusÂticia y Derechos
Humanos de la República Argentina). La presente investigación
respetó lo estipulado por el código de Núremberg de 1947 y
la declaración de Helsinki de 1964 y sus posteriores enmiendas
(última versión 2013).
Resultados
En nuestro hospital entre enero del 2018 a junio del 2020 se
realizó un total de 65 TxP en 64 individuos
(un mismo caso se realizó trasplante y posterior retrasplante durante
este mismo periodo de estudio). Todos los casos han sido ulteriormente seguidos
hasta la finalización del período de estudio. La mediana de edad
fue de 39 años (12-72), sexo femenino en 29/64 (45,3%). La Tabla 1 resume
las características socio-demográficas de los pacientes
incluidos.
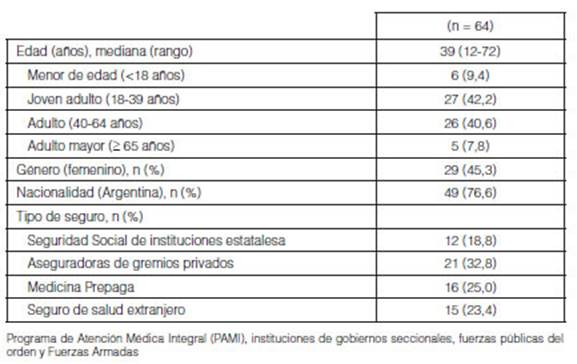
La fibrosis quística (FQ) constituyó el principal
motivo de TxP (17/65; 26,2%), seguido de la enferÂmedad
pulmonar obstructiva crónica (EPOC) (12/65; 18,5%), fibrosis pulmonar
idiopática (FPI) (11/65; 16,9%) e hipertensión arterial pulmonar
idiopática (HAPI) (11/65; 16,9%). En 30/65 (46,2%) casos se
priorizó el trasplante con criterio de emergencia. En 53/65 (81,5%) se
realizó trasplante bipulmonar. En 5/65 (7,7%)
casos se realizó retrasplante, teniendo en consideración que en este
periodo de estudio en un mismo caso se realizó trasplante y posterior re
trasplante a la finalización de este. (Tabla 2).
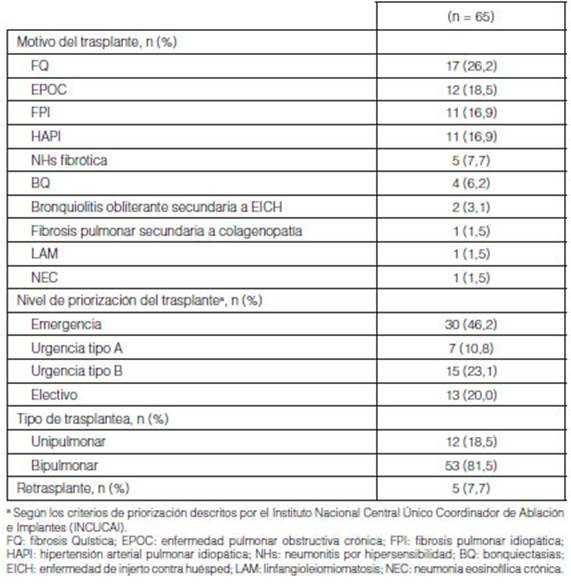
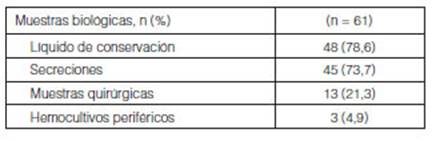
Del total de TxP realizados (n = 65) se
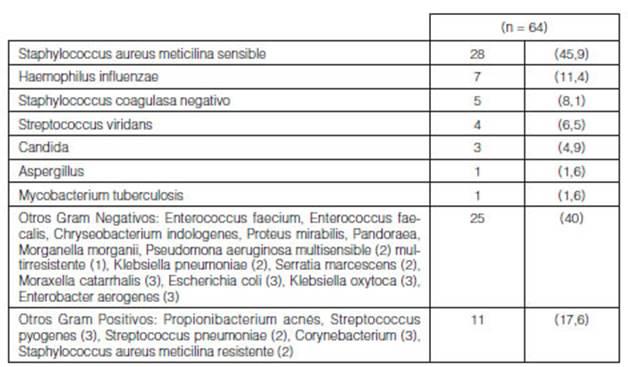
aisló al menos un germen en 61/65 (94%) de muestras bioÂlógicas
procedentes del donante (Tabla 3). De estas, los gérmenes
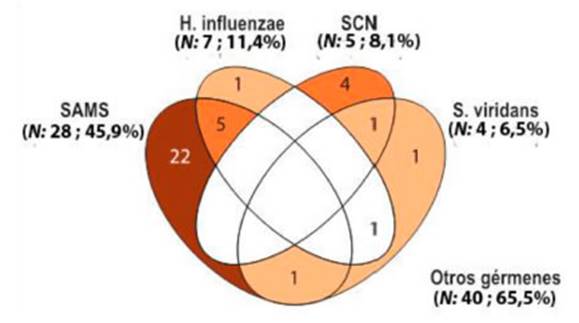
principalmente aislados fueron Staphylococcus aureus meticilina sensible (SAMS)
(28/61; 45,9%), seguido de Haemophilus influenzae (HE) (7/61; 11,4%), Staphylococcus
coagulasa negativo (SCN) (5/61; 8,1%) y Streptococcus viridans (4/61;
6,5%), otros gérmenes (40/61; 65,5%) (Figura 1 y Tabla 4).
Se identificaron IAD en 2/61 (3%) casos detallados en la Tabla
5, ambos recibieron tratamiento dirigido acorde a sensibilidad de los
rescates, se identificó una frecuencia en el total de trasplantes del
3,1% (IC 95% 0.4-10.7%) y una mediana de supervivencia global postrasplante de 12 meses (RIC 6 â 23).
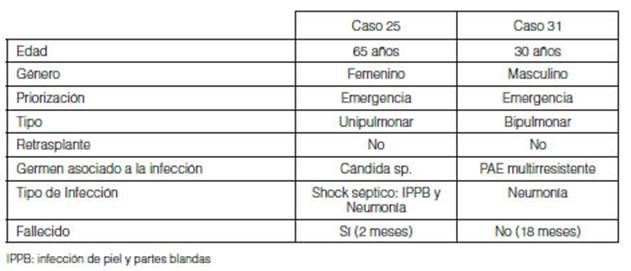
Un caso fallecido debido a IAD el cual desarrollo shock
séptico secundario a infección de piel y partes blandas de la
herida quirúrgica y neumonía con rescate de cándida sp. con sensibilidad a anfotericina
B, vorinocazol, caspofungina,
anidalofungina, el cual no respondió a
tratamiento con azoles a pesar de tener un
tratamiento acorde a sensibilidad y con dosajes
plasmático adecuados de las drogas usadas. (Figura 2). Llama la
atención que los dos casos que presentaron infección asociada al
donante, el criÂterio de priorización del trasplante fue emergente.

Discusión
Las infecciones postrasplante
constituyen, en su conjunto, una de las complicaciones más frecuentes y
más graves del trasplante.(3) La pesquisa
está dirigida a la identificación de infecciones activas y
latentes que supongan un riesgo para el receptor e incluyen: el examen
clínico, el interrogatorio epidemiológico y las pruebas de
laboratorio3.
Las pruebas de detección de enfermedades infecciosas que se
siguen son las recomendadas para toÂdos los donantes de órganos por la Organ Procurement and Transplantation Network (OPTN) y para receptores de
órganos4.
Las transmisiones inesperadas se definen como la
transmisión de un patógeno del donante al receptor, a pesar de la
selección del donante para descartar la presencia de una
infección en el mismo, que pueden ocurrir debido a información
del donante incompleta o inexacta, o debido a fallas de comunicación o
del sistema, si el donante ha adquirido recientemente la infección y
aún se encuentra en el período de eclipse o en la ventana serológica,
o si el donante está infectado con un patógeno poco común
o emerÂgente que no está incluido en los protocolos de detección
estándar. Es más probable que se produzcan transmisiones
inesperadas en el contexto de un donante cadavérico; sin embargo, también
pueden ocurrir en el trasplante de donante vivo2.
El curso de las infecciones postrasplantes
se dividen en tres períodos relacionados con los riesgos de
infección por patógenos específicos: Primer mes postrasplante: Podrian
corresponder a infección preexistente del donante o del receptor y
complicaciones infecciosas de la cirugía de trasplante y la
hospitalización. Los principales efectos de la inmunosupresión
exógena aún no son evidentes5.
1 a 6 meses postrasplante: el efecto de la
inmunosupresión suele ser máximo y los pacientes tienen mayor
riesgo de desarrollar infecciones oportunistas. Sin embargo, pueden persistir
problemas residuales del período perioperatorio.
La profilaxis retrasa pero no elimina el riesgo de
infecciones que pueden ocurrir en los meses posteriores al cese de la
profilaxis5.
Más de 6 a 12 meses postrasplante: la
mayoría de los pacientes reciben niveles estables y reducidos de
inmunosupresión. Estos pacientes están sujetos a neumonías
adquiridas en la comunidad debido a virus respiratorios, neumococo, Legionella u otros patógenos comunes. El âCitomegalovirus (CMV) tardíoâ puede surgir en
pacientes que recibieron proÂfilaxis durante los primeros tres a seis meses5.
Infecciones asociadas al donante en receptores de trasplante
pulmonar
Epidemiología
de las infecciones postrasplante
La tasa de infecciones bacterianas en TxP
y corazón (principalmente respiratorias) es mucho mayor que la observada
en otros receptores de trasplante de órganos sólidos (SOTR)6. La transmisión de
bacterias a través del injerto es muy frecuente en el TxP, el cual presenta una colonización bronquial
hasta en el 50% de los casos. Sin embargo es muy raro
en el resto de SOTR, en los que el órgano trasplantado es habitualmente
estéril7.
A partir de los datos disponibles de los sistemas de EE. UU. Y
Francia, la enfermedad derivada del donante se transmite en menos del 1% de los
trasplantes en general4 la tasa de mortalidad como conÂsecuencia
de IAD en trasplantes en general fue del 22%2.
La incidencia de IAD durante las primeras 2 semanas posoperatorias ha
disminuido notablemente debido a la profilaxis con antibióticos, la
mayoría de las neumonías bacterianas ocurren en el período
posoperatorio intermedio (< 6 meses) y tardío (>6 meses). La
incidencia acumulada general durante el primer año después del
trasplante es ∼70% y
permanece alta más allá del primer año (30%-40%). Casi
tres cuartas partes de todas las neumonías bacterianas son causadas por
especies de Pseudomonas y Enterobacteriaceae,
y el resto principalmente por Staphylococcus aureus, especies de Enterococcus
y Hemophilus influenzae8,
9. En nuestra serie los principal
gérmenes aislados fueron el Staphylococcus
aureus meticilina sensible
un 45,9%, Haemophilus influenzae
11,4%, Staphylococcus coagulasa
negativo 8,1%.
La segunda complicación infecciosa más común
después del TxP es la enfermedad por CMV. La
incidencia informada sin profilaxis en series más grandes oscila entre
el 53% y el 75%6.
En nuestro programa de trasplante la profilaxis para pacientes de alto riesgo
incluye cobertura con valganciclovir no menor de 6
meses, y controles secuenciales con PCR plasmática para CMV.
Las infecciones invasivas con especies de Cándida ocurren
durante el primer mes posoperatorio y la mayoría de ellas se transmiten
a través del órgano donante, las presentaciones más
comunes son candidemia, infección anastomótica bronquial necrosante,
mediastinitis e infección e
interrupción de la anastomosis aórtica después del
trasplante de corazón-pulmón8,
10. En nuestra serie 1/2 de los casos que desarrollo IAD
falleció a causa de shock séptico secundario a neumonía e
infección de piel y partes blandas en la herida quirúrgica por
cándida sp. sin respuesta a tratamiento con azoles acorde a sensiÂbilidad y con dosajes
plasmáticos acordes. El fuerte crecimiento de especies de Cándida
en el bronquio del donante es un obstáculo importante para aceptar los
órganos para el trasplante, las secuelas son mediastinitis,
sepsis o afectación de los grandes vasos que conducen a aneurismas micóticos y rotura consecutiva. En una serie, 3 de 4
receptores de trasplantes de pulmón con un fuerte crecimiento de
especies de Candida desarrollaron mediastinitis,
que fue uniformemente fatal11.
La infección por Mycobacterium
tuberculosis reconoce diferentes modalidades de adquisición en esta
población3:
como reactivación de infección previa, primo infección,
reinfección exógena e infección transmitida por el
órgano trasplantado. En aproximadamente el 6% de los receptores de TxP, el interÂvalo medio postrasplante
en el que se detecta Mycobacterium tuberculosis es de
115 días. En el 40% de los casos, el diagnóstico se obtuvo de los
pulmones explantados6.
En nuestra serie tuvimos el rescate de un granuloma tuberculoso: uno de los
injertos donantes presentaba una lesión indurada en lóbulo
superior derecho el cual se realizó exceresis intraoperatoria del mismo y obtuvimos el rescate bacterioÂlógico
y anatomo patológico posterior, en controles
posteriores mediante fibrobroncoscopia y cultivos no
se evidencio desarrollo de la enfermedad en el receptor. En general, el cribado
de Mycobacterium tuberculosis no se realiza en
donantes fallecidos, pero debe realizarse en todos los donantes vivos4, 12. A pesar de la
inmunosupresión, se observa una respuesta adecuada al tratamiento
antituberculoso y una baja incidencia de efectos secundarios adversos13<. La tuberculosis (TBC)
activa en cualquier donante es una contraindicación para la
donación; si se cree que un donante fallecido posiblemente tenga
tuberculosis, sus órganos no deben utilizarse a menos que se pueda
descartar definitivamente una infección activa de TBC4,
12, 14.
Consideraciones
diagnósticas
Como parte de nuestro protocolo institucional en el programa de
trasplante pulmonar en un paciente que cursa un post operatorio inmediato de
trasplante pulmonar con signos clínicos o radiológicos de
infección realizamos fibrobroncoscopia con LBA
y de ser el caso biopsia transbronquial (BTB), su
rendimiento diagnóstico es casi del 70%15,
además permite la inspección de las vías respiratorias que
puede revelar problemas anastomóticos o aspergilosis traqueobronquial. El
examen bacteriológico de los lavados bronquiales del pulmón del
donante es un requisito previo para el tratamiento de una poÂtencial
infección invasiva posterior en los receptores de trasplante, incluso el
crecimiento de la flora oral normal en el donante se considera un factor de
riesgo de neumonía bacteriana temprana en el receptor.
El LBA es muy sensible para la mayoría de patógenos,
la BTB es el único medio de diagnosticar el rechazo agudo y la
neumonitis por CMV16,
su sensibilidad y especificidad es casi del 100%. La tomografía
computarizada puede ser útil en el diagnóstico diferencial de las
enfermedades pulmonares infiltrativas bilaterales y
detectar complicaciones mediastínicas,
bronquiales o vasculares17.
La mayoría de los centros realizan actualmente broncoscopias de vigilancia de rutina después del
trasplante de pulmón. Además de la detección precoz de
episodios asintomáticos de rechazo agudo sigÂnificativo o neumonitis por
CMV en ∼20% -30% de
los procedimientos, permite la identificación precoz de casos
colonizados por Aspergillus8.
Revisión
de trabajos previos con documentación de infecciones asociadas al
donante en receptores de TxP
Existe escasa bibliografía que documente casos de IAD en
receptores de trasplante pulmonar, en esta revisión pudimos rescatar 3
estudios donde muestran su estadística con lo cual nos permitió
comparar nuestra experiencia. Ruiz I et al.18
evaluaron receptores que sobrevivieron más de 24 horas y
sus resÂpectivos donantes. La incidencia global de infección del donante
fue del 52% (103 de 197 donantes). Los tipos de infección del donante
incluyeron contaminación aislada de los fluidos de conservación
(n = 30, 29,1%), colonización del injerto (n = 65, 63,1%) y bacteriemia
(n = 8, 7,8%). Las tasas de infección de los donantes no difirieron
estadísticamente entre los que recibieron ventilación
mecánica durante 48 horas o menos, o más de 48 horas. La IAD
bacterianas o micóticas ocurrieron en 15 TxP (7,6%). En esta experiencia, el 25% de los donantes con
bacteriemia y el 14,1% de los injertos colonizados fueron los responsables de
transmitir la infección. Dos pacientes murieron a causa de IAD. Los
microorganismos para los que es extremadamente diseñar regímenes
profilácticos eficaces provocarón
infección fueron Aspergillus fumigatus, Stenotrophomonas maltophilia y
SAMR. Excluyendo estos casos, el fracaso de la profilaxis ocurrió en el
5,6% de los procedimientos.
Low et al.19
informaron que en 28 de los 29 lavados bronquiales tomados de
donantes crecieron al menos un microorganismo. Los microorganismos
identificados con mayor frecuencia fueron StaphyloÂcoccus
spp. y Enterobacter spp. En el 43% de estos casos, se aislaron microorganismos
similares del árbol traqueobronquial receptor
y, de éstos, el 21% tuvo IAD. Waller y col.20 realizaron una
comparación retrospectiva del resultado de 123 donantes en 125 TxP consecutivos de pulmón o corazón con
éxito técnico. La contaminación microbiana del lavado
bronquial de rutina del donante fue aproximadamente del 60%. Cinco muertes de
receptores TxP se debieron a IAD.
Características
en el tratamiento con antibióticos
No existen pautas o regímenes estandarizados con respecto a
la elección de la terapia antibiótica perioÂperatoria.
La profilaxis antibiótica en receptores de TxP
debe iniciarse con antimicrobianos de amplio espectro para cubrir Gram
negativos y Gram positivos.
Se recomienda que la cobertura antibiótica en los receptores
de TxP se inicie con un agente de amplio espectro y
se modifique en base de los cultivos obtenidos del donante19,
en nuestro programa de trasÂplante usamos vancomicina y ciprofloxacino
para receptores con patologías no sépticas, no colonizados y que
no hayan cursado una internación en el último mes, excepto en
enfermedad pulmonar séptica (FQ o BQ) que deben recibir agentes
antimicrobianos adaptados a sus cultivos pre trasplante durante al menos 2
semanas4, todas estas
pautas ajustadas posteriormente a los rescates obtenidos. En una serie, este
enfoque redujo la incidencia de neumonía bacteriana posoperatoria
temprana del 33% en un grupo de control histórico al 13% (p = 0,005)11.
En nuestro programa bajo recomendación de expertos
indicamos tobramicina o colistina
nebulizada desde la llegada del paciente a la UCI después de la
cirugía como profilaxis de aquellos casos en que se demuestre
colonización previa del receptor por gram
negativos. La duración de la profilaxis depende de los resultados de los
cultivos de muestras respiratorias del donante y del receptor en el momento del
TxP, cuando los cultivos son negativos los agentes
antibióticos profilácticos se retiran del tercer al quinto
día, cuando los cultivos son positivos o en receptores con enfermedad
pulmonar séptica, el traÂtamiento antibiótico se ajusta y se
mantiene durante 2 semanas o hasta que los cultivos sean negativos.
Con este enfoque, siempre que se aisle
un microorganismo clínicamente significativo en una muestra respiratoria
dentro de los primeros 3 meses, se inicia una terapia antibiótica
intravenosa específica, incluso si el paciente está
asintomático. Las únicas situaciones en las que no se debe
iniciar el trataÂmiento son la colonización por estreptococos orales o
SCN6.
Conclusión
Las infecciones derivadas de donantes se reconocen cada vez
más como causas de morbilidad y mortalidad que suelen presentarse en el
período postrasplante temprano. La
infección bacteriana es la complicación infecciosa más
frecuente en los receptores de TxP. Del total de TxP realizados en nuestra serie (n=65) se aisló al
menos un germen en 61/65 (94%) de las muestras biológicas procedentes
del donante, las principales especie rescatadas en los
cultivos del donante fueron Staphylococcus aureus meticilina sensible, Haemophilus influenzae y Staphylococcus coagulasa
negativo, principalmente en líquido de conservación 78,6%,
secreciones del donante 73,7% y solo en 3 casos se evidencio bacteriemia con el
donante (4.9%). La tasa de infecciones bacterianas en TxP
y corazón (principalmente respiratorias) es mucho mayor que la observada
en otros SOTR.
La prevalencia de IAD en receptores de TxP
en nuestra serie fue de 3,1%, siendo superior a lo docuÂmentado en trasplantes
de órganos sólidos en general (< 1%), aunque menor a la
comunicada en los pocos reportes publicados respecto a TxP
(7.6%).(18) De los 2 casos en los cuales se
identificó IAD, uno fallecido por el desarrollo de shock séptico
secundario a neumonía e infección de piel y partes blandas de la
herida quirúrgica por cándida sin respuesta a tratamiento con azoles.
Se observó una elevada SG, por ende, baja mortalidad
asociada al TxP. Es probable que la fuerte imÂplementación
de medidas profilácticas tanto a la hora de seleccionar la idoneidad del
injerto pulmonar donante como de pautas antibióticas de profilaxis al
receptor, impacten en gran medida en dicha SG.
Recomendaciones
Con respecto al manejo del injerto pulmonar se recomienda como
rutina:
Enviar una muestra de la solución de preservación,
en la que se recibió el órgano, a cultivo. Solicitar el resultado
de los cultivos para tomar las conductas correspondientes en el receptor. Se
debe considerar la posibilidad de IAD para todas las infecciones tempranas y
los pacientes con cursos clínicos atípicos.
La IAD es un evento frecuente después del trasplante de
pulmón con consecuencias fatales que pueden evitarse con un
régimen antibiótico profiláctico adecuado que debe
modificarse de acuerdo con los microorganismos aislados de cultivos de muestras
obtenidas de donantes, injertos, fluidos de conservación y receptores.
Bibliografía
1. Ison MG, Nalesnik
MA. An Update on Donor-Derived Disease Transmission in Organ Transplantation. Am J Transplant. 2011; 11(6): 1123-30.
2. White SL, Rawlinson W, Boan P, et al. Infectious Disease Transmission in Solid Organ Transplantation: Donor Evaluation, Recipient Risk, and Outcomes of Transmission. Transplant Direct [Internet]. 20
de diciembre de 2018; 5(1). Disponible en:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6324914/
3. Evaluación infectólogica.
https://www.incucai.gov.ar/files/docs-incucai/Materiales/profesionales/14-evaluacion_infectologica.pdf.
4. Theodoropoulos N, Ison
MG. Donor-Derived Infections:
Incidence, Prevention, and
Management. En: Ljungman P, SnydÂman
D, Boeckh M, editores. Transplant
Infections [Internet]. Cham:
Springer International Publishing; 2016. p. 113-27.
Disponible en: http://link.springer.com/10.1007/978-3-319-28797-3_8
5. Fishman JA. Infection
in the solid organ transplant recipient. Updated Aug 2020.
6. Len O, Roman
A, Gavaldà J. Risks
and Epidemiology of Infections
After Lung or HeartâLung
Transplantation. En: LjungÂman
P, Snydman D, Boeckh M,
editores. Transplant Infections
[Internet]. Cham: Springer
International Publishing; 2016. p. 167-83. Disponible en:
http://link.springer.com/10.1007/978-3-319-28797-3_11
7. Yuste JR, Pozo JL del, Quetglás
EG, Azanza JR. Infecciones más comunes en el
paciente trasplantado. An Sist
Sanit Navar [Internet].
agosto de 2006 [citado 21 de septiembre de 2020];29. Disponible en:
http://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S1137-66272006000400016&lng=en&nrm=iso&tlng=en
8. Speich R, van der Bij
W. Epidemiology and Management of Infections
after Lung Transplantation. Clin Infect Dis. 2001; 33(s1): S58-65.
9. Dauber JH, Paradis
IL, Dummer JS. Infectious complications in pulmonary allograft recipients. Clin Chest Med.
1990; 11(2): 291-308.
10. Palmer SM, Alexander BD, Sanders LL, et al. Significance of blood stream infection after lung transplantation:
analysis in 176 consecutive
patients. Transplantation.
2000; 69(11): 2360-6.
11. Zenati M, Dowling
RD, Dummer JS, Paradis IL,
Arena VC, Armitage JM, et al. Influence
of the donor lung on development
of early infections in lung transplant recipients. J Heart Transplant. octubre de 1990;9(5):502-8; discussion
508-509.
12. Subramanian AK, Morris MI. AST Infectious Diseases Community of Practice. Mycobacterium tuberculosis infections
in solid organ transplantation. Am J Transplant
Off J Am Soc Transplant Am Soc Transpl Surg.
2013; 13 Suppl 4: 68-76.
13. Bravo C, Roldán J, Roman A,
et al. Tuberculosis in lung transplant
recipients. Transplantation.
2005; 79(1): 59-64.
14. Morris MI, Daly JS, Blumberg E, et al. Diagnosis and management
of tuberculosis in transplant donors:
a donor-derived infections consensus conference report. Am J Transplant Off J Am Soc Transplant Am Soc Transpl Surg.
2012; 12(9): 2288- 300.
15. Chan CC, Abi-Saleh WJ, Arroliga AC, et al. Diagnostic yield and therapeutic impact of flexible bronchoscopy
in lung transplant recipients. J Heart Lung Transplant Off Publ Int Soc
Heart Transplant. 1996;
15(2): 196-205.
16. Boehler A, Vogt
P, Zollinger A, Weder W, Speich R. Prospective study of the value
of transbronchial lung biopsy after lung
transplantation. Eur Respir J. 1996; 9(4): 658-62.
17. Soyer P, Devine N, Frachon I, et al. Computed tomography of complications of lung transplantation. Eur Radiol. 1997; 7(6): 847-53.
18. Ruiz I, Gavaldà J, Monforte V, et al. Donor-to-host transmission of bacterial and fungal infections in lung transplantation. Am J Transplant Off J Am Soc Transplant Am Soc Transpl Surg. 2006; 6(1): 178-82.
19. Low DE, Kaiser
LR, Haydock DA, Trulock E,
Cooper JD. The donor lung: infectious and pathologic factors affecting outcome in lung transplantation. J Thorac Cardiovasc Surg. octubre de 1993; 106(4): 614-21.
20. Waller DA, Thompson AM, Wrightson WN, et al. Does the mode of donor
death influence the early outcome
of lung transÂplantation? A
review of lung transplantation from donors involved in major trauma. J Heart Lung Transplant Off Publ Int Soc
Heart Transplant. 1995;
14(2): 318-21.