Autor :Cruz M. Antonieta1 González B. Alejandra1 Segovia Jaime1 Fielli Mariano1 Lagües Cecilia2 Ruiz Claudio3
1Servicio de NeumonologĂa. Hospital Nacional Prof. Dr. Alejandro Posadas. El Palomar. Provincia de Buenos Aires. Argentina 2 Servicio de AnatomĂa PatolĂłgica. Hospital Nacional Prof. Dr. Alejandro Posadas. El Palomar. Provincia de Buenos Aires. Argentina 3Servicio de CirugĂa del TĂłrax. Hospital Nacional Prof. Dr. Alejandro Posadas. El Palomar. Provincia de Buenos Aires. Argentina
Correspondencia :Mariano Fielli - E-mail: mhfielli@gmail.com
Resumen
El
tumor fibroso solitario de la pleura (TFSP) representa una neoplasia benigna de
evolución habitualmente silente, hallazgo incidental y heterogeneidad en
su presentación. Raramente se malignizan y la sintomatología se
relaciona fundamentalmente con el compromiso por compresión de las
estructuras vecinas. Su tratamiento es la cirugía.
Se
describe el caso de un paciente masculino de 49 años con antecedentes de
hipertensión arterial, diabetes mellitus y obesidad que consultó
al Servicio de urgencias por disnea. Se solicitó tomografía de
tórax que evidenció voluminosa masa de densidad de partes blandas
en hemitórax izquierdo con desplazamiento del mediastino y descenso del
diafragma del mismo lado. La fibrobroncoscopia no
evidenció lesión endoluminal. Fue evaluado
por Cirugía del Tórax. Se realizó abordaje de la masa
mediante toracotomía posteroÂlateral
izquierda. El estudio anatomopatológico
informó formación tumoral de 25 Ă— 16 Ă— 13 cm, peso de 1905 gr y
en la microscopía se describió proliferación celular fibroblástica, células fusiformes de
núcleos pequeños ovoides y escaso citoplasma dispuestas en haces
desordenados con colágeno interpuesto. La inmunohistoquímica
informó vimentina y CD34 positivos. Se
realizó el diagnóstico de tumor fibroso solitario de la pleura.
La evolución posterior fue buena.
Palabras
clave: Tumor
fibroso solitario de la pleura; Inmunohistoquímica;
Diagnóstico
Abstract
Thesolitary fibrous tumor of the pleura
(SFTP) represents a benign neoplasm of commonly silent evolution, incidental finding and heterogeneous presentation. It rarely becomes malignant and symptoms mainly result from
the involvement of neighboring structures due to compression. It is treated
with surgery.
Wedescribe the case of
a 49-year-old male patient with history of arterial hypertension, diabetes mellitus and obesity
who consulted the Emergency Services
because he was experiencing dyspnea. We requested chest
tomography that showed a voluminous soft tissue density
mass in the left hemithorax with mediastinal shift and decreased diaphragm on the
same side. The fibrobronchoscopy didn’t show endoluminal lesion. The patient
was evaluated by the Thorax
Surgery staff. The mass was treated
by means of left posterolateral thorachotomy. The anatomopathological study reported the formation
of a tumor of 25 Ă— 16 Ă—13 cm and 1905 gr, and the microscopy described fibroblast cell proliferation, spindle cells of small ovoid nuclei and very little cytoplasm
placed in disorganized bundles
with collagen interposition. The immunohistochemistry disclosed
positive vimentin and CD34. The
patient was diagnosed with solitary fibrous tumor of the pleura, with good subsequent evolution.
Key
words: Solitary fibrous
tumor of the pleura; Lung mass; Pulmonary tumor
Introducción
Las
neoplasias pleurales primitivas son poco frecuentes (menos del 5%) siendo el
tumor fibroso solitario de la pleura (TFSP) una variedad benigna de
evolución clínica habitualmente silente y hallazgo inciÂdental.
Su presentación radiológica y heterogeneidad morfológica
plantean diagnósticos diferenciales con lesiones malignas y benignas 1. El diagnóstico se
basa en la sospecha clínica y el estudio anatomoÂpatológico
e inmunohistoquímico que
característicamente resulta positivo para vimentina
y CD342. El tratamiento de
elección es la resección quirúrgica completa2, 3.
Caso clínico
Paciente
masculino de 49 años con antecedentes de hipertensión arterial,
diabetes mellitus tipo 2, obeÂsidad grado II (BMI 37,87). Concurrió a
emergencias por cuadro de 72 hs de evolución
caracterizado por disnea progresiva hasta mMRC 4. Al
examen físico presentaba regular mecánica ventilatoria con tiraje
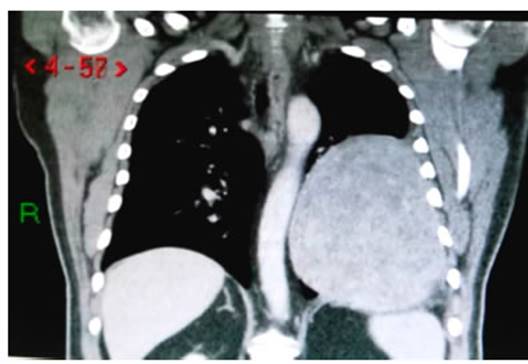
generalizado y sibilancias diseminadas. En la tomografía de tórax
se observó formación de aspecto sólido con densidad de
partes blandas en hemitórax izquierdo, disminución del volumen
del pulmón homolateral, efecto de masa sobre
el mediastino y descenso del diafragma del mismo lado (Figura 1). Se le
realizó espirometría que mostró
un patrón no obstructivo severo (FVC 1,97 40% LIN 3,98 FEV 1,56 LIN
3,05). La fibrobroncoscopía evidenció
compresión extrínseca del árbol bronquial izquierdo y
congestión de la mucosa que impidió la visualización de
los bronquios de los segmentos basales.
Se
realizó abordaje de la masa mediante toracotomía postero-lateral izquierda. La hemostasia fue dificultosa
por lo que se debió resecar el lóbulo inferior izquierdo con un
sangrado intraoperatorio de 1,5 litros.
Evolucionó con shock hipovolémico y pasó a terapia
intensiva con buena evolución posterior.
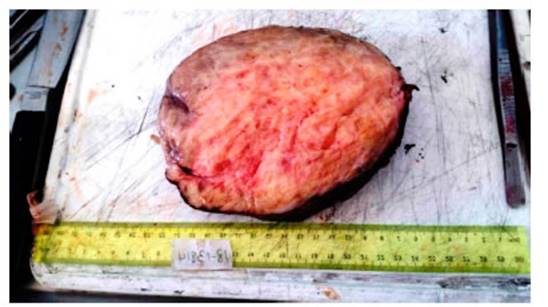
El
estudio anatomopatológico informó
formación tumoral de 25 Ă— 16 Ă— 13 cm, peso de 1905 gr y cápsula
congestiva pardo grisácea. Al corte
resultó sólida, homogénea, de coloración
blanquecino-amarillenta, de consistencia duro-elástica y aspecto
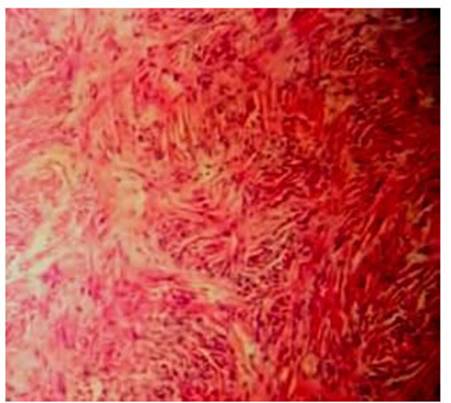
arremolinado (Figura 2). En la microscopía se describió
proliferación celular fibroblástica,
células fusiformes de núcleos pequeños ovoides y escaso
citoplasma dispuestas en haces desordenados con colágeno interpuesto y
estructuras vasculares grandes ramificadas (Figura 3).
Se
realizó inmunohistoquímica que
informó vimentina y CD34 positivos. El resto
de los marcadores fueron negativos: citoqueratina
AE1/AE3, antígeno epitelial de membrana (EMA), AML, desmina y S100. Se
diagnosticó tumor fibroso solitario de la pleura.
Discusión
El
TFSP es una entidad muy poco común. Sin embargo, constituye el segundo
tumor primitivo más frecuente en dicha topografía después
del mesotelioma maligno difuso. Es una neoplasia
benigna y de hallazgo incidental. Puede aparecer a cualquier edad con una media
de edad de presentación de 51 años sin diferencias entre ambos
sexos. No se asocia con la exposición al asbesto u otros
carcinógenos conocidos. Su presentación radiológica y
heterogeneidad morfológica plantean diagnósticos diferenciales
con neoplasias malignas y benignas1.
Cuando el origen es pleural (habitualmente a partir de la pleura visceral),
debe diferenciarse en primer término del mesotelioma.
Otros diagnósticos diferenciales son el cáncer de pulmón
no células pequeñas, el carcinoide atípico, el hamartoma, el linfoma, el schwannoma
y las metástasis. La tasa de incidencia es de 2,8 casos por 100.000
personas. Cerca de 900 casos de esta enfermedad han sido reportados en la
literatura. Si bien el origen pleural es el más común
también se ha descrito el origen intrapulmonar.
Sakurai y cols. han comentado en su
publicación sólo 11 casos de localización intrapulmonar hasta el año 2008, con igual
presentación con respecto a aquel de origen pleural4.
El
diagnóstico se basa fundamentalmente en la sospecha clínica ante
la presencia de un tumor de lento crecimiento puesto en evidencia en las
imágenes. La radiografía de tórax y la tomografía
computada no exhiben características específicas. En el caso de
la segunda, suele observarse una formación, que de presentar gran
tamaño desplaza estructuras vecinas, y que puede o no ser lobulada. La
densidad de la misma varía en relación a la composición de
la lesión (a mayor cantidad de colágeno, más densidad tomográfica). El realce provocado por el contraste
es heterogéneo y suele ser de intensidad leve a moÂderado, dependiendo
del grado de malignidad de la lesión. El patrón de
distribución es completamente inespecífico, resultando poco
útil en el diagnóstico diferencial5.
En el trabajo de Rosado-de-Christenson et al, se
menciona que el 100% de los pacientes con lesiones malignas presentan realce
mientras que solo el 60% de aquellas lesiones que tienen un comportamiento
benigno lo presentan6.
Por otro lado, en la imagen por resonancia magnética (IRM) el tumor
fibroso se presenta isointenso en T1 y con intenÂsidad
variable en T2, lo que se describe como un patrón mixto blanco y negro.
A pesar de ser tumores ampliamente vascularizados la
imagen clásica de vacío de flujo es poco común y su
presencia no se correlaciona con mayor probabilidad de malignidad7. En cuanto al PET-18 FDG,
sin bien los tumores con comportamiento benigno comúnmente presentan
poca actividad metabólica mientras que aqueÂllos con componente maligno
tienden a mostrar mayor actividad metabólica y ser más
homogéneos, no ha demostrado clara utilidad para poder diferenciarlos8. Se ha postulado que la utilización
de Ga- DOTATOC (en lugar de 18-FDG), que presenta afinidad por los receptores
de la somatostatina, sería más sensible
y de mayor utilidad9.
Con respecto a las manifestaciones clínicas, en general se relacionan
con compresión de estructuras vecinas. Los síntomas o signos
más comunes son tos, dolor de pecho, disnea y hemoptisis. El derrame
pleural se observó en hasta un 16% de los casos2.
Se han reportado síndromes paraneoplásicos
asociados, como la osteoartropatía pulmonar hipertrófica (hasta
en un 35% de los casos) y la hipoglucemia intermitente causada por la
producción de factor insulino símil 2.
Este último se denomina síndrome de Doeg-Potter
y se halla presente hasta en el 14% de los casos. Se ha descrito más
frecuentemente en tumores localizados en la cavidad pleural derecha, de gran
volumen y con alta actividad mitótica. Suele resolver completamente tras
la resección2, 10, 11.
En
1989 England y cols. describieron los criterios de
malignidad de los TFSP: alta celularidad, marcado pleomorfismo celular, actividad mitótica mayor a 4
mitosis por 10 campos de gran aumento, invasión vascular, atipia celular
y necrosis12.
La
presencia de un sólo criterio obliga a considerar el carácter
maligno de la lesión. Raramente pueden recurrir localmente o dar
metástasis luego de la resección. Las recurrencias pueden ser
tardías con un período de latencia de hasta 30 años. Las
formas malignas pueden ser de novo o resultar de la
transformación de una forma benigna3.
Es
necesaria la realización de técnicas de inmunohistoquímica
para la confirmación diagnóstica2.
El perfil inmunofenotípico
característico del TFSP es la positividad para vimentina
y, en más del 80% de los casos, para CD34. Desde el punto de vista
histopatológico debe diferenciarse del mesotelioma
(principalmente sus variantes sarcomatoide y desmoplásica), el timoma fusocelular, el fibrosarcoma, el histiocitoma fibroso maligno, el neurofibroma,
el neurofibrosarcoma, el schwannoma,
los tumores de músculo liso, el angiosarcoma,
el sarcoma de Kaposi, el hemangiopericitoma y el
carcinoma fusocelular metastásico,
entre otros1, 3, 13.
El
tratamiento de elección de estas neoplasias es siempre quirúrgico
con resección completa de toda la lesión lo que constituye el
único factor de buen pronóstico2,
11, 14. El procedimiento quirúrgico puede realizarse
por acceso convencional, o VATS (cirugía torácica video-asistida)
dependiendo siempre del tamaño tumoral2,
3. Ante la imposibilidad de obtener la resección
completa se podría considerar indicar tratamiento radiante3.
Conclusiones
El
TFSP debe ser sospechado ante la presencia de una gran masa pleural de lento
crecimiento, más aún en la presencia de hipoglucemia. La inmunohistoquímica es esencial para su
confirmación diagnóstica e identificación de criterios de
malignidad. Dada la posibilidad de que existan recurrencias tardías es
neceÂsario el seguimiento a largo plazo aún en las lesiones que muestran
características de buen pronóstico.
Conflictos
de interés
Los
autores declaran que no tienen conflictos de interés.
Bibliografía
1.
Vejvodova S, Spidlen V, Mukensnabl P, Krakorova G, Molacek J, Vodicka J. Solitary Fibrous Tumor-Less Common Neoplasms
of the Pleural Cavity. Ann Thorac Cardiovscu Surg 2017; 23: 12-18.
2.
Ortega M. V, Gualco G, Musto
L. M, Wins R, Maggiolo J, Ardao G. Tumor fibroso solitario de la pleura. Aspectos
clínicos-patológicos. Revista Española de Patología
2005; 38: 21-25.
3.
Patané AK, Raya M, Rosales A, Rivero H, Rojas
O. Tumor fibroso solitario pleural de lenta evolución. Rev Am Med Resp
2012; 4: 166-9.
4.
Sakurai H, Tanaka W, Kaji M, Yamazaki K, Suemasu K. Intrapulmonary Localized Fibrous Tumor of the Lung: A Very
Unusual Presentation. Ann Thorac Surg 2008; 86: 1360-2.
5.
Ginat DT, Bokhari A, Bhatt S, Dogra V. Imaging Features of Solitary Fibrous Tumors. Am J Roentgenol. 2011;
196: 487–95.
6.
Rosado-de-Christenson ML, Abbott GF, McAdams HP, Franks TJ, Galvin JR. From the Archives of the AFIP. Localized Fibrous Tumors of the Pleura. RadioGraphics. 2003; 23: 759-83.
7.
Weon YC, Kim EY, Kim H-J, Byun
HS, Park K, Kim JH. Intracranial Solitary
Fibrous Tumors: Imaging Findings in 6 ConÂsecutive Patients. Am J Neuroradiol. 2007; 28: 1466-9.
8.
Lococo F, Cafarotti S, Treglia G. Is 18F-FDG-PET/CT really able to differentiate between malignant and benign solitary fibrous tumor of the pleura? Clinical Imaging. 2013; 37: 976-7.
9.
Lococo F, Rapicetta C, Filice A, Mengoli MC, Ricchetti T, Borrelli R, et al.
Valor de la PET/TC con 68 Ga-DOTATOC en la detección de recidiva de un
tumor fibroso solitario de la pleura. Rev Esp Med Nucl
Imagen Mol. 2018; 37: 257-8.
10.
Sotuelo J, Moldes S, Martin A, Lutfi
R, Reyna M. Hipoglicemia inducida por tumor fibroso solitario pulmonar.
Síndrome de Doege-Potter. Rev
Med Chile 2016; 144: 129-33.
11.
Prado F, Dos Ramos J. P, Larrañaga N, Espil G,
Kozima S. Tumor Fibroso Solitario y Síndrome Doege-Potter. Medicina (Buenos Aires) 2018; 78: 47-9.
12.
England D, Hochholzer L,
McCarthy M. Localized benign
and malignant fibrous tumors of the pleura. A clinicopathologic review of 223
cases. Am J Surg Pathol.
1989; 13: 640-58.
13.
Ferreira E, Diaz J. Tumor Fibroso Solitario de la
Pleura. Rev Chil Cir 2008; 60: 465-72.
14.
Fuentes-Valdés E, Martín-Gonzalez M.
Tumor Fibroso Solitario de la Pleura. Descripción clínico
quirúrgico de 10 casos. Neumonol Cir Tórax (NCT). 2014; 73: 174-8.