Autor : Leiva AgÞero SebastiÃĄn, Larrateguy Luis, Coronel Mirta, Franceschini Carlos, Smurra Marcela, Nogueira Facundo, MartÃnez Fraga Alejandro, Borsini Eduardo
CoordinaciÃģn del proyecto: Leiva AgÞero SebastiÃĄn y Borsini Eduardo , Grupo de redacciÃģn: Leiva AgÞero SebastiÃĄn y Borsini Eduardo, Grupo de revisiÃģn del manuscrito: Larrateguy Luis, Coronel Mirta y Franceschini Carlos, ComitÃĐ Editorial: Nogueira Facundo, Smurra Marcela y MartÃnez Fraga Alejandro
Correspondencia : Dr. SebastiÃĄn Leiva AgÞero: sleiventilacion@gmail.com - Hospital de ClÃnicas Virgen de FÃĄtima. Universidad de La Rioja. Luis Vernet s/n, La Rioja, Argentina; (CP5300). TE: +5411-41955378 Dr. Eduardo Borsini: borsinieduardo@yahoo.com.ar - Hospital BritÃĄnico. Perdriel 74, Laboratorio Pulmonar, 1° piso Buenos Aires, Argentina; (CP1280AEB). TE: +5411-43096400 Ext: 2808
Resumen
En el seno de la SecciÃģn de SueÃąo,
Oxigenoterapia y Asistencia Ventilatoria de la AsociaciÃģn Argentina de Medicina
Respiratoria, se planteÃģ el desarrollo de sugerencias para la exploraciÃģn
respiratoria del paciente con obesidad y definiciones sobre el manejo perioÂperatorio en cirugÃa bariÃĄtrica
y procedimientos quirÚrgicos electivos (cirugÃa no bariÃĄtrica).
Esta iniciativa se basÃģ en la necesidad de contar con lineamientos adaptados a
la realidad local y discutida por expertos que se desempeÃąan en la realidad
coyuntural cotidiana de nuestro paÃs.
La agenda se iniciÃģ en agosto de 2020 en
un grupo de revisiÃģn de la bibliografÃa y redacciÃģn. Revisores de diferentes
provincias argentinas efectuaron una extensa valoraciÃģn de la evidencia. Luego,
un comitÃĐ editorial realizo una revisiÃģn crÃtica del documento. Finalmente,
todo el grupo debatiÃģ las sugerencias que se exponen como puntos clave.
Este documento exhorta a cirujanos y
clÃnicos a trabajar junto a especialistas respiratorios en la evaluaciÃģn del
riesgo, definiciÃģn de la aptitud operatoria y correcciÃģn de trastornos
funcionales y apneas del sueÃąo.
La cirugÃa en individuos con obesidad y
la cirugÃa bariÃĄtrica, son procedimientos a los que
se arriba luego de una evaluaciÃģn exhaustiva de la situaciÃģn clÃnica y
funcional. La tarea multidisciplinaria y el tratamiento de las anormalidades
detectadas pueden disminuir los riesgos perioperatorios.
Pacientes con obesidad que requieren
cirugÃa electiva con anestesia general deben ser evaluados mediante pruebas
objetivas para confirmar la presencia de apneas del sueÃąo y estar adecuadamente
tratados con CPAP.
Palabras clave: Obesidad; CirugÃa bariÃĄtrica;
Tratamiento con CPAP; FunciÃģn pulmonar; Apnea obstructiva del sueÃąo
Abstract
Within the Sleep, Oxygen Therapy and Ventilatory
Assistance Section of the Argentine Association of Respiratory Medicine, we deÂvelopment
of recommendations for the respiratory exploration of patients with obesity and
definitions on perioperative management in bariatric surgery and elective
surgical procedures (surgery non bariatric). This initiative was based on the
need to have guidelines adapted to the local reality and discussed by experts
who work in the daily conjunctural reality of our
country.
The schedule was started in August 2020 in a literature review group.
Reviewers from different Argentine provinces carried out an extensive
assessment of the evidence. Then, an editorial committee performed a critical
review of the document. Finally, the whole group discussed the suggestions that
are presented as key points.
This document encourages surgeons and clinicians to work close to
respiratory specialists in assessing risk, defining operative competence, and
revise functional disorders and sleep apnea.
Surgery in obese individuals and bariatric surgery are procedures that
are reached after a detailed evaluation about clinical and functional
situation. The multidisciplinary team and the treatment of detected
abnormalities can reduce perioperative risks.
Obese patients who require elective surgery with general anesthesia
should be evaluated by objective tests to confirm the presence of sleep apnea
and be adequately treated with CPAP.
Key words: Obesity; Bariatric surgery; CPAP treatment; Pulmonary
function; Obstructive sleep apnea
Abreviaturas
AACE (American Association
of Clinical Endocrinologists)
AsociaciÃģn Americana de EndocrinÃģlogos ClÃnicos; sigla en inglÃĐs.
AOS Apneas Obstructivas del SueÃąo.
ASA score (American Society of Anesthesiologist checklist), Sociedad Americana de AnestesiologÃa, sigla en
inglÃĐs.
AAMR AsociaciÃģn Argentina de Medicina
Respiratoria.
ASMBS (American Society
for Metabolic & Bariatric Surgery), Sociedad
Americana de CirugÃa MetabÃģlica y BariÃĄtrica; sigla
en inglÃĐs.
TOS (The Obesity Society), Sociedad de
obesidad, sigla en inglÃĐs.
CB CirugÃa bariÃĄtrica.
CO2 DiÃģxido
de carbono.
CPAP (Continuous
positive airway pressure),
presiÃģn positiva en las vÃas aÃĐreas; sigla en inglÃĐs.
CPT Capacidad pulmonar total.
CRF Capacidad residual funcional.
CSB Cuestionario STOP-BANG, sigla en
inglÃĐs.
CVF Capacidad vital forzada.
DLCO (Diffusing
Capacity of Carbon Monoxide), difusiÃģn de monÃģxido de carbono; sigla en
inglÃĐs.
ENFR Encuesta Nacional de Factores de
Riesgo.
ENNyS-2 Segunda Encuesta Nacional de
NutriciÃģn y Salud
EPOC Enfermedad pulmonar obstructiva
crÃģnica.
ESS (Epworth Sleepiness Scale), escala de
somnolencia subjetiva de Epworth, sigla en inglÃĐs.
HCO3- Bicarbonato
sÃĐrico.
IAH Ãndice de apneas e hipoapneas.
IDO Ãndice de desaturaciones
por hora.
IMC Ãndice de masa corporal.
OMS OrganizaciÃģn Mundial de la Salud.
PaCO2 PresiÃģn
arterial de diÃģxido de carbono
Pemax PresiÃģn espiratoria mÃĄxima.
Pimax PresiÃģn inspiratoria mÃĄxima.
PR PoligrafÃa respiratoria.
Ev/h eventos por hora.
PSG PolisomnografÃa.
SOH SÃndrome de obesidad e
hipoventilaciÃģn.
SDQ (Sleep disorder questionnaire),
cuestionario de desÃģrdenes del sueÃąo, sigla en inglÃĐs.
T90 Tiempo de saturaciÃģn debajo de 90%.
VAS VÃa aÃĐrea superior.
VEF1 Volumen espiratorio forzado en el
primer segundo.
VMNI VentilaciÃģn mecÃĄnica no invasiva.
VO2 Consumo
de oxÃgeno en reposo.
VR Volumen residual.
VRE Volumen de reserva espiratorio.
IntroducciÃģn
Los problemas vinculados al exceso de
peso constituyen uno de los principales desafÃos para la salud pÚblica del
siglo XXI. La OrganizaciÃģn Mundial de la Salud (OMS) calcula un billÃģn de
personas alreÂdedor del mundo padece sobrepeso y la prevalencia de obesidad en
paÃses occidentales supera el 20%, con una inquietante tendencia incremental1.
La obesidad en adultos es uno de los
factores determinantes que explican el crecimiento de la morbilidad y mortalidad
cardiovascular y se estima que causa mÃĄs de 4 millones de muertes al aÃąo en el
mundo2.
La Última Encuesta Nacional de Factores
de Riesgo (ENFR) del 2019 muestra un alarmante aumento sostenido respecto sus
ediciones anteriores, registrando un 33,7% de sobrepeso y un 32.4% de obesiÂdad
en la poblaciÃģn adulta de Argentina2, 3.
Por lo tanto, y segÚn datos oficiales, mÃĄs de la mitad de la poblaciÃģn de
Argentina (66,1%) tiene exceso de peso en algÚn grado2.
La Segunda Encuesta Nacional de NutriciÃģn
y Salud (ENNyS-2) obtuvo valores de sobrepeso en la poblaciÃģn adulta del 34%
con mayor prevalencia de sobrepeso en los varones (37,5%) con respecto a las
mujeres (31,1%). AdemÃĄs, expuso que el grupo de menor nivel educativo tuvo una
prevalencia de obesidad 1,4 veces mayor que el segmento educativo mÃĄs alto
(39,8% vs 28,3%)4.
Obesidad y funciÃģn pulmonar
En la obesidad, las propiedades mecÃĄnicas
de los pulmones y la pared torÃĄcica se alteran por los depÃģsitos de grasa en el
mediastino y en la cavidad abdominal, que resultan en una disminuciÃģn de la
distensiÂbilidad toracopulmonar. Las presiones intraabdominal y pleural aumentan, por lo cual el
movimiento hacia abajo del diafragma y el retroceso de la pared torÃĄcica hacia
afuera se restringen alterando el patrÃģn respiratorio y condicionando una
reducciÃģn del volumen de reserva espiratorio (VRE) y la capaÂcidad residual
funcional (CRF). Los volÚmenes pulmonares estÃĄticos como la capacidad pulmonar
total (CPT) y el volumen residual (VR), pueden encontrarse levemente
disminuidos, al igual que medidas dinÃĄmicas de funciÃģn pulmonar como el volumen
espiratorio forzado en el primer segundo (VEF1) y la capacidad vital forzada
(CVF). El volumen corriente tambiÃĐn es menor en pacientes con obesidad, aunque
el aumento de la frecuencia respiratoria compensa el patrÃģn de respiraciÃģn
superficial. La distribuciÃģn de la grasa a predominio abdominal (androide) es
un factor de riesgo de disminuciÃģn del VEF1 y CVF independiente del IMC5.
La reducciÃģn de los volÚmenes pulmonares,
el aumento del volumen sanguÃneo pulmonar y colapso alveolar por cierre de la
pequeÃąa vÃa aÃĐrea contribuyen a la disminuciÃģn de la distensibilidad pulmonar,
que segÚn las revisiones serÃa el principal causante de la diminuciÃģn de la
distensibilidad del aparato respiratorio en estos pacientes6, 7.
Las presiones bucales mÃĄximas (presiÃģn
inspiratoria [Pimax] y espiratoria mÃĄxima [Pemax]) son en general normales, pero pueden encontrarse
disminuidas en la obesidad grave. Un comportamiento similar suele observarse en
la resistencia de los mÚsculos respiratorios, que se ve alterada en la obeÂsidad
extrema8.
Como consecuencia de estas anomalÃas el
trabajo ventilatorio se incrementa, de manera que en los pacientes con obesidad
mÃģrbida (Ãndice de masa corporal [IMC] > 40 kg/m2) el consumo de oxÃgeno en reposo (VO2) puede alcanzar
hasta el 16% de la VO2 total,
mientras que no excede el 3-5% en no obesos9, 10.
Por otra parte, en los pacientes con
obesidad existen anomalÃas del control de la ventilaciÃģn que faÂvorecen la
retenciÃģn de diÃģxido de carbono (CO2)
durante el sueÃąo e inclusive durante la vigilia, como ocurre en la
hipoventilaciÃģn alveolar central de pacientes con obesidad8, 10.
Otras dos entidades, la Enfermedad
Pulmonar Obstructiva CrÃģnica (EPOC) y las Apneas ObstructiÂvas del SueÃąo (AOS),
frecuentemente presentes en obesos, pueden agravar la hipoventilaciÃģn alveolar
diurna y nocturna
Diferentes estudios han detectado la existencia
de una asociaciÃģn entre el Ãndice de masa corporal (IMC) basal y el posterior
desarrollo de asma, concluyendo que la obesidad es la principal comorbilidad
asociada a esta enfermedad11,
12.
La asociaciÃģn de asma y obesidad son
consideradas un fenotipo particular, con caracterÃsticas clÃnicas, biolÃģgicas y
funcionales propias13,
14.
Al igual que la obesidad, la EPOC
incrementa el trabajo ventilatorio, modifica la mecÃĄnica respiÂratoria y
disminuye la eficiencia de los mÚsculos respiratorios. La coexistencia de ambas
condiciones contribuye a la hipercapnia. Adicionalmente, la coexistencia de
estas anormalidades con apneas del sueÃąo ha sido denominada por algunos autores
como: âtriple Oâ (Obstructive, Obstruction,
Obesity), con mayor riesgo de requerir soporte
ventilatorio ante injurias variadas15.
Puntos clave
â La obesidad condiciona una
disminuciÃģn en la distensibilidad del sistema respiratorio, un descenso de
volÚmenes pulmonares, una afectaciÃģn de la permeabilidad de la vÃa aÃĐrea
superior y de la capaÂcidad de oxigenaciÃģn y depuraciÃģn de la CO2.
â La coexistencia de enfermedades
pulmonares crÃģnicas puede agravar las alteraciones vinculadas a la obesidad y
viceversa.
EvaluaciÃģn bÃĄsica de la funciÃģn pulmonar en el
paciente con obesidad
La espirometrÃa
es una tÃĐcnica sencilla, no invasiva y de bajo costo, que permite una
aproximaciÃģn rÃĄpida al conocimiento de la funciÃģn pulmonar. Sus alteraciones se
han correlacionado con complicaÂciones postoperatorias en casos de cirugÃa bariÃĄtrica (CB) y no bariÃĄtrica
en pacientes con obesidad y comorbilidades16-18. Es la tÃĐcnica bÃĄsica que se recomienda
en el paciente obeso para la evaluaciÃģn del riesgo segÚn la magnitud de la
limitaciÃģn funcional10,
19. Los pacientes evaluados para cirugÃa (aÚn asintomÃĄticos),
deben tener un estudio espiromÃĐtrico aceptable y
reproducible en los Últimos 3 meses con una adecuada interpretaciÃģn clÃnica20-22.
Cualquier alteraciÃģn de las pruebas
funcionales debe ser interpretada por un neumonÃģlogo
y recibir el tratamiento acorde al diagnÃģstico final (segÚn la normativa
vigente actualizada para la mejor prÃĄcÂtica clÃnica) antes de ser aceptado para
cirugÃa, fundamentalmente en CB21,
23, 24. Todos los hallazgos y tratamientos instituidos
deben ser adecuadamente consignados en la historia clÃnica.
Los volÚmenes pulmonares y la difusiÃģn de
monÃģxido de carbono (DLCO) no forman parte de la evaluaciÃģn rutinaria de los
candidatos a CB, aunque en casos seleccionados podrÃĄ recurrirse a este tipo de
estudios segÚn criterio del mÃĐdico especialista cuando la espirometrÃa
no ofrezca informaciÃģn concluyente (tabaquistas, antecedentes de resecciÃģn
pulmonar, coexistencia con enfermedades ocupaÂcionales, EPOC con VEF1 < 50%,
fibrosis pulmonar, compromiso funcional severo por otra causa, etc.).
En circunstancias especÃficas,
dependiendo del criterio del mÃĐdico especialista que evalÚe el caso, puede ser
necesario incluso adicionar otras pruebas tales como presiones bucales mÃĄximas,
espirometrÃa sentado-acostado o un test de ejercicio cardio-pulmonar con consumo de oxÃgeno.
La determinaciÃģn de gases en sangre
arterial (punciÃģn arterial y estado ÃĄcido-base) no forma parte de la rutina en
la evaluaciÃģn preoperatoria del paciente obeso. Sin embargo, se sugieren
contemplar en las condiciones detalladas en la Tabla 1.
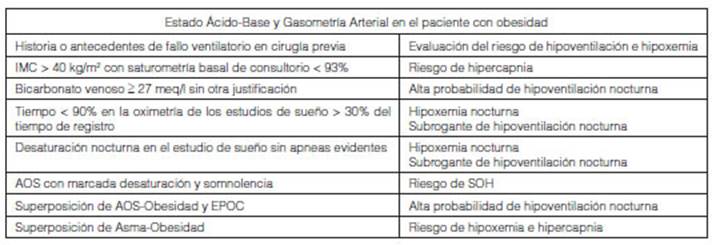
La identificaciÃģn de hipercapnia en
vigilia constituye un indicador de la presencia del SÃndrome de obesidad e
hipoventilaciÃģn (SOH); definido como la combinaciÃģn de obesidad (IMC > 30
kg/m2)
e hiperÂcapnia diurna (PaCO2 >
45 mmHg) en ausencia de causas concurrentes10, 25. Esta es
una condiciÃģn de alto riesgo que no representa una contraindicaciÃģn absoluta
para la CB per se, pero obliga a un manejo cuidadoso, considerando el soporte
ventilatorio no invasivo en el perioperatorio ya que
la mitad de los casos de SOH se diagnostican durante un episodio de fracaso
ventilatorio26-28.
Las caracterÃsticas clÃnicas que deberÃan
hacer sospechar SOH son; la obesidad severa, disnea, nicturia,
edema de las extremidades inferiores, somnolencia diurna excesiva, fatiga,
ronquidos de alta intensidad, apneas presenciadas, asà como una oximetrÃa de
pulso (SpO2)
< 92% durante la vigilia y / o hipoxemia
significativa durante el sueÃąo (SpO2 < 90%). Valores
elevados de bicarbonato sÃĐrico (HCO3-)
venoso hacen sospechar hipoventilaciÃģn y SOH. Ante el hallazgo de ≥ 27 mmol/l se sugiere una determinaciÃģn de gases arteriales
para verificar el valor de PaCO225.
Puntos clave
â Es prudente que los pacientes con
obesidad evaluados para procedimientos quirÚrgicos con anestesia general
realicen una espirometrÃa aceptable y reproducible en
los Últimos 3 meses con una adecuada interpretaciÃģn clÃnica.
â Toda alteraciÃģn funcional debe recibir
el tratamiento acorde con el diagnÃģstico etiolÃģgico, antes de cualquier cirugÃa
electiva.
â Otras pruebas funcionales no se
consideran de rutina, aunque son auxiliares del diagnÃģstico cuando los patrones
espiromÃĐtricos son anormales o existe sospecha
clÃnica de enfermedades que comprometen la funciÃģn pulmonar.
â La pesquisa de SOH se recomienda a
travÃĐs de la sospecha clÃnica y valores gasomÃĐtricos.
Trastornos respiratorios del sueÃąo en pacientes
con obesidad
La AOS es un problema de salud pÚblica
por su elevada prevalencia y por el aumento de la morbi-mortalidad
que ocasiona29,
30. Su prevalencia en la poblaciÃģn general oscila entre el
9% y el 38%31-33,
situÃĄndose cerca del 28% en AmÃĐrica Latina34, haciendo necesarias estrategias prÃĄcticas
para casi un billÃģn de afectados en el mundo35.
En poblaciÃģn quirÚrgica, la AOS es
significativamente mÃĄs prevalentes que en la poblaciÃģn general y 6 de cada 10
pacientes candidatos a cirugÃa bariÃĄtrica tienen
apneas del sueÃąo definida por un IAH > 10 ev/h29, 31, 36, 37.
Akram Khan y cols, en Pittsburgh, llevaron adelante el estudio LABS-2
(evaluaciÃģn de adultos canÂdidatos a cirugÃa bariÃĄtrica)
y en 693 pacientes con polisomnografia (PSG)
preoperatoria hallando una prevalencia de IAH > 5 ev/h
del 80,7%38.
El diagnÃģstico de AOS se confirma
convencionalmente mediante una PSG, aunque se acepta como vÃĄlido el diagnÃģstico
mediante una poligrafÃa respiratoria (PR) en poblaciones con probabilidad
clÃnica moderada o alta32,
39.
Casi la mitad de los pacientes con AOS en
evaluaciÃģn para CB reÚnen criterios para tratamiento con presiÃģn positiva en
las vÃas aÃĐreas (CPAP)40-42 debido a la severidad
del trastorno y a las comorbilidades con las que se asocia38.
Los pacientes con AOS tienen riesgo de
complicaciones respiratorias y cardiovasculares en relaciÃģn a cirugÃas que
requieren anestesia general, sedaciÃģn y/o analgesia, en forma directamente
proporcional a la severidad por IAH y al grado de hipoxemia37, 43, 44.
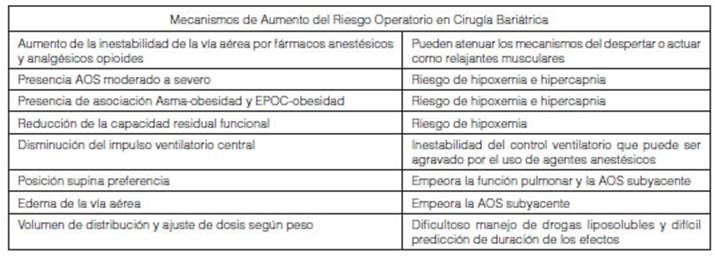
Los factores que pueden contribuir al aumento del riesgo operatorio en obesos
se detallan en la Tabla 2. Dos metaanÃĄlisis y
una revisiÃģn sistemÃĄtica de 63 publicaciones basadas en 413 576 pacientes con
AOS y 8 557 044 controles, confirmaron una mayor incidencia de desaturaciones de oxÃgeno en el postoperatorio, eventos
cardÃacos e insuficiencia respiratoria en presencia de apneas del sueÃąo45.
Estas complicaciones incluyen: hipoxia, hipercapnia, neumonÃa, atelectasias,
broncoespasmo, dificultad respiratoria aguda, edema pulmonar y la necesidad de
ventilaciÃģn no invasiva y/o intubaciÃģn45, 46.
En pacientes con elevada sospecha clÃnica
de apneas del sueÃąo y que deban ser sometidos a cirugÃas electivas, existen
recomendaciones para la realizaciÃģn de un estudio de sueÃąo que confirme el
diagnÃģstico, determine el grado de severidad y la necesidad de tratamiento con
CPAP u otras terapias especÃficas37, 38. Si no fuese posible un
estudio de sueÃąo (cirugÃa no electiva) los pacientes con diagnÃģstico clÃnico
presuntivo deben ser manejados con las mismas precauciones postoperatorias que
los pacientes con AOS confirmado39, 44.
Un aspecto relevante del problema es que,
a pesar de conocerse esta asociaciÃģn, frecuentemente numerosos pacientes
candidatos en programas de cirugÃa bariÃĄtrica no son
diagnosticados ni reciben tratamiento antes de la cirugÃa43, 47, 48.
Debido a la magnitud del problema, se han
diseÃąado cuestionarios y modelos de predicciÃģn de AOS con la intenciÃģn de
priorizar los pacientes para una prueba de sueÃąo que confirmarÃĄ el diagnÃģstico39,
49.
El cuestionario de BerlÃn49, ampliamente
usado en la poblaciÃģn general como mÃĐtodo tamiz, supone alto riesgo con IMC
> 30 kg/m2 y por ello muestra escasa utilidad prÃĄctica en CB,
donde los candidatos tendrÃĄn riesgo elevado de padecer apneas del sueÃąo (>
30% de probabilidad estadÃstica de padecer un IAH > 10 ev/h
por hora).
Las unidades que trabajan con pacientes
candidatos a CB utilizan mediciones antropomÃĐtricas. Las mÃĄs estudiadas como
factores de riesgo para AOS serÃan: el IMC, la circunferencia del cuello y el
diÃĄmetro de cintura50. Borsini y Cols., en
81 pacientes candidatos a CB no hallaron correlaciÃģn entre el Ãndice de
cintura-cadera (ICC) y diÃĄmetro sagital (DS) con la probabilidad de AOS,
atribuible a la elevada prevalencia de IAH > 15 ev/h
(55% de los obesos)51.
El cuestionario STOP-BANG (CSB) descripto
por Chung, fue validado para el cribado de AOS en
poblaciÃģn quirÚrgica. Consta de 8 preguntas, con una sensibilidad del 93 al
100% y una especificidad del 43%52, 53. Borsini
et al., estudiaron la utilidad de CSB con PR y demostraron que la mejor
relaciÃģn sensibilidad (S) y especificidad (E) para la identificaciÃģn de AOS se
obtuvo con tres componentes de STOP en cualquier combinaciÃģn posible (S: 52,9%;
E: 60.0%) o dos componentes de BANG (S: 79,0% â E: 43,7%). Cinco componentes
CSB (cualquier combinaciÃģn) alcanzaron sensibilidad de 60,7% y esÂpecificidad
de 65%46, 53,
ÃĄrea bajo la curca ROC de 0,7654,
55 permitiendo
priorizar individuos de riesgo.
Sin embargo, la metodologÃa empleada para
el diagnÃģstico o el tipo de poblaciÃģn pueden modificar la predicciÃģn del
cuestionario, como lo han propuesto Silva56, usando PSG domiciliaria, quien comunico que
el desempeÃąo de CSB difiere del trabajo de validaciÃģn original o Glazer notificando limitada eficacia de predicciÃģn de CSB y
BerlÃn, utilizando PSG en obesos candidatos a cirugÃa bariÃĄtrica57, 58. En esa misma lÃnea tambiÃĐn se han
descripto diferencias del desempeÃąo segÚn el gÃĐnero, remarcando mejor
predicciÃģn de los cuestionarios en las mujeres59.
En un metaanÃĄlisis,
Ramachandran y Josephs
compararon instrumentos multiparamÃĐtricos para
identificar pacientes con apneas del sueÃąo, concluyendo que BerlÃn y CSB fueron
mÃĄs eficaces60.
AbrisÂhami y cols., arriban a conclusiones similares,
destacando que es posible que el uso concomitante de mÃĄs de una herramienta de
predicciÃģn mejore los resultados61.
Independientemente de la predicciÃģn
previa a la realizaciÃģn de un estudio de sueÃąo, las guÃas prÃĄcticas de la AsociaciÃģn
Argentina de Medicina Respiratoria (AAMR) sugieren que los pacientes candidatos
a CB deben ser evaluados para descartar AOS y SOH mediante una prueba objetiva
(estudio de sueÃąo)39,62.
Los candidatos deberÃan tener siempre una
evaluaciÃģn con radiografÃa (Rx) de tÃģrax, espirometrÃa y cribado estandarizado para AOS49, 63, 64. Valores
elevados de bicarbonato venoso hacen sospechar hipoÂventilaciÃģn y SOH. Ante el
hallazgo de 27 mmol/l
se sugiere una determinaciÃģn de gases arteriales para medir la PaCO25, 54, 65.
En el mismo sentido, las guÃas de la American Association
of Clinical Endocrinologists
(AACE), The Obesity Society (TOS) y la American Society
for Metabolic & Bariatric Surgery (ASMBS)
recomiendan la pesquisa de AOS mediante un estudio de sueÃąo de adecuada
calidad, en candidatos a cirugÃa bariÃĄÂtrica y el uso
de CPAP en el perÃodo preoperatorio66.
En EE.UU. la tasa de indicaciÃģn de CPAP
es del orden del 40% de los pacientes a quienes se realizÃģ PSG preoperatoria38, 67. Datos
de nuestro paÃs han comunicado una tasa de prescripciÃģn de CPAP previo a CB de
35,8% en el 201551.
Puntos clave
- Teniendo en cuenta que la AOS es
altamente prevalente en candidatos a CB, que los cuestionarios de sueÃąo tienen
poca exactitud, se recomienda realizar un estudio de sueÃąo (PSG o PR) como
parte de la evaluaciÃģn prequirÚrgica, y determinar la
necesidad de tratamiento con CPAP u otras terapias especÃficasâ.
Protocolo bÃĄsico de actuaciÃģn clÃnica
La CB es un tratamiento con alta eficacia
para la obesidad grave, ya que reduce la mortalidad por todas las causas,
mejora la expectativa de vida y la calidad de vida, impactando sobre las
comorbilidades (diabetes tipo 2, hipertensiÃģn arterial, AOS, esteatosis
hepÃĄtica, etc.)68,
69, 70.
La CB se realiza como un tratamiento a
largo plazo para obesidad mÃģrbida (IMC > a 40 kg/m2) o IMC > de 35 kg/m2 en
combinaciÃģn con comorbilidades relacionadas. En la actualidad, se realizan
alrededor de 500.000 procedimientos en todo el mundo y su nÚmero continÚa
creciendo71.
Una pÃĐrdida de peso de 10% o mayor puede
mejorar las apneas del sueÃąo segÚn el IAH72, 73. Estudios clÃnicos que evalÚan la
eficacia de la CB han demostrado eficacia para mejorar la sintomatologÃa y las
puntuaciones de IAH en pacientes con AOS74-76.
La evaluaciÃģn de riesgo respiratorio en
el marco de la evaluaciÃģn del riesgo operatorio para CB debe ser mandatoria y sistemÃĄtica39, 45, 46, 66, 68, 77-79.
Los pacientes que padezcan insuficiencia
respiratoria diurna, insuficiencia cardiaca, apneas del sueÃąo previamente
diagnosticada o bien que usen oxigeno suplementario o algÚn tipo de dispositivo
de ventilaciÃģn deberÃĄn estar en seguimiento por mÃĐdicos con formaciÃģn y
experiencia en el manejo de la patologÃa respiratoria, constatÃĄndose la
correcciÃģn de los trastornos.
El paciente con AOS con CPAP deberÃĄ
utilizar su propio dispositivo tras la intervenciÃģn y esta teÂrapia serÃĄ
aplicada en el postoperatorio inmediato y en todo el periodo perioperatorio. Sin embargo, en pacientes con un nivel de
cumplimiento de CPAP inadecuado o que presentan efectos secundarios deberÃĄn ser
evaluados por el especialista de sueÃąo para identificar y solucionar las causas
de intolerancia.
Si el paciente acude con estudios de
sueÃąo realizados con anterioridad, estos pueden aceptarse como vÃĄlidos si su
vigencia es < 3 meses y han sido revisados por un especialista para
verificar que cumplan criterios de reproducibilidad, aceptabilidad y calidad
del informe80.
La Figura 1 sintetiza el algoritmo
de manejo inicial de la evaluaciÃģn del riesgo respiratorio en CB.
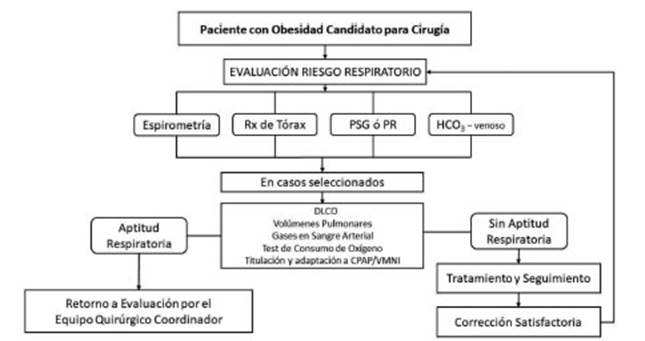
Puntos clave
â La evaluaciÃģn de riesgo respiratorio
en el marco de la evaluaciÃģn del riesgo operatorio en CB debe ser mandatoria y sistemÃĄtica.
â Los pacientes que padezcan
insuficiencia respiratoria diurna deberÃĄn estar en seguimiento y su aptitud se
decidirÃĄ de manera individualizada.
â El paciente con AOS e indicaciÃģn de
CPAP, deberÃĄ utilizar el tratamiento antes de la intervenciÃģn en todo el
periodo perioperatorio.
Manejo perioperatorio
Preoperatorio
Es recomendable identificar situaciones
que podrÃan favorecer la apariciÃģn de complicaciones respiratoÂrias en el perioperatorio y factores predictores de vÃa aÃĐrea de
difÃcil manejo; Mallampati III/IV, obesidad mÃģrbida,
portadores de enfermedades neuromusculares, sÃndrome de obesidad e
hipoventilaciÃģn, apneas del sueÃąo, comorbilidades cardiovasculares y otras
enfermedades respiratorias crÃģnicas que impactan en la obesidad (asma, EPOC,
fibrosis pulmonar, etc.)13,
14, 81, 82. Considerar siempre el protocolo de manejo de
vÃa aÃĐrea dificultosa incluyendo la intubaciÃģn asistida por endoscopia.
Adicionalmente, se sugerirÃĄ la
cesaciÃģn-tabÃĄquica como mÃnimo 6 semanas antes de la cirugÃa y en el
postoperatorio dado el mayor riesgo de retraso en la cicatrizaciÃģn y Úlcera
anastomÃģtica78.
Cuando el diagnÃģstico de apneas del sueÃąo
estÃĄ confirmado, se debe iniciar el tratamiento en el perÃodo preoperatorio38, 83. Es
importante que la AOS reciba adecuado tratamiento al menos 2-4 semanas antes de
la fecha prevista de cirugÃa para resolver la respuesta inflamatoria y el
riesgo cardio-metabÃģlico. Esta instancia deberÃĄ ir
seguida de adecuado monitoreo objetivo (monitoreo del cumplimiento y de la
eficacia de la CPAP mediante tarjeta de memoria o vigilancia remota)84, 85.
En el manejo preoperatorio es aconsejable
la preoxigenaciÃģn al 100% antes de la inducciÃģn
anestÃĐsica y elegir agentes anestÃĐsicos y bloqueantes musculares (en caso de
ser necesarios) fÃĄcilmente reversibles, prefiriÃĐndose los de acciÃģn corta86, 87.
Se deben maximizar los esfuerzos para
controlar el riesgo de reflujo gastroesofÃĄgico y de broncoasÂpiraciÃģn7.
El diÃĄmetro traqueal se reduce con el
aumento del IMC88.
Debe optimizarse la permeabilidad de la vÃa aÃĐrea, con la posiciÃģn en Trendelemburg invertido (elevar la cabeza y parte superior
del tÃģrax 20 a 30° por arriba del plano horizontal) ya que optimiza la
oxigenaciÃģn87,
89, 90. Durante la inducciÃģn anestÃĐsica de pacientes
con AOS el uso de CPAP puede usarse para mantener la capacidad residual
funcional y reducir el tiempo de desaturaciÃģn79.
Intraoperatorio
La sociedad americana de anestesia y
medicina del sueÃąo han publicado durante el 2018 las guÃas de manejo intraoperatorio del paciente con AOS. El procedimiento
anestÃĐsico va a estar determinado por el tipo de cirugÃa y las necesidades de
analgesia91.
En tÃĐrminos generales se debe seleccionar la tÃĐcnica anestÃĐsica que permita
minimizar o evitar el uso de depresores respiratorios de efecto prolongado.
El Propofol
presenta un efecto en la permeabilidad de la vÃa aÃĐrea superior (VAS) dosis
dependiente, con disminuciÃģn del tono muscular y del diÃĄmetro anteroposterior
de la VAS. El uso de capnografÃa durante la sedaciÃģn,
disminuye la incidencia de complicaciones respiratorias91.
La Dexmedetomidina
es un agonista α2 cuyo efecto sobre la VAS es mÃnimo. Este agente induce
sueÃąo no REM sin depresiÃģn respiratoria por lo que podrÃa valorarse en funciÃģn
de las comorbilidades del paciente. No obstante, no hay evidencia suficiente
para sugerir su uso sistemÃĄtico en pacientes con AOS. La Ketamina,
antagonista del receptor N-metil-D-Aspartato, tiene un efecto favorable sobre la colapsabilidad de la VAS, siendo otra buena alternativa92.
Los pacientes con AOS son sensibles a los
efectos depresores de sedantes y opiÃĄceos, lo cual puede ser controlado por la
aplicaciÃģn de bajas dosis de drogas de acciÃģn corta, ademÃĄs de tener siempre
disponibles agentes que reviertan su acciÃģn67. Los benzodiacepinas son fÃĄrmacos que deben
evitarse, incluso como premedicaciÃģn, debido a su
capacidad de inhibir el centro respiratorio, a su efecto relajante muscular y a
su vida media larga. Las fasciculaciones asociadas a
relajantes despolarizantes pueden aumentan el consumo
de oxÃgeno86.
Se recomienda monitoreo continuo de la
oxigenaciÃģn por oximetrÃa, e idealmente de la ventilaciÃģn con capnografÃa, restringiendo el aporte excesivo de fluidos ya
que agravan el edema en la vÃa aÃĐrea93.
Postoperatorio
La extubaciÃģn
se decidirÃĄ cuando la ventilaciÃģn espontÃĄnea y la oxigenaciÃģn sean adecuadas,
con el paciente semisentado, controlando que los
reflejos de la VAS estÃĐn conservados y efectos de bloqueantes neuromusculares
revertidos79.
En los pacientes con obesidad las atelectasias postoperatorias persisten
durante mÃĄs tiempo, por lo que debe considerarse el riesgo de hipoxemia94. Algunos
estudios sugieren que el riesgo de complicaciones es mayor en varones95, > 50 aÃąos
y con IMC ≥ 60 kg/m2.
El monitoreo postoperatorio deberÃa
llevarse a cabo al menos en una sala de recuperaciÃģn post anestÃĐÂsica con pulsioximetrÃa continua96, 97, e idealmente en unidades con mayor
capacidad de monitoreo98,
99, 100.
En aquellos pacientes que requieren O2 suplementario
debido a comorbilidades respiratorias debe monitorizarse la ventilaciÃģn con capnografÃa o estado ÃĄcido base con gases arteriales en el
postoperatorio inmediato78.
Es recomendable que los pacientes adopten la posiciÃģn semisentada
en el postoperatorio para reducir la hipoxemia postoperatoria, la disfunciÃģn
diafragmÃĄtica y los eventos obstructivos101, 102. Esto se fundamenta en que el decÚbito
supino genera mayor caÃda de la CRF, mÃĄs hipoxemia y mayor frecuencia de
apneas/hipopneas obstructivas101, 102. Por otro lado, se ha documentado
disfunciÃģn diaÂfragmÃĄtica en el postoperatorio de cirugÃa abdominal y cirugÃa
torÃĄcica103.
En pacientes con AOS, la administraciÃģn
de O2 sin CPAP mejora la
oximetrÃa, pero puede agravar la retenciÃģn de CO2 y
disminuir los microdespertares protectores, por lo
que debe administrarse el menor flujo que mantenga una adecuada saturaciÃģn y
controlarse el patrÃģn ventilatorio, el sensorio y los niveles de CO2104-106.
En el postoperatorio, la hipoventilaciÃģn
con hipoxemia e hipercapnia no son infrecuentes debido a efecto residual de
drogas anestÃĐsicas, atelectasias y dolor, razÃģn por la cual debe considerase la
instauÂraciÃģn de CPAP. Cuando sea necesario, tambiÃĐn se puede considerar adicionar
oxÃgeno25, 68, 77-79.
AdicioÂnalmente, se recomienda el uso de CPAP en los pacientes con uso previo
del dispositivo o en aquellos pacientes en los que se documenten eventos
obstructivos en la unidad de recuperaciÃģn104, 105, 106.
La CPAP en el postoperatorio inmediato ha
demostrado ser segura, sin incremento en la incidencia de fÃstulas o
dehiscencias (no tiene riesgo de alterar la integridad de la anastomosis ni la
circulaciÃģn local peri-anastomÃģtica)107-110. En casos de retenciÃģn de CO2 se debe contemplar la implementaciÃģn de VMNI25, 37, 68, 77-79, 107.
Para el control del dolor postoperatorio
se pueden combinar tÃĐcnicas loco-regionales (infiltraciÃģn, analgesia
epidural y bloqueo de nervios perifÃĐricos) con fÃĄrmacos de diferente blanco
terapÃĐutico; paraÂcetamol, antiinflamatorios no esteroideos o ketamina, intentando disminuir necesidad de opiÃĄceos67, 79, 101.
La mayorÃa de los pacientes con AOS (80%)
muestran mejorÃa con la pÃĐrdida de peso112, 113. Estudios prospectivos describen que
en al menos tres cuartas partes de los pacientes con IAH preoperatorio ≥
15 ev/h, podrÃa reducirse por debajo de este punto
durante el seguimiento. Alrededor del 75% de los pacientes con CPAP en el
preoperatorio podrÃan prescindir de esta terapia despuÃĐs de la CB113.
La pÃĐrdida de peso inducida
quirÚrgicamente no solo disminuye la gravedad de las apneas del sueÃąo, sino
tambiÃĐn la gravedad del SOH. MÚltiples estudios han demostrado que esta pÃĐrdida
de peso mejora la gasometrÃa arterial, la funciÃģn hemodinÃĄmica y los volÚmenes
pulmonares25,
114-117.
Por otro lado, revisiones sistemÃĄticas
muestran que el 20% de los pacientes podrÃan persistir con AOS moderado a
severo al aÃąo de la cirugÃa68.
Un estudio holandÃĐs en 205 pacientes sometidos a bypass gÃĄstrico, estableciÃģ que
el mayor predictor de falta de remisiÃģn de las apneas del sueÃąo fue un IAH
preoperatorio ≥ 30 ev/h (OR 5.7; IC del 95%:
2.4-13.2)113.
Una menor edad e Ãndice de desaturaciÃģn de oxÃgeno
(IDO) menor, serÃan predictivos de mejorÃa despuÃĐs del bypass gÃĄstrico118.
La oportunidad de reevaluar la
continuidad de CPAP Ãģ VMNI mediante un nuevo estudio
de sueÃąo estÃĄ determinada por; la magnitud de la pÃĐrdida de peso, la mejorÃa de
los sÃntomas y la reducciÃģn de la presiÃģn terapÃĐutica de CPAP requerida en los
controles119.
Por otro lado, datos recientes sugieren que alteraciones hormonales podrÃan
estar asociadas a cambios en el IAH independientemente a la pÃĐrdida de peso. Amin y cols., describieron una asociaciÃģn entre la
disminuciÃģn de la leptina y aumento de la orexina con una disminuciÃģn del IAH entre 3 y 5 semanas del
postoperatorio, independientemente de la pÃĐrdida de peso120, 121.
Si bien no estÃĄ claro cuÃĄl es el momento
ideal, guÃas de manejo clÃnico sugieren que los pacientes con AOS deben
continuar con CPAP o VMNI despuÃĐs de la cirugÃa durante al menos 3 a 6 meses68, 77, 79. A
partir de la pÃĐrdida del 10-15% del peso corporal se deberÃĄ considerar la
realizaciÃģn de un nuevo estuÂdio de sueÃąo para determinar la necesidad de
continuar la terapia y/o para el ajuste de parÃĄmetros122.
La mejorÃa sintomÃĄtica no serÃa
suficiente para indicar la suspensiÃģn del tratamiento de la AOS luego de la CB.
Franceschini y cols., valoraron que la magnitud del
cambio en el IMC y los sÃntomas de somnolencia (EES) son factores predictivos
de suspensiÃģn de CPAP a dos aÃąos de la cirugÃa bariÃĄtrica50.
Antes de la decisiÃģn final de suspender
la CPAP Ãģ VMNI, se sugiere un estudio de sueÃąo
postoperaÂtorio alejado (PSG o PR)77,
79, 119, 123, 124. Se ha informado que hasta el 50-60% de
los pacientes con AOS no realizan una PSG postoperatoria112, 113, 125.
AdemÃĄs, algunos trabajos alertan que una
elevada proporciÃģn de pacientes con CB y disminuciÃģn de peso no cumplen la
terapia con CPAP a largo plazo126.
Para aumentar la adherencia y adecuar las expectativas del paciente, el
asesoramiento y el seguimiento del tratamiento con CPAP debe comenzar antes de
la CB124, 127.
En caso de AOS persistente pese a un
adecuado descenso de peso, se recomiendan los lineamentos establecidos por las
guÃas argentinas de diagnÃģstico y tratamiento39.
Algunos pacientes con CPAP pueden
utilizar tratamientos alternativos de acuerdo a los resultados de la evaluaciÃģn
en el postoperatorio (dispositivos de avance mandibular, terapia posicional,
etc.).
Conclusiones
La cirugÃa en individuos con obesidad y
la CB son procedimientos a los que se arriba luego de una evaÂluaciÃģn
exhaustiva de la situaciÃģn clÃnica y funcional, por lo que es necesaria una
evaluaciÃģn respiratoÂria que incluya un examen de la funciÃģn pulmonar y de los
trastornos respiratorios durante el sueÃąo.
La tarea multidisciplinaria y el
tratamiento de las anormalidades detectadas en un examen sistemÃĄÂtico y
ordenado pueden disminuir los riesgos peri-operatorios.
Pacientes con obesidad que requieren
cirugÃa electiva con anestesia general deben ser evaluados meÂdiante pruebas
objetivas para confirmar o descartar la AOS. Los pacientes obesos con AOS
candidatos quirÚrgicos deben estar adecuadamente tratados con CPAP.
BibliografÃa
1. Akram DS, Astrup AV, Atinmo T, et al. Obesity: preventing and
managing the global epidemic. WHO Technical Report Series.
[Internet].2004 [acceso 1 de diciembre de 2020];894:1-256. Disponible en:
https://www.who.int/nutrition/publicaÂtions/obesity/WHO_TRS_894/en/.
2. Ministerio de Salud. RepÚblica
Argentina. 1° Encuesta nacional de factores de riesgo 2005 para enfermedades no
transÂmisibles. [Internet].2005 [acceso 1 de diciembre de 2020]. Disponible en:
http://www.bvs.org.ar/indicador.htm.
3. Ministerio de Salud y Desarrollo
Social de la NaciÃģn. 4ta. Encuesta Nacional de Factores de Riesgo. Buenos
Aires, ArÂgentina. [Internet].2018 [acceso 1 de diciembre de 2020]; 4: 1-22.
Disponible en: https://bancos.salud.gob.ar/sites/default/files/2020-01/4ta-encuesta-nacional-factores-riesgo_2019_principales-resultados.pdf.
4. Ministerio de Salud. RepÚblica
Argentina. 2° Encuesta nacional de NutriciÃģn y Salud. Argentina. [Internet]
2019 [acceso 1 de diciembre de 2020];2:1-20.
Disponible en:
https://cesni-biblioteca.org/wp-content/uploads/2019/10/0000001565cnt-ennys2_resumen-ejecutivo-20191.pdf.
5. Dixon AE, Peters U. The effect of obesity on lung function. Expert Rev Respir Med. 2018; 12(9): 755-67.
6. de Lucas Ramos P, RodrÃguez
GonzÃĄlez-Moro JM, Rubio Socorro Y. Obesidad y funciÃģn pulmonar. Arch Bronconeumol. 2004; 40(5): 27-31.
7. Benumof Hagberg
C. Benumof and Hagberg`s
Airway Management. 3ered.
Philadelphia: Elsevier; 2012. p. 892-901.
8. Rochester DF, Enson Y. Current concepts in
the pathogenesis of the obesity-hypoventilation syndrome. Mechanical and
circulatory factors. Am J Med. 1974; 57(3): 402-20.
9. Koenig SM. Pulmonary complications of obesity. Am J Med Sci. 2001;
321(4): 249-79.
10. Rabec C, de Lucas Ramos P, Veale D.
Respiratory complications of obesity. Arch Bronconeumol.
2011; 47(5): 252-61.
11. Ford ES. The epidemiology of obesity and asthma. J Allergy Clin Immunol. 2005;115(5):
897-910.
12. Pite H, Aguiar
L, Morello J, et al. Metabolic Dysfunction and Asthma: Current Perspectives. J
Asthma Allergy. 2020; 13: 237-47.
13. Villeneuve T, Guilleminault L. Asthma and
obesity in adults. Rev Mal Respir. 2020;
37(1): 60-74.
14. Peters U, Dixon AE, Forno E. Obesity and
asthma. J Allergy Clin Immunol.
2018; 141(4): 1169-79.
15. Drummond M, Santos A, Pinto T et al. Triple
0 - A new respiratory syndrome? Eur Respir J.2012; 40 (56): 2071.
16. BÃķhmer AB, Wappler
F. Preoperative evaluation and preparation of the morbidly obese patient. Curr Opin Anaesthesiol.
2017; 30(1): 126-32.
17. Bluth T, Pelosi P, de Abreu MG. The obese patient
undergoing nonbariatric surgery. Curr
Opin Anaesthesiol. 2016;
29(3): 421-9.
18. Bazurro S, Ball L, Pelosi P. Perioperative
management of obese patient. CurrOpin Crit Care. 2018; 24(6): 560-7.
19. Clavellina-GaytÃĄn D,
VelÃĄzquez-FernÃĄndez D, Del-Villar E, et al. Evaluation of spirometric testing as a routine preoperaÂtive assessment
in patients undergoing bariatric surgery. Obes Surg.
2015; 25(3): 530-6.
20. Lung function testing: selection of reference values and
interpretative strategies. American Thoracic Society. Am Rev Respir Dis. 1991; 144(5): 1202-18.
21. Pellegrino R, Viegi G, Brusasco
V, et al. Interpretative strategies for lung function tests. Eur Respir J. 2005; 26(5): 948-68. 410 411
ValoraciÃģn Respiratoria en pacientes con
obesidad candidatos a cirugÃa
22. Position paper. Implications of obesity for outcomes of
non-bariatric. royal australasian college of surgeons surgery. [internet].2015.[acceso 1 de diciembre de
2020];1:1-2. Disponible en: https://www.surgeons.org/News/Advocacy/2018-06-05-implications-of-obesity-for-outcomes-of-non-bariatric-surgery.
23. Chevalier-Bidaud B, Gillet-Juvin K, Callens E, et al. Non specific pattern of lung function in a respiratory
physiology unit: causes and prevalence: results of an observational
cross-sectional and longitudinal study. BMC Pulm Med.
2014; 14: 148.
24. Hyatt RE, Cowl CT, Bjoraker JA, Scanlon
PD. Conditions associated with an abnormal nonspecific pattern of pulmonary
function tests. Chest. 2009; 135(2): 419-24.
25. Mokhlesi B, Masa JF, Brozek
JL, et al. Evaluation and Management of Obesity Hypoventilation Syndrome. An
Official American Thoracic Society Clinical Practice Guideline. Am J Respir Crit Care Med. 2019;
200(3) 6-24.
26. Nowbar S, Burkart
KM, Gonzales R, et al. Obesity-associated hypoventilation in hospitalized
patients: prevalence, effects, and outcome. Am J Med. 2004; 116(1): 1-7.
27. Marik PE, Desai H. Characteristics of
patients with the âmalignant obesity hypoventilation syndromeâ admitted to an
ICU. J Intensive Care Med. 2013; 28(2): 124-30.
28. Borsini E,
Ballestero F, Blasco M et al. SÃndrome de obesidad e hipoventilaciÃģn en terapia
intensiva. Reporte de serie de casos de un Hospital de Comunidad. Rev Am Med Resp. 2014;
4: 494-503.
29. Phillipson EA. Sleep apnea--a major public health problem. N Engl J Med. 1993; 328(17): 1271-3.
30. Leiva S, Larrateguy
L D, Nogueira F et al. Tratamiento con presiÃģn positiva de la Apnea Obstructiva
del SueÃąo. PosiciÃģn de la AsociaciÃģn Argentina de Medicina Respiratoria. Rev Am Med Resp
2019; 19(4): 332-48.
31. Young T, Palta M, Dempsey J, Skatrud J, Weber S, Badr S. The
occurrence of sleep-disordered breathing among middle-aged adults. N Engl J Med. 1993; 328(17): 1230-5.
32. DurÃĄn J, Esnaola
S, Rubio R, Iztueta A. Obstructive sleep
apnea-hypopnea and related clinical features in a population-based sample of
subjects aged 30 to 70 yr. Am J Respir Crit Care Med. 2001; 163(3): 685-9.
33. Senaratna CV, Perret JL, Lodge CJ, et al.
Prevalence of obstructive sleep apnea in the general population: A systematic
review. Sleep Med Rev. 2017; 34: 70-81.
34. Tufik S, Santos-Silva R, Taddei JA, Bittencourt LR.
Obstructive sleep apnea syndrome in the Sao Paulo Epidemiologic Sleep Study.
Sleep Med. 2010; 11(5): 441-6.
35. Benjafield AV, Ayas
NT, Eastwood PR, et al. Estimation of the global prevalence and burden of
obstructive sleep apnoea: a literature-based
analysis. Lancet Respir Med. 2019; 7(8): 687-98.
36. Collop NA, Anderson WM, Boehlecke B, et
al. Clinical guidelines for the use of unattended portable monitors in the diÂagnosis
of obstructive sleep apnea in adult patients. Portable Monitoring Task Force of
the American Academy of Sleep Medicine. J Clin Sleep
Med. 2007; 3(7): 737-47.
37. De Jong A, Verzilli D, Chanques
G, Futier E, Jaber S.
Preoperative risk and perioperative management of obese patients. Rev Mal Respir. 2019; 36(8): 985-1001.
38. Khan A, King WC, Patterson EJ, et al. Assessment of obstructive
sleep apnea in adults undergoing bariatric surgery in the longitudinal
assessment of bariatric surgery-2 (LABS-2) study. J Clin Sleep Med. 2013; 9(1): 21-9.
39. Nogueira F, Nigro
C, Cambursano H, Borsini E,
Silio J, Avila J. GuÃas
prÃĄcticas de diagnÃģstico y tratamiento del sÃndrome de apneas e hipopneas obstructivas del sueÃąo. Medicina (B Aires). 2013;
73(4): 349-62.
40. Flum DR, Belle SH, King WC, et al.
Perioperative safety in the longitudinal assessment of bariatric surgery. N Engl J Med. 2009; 361(5): 445-54.
41. Grunstein RR, StenlÃķf
K, Hedner JA, SjÃķstrÃķm L.
Impact of self-reported sleep-breathing disturbances on psychosocial
performance in the Swedish Obese Subjects (SOS) Study. Sleep. 1995; 18(8):
635-43.
42. Kositanurit W, Muntham
D, Udomsawaengsup S, Chirakalwasan
N. Prevalence and associated factors of obstructive sleep apnea in morbidly
obese patients undergoing bariatric surgery. Sleep Breath. 2018; 22(1): 251-6.
43. Bose S. Obstructive sleep apnea and perioperative complications. Chest. 2008; 134(4): 890-1.
44. Weaver JM. Increased anesthetic risk for patients with obesity and
obstructive sleep apnea. Anesth Prog.
2004; 51(3): 75.
45. Opperer M, Cozowicz
C, Bugada D, et al. Does Obstructive Sleep Apnea
Influence Perioperative Outcome? A Qualitative Systematic Review for the
Society of Anesthesia and Sleep Medicine Task Force on Preoperative Preparation
of Patients with Sleep-Disordered Breathing. Anesth Analg. 2016; 122(5): 1321-34.
46. Chung F, Memtsoudis SG, Ramachandran SK,
et al. Society of Anesthesia and Sleep Medicine Guidelines on Preoperative
Screening and Assessment of Adult Patients With Obstructive
Sleep Apnea. Anesth Analg. 2016; 123(2):
452-73.
47. Puertas Cuesta F.J, Pin Arboledas G,
Santa Maria Cano J, et al. Grupo EspaÃąol de SueÃąo
(GES). Documento consenso espaÃąol sobre el sÃndrome de apneas-hipopneas del sueÃąo. Arch Bronc.2005; 41(4):
1-100.
48. Nimeri A, Al Hadad
M, Khoursheed M, et al. The Peri-operative
Bariatric Surgery Care in the Middle East Region. Obes
Surg. 2017; 27(6): 1543-7.
49. Netzer NC, Stoohs
RA, Netzer CM, Clark K, Strohl
KP. Using the Berlin Questionnaire to identify patients at risk for the sleep
apnea syndrome. Ann Intern Med. 1999; 131(7): 485-91.
50. Franceschini,
C, Rabec, C, RodrÃguez et col. Factores predictivos
de suspensiÃģn de CPAP en el seguimiento de pacientes con cirugÃa bariÃĄtrica durante 2 aÃąos. Rev Am
Med Resp. 2014; 14:
27-21273.
51. Borsini E,
Delgado Viteri C, Reynoso C, Gomez J, et al.
Indicadores de la poligrafÃa respiratoria y su relaciÃģn con los parÃĄmetros
antropomÃĐtricos en obesos evaluados para cirugÃa bariÃĄtrica.
Rev Am Med Resp 2015; 1: 18-27.
52. Chung F, Yegneswaran B, Liao P, et al.
STOP questionnaire: a tool to screen patients for obstructive sleep apnea. AnesÂthesiology.
2008; 108(5): 812-21.
53. Chung F, Subramanyam R, Liao P, Sasaki E,
Shapiro C, Sun Y. High STOP-Bang score indicates a high probability of
obstructive sleep apnoea. Br J Anaesth.
2012; 108(5): 768-75.
54. Borsini E,
Ernst G, Salvado A, et al. Utility of the STOP-BANG components to identify sleep
apnea using home respiratory polygraphy. Sleep Breath. 2015; 19(4):
1327-33.
55. Borsini E,
Salvado A, Bosio M, et al. Utilidad de los
componentes del cuestionario Stop-Bang para
identificar pacientes con apneas del sueÃąo. Rev Am Med Resp. 2014;
4(3): 82-403.
56. Vana KD, Silva GE, Goldberg R. Predictive
abilities of the STOP-Bang and Epworth Sleepiness Scale in identifying sleep
clinic patients at high risk for obstructive sleep apnea. Res Nurs Health. 2013; 36(1): 84-94.
57. Chung F, Yegneswaran B, Liao P, et al.
Validation of the Berlin questionnaire and American Society of
Anesthesiologists checklist as screening tools for obstructive sleep apnea in
surgical patients. Anesthesiology. 2008; 108(5): 822- 30.
58. Glazer SA, Erickson AL, Crosby RD, Kieda J,
Zawisza A, Deitel M. The
Evaluation of Screening Questionnaires for ObstrucÂtive Sleep Apnea to Identify
High-Risk Obese Patients Undergoing Bariatric Surgery. Obes
Surg. 2018; 28(11): 3544-52.
59. Horvath CM, Jossen J, KrÃķll
D, et al. Prevalence and Prediction of Obstructive Sleep Apnea Prior to
Bariatric Surgery- Gender-Specific Performance of Four Sleep Questionnaires. Obes Surg. 2018; 28(9): 2720-6.
60. Ramachandran SK, Josephs LA. A meta-analysis of clinical screening
tests for obstructive sleep apnea. Anesthesiology. 2009; 110(4): 928-39.
61. Abrishami A, Khajehdehi
A, Chung F. A systematic review of screening questionnaires for obstructive
sleep apnea. Can J Anaesth.
2010; 57(5): 423-38.
62. Raveendran R, Wong J, Singh M, Wong DT,
Chung F. Obesity hypoventilation syndrome, sleep apnea, overlap syndrome:
perioperative management to prevent complications. Curr
Opin Anaesthesiol. 2017;
30(1):146-55.
63. Catheline JM, Bihan
H, Le Quang T, et al. Preoperative cardiac and
pulmonary assessment in bariatric surgery. Obes Surg. 2008; 18(3): 271-7.
64. de Raaff
CA, Pierik AS, Coblijn UK,
de Vries N, Bonjer HJ, van Wagensveld BA. Value of routine polysomnography in bariatric surgery. Surg Endosc. 2017; 31(1): 245-8.
65. Masa JF, Mokhlesi B, BenÃtez
I, et al. Long-term clinical effectiveness of continuous positive airway
pressure therapy versus non-invasive ventilation therapy in patients with
obesity hypoventilation syndrome: a multicentre,
open-label, randomised controlled trial. Lancet.
2019; 393(10182): 1721-32.
66. Mechanick JI, Youdim
A, Jones DB. Clinical Practice Guidelines for the perioperative nutritional,
metabolic, and nonsurgical support of the bariatric surgery patient â 2013
update: cosponsored by American Association of Clinical Endocrinologists. The
Obesity Society and American Society for Metabolic and Bariatric Surgery. EndocrPract. 2013; 19: 1-36.
67. Chung F, Liao P, Elsaid H, Shapiro CM,
Kang W. Factors associated with postoperative exacerbation of sleep-disordered
breathÂing. Anesthesiology. 2014; 120 (2): 299.
68. Harraca JL,
Duartez PM, Aguirre Ackermann
M, et al. Consenso intersocietario. CirugÃa BarÃatrica y MetabÃģlica. AAC, SACO, SAC, SAD, SAN y SAP.
[internet].2019. [acceso 1 de diciembre de 2020];1:1-90.
Disponible en: https://www.sac.org.
ar/wp-content/uploads/2019/09/consenso-intersocietario-cirugia-cariatrica-y-metabolica.pdf.
69. Coen PM, Carnero EA, Goodpaster
BH. Exercise and Bariatric Surgery: An Effective Therapeutic Strategy. Exerc Sport Sci Rev. 2018; 46(4):
262-70.
70. Lockhart EM, Willingham MD, Abdallah AB, et al. Obstructive sleep
apnea screening and postoperative mortality in a large surgical cohort. Sleep
Med. 2013; 14(5): 407-15.
71. Angrisani L, Santonicola
A, Iovino P, Formisano G, Buchwald H, Scopinaro N. Bariatric Surgery Worldwide 2013. Obes Surg. 2015; 25(10): 1822-32.
72. Lloberes P, DurÃĄn-Cantolla
J, MartÃnez-GarcÃa MÃ, et al. Diagnosis and treatment
of sleep apnea-hypopnea syndrome. Spanish Society of Pulmonology and Thoracic
Surgery. Arch Bronconeumol. 2011; 47(3): 143-56.
73. TomÃĄs L, Estirado
C, Zorrilla V et al. ReducciÃģn de peso en pacientes obesos con trastornos respiratorios
durante el sueÃąo. Arch Bronconeumol. 1999; 35: 24.
74. Haines KL, Nelson LG, Gonzalez R, et al. Objective evidence that
bariatric surgery improves obesity-related obstructive sleep apnea. Surgery.
2007; 141: 354-8.
75. Fusco M, James S, Cornell C, Okerson T.
Weight loss through adjustable gastric banding and improvement in daytime
sleepiness: 2 year interim results of APEX study. Curr
Med Res Opin. 2014; 30(5): 849-55.
76. Hariri K, Kini SU, Herron DM,
Fernandez-Ranvier G. Resolution of Symptomatic Obstructive Sleep Apnea Not
Impacted by Preoperative Body Mass Index, Choice of Operation Between Sleeve
Gastrectomy and Roux-en-Y Gastric Bypass Surgery, or
Severity. Obes Surg. 2018; 28(5): 1402-7.
77. Busetto L, Dicker D, Azran
C, et al. Obesity Management Task Force of the European Association for the
Study of Obesity Released âPractical Recommendations for the Post-Bariatric
Surgery Medical Managementâ. ObesSurg. 2018;
28(7): 2117-21.
78. Mechanick JI, Apovian
C, Brethauer S, et al. Clinical practice guidelines
for the perioperative nutrition, metabolic, and nonsurgical support of patients
undergoing bariatric procedures - 2019 Update: Cosponsored by American
Association of Clinical Endocrinologists/American College of Endocrinology, the
Obesity Society, American Society for Metabolic & Bariatric Surgery,
Obesity Medicine Association, and American Society of Anesthesiologists -
executive summary. Endocr Pract.
2019; 25(12): 1346-59.
79. de Raaff CAL, Gorter-Stam
MAW, de Vries N, et al. Perioperative management of
obstructive sleep apnea in bariatric surgery: a consensus guideline. Surg Obes Relat Dis. 2017; 13(7): 1095-109. 412 413
ValoraciÃģn Respiratoria en pacientes con
obesidad candidatos a cirugÃa
80. Borsini E,
Blanco M, Reynoso C et al. EvaluaciÃģn respiratoria para cirugÃa bariÃĄtrica. Fronteras en Medicina. 2018; (4): 0207-13.
81. Brock JM, Billeter A, MÞller-Stich BP, Herth F. Obesity and the Lung: What We Know Today.
Respiration. 2020; 99(10): 856-66.
82. Gries CJ, Bhadriraju
S, Edelman JD, Goss CH, Raghu G, Mulligan MS. Obese patients with idiopathic
pulmonary fibrosis have a higher 90-day mortality risk with bilateral lung
transplantation. J Heart Lung Transplant. 2015; 34(2): 241-6.
83. Gross JB, Bachenberg KL, Benumof JL, et al. Practice guidelines for the
perioperative management of patients with obstructive sleep apnea: a report by
the American Society of Anesthesiologists Task Force on Perioperative
Management of patients with obstructive sleep apnea. Anesthesiology. 2006; 104(5): 1081-118.
84. Kaw R, Gali B, Collop NA. Perioperative
care of patients with obstructive sleep apnea. Curr
Treat Options Neurol. 2011; 13(5): 496-507.
85. Aceto P, Perilli
V, Modesti C, Ciocchetti P,
Vitale F, Sollazzi L. Airway management in obese
patients. Surg Obes Relat Dis. 2013; 9(5): 809-15.
86. Hennis PJ, Meale
PM, Hurst RA, et al. Cardiopulmonary exercise testing predicts postoperative
outcome in patients undergoing gastric bypass surgery. Br J Anaesth. 2012;
109(4): 566-71.
87. Telem DA,
Jones DB, Schauer PR, et al. Updated panel report:
best practices for the surgical treatment of obesity. Surg Endosc. 2018; 32(10): 4158-64.
88. DâAnza B, Knight J, Greene JS. Does body
mass index predict tracheal airway size?.
Laryngoscope. 2015; 125(5): 1093-7.
89. Neligan PJ. Metabolic syndrome: anesthesia
for morbid obesity. Curr Opin
Anaesthesiol. 2010; 23(3): 375-83.
90. Dakin J, Margarson M. Sleep-disordered
breathing and anaesthesia in the morbidly obese.
Current Anaesthesia and CritiÂcal Care.2010; 21(1):
24-30.
91. Memtsoudis SG, Cozowicz
C, Nagappa M, et al. Society of Anesthesia and Sleep
Medicine Guideline on Intraoperative Management of Adult Patients With Obstructive Sleep Apnea. Anesth
Analg. 2018; 127(4): 967-87.
92. Ehsan Z, Mahmoud M, Shott SR, Amin RS, Ishman SL. The effects of anesthesia and opioids on the
upper airway: A systematic review. Laryngoscope. 2016; 126(1): 270-84.
93. Lam T, Singh M, Yadollahi A, Chung F. Is
Perioperative Fluid and Salt Balance a Contributing Factor in Postoperative
Worsening of Obstructive Sleep Apnea?. Anesth Analg. 2016; 122(5):
1335-39.
94. Eichenberger A, Proietti
S, Wicky S, et al. Morbid obesity and postoperative
pulmonary atelectasis: an underestimated problem. Anesth
Analg. 2002; 95(6): 1788-92.
95. Weinberg L, Tay S, Lai CF, Barnes M.
Perioperative risk stratification for a patient with severe obstructive sleep apnoea undergoing laparoscopic banding surgery. BMJ Case
Rep. 2013;2013:bcr2012008336.
96. Gallagher SF, Haines KL, Osterlund LG,
Mullen M, Downs JB. Postoperative hypoxemia: common, undetected, and unÂsuspected
after bariatric surgery. J Surg Res. 2010; 159(2):
622-6.
97. Goucham AB, Coblijn
UK, Hart-Sweet HB, de Vries N, Lagarde
SM, van Wagensveld BA. Routine Postoperative MoniÂtoring
after Bariatric Surgery in Morbidly Obese Patients with Severe Obstructive
Sleep Apnea: ICU Admission is not Necessary. Obes Surg. 2016; 26(4): 737-42.
98. Torres A, Ferrer M, Blanquer JB, et al. Unidades de cuidados respiratorios
intermedios. DefiniciÃģn y caracterÃsticas
[InÂtermediate respiratory intensive care units: definitions and
characteristics]. Arch Bronconeumol. 2005;
41(9): 505-12.
99. Heili-Frades
S, Carballosa de Miguel MDP, Naya Prieto A, et al. Cost and Mortality
Analysis of an Intermediate RespiraÂtory Care Unit. Is It Really Efficient and
Safe? Arch Bronconeumol. 2019; 55(12): 634-41.
100. Plate JDJ, Leenen LPH, Houwert M, Hietbrink F. Utilisation of Intermediate Care Units: A Systematic
Review. Crit Care Res Pract.
2017;2017:8038460.
101. American Society of Anesthesiologists Task Force on Perioperative
Management of patients with obstructive sleep apnea. Practice guidelines for
the perioperative management of patients with obstructive sleep apnea: an
updated report by the American Society of Anesthesiologists Task Force on
Perioperative Management of patients with obstructive sleep apnea. Anesthesiology.
2014; 120(2): 268-86.
102. Broadbent E, Kahokehr A, Booth RJ, et al.
A brief relaxation intervention reduces stress and improves surgical wound
healing response: a randomised trial. Brain Behav Immun. 2012; 26(2): 212-17.
103. Sasaki N, Meyer MJ, Eikermann M.
Postoperative respiratory muscle dysfunction: pathophysiology and preventive
strateÂgies. Anesthesiology. 2013; 118(4): 961-78.
104. Roesslein M, Chung F. Obstructive sleep apnoea in adults: peri-operative
considerations: A narrative review. Eur J AnaesÂthesiol. 2018; 35(4): 245-55.
105. Raveendran R, Chung F. Perioperative
consideration of obstructive sleep apnea in ambulatory surgery. Anesthesiol Clin. 2014; 32(2):
321-8.
106. Tamisier R, Fabre F, OâDonoghue
F, LÃĐvy P, Payen JF, PÃĐpin JL. Anesthesia and sleep apnea. Sleep Med Rev. 2018;
40: 79-92.
107. Jaber S, De Jong A, Castagnoli A, Futier E, Chanques G.
Non-invasive ventilation after surgery. Ann Fr Anesth
Reanim. 2014; 33(7-8): 487-91.
108. Tabone LE. Comment on: Noninvasive
positive pressure ventilation in the immediate post-bariatric surgery care of
patients with obstructive sleep apnea: a systematic review. Surg
Obes Relat Dis. 2017;
13(7): 1233-35.
109. Tong S, Gower J, Morgan A, Gadbois K, Wisbach G. Noninvasive positive pressure ventilation in the
immediate post-bariatric surgery care of patients with obstructive sleep apnea:
a systematic review. Surg Obes Relat Dis. 2017; 13(7): 1227-33.
110. Weingarten TN, Kendrick ML, Swain JM, et al. Effects of CPAP on
gastric pouch pressure after bariatric surgery. Obes Surg. 2011; 21(12): 1900-5.
111. Buchwald
H, Avidor Y, Braunwald E,
et al. Bariatric
surgery: a systematic review and meta-analysis [published correction appears in
JAMA. 2005; 293(14): 1728]. JAMA. 2004; 292(14): 1724-37.
112. Sillo TO, Lloyd-Owen S, White E, et al.
The impact of bariatric surgery on the resolution of obstructive sleep apnoea. BMC Res Notes. 2018;
11(1): 385.
113. De Raaff
CA, Coblijn UK, Ravesloot
MJ, de Vries N, de Lange-de
Klerk ES, van Wagensveld
BA. Persistent
moderate or severe obstructive sleep apnea after laparoscopic Roux-en-Y gastric bypass: which patients? Surg
Obes Relat Dis. 2016(10):
1866-72.
114. Sugerman HJ, Baron PL, Fairman RP, Evans
CR, Vetrovec GW. Hemodynamic dysfunction in obesity
hypoventilation syndrome and the effects of treatment with surgically induced
weight loss. Ann Surg. 1988; 207(5): 604-13.
115. Sugerman HJ, Fairman RP, Sood RK, Engle K, Wolfe L, Kellum
JM. Long-term effects of gastric surgery for treating respiratory insufficiency
of obesity. Am J Clin Nutr.
1992; 55(2): 597-601.
116. Marik PE. The malignant obesity
hypoventilation syndrome (MOHS). Obes Rev. 2012;
13(10): 902-9.
117. Mokhlesi B, Tulaimat
A. Recent advances in obesity hypoventilation syndrome. Chest. 2007; 132(4):
1322-36.
118. Magne F, Gomez E, Marchal
O, et al. Evolution and Predictive Factors of Improvement of Obstructive Sleep
Apnea in an Obese Population After Bariatric Surgery. J Clin
Sleep Med. 2019; 15(10): 1509-16.
119. Ravesloot MJ, Hilgevoord
AA, van Wagensveld BA, de Vries
N. Assessment of the effect of bariatric surgery on obstructive sleep apnea at
two postoperative intervals. ObesSurg. 2014;
24(1): 22-31.
120. de Raaff
CAL, de Vries N, van Wagensveld
BA. Obstructive sleep
apnea and bariatric surgical guidelines: summary and update. Curr Opin Anaesthesiol.
2018; 31(1): 104-9.
121. Amin R, Simakajornboon N, Szczesniak R, Inge T. Early
improvement in obstructive sleep apnea and increase in orexin levels after
bariatric surgery in adolescents and young adults. Surg
Obes Relat Dis. 2017;
13(1): 95-100.
122. Giles TL, Lasserson TJ, Smith BJ, White
J, Wright J, Cates CJ. Continuous positive airways pressure for obstructive
sleep apnoea in adults. Cochrane Database Syst Rev. 2006; (1): CD001106.
123. Giles TL, Lasserson TJ, Smith BH, White
J, Wright J, Cates CJ. Continuous positive airways pressure for obstructive
sleep apnoea in adults. Cochrane Database Syst Rev. 2006;(3):CD001106.
124. Greenburg DL, Lettieri CJ, Eliasson AH. Effects of surgical weight loss on measures of
obstructive sleep apnea: a meta-analysis. Am J Med. 2009; 122(6): 535-42.
125. de Raaff CA, Bindt
DM, de Vries N, van Wagensveld
BA. Positional obstructive sleep apnea in bariatric surgery patients: risk
factor for postoperative cardiopulmonary complications? Sleep Breath. 2016;
20(1): 113-9.
126. Guralnick AS, Pant M, Minhaj
M, Sweitzer BJ, Mokhlesi B.
CPAP adherence in patients with newly diagnosed obstructive sleep apnea prior
to elective surgery. J Clin Sleep Med. 2012; 8(5): 501-6.
127. Nogueira JF, Borsini
E, Nigro C. Estrategias para mejorar la adaptaciÃģn al
tratamiento con CPAP en pacientes con SAHOS. Rev Am Med Resp. 2016; 4: 365-77.