Autor Dr. Juan Antonio Mazzei1; Dr. Carlos Gustavo Di Bartolo2
1 Academia Nacional de Medicina de Buenos Aires, Argentina 2 Instituto Argentino de DiagnĂłstico y Tratamiento, Buenos Aires, Argentina
Correspondencia : Juan Antonio Mazzei - E-mail: consultoriomazzei@fibertel.com.ar
Resumen
La evaluación del riesgo quirúrgico pulmonar es obligatoria antes de considerar el tratamiento quirúrgico de los estadíos iniciales del cáncer del pulmón.
La espirometría y la capacidad de difusión expresadas en porcentaje del valor teórico y del valor predicho posoperatorio son las pruebas iniciales para realizar la evaluación.
En virtud de la pandemia COVID-19 se han establecido normas de bioseguridad y prevención para la realización de dichas pruebas.
Aquellos pacientes que no reúnan condiciones para la cirugía de acuerdo a los valores preestablecidos deben realizar pruebas adicionales antes de ser descartados para el tratamiento quirúrgico.
La prueba de la escalera puede constituirse en un instrumento útil para ese fin dada la falta de disponibilidad de la prueba de ejercicio cardiopulmonar por su contraindicación en las actuales circunstancias de la pandemia COVID-19 y la escasez de equipos para su realización en nuestro medio.
Palabras clave: COVID-19; Cirugía torácica; Cancer del pulmón; Prueba de función pulmonar.
Abstract
The assessment of the preoperative pulmonary risk is compulsory before considering the surgical treatment of early stage lung cancer.
The spirometry and diffusion capacity expressed in percentages of the theoretical and predicted postoperative values are the initial tests necessary to carry out the assessment.
Taking into account the COVID-19 pandemic, some biosafety and prevention rules have been established for doing such tests.
Patients who do not meet certain conditions for surgery in accordance with previously established values shall do additional tests before disregarding surgical treatment.
The Step Test may be a useful tool for that purpose, since the cardiopulmonary exercise test is unavailable, given its contraindication under the current circumstances of the COVID-19 pandemic and the shortage of equipment for doing it.
Key words: COVID-19; Thoracic Surgery; Lung cancer; Lung function test.
Introducción
Actualmente el cáncer del pulmón es la causa principal de muerte por cáncer en todo el mundo.
En la Argentina en el año 2018 fue responsable de 9273 muertes, discriminadas en 6124 hombres y 3149 mujeres, siendo también la principal causa de muerte por cáncer1.
La cirugía se considera el tratamiento óptimo para pacientes con estadios iniciales2, sin embargo, la cirugía de resección del cáncer es habitualmente una intervención mayor que puede tener morbilidad significativa3. La valoración del riesgo pulmonar de los candidatos a la cirugía es fundamental a la hora de plantear la conducta quirúrgica. Diferentes sociedades han establecido guías para dicha evaluación, entre otras American College of Chest Physicians4, European Respiratory Society y European Society of Thoracic Surgeon5 y British Thoracic Society6.
En virtud de la pandemia se han dejado de atender muchas diferentes al COVID-19, lo que ha retrasado la atención de importantes entidades no infecciosas como la realización del tratamiento quirúrgico del cáncer del pulmón.
El objetivo de este artículo es actualizar la valoración del riesgo quirúrgico pulmonar en la cirugía del cáncer de pulmón en las actuales circunstancias de la pandemia de COVID 19, en que se han establecido normas de bioseguridad y prevención para la realización de las pruebas de función pulmonar.
Evaluación pulmonar prequirúrgica
Antes de una cirugía de pulmón todos los pacientes deben realizar estudios funcionales con el objetivo de determinar el riesgo de complicaciones y valorar la capacidad pulmonar posoperatoria.
A lo largo de los años se propusieron múltiples modalidades para este fin. Actualmente las pruebas iniciales son la espirometría y la capacidad de difusión de monóxido de carbono (DLCO)5.
Otras pruebas, como la medición de gases en sangre, la máxima ventilación voluntaria, la medición de volúmenes pulmonares por pletismografía o por dilución son de menor importancia7.
Espirometría
Bioseguridad y prevención de infecciones cruzadas
La espiración forzada durante la realización de la espirometría genera la aerosolización de secreciones respiratorias en forma de micropartículas con un tamaño de hasta 20 μm8 en el ambiente cercano al paciente. Mientras las partículas más grandes pueden ser expelidas hasta 2 metros, las más pequeñas (menores a 5 μm) pueden quedar suspendidas temporariamente en el aire especialmente cuando la ventilación del local donde se realiza la prueba es inadecuada. Durante las maniobras respiratorias forzadas realizadas con la espirometría pueden generarse flujos espiratorios superiores a 700 L/min, lo cual produce potencialmente una elevada diseminación de secreciones respiratorias en forma de microgotas. Este fenómeno puede ser más acentuado con la tos y durante la ejecución de maniobras caracterizadas por un aumento sostenido de la ventilación9. Al considerar la realización de estudios de función respiratoria durante la epidemia COVID-19 deben indicarse aquellos estudios que provean la información más útil y específica para el caso que se explora, y que al mismo tiempo sean los exámenes más sencillos y breves con la menor aerosolización posible de secreciones respiratorias.
La espirometría y la medición de la transferencia de CO por respiración única (DLCO-SB) son exámenes considerados útiles y sencillos, que se pueden realizar con las medidas de precaución adecuadas para evitar la diseminación viral, preferentemente en el período de estabilidad de la epidemia o de descenso del número de casos locales.
A fin de reducir el riesgo de diseminación del SARS CoV-2, se aconseja que:
1. Los estudios deben llevarse a cabo asignando turnos espaciados, estimando un tiempo mínimo de 30 minutos desde la finalización del estudio previo hasta el inicio del siguiente para realizar el acondicionamiento e higiene del laboratorio pulmonar. La adecuada ventilación y renovación del aire de la sala de espera y del local del estudio son importantes para reducir la permanencia de partículas infectantes en el ambiente10, 11. La sala de procedimientos debe estar ventilada mediante ventanas o ventilación forzada de aire hacia el exterior.
2. Al ingresar al laboratorio, el paciente debe higienizarse las manos con alcohol en gel. Existe evidencia de emisión aerógena de partículas por hablar y respirar normalmente11. El uso de barbijo o tapabocas en forma permanente puede contribuir a minimizar esta aerosolización. El operador y el paciente son los únicos que deben permanecer en el local, a menos que sea imprescindible la presencia de un
acompañante. El paciente y su eventual acompañante deben estar en todo momento con el barbijo colocado, retirándolo sólo para hacer las maniobras.
3. Las maniobras necesarias para realizar las pruebas funcionales pueden diseminar al ambiente una gran cantidad de partículas virales infectantes8, por lo que es recomendable el empleo de filtros antimicrobianos /antivirales para contenerlas12-14. El filtro debe estar diseñado específicamente para pruebas de función pulmonar, y de un solo uso por paciente y por estudio15. El operador debe controlar la correcta oclusión labial sobre la interfaz con el filtro a fin de minimizar la posibilidad de fugas aéreas durante las maniobras.
4. El operador debe utilizar los equipos de protección personal (EPP) recomendados para el contacto físico con un paciente sospechoso de COVID19 de acuerdo con las normas de las autoridades sanitarias16, 17.Los EPP habitualmente recomendados incluyen el (uso de) barbijo N95 y barbijo quirúrgico por sobre el anterior para prolongar su durabilidad, protección ocular o facial, camisolín, guantes, cofia y botas descartables.
5. Durante la administración de broncodilatadores inhalados y en el lapso de espera entre la fase pre y la fase post-broncodilatador, el operador debe permanecer con los EPP colocados. No es conveniente la salida del paciente a la sala de espera entre las fases del estudio. No se recomienda intercalar pacientes entre las fases de la prueba broncodilatadora.
6. Finalizado el estudio, se debe proceder a la limpieza del área de trabajo y de toda superficie que pueda haber tomado contacto con el operador o el paciente. Esta limpieza puede ser realizada por el propio operador o por personal de limpieza dedicado, mediante el uso de soluciones de hipoclorito de sodio, de etanol al 70% o de amonio cuaternario.
Espirometría en la evaluación prequirúrgica
Existe una relación inversa entre el volumen espiratorio forzado en el primer segundo (FEV1) y la morbilidad y mortalidad posoperatoria18-21. Durante mucho tiempo se propusieron valores absolutos de esta medición, pero esta modalidad ha sido abandonada, ya que el mismo depende de la talla, edad y sexo.
Hasta la década del ‘90 se consideraba que 2 litros era un valor aceptable para una neumonectomía y 1 a 1,5 litros para una lobectomía6.
En esa época los pacientes con dichos valores no necesitaban una evaluación más completa.
Algunos años antes, estudios realizados en nuestro país mostraron que aquellos pacientes que presentaban un FEV1 % > a 60% del teórico podían ser sometidos a cirugía sin riesgo respiratorio adicional22.
Actualmente los valores hallados deben ser expresados en porcentaje del valor predicho y se toma un valor de corte de 80% del valor predicho, como índice de menor morbilidad y mortalidad posoperatoria.
Capacidad de difusión de monóxido de carbono (DLCO)
Bioseguridad y prevención de infecciones cruzadas
En general, se aplican los mismos procedimientos que rigen para la realización de las espirometrías.
1. Debe asegurarse que el paciente no presente síntomas sugestivos de infección por COVID19 el día del estudio. Cualquier sintomatología respiratoria de reciente aparición se presupone asociada a COVID19 (excepto cuando hay prueba reciente de PCR negativa documentada).
2. El personal técnico debe llevar equipo de protección personal completo.
3. El paciente debe permanecer con el barbijo colocado durante su estadía en el laboratorio pulmonar y sólo debe retirarlo durante el momento de realizar la prueba.
4. Sólo debe realizarse la prueba de determinación de la DLCO si se utilizan filtros antibacterianos/ antivirales.
5. Se recomienda el método de determinación mediante respiración única (DLCO-SB).
6. Las boquillas, clips nasales y adaptadores no desechables deben descontaminarse mediante procedimientos seguros aprobados por el Comité Institucional de Control de Infecciones.
7. Concluida la prueba se deben limpiar todas las superficies que hayan estado en contacto con el paciente o en la trayectoria del aire espirado.
8. También es necesario limpiar (también) aquellas superficies que el personal técnico haya tocado durante la prueba, ya que a menudo durante su transcurso se tiene contacto con el paciente ayudándole con la colocación de la boquilla, así como en la colocación de las pinzas nasales.
Capacidad de difusión de monóxido de carbono en la evaluación pre quirúrgica
Esta prueba se incorporó más recientemente para estadificar el riesgo posoperatorio del cáncer del pulmón23-25.
Inicialmente se asociaron valores por debajo del 60% del predicho a una mortalidad de hasta el 25%4, 23, 26-30.
Actualmente se considera que un valor ≥ 80% del valor teórico se asocia a bajo riesgo para la cirugía23-25.
Estimación de la función pulmonar predicha posoperatoria
Otra metodología para la evaluación del riesgo para la cirugía consiste en estimar el valor predictivo postoperatorio (ppo) mediante diferentes metodologías. Las mismas que se aplican no solo para el FEV1 sino también para el cálculo de del valor predictivo posoperatorio (ppo) de la DLCO y del O2max (Consumo de Oxígeno Máximo).
Se considera que un ppo FEV1 > 60% y una ppo DLCO > 60% tienen bajo riesgo para la cirugía4.
Existen tres metodologías para el cálculo del valor predicho postoperatorio:
1. Cálculo aritmético de la contribución de cada segmento resecado.
2. Cálculo a partir del centellograma pulmonar preoperatorio.
3. Cálculo a partir de la tomografía computada de tórax con medición de volúmenes pulmonares y lóbulos pulmonares mediante un programa dedicado.
1 - Cálculo aritmético
Se basa en la asunción de que se resecarán segmentos pulmonares no funcionantes u obstruidos y segmentos pulmonares funcionantes.
Estas técnicas pueden subestimar el valor posoperatorio real.
Las siguientes ecuaciones deberían utilizarse para calcular los valores posoperatorios previstos para FEV1, DLCO y también para el O2max.
• T es el número total de segmentos funcionantes antes de la operación.
• R es el número residual de segmentos funcionantes después de la operación.
• a es el número de segmentos no obstruidos que se van a resecar.
• b es el número total de segmentos no obstruidos.
Se considera que en conjunto los pulmones tienen 19 segmentos. La fórmula sería la siguiente:
19 - número de segmentos obstruidos (estimados por técnicas de imagen y/o broncoscopia) = T
T - número de segmentos en funcionamiento a resecar = R
valores ppo = (valor preoperatorio/T) × R
Por ejemplo: En el caso de un cáncer en el lóbulo superior derecho donde existen 3 segmentos, si uno de ellos está obstruido (no contribuye al valor obtenido en la prueba) y dos van a ser resecados porque se realizará una lobectomía superior derecha. Suponiendo un valor preoperatorio medido del FEV1 de 80 las fórmulas quedarían de la siguiente manera:
19 - 1 = T = 18
18 - 2 = R = 16
valores ppo = (80/18) × 16 = 71,1
O, expresado en otra forma, FEV1 ppo antes de la lobectomía:
FEV1ppo = FEV1preoperatorio x (1 - a/b)
Siguiendo el mismo ejemplo
FEV1 ppo = 80 × (1 - 2/16) = 70
2 - Cálculo a partir del centellograma pulmonar preoperatorio
Esta técnica tiene una correlación variable con los resultados posoperatorios, con un valor entre r = 0,67 a r = 0,95, aunque es mucho más exacta en el caso de practicarse una neumonectomía, ya que permite valorar la función individual de cada uno de los pulmones.
Cuando se solicita para lobectomía se debe pedir la valoración de los tercios superiores, medio e inferior de cada pulmón por separado
FEV1 ppo antes de la lobectomía:
FEV1 ppo = FEV1 preoperatorio × (1 - a/b)
FEV1 ppo antes de la neumonectomía:
FEV1 ppo = FEV1 preoperatorio × (1 - fracción de perfusión total para el pulmón a resecar)
DLCO ppo antes de la lobectomía:
DLCO ppo = DLCO preoperatoria × (1 - a/b)
DLCO ppo antes de la neumonectomía:
DLCO ppo = DLCO preoperatoria × (1 - fracción de perfusión total para el pulmón a resecar)
VO2max ppo antes de la lobectomía:
VO2max ppo = O2max preoperatorio × (1 - a/b)
VO2max ppo antes de la neumonectomía:
VO2max ppo = O2max preoperatorio × (1 - fracción de perfusión total para el pulmón a resecar)
3 - Cálculo a partir de la tomografía computada de tórax con medición del volumen pulmonar total, el de cada pulmón por separado y el de cada uno de los lóbulos por separado mediante un programa dedicado
Utiliza para ello un software dedicado que se aplica una vez realizada una tomografía computada convencional, por ejemplo soft Veolicity Philips.
En la Figura 1 se observa un ejemplo de esta forma de valoración.
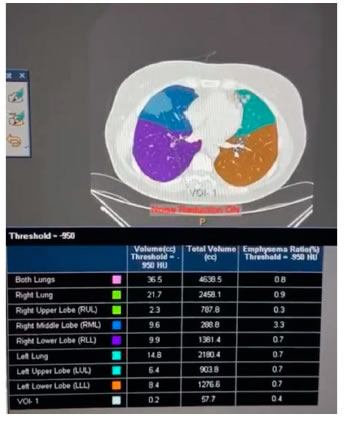
En los últimos años se han propuesto técnicas de diagnóstico por imágenes para predecir la función pulmonar posoperatoria además de la Tomografía Computada tomografía computarizada (TC): resonancia magnética (RM), tomografía computarizada por emisión de fotón único (SPECT) o una combinación de estas.
Criterios actuales de bajo riesgo para la cirugía
Si el FEV1 y DLCO son mayores del 80% del valor teórico, y si el FEV1 ppo % y el DLCO ppo % son mayores de 60% se considera que el riesgo quirúrgico es bajo.
Sin embargo algunos autores consideran como valor de corte un FEV1 y una DLCO mayores del 60% y un FEV1 ppo % y una DLCO ppo % mayor del 40% para predecir baja posibilidad de complicaciones quirúrgicas31.
Si el FEV1% y/o la DLCO% son menores del 80% y el FEV1 ppo y DLCO ppo son menores del 60% se considera que es necesaria la realización de pruebas adicionales: prueba de la escalera o un Shuttle test o una prueba de ejercicio cardiopulmonar.
La prueba de ejercicio cardiopulmonar está disponible en pocos centros en la Argentina y en la actual pandemia de COVID19 está contraindicada por la aerosolización de las secreciones durante su realización.
.
.
.
.
Prueba de la Escalera
Bioseguridad y prevención de infecciones cruzadas
1. El médico que acompañe al paciente debe llevar equipo de protección personal completo.
2. El paciente debe permanecer con el barbijo colocado durante toda la realización de la prueba.
3. Concluida la prueba se deben limpiar todas las superficies que hayan estado en contacto con el paciente.
4. También es necesario limpiar aquellas superficies que el personal técnico haya tocado durante la prueba, ya que a menudo en el transcurso de la misma se tiene contacto con el paciente ayudándole en la colocación del barbijo.
5. El paciente debe permanecer con el barbijo colocado durante su estadía en el laboratorio pulmonar.
Prueba de la escalera en la evaluación pre quirúrgica
La prueba ha sido estandarizada de la siguiente manera32:
Los pacientes deben subir una escalera a su propio ritmo y ascender elmáximo número de escalones, deteniéndose solo por agotamiento, disnea limitante, fatiga de las piernas o dolor de pecho.
A los efectos de la realización de la prueba, se debe investigar la existencia de enfermedad cardíaca concomitante que se definirá de la siguiente manera:
• cirugía cardíaca previa.
• infarto de miocardio previo.
• historia de enfermedad arterial coronaria.
• tratamiento actual para hipertensión.
• arritmia.
• insuficiencia cardíaca.
Todos pacientes con una enfermedad cardíaca serán evaluados por un cardiólogo antes de realizar el test de la escalera y sólo podrán realizarlo si se hallan compensados hemodinámicamente.
Para la realización de esta prueba, el paciente debe estar siempre acompañado por un médico y alentado para continuarla. Además, debe haber una interacción verbal continua entre el paciente y el médico para la evaluación de la disnea y la aparición de otros síntomas.
Durante el ejercicio se monitorea la frecuencia cardíaca y la saturometria de pulso con un oxímetro portátil.
Se registrará el número de escalones subidos y el tiempo necesario para completar la prueba. Se calcularán las siguientes variables ergométricas, que se van a utilizar para el análisis del trabajo realizado:
• Distancia recorrida: alzada del escalón en metros × pasos.
Otras mediciones y cálculos no están validadas, ellas incluyen:
• Consumo máximo de oxígeno (O2max) estimado en mililitros por minuto (5,8x peso en kilogramos +151 + 10,1 × trabajo).
• O2max / kg de peso (O2max estimado dividido kg de peso) expresado en ml/kg/min.
• O2max corregido para el área de superficie corporal en mililitros por minuto al cuadrado.
• Pulso de oxígeno (O2max dividido por frecuencia cardíaca [FC]).
• FC máxima prevista se estimará mediante la siguiente fórmula: 220 - edad en años.
• Trabajo (alzada del escalón en metros × pasos por minuto × peso corporal en kilogramos × 0,1635).
• Reserva de FC en porcentaje mediante la siguiente ecuación: (FC máxima prevista - FC máxima real).
• Reserva de FC en porcentaje mediante la siguiente ecuación: (FC máxima prevista - FC máxima real) FC máxima prevista × 100./
La prueba se terminará en caso de completar más de 22 metros, o cuando el paciente manifieste agotamiento o incapacidad de continuarla o precordialgia o desaturación por debajo del 85%.
Desde el punto de vista práctico, si se tiene en cuenta que la alzada promedio de los escalones no excede los 18 cm, y cada tramo de escalera tiene aproximadamente 20 escalones, los pacientes deberían subir 6 pisos de escalera para recorres 22 metros.
Los pacientes que realicen la prueba de la escalera deberían firmar un consentimiento informado, cuyo formulario figura en el Anexo.
La mayoría de las guías recomiendan que si el paciente no logra alcanzar los 22 metros en la prueba de la escalera, se debe realizar una Prueba de Ejercicio Cardiopulmonar con medición del O2max.
Debido a las circunstancias actuales ocasionadas por la pandemia, en este momento no se realizan dichas pruebas.
En estas circunstancias existen tres posibilidades:
1. Realizar rehabilitación respiratoria preoperatoria, que de acuerdo a los trabajos de Weinstein33 y Bobbio34 puede resultar en un aumento del O2max.
Una vez concluida la Rehabilitación se reevaluará nuevamente al paciente con la realización de una nueva espirometría y DLCO y, si estuviere indicado, la repetición de la prueba de la escalera.
2. Realizar una reunión multidisciplinaria entre neumonólogos, cirujanos y oncólogos y evaluar los riesgos y beneficios de la cirugía en un paciente de alto riesgo de complicaciones post operatoria6.
3. Realizar una resección limitada, o bien radioterapia corporal estereotáxica (SBRT) o bien quimioterapia.
Los conceptos desarrollados hasta aquí se resumen en el Algoritmo de la Figura 2.
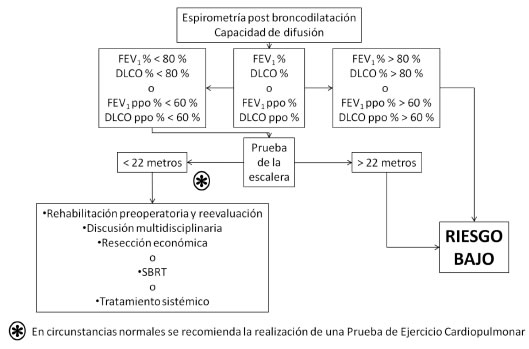
FEV1: Volumen espiratorio forzado en el primer segundo - FEV1 ppo: Volumen espiratorio forzado en el primer segundo pos operatorio predicho - DLCO: Capacidad de difusión de monóxido de carbono – DLCO ppo: Capacidad de difusión de monóxido de carbono pos operatoria predicha.
Conclusiones
La cirugía es el tratamiento óptimo para pacientes con cáncer del pulmón en estadios iniciales. La valoración del riesgo pulmonar de los candidatos a cirugía debe realizarse en todos antes de operarse.
Los estudios iniciales son la espirometría post broncodilatadores y la capacidad de difusión de monóxido de carbono.
Además de los valores expresados en porcentaje del teórico, se recomienda la estimación de la función pulmonar predicha posoperatoria.
Existen recomendaciones de bioseguridad y prevención de infecciones cruzadas para la realización de la espirometría y de la capacidad de difusión de CO.
Para la determinación de la estimación pulmonar predicha posoperatoria se pueden utilizar cálculos aritméticos de los segmentos no funcionantes y que se resecarán o el cálculo a partir de centellogramas pulmonares cuantitativos o bien a partir de tomografía computada de tórax con cálculos volumétricos.
Los valores de corte para bajo riesgo son FEV1 y DLCO mayores del 80% del valor teórico o un FEV1 ppo % y DLCO ppo % mayores del 60%.
Si los valores hallados son menores se recomienda la realización de pruebas complementarias.
La prueba de la escalera es un instrumento útil en estas circunstancias.
En pacientes que no puedan recorrer 22 metros se plantean diferentes estrategias a fin de evaluar las posibilidades terapéuticas.
Conflicto de intereses
El Dr. Juan Antonio Mazzei ha viajado a Congresos durante el año 2019 financiado por los laboratorios Bagó y Tuteur
El Dr. Carlos Gustavo Di Bartolo no posee conflictos de intereses
1. Ministerio de Salud - Secretaría de Acceso a la Salud. Estadísticas Vitales - Información básica - Argentina - Año 2018. [Online]. C.A.Buenos Aires: Subsecretaría de Medicamentos e Información Estratégica; 2019 [cited 2020 SEP 5. Available from: http://www.deis.msal.gov.ar/wp-content/uploads/2020/01/Serie5Nro62.pdf.
2. Howington JA, Blum MG, Chang AC, Balekian AA, Murthy SC. Treatment of Stage I and II Non-small Cell Lung Cancer. Diagnosis and Management of Lung Cancer, 2rd ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2013; 143(5): e278S-e313S.
3. Le Leyn P, Decker G. Surgical treatment of non-small cell lung cancer. Rev Mal Respir. 2004; 21(5 Pt 1): 971-82.
4. Brunelli A, Kim AW, Berger KI, Addrizzo-Harris DJ. Physiologic Evaluation of the Patient With Lung Cancer Being Considered for Resectional Surgery. Diagnosis and Management of Lung Cancer, 3rd ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. 2013; 143(5 (Suppl)): p. e166S-e190S.
5. Brunelli A, Charloux A, Bolliger CT, et al. ERS/ESTS clinical guidelines on fitness for radical therapy in lung cancer patients (surgery and chemo-radiotherapy). Eur Respir J. 2009; 34(1): 17-41.
6. British Thoracic Society, Society of Cardiothoracic Surgeons of Great Britain and Ireland Working Party. BTS Guidelines: Guidelines on the selection of patients with lung cancer for surgery. Thorax. 2001; 56(2): 89-108.
7. Weinberger SE. UpToDate. [Online].; 2020 [cited 2020 Aug 24. Available from: https://www.uptodate.com.
8. Tellier R. Aerosol transmission of influenza A virus: a review of new studies. J R Soc Interface. 2009; Suppl 6: S783-S790.
9. Kendrick AH, Johns DP, Leeming JP. Infection control of lung function equipment: a practical approach. Resp Med. 2003; 97(11): 1163-79.
10. Bourouiba L, Hu DL, Levy R. Surface-Tension Phenomena in Organismal Biology: An introduction to the symposium. Integr Comp Biol. 2014; 54(6): 955-8.
11. Bourouiba L. Turbulent Gas Clouds and Respiratory Pathogen Emissions: Potential Implications for Reducing Transmission of COVID-19. JAMA. 2020; 323(18): 1837-8.
12. Hazaleus RE, Cole J, Berdischewsky M. Tuberculin skin test conversion from exposure to contaminated pulmonary function testing apparatus. Respir Care. 1981; 26(1): 53-5.
13. Gough J, McGhie D, Anderson EC, et al. Cross-infection by non-encapsulated Haemophilus influenzae. The Lancet. 1990; 336(8708): p. 159-60.
14. Zhang Y. High justification for universal stringent precautions in lung function testing. Respir Med. 2005; 99(8): 1064-6.
15. Arce SC, Baldasaria RA, Brea Folco JC, Rodriguez Moncalvo JJ. Bioseguridad y prevención de infecciones cruzadas durante la ealización de estudios de función pulmonar. Rev Am Med Resp. 2020 May; Suplemento Especial COVID-19: 25-31.
16. Ministerio de Salud - Jefatura de Gobierno de la Ciudad de Buenos Aires. Recomendaciones para el uso de los equipos de protección personal (EPP) en el manejo del paciente sospechoso de infección por COVID 19. [Online].; 2020 [cited 2020 SEP 5. Available from: https://www.buenosaires.gob.ar/sites/gcaba/files/protocolo_equipos_de_proteccion_personalv5.pdf.
17. Ministerio de Salud de la Nación. Recomendaciones para el uso de los EPP. [Online].; 2020 [cited 2020 SEP 5. Available from: https://www.argentina.gob.ar/salud/coronavirus-COVID-19/recomendaciones-uso-epp.
18. Boushy S, Billig D, North L, Helgason A. Clinical course related to preoperative and postoperative pulmonary function in patients with bronchogenic carcinoma. Chest. 1971; 59(4): 383-91.
19. Keagy BA, Lores ME, Starek PJ, Murray GF, Lucas CL, Wilcox BR. Elective Pulmonaw Lobectomv: Factors Associatedhh Morbidity and Operative Mortality. The Annals of Thoracic Surgery. 1985; 40(4): 349-52.
20. Miller J, Grossman G, Hatcher C. Pulmonary function test criteria for operability and pulmonary resection. Surg Gynecol Obstet. 1981; 153(6): 893-5.
21. Olsen GN, Block A, Swenson EW, Castle JR, Wynne JW. Pulmonary Function Evaluation of the Lung Resection Candidate: A Prospective Study. Am Rev Respir Dis. 1975; 111(4): 379-87.
22. Esteva H, Maya CD, Ruiz D, Santas AA. et al. Riesgo quirúrgico de las toracotomías. Rev Argent Cirug. 1980; 38: p. 28.
23. Ferguson M, Little L, Rizzo L, et al. Diffusing capacity predicts morbidity and mortality after pulmonary resection. J Thorac Cardiovasc Surg. 1988; 96(6): 894-900.
24. Ferguson MK, Vigneswaran WT. Diffusing Capacity Predicts Morbidity After Lung Resection in Patients Without Obstructive Lung Disease. Ann Thorac Surg. 2008; 85(4): 1158-65.400 401
25. Liptay MJ, Basu S, Hoaglin MC, et al. Diffusion lung capacity for carbon monoxide (DLCO) is an independent prognostic factor for long-term survival after curative lung resection for cancer. J Surg Oncol. 2009; 100(8): 703-7.
26. Berry MF, Villamizar-Ortiz NR, Tong BC, et al. Pulmonary Function Tests Do Not Predict Pulmonary Complications After Thoracoscopic Lobectomy. Amm Thorac Surg. 2010; 89(4): 1044-52.
27. Ferguson MK, Siddique J, Karrison T. Modeling major lung resection outcomes using classification trees and multiple imputation techniques. Eur J Cardiothorac Surg. 2008; 34(5): 1085-9.
28. Markos J, Mullan BP, Hillman DR, et al. Preoperative Assessment as a Predictor of Mortality and Morbidity after Lung Resection. Am Rev Respir Dis. 1989; 139(4): 902-10.
29. Cerfolio RJ, Bryant AS. Different Diffusing Capacity of the Lung for Carbon Monoxide as Predictors of Respiratory Morbidity. Ann Thorac Surg. 2009; 88(2): 405-10.
30. Pierce RJ, Copland JM, Sharpe K, Barter CE. Preoperative risk evaluation for lung cancer resection: predicted postoperative product as a predictor of surgical mortality. Am J Respir Crit Care Med. 1994; 150(4): 947-55.
31. Niven AS, Weisman IM. Valoración del riesgo quirúrgico pulmonar en la cirugía del cáncer de pulmón. In Reuters T, editor. Manual de Pruebas de Función Pulmonar: De la fisiología a la práctica. Barcelona: Prous Science. 2010; 421-6.
32. Brunelli A, Pompili C, Salati M. Low-technology exercise test in the preoperative evaluation of lung resection candidates. Monaldi Arch Chest Dis. 2010; 73(2): 72-8.
33. Weinstein H, Bates AT, Spaltro BE, Thaler HT, Steingart RM. Influence of preoperative exercise capacity on length of stay after thoracic cancer surgery. Ann Thorac Surg. 2007; 84(1): 197-202.
34. Bobbio A, Chetta A, Ampollini L, et al. Preoperative pulmonary rehabilitation in patients undergoing lung resection for non-small cell lung cancer. Eur J Cardiothorac Surg. 2008; 33(1): 95-8.