Autor : Bosio MartĂn1, Young Pablo2, Finn Bárbara C2, Ernst Glenda1, Borsini Eduardo1, DĂ©cima Tamara1, Salvado Alejandro1
1 Servicio de NeumonologĂa, Hospital Británico de Buenos Aires 2 Servicio de ClĂnica MĂ©dica, Hospital Británico de Buenos Aires
Correspondencia : DirecciĂłn postal: Dr. Martin Bosio. Servicio de NeumonologĂa, Hospital Británico, Perdriel 74, 1280 Buenos Aires, Argentina
Resumen
La sarcoidosis es una enfermedad inflamatoria granulomatosa sistémica de etiología desconocida y con incidencia variable. Con el objetivo de describir la presentación clínica de un grupo de pacientes con diagnóstico de sarcoidosis en un hospital de comunidad, se realizó la revisión de las historias clínicas de los pacientes con diagnóstico compatible con sarcoidosis desde 2007 hasta 2017. En este período se incluyeron 24 pacientes, al momento de la presentación se encontraban de acuerdo a la radiología en estadio I el 75% de los casos, en el II el 5%, estadio III el 10% y 10% en estadio IV. Recibieron tratamiento el 60% de los pacientes.
En este estudio se describen las características de los pacientes con la finalidad de contribuir a identificar esta entidad y optimizar su diagnóstico y manejo temprano.
Palabras clave: Sarcoidosis; Pronóstico; Epidemiología; Tratamiento; Pruebas de Función Respiratoria.
Introducción
La sarcoidosis es una enfermedad inflamatoria granulomatosa sistémica de etiología desconocida. Se caracteriza por la presencia de granulomas no caseificantes que comprometen pulmones, ganglios hiliares y mediastinales en más del 90% de los casos1-3. Si bien la primera descripción fue realizada por Jonathan Hutchinson (1828-1913) en 1869, el origen del nombre sarcoidosis (por su semejanza a lesiones sarcomatosas; que significa en griego condición similar a la carne) se remonta al año 1898, cuando el dermatólogo noruego Caesar Boeck (1845-1917), describió nódulos cutáneos caracterizados por focos de células epiteliodes y células gigantes, denominando así a esta condición benigna de la piel, término aceptado universalmente desde 19404, 5.
Esta enfermedad afecta a personas de ambos sexos, de todas las razas y edades, aunque predomina en adultos jóvenes. Su frecuencia varía a lo largo del mundo y se informa una incidencia entre 5 a 40 casos por cada 100000 habitantes/año. En los países escandinavos y población afro-norteamericana; se han descripto las formas más severas de la enfermedad6-9.
Latinoamérica es una región con baja incidencia, quizás por diferencias genéticas y de exposición ambiental a determinados antígenos. La falta de datos y la alta prevalencia de otras enfermedades granulomatosas como la tuberculosis o micosis profundas confunden el diagnóstico. Algunas series de casos locales han sido publicados, sin embargo, no se cuenta en nuestro medio, con estudios que brinden información actualizada10-14 . Nuestro objetivo fue, describir la presentación clínica de una cohorte de pacientes con diagnóstico de sarcoidosis en un hospital de comunidad y mostrar la experiencia de nuestro centro de tal manera que permita la generación de futuros trabajos de investigación en el tema.
Materiales y métodos
Se revisaron en forma sistemática datos de pacientes asistidos en forma consecutiva en nuestro centro desde diciembre del 2007 hasta marzo del 2017. Se utilizó la clasificación WASOG para el diagnóstico de sarcoidosis14 siguiendo los criterios requeridos, un cuadro clínico sugestivo de sarcoidosis y un análisis histopatológico con presencia de granulomas no caseificantes, descartando otras causas de lesiones granulomatosas. El diseño fue retrospectivo, descriptivo. Este estudio fue aprobado por el Comité de Revisión Institucional del Hospital Británico de Buenos Aires en acuerdo con la Declaración de Helsinki.
Una vez identificados los pacientes que cumplían con los criterios de elegibilidad, se buscaron en sus historias clínicas datos demográficos, presentación clínica y tratamiento. Se registraron los hallazgos de la radiografía de tórax, tomografía de tórax de alta resolución (TACAR) y pruebas de función pulmonar como espirometría computada y difusión de monóxido de carbono (DLCO).
Se registraron además los siguientes datos: estadios radiológicos de Scadding, tabaquismo, compromiso extrapulmonar, síntomas de presentación, y análisis bioquímicos.
Se utilizó el programa Graph Pad Prism 7.04. Las variables cuantitativas (continuas) se expresaron en mediana ± intervalo intercuartilo 25-75%; las variables categóricas (nominales), en porcentajes. Se calcularon los intervalos de confianza para el 95%. Para la asociación de variables categóricas, se utilizó el test exacto de Fisher; para las variables cuantitativas, el test t de Student. Se consideró como significativo un valor de p < 0.05.
Resultados
En este periodo se incluyeron 24 pacientes. No hubo diferencias en la proporción de ambos sexos, la edad media de los pacientes fue 51.2 ± 17.3 años (rango de 30-78) Tabla 1.
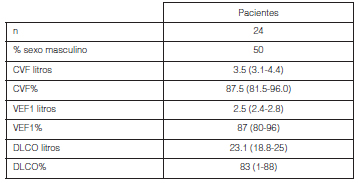
Al momento del diagnóstico, el 80% presentó espirometría normal, el 10% un patrón obstructivo de grado moderado y el 10% restante un patrón restrictivo, también del mismo grado. En el 70% de los pacientes se realizó test de difusión de monóxido de carbono (DLCO) siendo normal en el 80% de los casos (Tabla 1).
Los principales síntomas de presentación fueron disnea y tos 30%, seguidos de astenia en el 20%, dolor abdominal, hemoptisis 5% de los casos. El síndrome de Löfgren se observó en el 5% de los pacientes. Algunos pacientes presentaron más de un síntoma, mientras que un 55% de los mismos fueron asintomáticos. El compromiso extrapulmonar se observó en el 45% de los pacientes, 25% presentó compromiso de piel, presentando en su mayoría eritema nodoso, 10% derrame pericárdico moderado y 5% pleural. Se observó anemia leve en el 10%, el 25% tuvo eritrosedimentación elevada en forma leve y el 15% enzima convertidora de angiotensina (ECA) elevada.
El 60% de los pacientes nunca había fumado, el 25% era ex tabaquista y el 15% continuaba fumando.
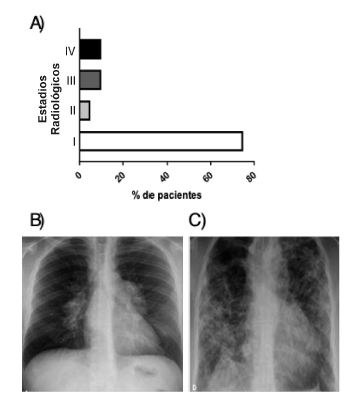
Al momento de la presentación se encontraban en estadio I (adenopatías hiliares y mediastinales sin infiltrados pulmonares el 75% de los casos, en el II (adenopatías hiliares e infiltrados pulmonares predominantemente en las zonas superiores el 5%, estadio III) infiltrados pulmonares principalmente en lóbulos superiores en ausencia de ganglios hiliares el 10% y 10% en estadio IV (Fibrosis pulmonar con pérdida de volumen (Figura 1).
La herramienta diagnóstica utilizada fue la mediastinoscopía en el 40% de los casos, videotoracoscopía en el 20%, fibrobroncoscopía con biopsia transbronquial en el 15%, biopsia de piel en el 10%, ultrasonido endobronquial (EBUS) en el 5% y biopsia hepática en el 5%, evidenciando granulomas no caseificantes en la muestra de biopsia. En el 5% restante el diagnóstico fue clínico atribuido al síndrome de Löfgren18.
Recibieron tratamiento con corticoides, meprednisona, el 60% de los pacientes, la dosis más utilizada fue 0.5 mg/kg y continúan en manejo ambulatorio con buena evolución, el 28.5% presentó recaída de la enfermedad y todos dentro del año de haber suspendido los corticoides, en todos los casos se repitió el mismo esquema de tratamiento con mejoría de los síntomas, sin necesidad de cambiar el tratamiento.
Discusión
A pesar de la ausencia de una etiología definitiva, se sostiene que la patogénesis de la sarcoidosis implica la exposición a uno o varios agentes ambientales o no ambientales en un individuo genéticamente susceptible6, 13. Esta combinación desencadena la activación de los componentes del sistema inmunitario y la formación de granulomas no necrotizantes que son las lesiones características de la enfermedad. Dependiendo de alteraciones genéticas desconocidas o de defectos del sistema inmunológico, la reacción granulomatosa se resuelve o persiste como inflamación crónica, llevando finalmente a la fibrosis. Las diferentes combinaciones de exposiciones y defectos del huésped determinan la existencia de los múltiples fenotipos observados en la sarcoidosis14. Newman y colaboradores realizaron un estudio etiológico de casos control de sarcoidosis (ACCESS) para identificar si existía asociación ocupacional y ambiental15, ellos concluyeron que severas exposiciones fueron asociadas con el riesgo de desarrollar sarcoidosis incluyendo insecticidas, empleo agrícola, bioaerosoles, también concluyeron que fumar tuvo un efecto protectivo. Más aún; algunos autores han postulado la asociación con el Mycobacterium tuberculosis, sería uno de los agentes infecciosos potencialmente responsables, existiendo estudios que detectaron la proteína micobacteria catalasa peroxidasa (mKatG) en muestras de tejido de pacientes con sarcoidosis15-19, esta proteína tiene las mismas propiedades fisicoquímicas como la Kveim Siltzbach, la cual ha sido utilizada para inducir granulomas en la piel de pacientes con sarcoidosis, estos antígenos de las micobacterias son liberados durante la muerte del organismo20.
La sarcoidosis presenta mejor evolución que otras enfermedades pulmonares intersticiales. Su alta tasa de remisión espontánea con escasas consecuencias y el curso crónico de la enfermedad se dan en aproximadamente un tercio de los pacientes. La mortalidad reportada es solo entre 1 y el 6%21-23.
De acuerdo con el consenso internacional existen tres criterios para el diagnóstico, presentación clínica y radiológica compatible, evidencia patológica de granulomas no caseificantes con o sin mínima necrosis central y exclusión de otras enfermedades con hallazgos similares7, 14.
Los estadios radiológicos propuestos por K. Wurn en 1958 y luego adoptados por Scadding JG25 en 1961 son derivados de la radiografia de tórax (RxTx) y no de la Tomografia computada de alta resolución (TCAR). A pesar de la discordancia existente en muchos pacientes entre los hallazgos en la RxTx y la TCAR, las alteraciones pulmonares no han sido suficientemente estudiadas para la valoración pronóstica de la enfermedad con TCAR y, por tanto, la estadificación se sigue realizando fundamentalmente en función de los hallazgos en la placa7, 25.
Solo en muy pocos pacientes con presentación clínico radiológica específica, el diagnóstico de sarcoidosis puede ser hecho sin biopsia: presencia de adenopatías hiliares en la radiografía de tórax en un paciente asintomático; Síndrome de Lofgrens: adenopatías bilaterales en la RxTx, eritema nodoso y artritis; Síndrome de Heerfordt: parotiditis parálisis facial uveítis anterior y fiebre; signo de Panda (captación en glándulas parótida y lagrimal) y lambda ( captación en ganglios paratraqueal derecho y bilateral hiliares) en el centellograma con Galio 67.
Es importante destacar que la evidencia de granulomas en la anatomía patológica solamente, fuera de un contexto clínico compatible, es insuficiente para el diagnóstico de sarcoidosis, debido a que existen numerosas otras entidades caracterizadas por este tipo de inflamación, infección, neumonitis por hipersensibilidad, aspiración crónica, beriliosis, desordenes linfoproliferativos, neumoconiosis, etc
Diversos estudios han sugerido diferencias en la forma de presentación de sarcoidosis en el mundo. El compromiso pulmonar ocurre en algún momento en todos los pacientes con sarcoidosis, el compromiso subclínico está presente, aun cuando las manifestaciones extratorácicas dominen el cuadro. Tos seca, disnea y disconfort están presentes en el 30% al 50% de los pacientes, hay una sustancial demora entre el comienzo de los síntomas y el diagnóstico, aproximadamente la mitad de los pacientes reciben un correcto diagnóstico más de 3 meses después del comienzo de los síntomas26. En una cohorte de Estados Unidos de 448 pacientes con sarcoidosis incidente entre 1976 y 2013, el compromiso intratorácico fue reportado en 97%, de estos, el 87% se presentó con adenomegalias intratorácicos y 50% con compromiso parenquimatoso, aunque el 43% estaban asintomáticos27. Existen también diferencias clínicas al momento de la presentación según la edad, en los menores de 45 años con compromiso extratorácico
ganglionar presentaban mayor compromiso de glándulas salivales, parótidas e hígado , mientras que el compromiso cardíaco , muscular, ocular y renal ocurrió más frecuente en los mayores de 45 años28 . En nuestra serie, la mayoría de los casos estaba asintomático, siendo un hallazgo incidental en pacientes que son estudiados por síntomas inespecíficos concurriendo a la guardia del Hospital. Esto podría sugerir, una sobre utilización en nuestro medio de la TCAR, y eso podría explicar el mayor porcentaje de pacientes diagnosticados en estadio I y asintomáticos.
El resto de las manifestaciones clínicas más frecuentes son el eritema nodoso y escasos síntomas respiratorios, como tos seca irritativa, dolor torácico y disnea, con disociación clínico-radiológica (mayor afectación radiológica que clínica)29. La piel y los ojos son los órganos más comunes de compromiso extrapulmonar, el corazón y el sistema nervioso son los más serios, es esencial monitorear el compromiso extrapulmonar debido a que el diagnóstico temprano puede prevenir la afección irreversible30.
La típica anormalidad fisiológica es el defecto ventilatorio restrictivo con disminución de la capacidad de difusión de monóxido de carbono (DLCO), una aislada reducción moderada de la DLCO es también frecuente, sin embargo la obstrucción al flujo aéreo ha sido más prevalente en algunas cohortes31.
Debido a que el compromiso parenquimatoso es altamente prevalente en sarcoidosis, la fibrobroncoscopia (FBC) tiene alto rendimiento diagnóstico, se pueden incluir muestras de la vía aérea, biopsias endobronquiales, parénquima pulmonar, biopsias transbronquiales y criobiopsia o EBUS con muestra de ganglios linfáticos intratorácicos. Los diagnósticos diferenciales (estadio I Scadding) más comunes son los infecciosos como la tuberculosis, hongos y otros como linfoma. Cuando existen visibles anormalidades en la FBC la posibilidad de obtener diagnóstico es alto, mayor al 70%, pero disminuye al 30% si la mucosa es normal32.
Estudios individuales y un metaanálisis han mostrado que el EBUS tiene una exactitud diagnóstica que excede el 80%, si bien su sensibilidad es alta para detectar granulomas, su especificidad es baja para el diagnóstico de sarcoidosis, ya que pueden confundirse con linfadenopatìa tuberculosa y pueden encontrarse adyacentes al cáncer de pulmón33-36.
La criobiopsia y el EBUS en 36 pacientes no seleccionados con sospecha de sarcoidosis presentaron una sensibilidad del 67% cada procedimiento por separado, pero del 100% cuando fueron combinados37.
En nuestro análisis registramos un 25% de casos con afección dermatológica. Generalmente la afección de la piel es un hallazgo temprano, mayormente asintomático, aunque algunas veces se presenta con prurito. La mayoría de las lesiones pueden ser tratadas con agentes tópicos, las 2 lesiones más importantes son el eritema nodoso y el lupus pernio. Debido a que el compromiso ocular es por inflamación y generalmente es asintomático, se requiere de evaluaciones oftalmológicas anuales para evitar alteraciones permanentes, las presentaciones más frecuentes son la uveítis anterior y la queratoconjuntivitis que pueden ser tratados con agentes tópicos, la uveítis anterior severa y posterior requiere tratamiento sistémico38.
Aunque la sarcoidosis cardiaca se observa en el 25% al 70% de las autopsias39, el compromiso cardíaco clínico ocurre en el 5% de los pacientes en nuestra serie.
El compromiso neurológico ocurre en menos del 10% de los pacientes, siendo los pares craneales el compromiso más frecuente y de ellos el VII par es el más comúnmente afectado40.
El tratamiento no está indicado en pacientes asintomáticos en estadios I y II debido a que la resolución espontánea es de 60% a 90% a 2 años en estadio I, siendo la forma de presentación entre 25% y 65%; en el estadio II la remisión es de 40% a 70%, el resto permanece estable o puede progresar en el tiempo y los hallazgos están presentes en el diagnóstico inicial entre 20% a 40%; en el estadio III, 10% a 20% tienen resolución espontánea y es la forma de presentación en el 10% al 15% de los casos y por último en el estadio IV no hay resolución espontánea y se presentan en el 5%7.
Los corticoides son el tratamiento principal pero no curan la enfermedad, mientras que los inmunomoduladores y agentes citotóxicos son generalmente utilizados cuando fallan los corticoides o no son bien tolerados. No existen protocolos validados o algoritmos para el tratamiento oral con corticoides. Este debería ser considerado en pacientes con síntomas significativos o empeoramiento de los mismos, principalmente disnea, alteración de la función pulmonar o su deterioro (mayor al 10% de la capacidad vital o 15% o más de reducción de la DLCO) mayor progresión radiográfica, aún en estos casos el tratamiento está basado en recomendaciones de expertos más que en resultados de estudios randomizados controlados. Un metaanálisis identificó 13 estudios con 1066 pacientes tratados con corticoides sistémicos durante 6 a 24 meses, los autores encontraron mejoras en los síntomas y la función pulmonar en pacientes con estadios II y III41. Las decisiones terapéuticas debieran estar basadas en la calidad de vida y deberían estar hechas caso por caso.
A pesar de diagnosticar a la mayoría de los pacientes en estadios I y II al momento del diagnóstico, la mitad fueron tratados con dosis altas de corticoides, siendo en algunos casos indicados por médicos de otras especialidades sin previa discusión interdisciplinaria. Conocer estas características y el manejo terapéutico adecuado podría contribuir a mejorar el manejo clínico de esta enfermedad.
Conflicto de interés: Los autores declaran que no tienen conflicto de intereses.
1. Bargagli E, Prasse A. Sarcoidosis: a review for the internist (Review). Intern Emerg Med 2018; 13: 325-31.
2. Carmona EM, Kalra S, Ryu JH. Pulmonary Sarcoidosis: Diagnosis and Treatment (Review). Mayo Clin Proc 2016; 91: 946-54.
3. Valeyre D, Prasse A, Nunes H, Uzunhan Y, Brillet PY, Müller-Quernheim J. Sarcoidosis (Review). Lancet 2014; 383: 1155-67.
4. Young P, Finn BC, Pellegrini D, Bruetman JE. Hutchinson (1828-1913), su historia, su tríada y otras tríadas de la medicina. Rev Med Chil 2010; 138: 383-7.
5. Fernández Fabrellas E. Epidemiología de la sarcoidosis (Review). Arch Bronconeumol 2007; 43: 92-100.
6. Newman LS, Rose CS, Maier LA. Sarcoidosis (Review). N Engl J Med 1997; 336: 1224-34.
7. Hunninghake G, Costabel U, Ando M, Statement on sarcoidosis. Joint Statement of the American Thoracic Society (ATS), the European Respiratory Society (WASOG) adopted by the ATS Board Directors and by the ERS Executive Committee. Am J Respir Crit Care Med 1999; 160: 736-55.
8. Rybicki BA, Major M, Popovich J, Maliarik MJ, Iannuzzi MC. Racial differences in sarcoidosis incidence: a 5-year study in a health maintenance organization. Am J Epidemiol 1997; 145: 234-41.
9. Baughman RP, Teirstein AS, Judson MA, et al. ACCESS Research Group. Clinical characteristics of patients in a case control study of sarcoidosis. Am J Respir Crit Care Med 2001; 164: 1885-9.
10. Bethlem NM. Epidemiology of sarcoidosis in Brazil. Sarcoidosis 1985; 2: 162.
11. Corrêa da Silva LC, Hertz FT, Cruz DB, et al. Sarcoidose no sul do Brasil: Estudo de 92 pacientes. J Bras Pneumo 2005; 31: 398-406.
12. Purriel P, Navarrete E. Epidemiology of sarcoidosis in Uruguay and other countries of Latin America. Am Rev Respir Dis 1961; 84: 155-61.
13. Song Z, Marzilli L, Greenlee BM, et al. Mycobacterial catalase-peroxidase is a tissue antigen and target of the adaptive immune response in systemic sarcoidosis. J Exp Med 2005; 201: 755-67.
14. Judson MA1, Costabel U, Drent M, et al. The WASOG Sarcoidosis Organ Assessment Instrument, Sarcoidosis Vasc Diff Lung Dis 2014 ;31: 19-27
15. Newman LS, Rose CS, Bresnitz EA A case control etiologic study of sarcoidosis: environmental and occupational risk factors. Am J Respir Crit Care Med 2004; 170; 1324-30
16. Semeniuk G, Bercovich C, Bernasconi D, Quesada Elias A, Schiavi E. Sarcoidosis. Revisión de 12 casos. Medicina (B Aires) 1983; 43: 257-62.
17. González EL, Vigliano C, Cáneva J. Sarcoidosis. Presentación clínica y pronóstico. Medicina (B Aires) 2010; 70: 499-502.
18. Cambursano H, Cazaux A, Langer M, et al. Sarcoidosis Broncopulmonar. Revisión breve y descripción de 8 casos. Rev Fac Cien Med Univ Nac Cordoba 2006; 63: 24-35.
19. Rodríguez Castells H, Carlos Rey J, Gustavo Dimier H, Valli EF. Encuesta de Sarcoidosis en la República Argentina-1969. Torax 1970; 19: 236-7.
20. Moller D, Potential etiologic agents in sarcoidosis. Dr Proc Am thorac Soc 2007;4:465-468.
21. Mañá J, Gómez-Vaquero C, Montero A, et al. Löfgren’s syndrome revisited: a study of 186 patients. Am J Med 1999; 107: 240-5.
22. Neville E, Walker A, James D. Prognostic factors predicting the outcome of sarcoidosis: an analysis of 818 patients. Q J Med 1983; 52: 525-33.
23. Hunninghake G, Gilbert S, Pueringer R, et al. Outcome of the treatment for sarcoidosis. Am J Respir Crit Care Med 1994; 149: 893-8.
24. Scadding JG , Prognosisi of intrathoracic sarcoidosis in England. Br Med 1961: 2: 1165-72
25. Lynch JP. Computed tomographic scanning in sarcoidosis. Semin Respir Crit Care Med 2003; 24: 393-418.
26. Judson MA, Thompson BW, Rabin D. The diagnostic pathway to sarcoidosis. Chest 2003; 123: 406 12.
27. Epidemiology of Sarcoidosis 1946–2013: A Population Based Study Ungprasert P, Carmona EM, Utz JP et al. Mayo Clin Proc. 2016; 91: 183-188.
28. Chevalet P, Clément R, Rodat O, Sarcoidosis diagnosed in elderly subjects: retrospective study of 30 cases Chest. 2004; 126: 1423-30.
29. Myers JL, Tazelaar HD. Challenges in pulmonary fibrosis: Problematic granulomatous lung disease. Thorax 2008; 63: 78-84.
30. Rizzato G, Palmieri G, Agrati AM, Zanussi C. The organ-specific extrapulmonary presentation of sarcoidosis: a frequent occurrence but a challenge to an early diagnosis. A 3-year-long prospective observational study. Sarcoidosis Vasc Diffuse Lung Dis 2004; 21: 119-26.
31. Bussinguer M, Danielian A, Sharma OP. Cardiac sarcoidosis: diagnosis and management. Curr Treat Options Cardiovasc Med 2012; 14: 652-64.
32. Nunes H, Humbert M, Capron F, Pulmonary hypertension associated with sarcoidosis: mechanisms, haemodynamics and prognosis. Thorax 2006; 61: 68-74.
33. Shorr AF, Torrington KG, Hnatiuk OW. Endobronchial biopsy for sarcoidosis: a prospective study Chest 2001 ;120: 109-14
34. Agarwal R, Srinivasan A, Aggarwal AN, Efficacy and safety of convex probe EBUS-TBNA in sarcoidosis: a systematic review and meta-analysis. Respir med 2012; 106: 883-92,
35. Trisolini R, Lazzari Agli L, Tinelli C. Endobronchial ultrasound-guided transbronchial needle aspiration for diagnosis of sarcoidosis in clinically unselected study populations. Respirology 2015; 20: 226-34,
36. Navani N, Molyneaux PL, Breen RA .Utility of endobronchial ultrasound-guided transbronchial needle aspiration in patients with tuberculous intrathoracic lymphadenopathy: a multicentre study. Thorax 2011; 66: 889-93
37. Aragaki-Nakahodo AA, Baughman RP, Shipley RT. The complimentary role of transbronchial lung cryobiopsy and endobronchial ultrasound fine needle aspiration in the diagnosis of sarcoidosis. Respir Med 2017;131:65-9.
38. Al-Kofahi K, Korsten P, Ascoli C et al. Management of extrapulmonary sarcoidosis: challenges and solutions. Ther Clin Risk Manag. 2016; 12: 1623-163.
39. Bussinguer M, Danielian A, Sharma OP. Cardiac sarcoidosis: diagnosis and management. Curr Treat Options Cardiovasc Med 2012; 14: 652-64.
40. Stern BJ. Neurological complications of sarcoidosis. Curr Opin Neurol 2004; 17: 311-6.
41. Paramothayan NS, Lasserson TJ, Jones PW. Corticosteroids for pulmonary sarcoidosis. Cochrane Database Syst Rev 2005; (2): CD001114.