Autor : Uribe EchevarrÃa Loli1, Castro Zorrilla Liliana2, Ernst Glenda3, Camargo Vargas Bethy5, Di Tullio Fernando3, Troncoso Diana2, LÃĄzari Nuria2, Resguardo AnalÃa2, Palma Ileana2, Cruz Haydee Vilma2, Rolan NicolÃĄs4, Kofman Carlos5, Teper Alejandro5; Salvado Alejandro3
1 Sanatorio Allende, Sede Nueva CÃģrdoba, CÃģrdoba Argentina
2 Instituto de TisioneumonologÃa âProf. Dr. RaÚl Vaccarezzaâ, Facultad de Medicina, UBA. Ciudad AutÃģnoma de Buenos Aires, Argentina
3 Hospital BritÃĄnico, Ciudad AutÃģnoma de Buenos Aires, Argentina
4 Hospital de ClÃnicas JosÃĐ de San MartÃn, Facultad de Medicina UBA. Ciudad AutÃģnoma de Buenos Aires, Argentina.
5 Hospital de NiÃąos Ricardo GutiÃĐrrez, Ciudad AutÃģnoma de Buenos Aires, Argentina
Correspondencia : Dr. Alejandro Salvado - Servicio de Neumonologia - Hospital BritÃĄnico - Ciudad AutÃģnoma de Buenos Aires, CP: 1280 - Argentina
Resumen
Las enfermedades broncopulmonares se asocian a diversos mecanismos inflamatorios de las vÃas aÃĐreas. Evaluar y comprender el perfil inflamatorio de estos pacientes podrÃa contribuir a conocer la etiologÃa y asà optimizar el tratamiento. El esputo inducido es una tÃĐcnica mÃnimamente invasiva, por lo que su implementaciÃģn resulta de interÃĐs en la prÃĄctica habitual.
Aunque el estudio del esputo inducido ha demostrado utilidad y seguridad, los centros que desarrollan esta tÃĐcnica en la Argentina son escasos. Con el objetivo de estandarizar el procedimiento de recolecciÃģn y anÃĄlisis de muestras de esputo inducido en pacientes con enfermedades inflamatorias broncopulmonares, se desarrollÃģ esta guÃa consensuada por los centros con experiencia en esta tÃĐcnica en nuestro paÃs. Es nuestra intenciÃģn difundir esta tÃĐcnica, mÃnimamente invasiva, para su aplicaciÃģn en servicios especializados. Esta guÃa de procedimientos detalla los materiales que son requeridos, los mÃĐtodos y los estÃĄndares de calidad y seguridad tanto para los pacientes como para los operadores.
Palabras claves: Esputo inducido; Asma severa; EstandarizaciÃģn; Enfermedades inflamatorias de la vÃa aÃĐrea.
Abstract
Bronchopulmonary diseases are associated with different inflammatory mechanisms of the airways. Assessing and understanding the inflammatory profile of these patients could contribute to the understanding of the etiology and thus optimize the treatment. Induced sputum is a minimally invasive technique, so its implementation is of interest in the usual practice.
Although the studies of induced sputum have shown usefulness and safety, the centers that develop this technique in Argentina are scarce. With the aim of standardizing the procedure that includes the collection and analysis of induced sputum samples in patients with bronchopulmonary inflammatory diseases, some centers in our country with experience in this technique achieved a consensus on the development of this Guide. It is our intention to disseminate this minimally invasive technique for its application in specialized services. This procedure guide details the necessary materials and methods and quality and safety standards for both patients and operators.
Key words: Induced sputum; Severe asthma; Standardization; Inflammatory diseases of the airways.
IntroducciÃģn
Enfermedades de las vÃas respiratorias como asma, enfermedad pulmonar obstructiva crÃģnica (EPOC), y otras enfermedades inflamatorias de las vÃas aÃĐreas pueden compartir sÃntomas clÃnicos y responder a diferente tratamiento segÚn el perfil inflamatorio1. El control de la inflamaciÃģn de la vÃa aÃĐrea constituye un objetivo fundamental en el manejo de estas enfermedades, ya que su persistencia estÃĄ relacionada con el deterioro de la funciÃģn respiratoria, y eventualmente con la remodelaciÃģn estructural de la vÃa aÃĐrea.
Los mediadores de estos procesos inflamatorios pueden estudiarse a partir del desarrollo de tÃĐcnicas no invasivas simples, seguras y validadas. Estas incluyen la mediciÃģn de los niveles de Ãģxido nÃtrico exhalado, mediciÃģn de gases volÃĄtiles en aire exhalado, recuentos celulares y la evaluaciÃģn de concentraciones de mediadores en muestras de esputo inducido2, 3. El uso combinado de dichas tÃĐcnicas no invasivas junto a marcadores clÃnicos, funcionales y bioquÃmicos podrÃa facilitar interpretaciones clÃnicamente Útiles en pacientes con asma y EPOC4, 5. En las Últimas dÃĐcadas se han difundido numerosas publicaciones que utilizan la tÃĐcnica de esputo, y se ha optimizado la inducciÃģn de su recolecciÃģn mediante soluciones salinas hipertÃģnicas6-8. La tÃĐcnica de inducciÃģn del esputo fue redactada inicialmente en 19929, y desde entonces se han descripto algunas modificaciones. En 2002 la AsociaciÃģn Americana del TÃģrax y la Sociedad Respiratoria Europea publicaron la estandarizaciÃģn de esta tÃĐcnica10, 11. En Argentina los estudios de esputo inducido se implementaron a partir del aÃąo 2000 en pacientes adultos12-21, y desde el aÃąo 2017 en pediatrÃa.
En la actualidad, diversos centros de Argentina desarrollan tÃĐcnicas similares para obtener y procesar las muestras de esputo inducido. Sin embargo, para que este mÃĐtodo pueda usarse en forma difundida y que las observaciones sean comparables entre las distintas instituciones debe ser validado y estandarizado.
El objetivo de la presente publicaciÃģn es unificar los criterios que se utilizan para la recolecciÃģn y para el anÃĄlisis de las muestras de esputo inducido.
1. TÃĐcnica de inducciÃģn
Se deben considerar 3 aspectos especiales: del ambiente, del recurso humano y del paciente.
Del ambiente
El sitio que se dispondrÃĄ para la inducciÃģn del esputo serÃĄ un espacio silencioso, sin circulaciÃģn de otros pacientes y/o profesionales, donde el paciente se encuentre cÃģmodo para su realizaciÃģn. Se requiere que sea un ambiente de adecuada temperatura, iluminaciÃģn y ventilaciÃģn, con filtro HEPA (High Efficiency Particulate Air) activo en situaciones que lo requieran, por ejemplo, ante la sospecha de enfermedades respiratorias infectocontagiosas.
Del recurso humano
El personal dedicado a la inducciÃģn del esputo deberÃĄ estar especialmente entrenado. En el caso que la persona que conduzca el procedimiento no sea mÃĐdico, un mÃĐdico deberÃĄ estar prÃģximo para la atenciÃģn de posibles eventos adversos del paciente22. El profesional actuante deberÃĄ brindar al paciente una explicaciÃģn teÃģrica previa de las maniobras a realizar: mediciÃģn de la funciÃģn pulmonar, forma y duraciÃģn de las nebulizaciones y modo de toser y expectorar para lograr muestras adecuadas. Luego del procedimiento elaboraraĖun informe donde consten los horarios de inicio y final del procedimiento, los valores de funcioĖn pulmonar basal y final, el nuĖmero de nebulizaciones requeridas, la presencia de eventos adversos y la factibilidad en la toma de la muestra.
Del paciente
No se podrÃĄ indicar este estudio a pacientes que no sean capaces de comprender el procedimiento o de realizar espirometrÃas confiables.
Los pacientes que se sometan a una inducciÃģn deberÃĄn estar en condiciones clÃnicas adecuadas:
- no presentar exacerbaciones de enfermedades obstructivas
- no presentar fiebre
- no haber presentado enfermedades infecciosas de vÃas aÃĐreas superiores o inferiores en el Último mes
- no haber realizado tratamiento con corticoides sistÃĐmicos en el Último mes (o sin aumento de la dosis del corticoide oral en los que los reciben en forma diaria)
- ayuno de mÃĄs de 2 horas
Luego de haber recibido la informaciÃģn relacionada con el procedimiento, el paciente brindarÃĄ su consentimiento firmando un formulario especÃfico. (Anexo I).
1.1 Materiales requeridos
- Nebulizador ultrasÃģnico De VilbissÂŪ, Ultra-NebÂŪ 2000 (o similar que administre un flujo aproximado de 1 ml/min con un diÃĄmetro aerodinÃĄmico mediano de masa de 3 micrones), para generar partÃculas capaces de alcanzar las vÃas respiratorias distales23. El reservorio, la tubuladura y la pipeta bucal deben estar limpios y desinfectados con alcohol isopropÃlico al 70% luego de cada uso.
- SoluciÃģn salina estÃĐril de diferentes concentraciones (0,9 a 7%).
- EspirÃģmetro.
- Pinza nasal.
- Medidor de oximetrÃa de pulso.
- Salbutamol (Inhalador dosis medida).
- AerocÃĄmara o cÃĄmara espaciadora.
- Frasco estÃĐril para recolecciÃģn del material (pesado en balanza de precisiÃģn).
- Agua y vasos para enjuague bucal.
- Barbijo tipo 3M N 9524.
- En ambientes con alta prevalencia de enfermedades infectocontagiosas se deberÃa contar purificador de aire con Filtro HEPA.
- ProtecciÃģn ocular o antiparras para el operador.
- Guantes.
- CronÃģmetro.
1.2 ObtenciÃģn de la muestra
Aunque existen distintas variantes en los procedimientos para obtener las muestras25, en adultos el mÃĄs utilizado se detalla a continuaciÃģn12.
1. EspirometrÃa basal para obtener el valor del volumen espiratorio forzado en el primer segundo (VEF1). Con un valor de VEF1< 0.5 litros no se deberÃa realizar el procedimiento.
2. Administrar 4 inhalaciones de salbutamol con espaciador (dosis total 400 mcg). El uso de salbutamol no altera el recuento celular26.
3. EspirometrÃa postbroncodilatadora 15 minutos despuÃĐs de la primera. Se consigna el valor del VEF1 postbroncodilatador para considerar el porcentaje de cambio luego de cada nebulizaciÃģn posterior.
4. Se administra la primera nebulizaciÃģn a travÃĐs de pieza bucal con clip nasal. Si el VEF1 basal es menor o igual 65% del valor teÃģrico esta nebulizaciÃģn se harÃĄ con soluciÃģn salina isotÃģnica (0,9%)27 durante 5 a 7 minutos. Si el VEF1 basal es superior al 66% del valor teÃģrico, se harÃĄ con soluciÃģn salina al 3%, durante 5 a 7 minutos.
Alternativamente se pueden realizar nebulizaciones con igual concentraciÃģn de soluciÃģn hipertÃģnica al 4,5% durante 5 minutos cada una, tiempo mÃĄximo de nebulizaciÃģn 20 minutos.
5. Se solicita al paciente despejar las secreciones nasales y realizar un enjuague bucal con agua corriente.
6. Se indica al paciente que expectore con la siguiente tÃĐcnica: luego de una inspiraciÃģn mÃĄxima, toser en forma reiterada utilizando musculatura abdominal con el cuerpo inclinado ligeramente hacia adelante, con esfuerzos progresivamente crecientes y carraspeo posterior. Luego de recolectar la muestra en el frasco estÃĐril se realiza espirometrÃa final para objetivar el VEF1 y asà concluye la inducciÃģn del esputo.
7. En caso de no recolectarse la muestra, y si el VEF1 es mayor o igual al 80% del valor postbroncodilatador, se continÚa el procedimiento nebulizando con concentraciones crecientes de soluciÃģn salina hipertÃģnica. Estas concentraciones serÃĄn de 4% y luego de 5% durante 5 a 7 minutos cada una. Diferentes estudios han mostrado que la duraciÃģn de la nebulizaciÃģn puede alterar la composiciÃģn celular y bioquÃmica de la muestra de esputo28-31 por lo que se sugiere un tiempo mÃĄximo total de nebulizaciÃģn de 20 minutos, dejar intervalos de 5 minutos entre cada nebulizaciÃģn, repitiendo luego de cada una los puntos 8 y 9.
8. FinalizaciÃģn del procedimiento: la inducciÃģn del esputo finaliza cuando
a. Se obtiene muestra suficiente.
b. No se obtiene esputo luego 20 minutos de nebulizaciÃģn.
c. En presencia de eventos adversos:
Â- ObstrucciÃģn bronquial, evidenciada por descenso significativo (>20% VEF1 basal postb2).
En este caso, se administrarÃĄ tratamiento broncodilatador que se considere necesario.
Â- NÃĄuseas y/o vÃģmitos.
Â- Cefaleas intensas
Â- Dolor abdominal
9. En caso que sea necesario repetir el procedimiento de inducciÃģn, ÃĐste no podrÃĄ ser realizado dentro de las 48 horas siguientes.
10. Tras la obtenciÃģn de la muestra, conservar en heladera (4 °C). Se sugiere realizar el procesamiento dentro de las 2 horas de la obtenciÃģn de la misma.
El esquema de inducciÃģn que se utiliza en adultos se encuentra detallado en la Figura 1 y el que se utiliza en niÃąos en la Figura 2.


1.3 InducciÃģn de esputo en pediatrÃa
La seguridad de esta tÃĐcnica ha sido demostrada en niÃąos mayores de 6 aÃąos; aunque es necesario realizarlo en centros que cuenten con personal especializado y la infraestructura requerida para el inmediato procesamiento de las muestras32-34.
La tÃĐcnica de inducciÃģn del esputo en los niÃąos sigue todos los pasos anteriormente descritos, pero tiene algunas diferencias con respecto a la de los adultos, que se describen a continuaciÃģn:
1. El ambiente en el cual se realiza la inducciÃģn deberÃĄ ser amigable para un paciente pediÃĄtrico y no deberÃĄn existir factores que perturben su tranquilidad y concentraciÃģn para la realizaciÃģn de las maniobras requeridas.
2. Durante las nebulizaciones se recomienda la muestra de videos que entretengan al paciente ya que esto favorece la adherencia.
3. El personal a cargo del estudio deberÃĄ estar familiarizado con la atenciÃģn de niÃąos, ya que las explicaciones y estÃmulos que se den son diferentes a las que se suelen emplear para pacientes adultos.
4. El paciente otorga su asentimiento si es menor de 13 aÃąos y los padres o represante legal el consentimiento para la realizaciÃģn del procedimiento. En el caso de pacientes mayores de 13 aÃąos, ÃĐstos darÃĄn su consentimiento y los padres o representante legal el asentimiento.
5. El espirÃģmetro contarÃĄ con software de incentivo especÃfico para los niÃąos.
6. No se utiliza medidor de pico flujo por la baja sensibilidad.
7. Si el VEF1 post broncodilatador es menor a 60% se contraindica el procedimiento.
8. Las nebulizaciones se realizan con concentraciones de solucion salina hipertÃģnica siempre al 4,5% durante 5 minutos en todas las administraciones hasta que se consigue la muestra, con un mÃĄximo de 4 nebulizaciones.
2. Procesamiento de la muestra
2.1 Requerimiento de infraestructura para el procesamiento
El laboratorio deberÃĄ estar equipado para el procesamiento de muestras biolÃģgicas y debe cumplir las normas de bioseguridad vigentes. Las decisiones en relaciÃģn con las medidas de bioseguridad mÃĄs apropiadas deben adoptarse aplicando un enfoque basado en la evaluaciÃģn de riesgos que tenga en cuenta los distintos tipos de procedimientos que se realizan en el laboratorio.
Debido a la posibilidad de recibir muestras de pacientes con patologÃa infecciosa se deben adoptar las medidas recomendadas por el Manual de Bioseguridad en laboratorio de tuberculosis de la OMS35.
-
Elementos mÃnimos de Bioseguridad:
o Descartadores de material contaminado y cortopunzante.
o SoluciÃģn de hipoclorito de sodio al 1% para decontaminaciÃģn de material de laboratorio utilizado.
o Recipientes para eliminaciÃģn de residuos peligrosos (excedentes de reactivos utilizados, y de la muestra tomada) de acuerdo a las normas de eliminaciÃģn vigentes.
- Requerimientos de bioseguridad para el operador:
1. Barbijo tipo 3M N95.
2. Antiparras.
3. Guantes.
4. Guardapolvo o camisolÃn.
2.2 Equipamiento requerido para procesamiento. Recomendaciones mÃnimas:
A. Equipamientos
1. Balanza analÃtica de precisiÃģn.
2. Pinza de punta fina.
3. Micropipetas con volÚmenes variables 0-1000 Ξl.
4. BaÃąo termostÃĄtico.
5. Agitador magnÃĐtico o mecÃĄnico de tipo Vortex.
6. Gasa para filtrar o malla de nylon con trama de 48 Ξm.
7. CÃĄmara de Neubauer.
8. CentrÃfuga
9. CitocentrÃfuga.
10. Microscopio Ãģptico con objetivos de 40x y 100x.
B. Reactivos
1. Dithiothreitol (DTT) al 0,1%.
2. Phosphate Buffered Saline (PBS).
3. SoluciÃģn de Tripan blue.
4. Colorante Giemsa.
5. SoluciÃģn de montaje.
C. Material descartable y de vidrio
1. Tubos de poliestireno 10 ml con tapa pesado previamente.
2. Tubos de poliestireno 10 ml sin tapa.
3. Tubos eppendorf 2 ml.
3. Pipetas Pasteur.
4. Copas de citocentrÃfuga.
5. Filtros para citocentrÃfuga.
6. Tips para micropipetas.
7. Placas de Petri.
8. Probetas.
2.3 Personal requerido para procesamiento
Un mÃĐdico, un bioquÃmico y un tÃĐcnico altamente capacitado. Es recomendable que el centro cuente con la participaciÃģn de un patÃģlogo especializado en citologÃa.
2.4 TÃĐcnica de procesamiento
Nota importante: Una vez obtenida la muestra de esputo inducido en un frasco estÃĐril, deberÃĄ ser procesada dentro de las 2 horas de recolectada.
Paso a Paso
1. Pesar la muestra entera en el frasco de recolecciÃģn.
2. Depositar la muestra entera de esputo en una placa de Petri. Anotar la apariencia macroscÃģpica sobre un fondo oscuro.
3. Seleccionar con pinzas finas los tapones de esputo o âplugsâ libres de saliva, colocarlos en un tubos de poliestireno 10 ml con tapa pesado previamente.
4. Registrar el peso de la muestra seleccionada (el peso recomendado no podrÃĄ ser menor a 0,20 g).
5. Agregar a la muestra seleccionada una soluciÃģn de Dithiotreitol (DTT) al 0,1 %, en un volumen de 4 veces el peso de la muestra y colocar en baÃąo a 37 °C durante 15 minutos, agitando la mezcla en un agitador tipo Vortex varias veces durante este intervalo de tiempo.
IMPORTANTE: La soluciÃģn DTT al 0,1 % debe ser preparado antes de usar.
6. Agregar a la muestra anterior, PBS en un volumen 4 veces el peso de la muestra y agitar la mezcla en Vortex durante 5 minutos.
7. Filtrar con gasa o nylon de 48 Ξm para retirar el excedente de mucosidad.
8. Centrifugar la suspensiÃģn celular a 1500 rpm durante 10 minutos.
9. A partir del pellet celular diluir con 0,5 ml de PBS y homogeneizar la muestra con pipeta de pasteur.
10. Realizar recuento celular (RCT) y viabilidad: colocar en un tubo ependorf 30Ξl de la suspensiÃģn celular y 30Ξl de una soluciÃģn al 0,4% de azul de tripan preparada con PBS. Realizar el recuento en cÃĄmara de Neubauer (con microscopio Ãģptico 40X) clasificando las cÃĐlulas como viables (V), no viables (NV) y las cÃĐlulas escamosas (CE) independientemente de su viabilidad.
Anotar el recuento total (E) en la hoja de datos.
El recuento celular total (RCT) serÃĄ el total (E) menos las cÃĐlulas escamosas contaminantes (CE): (E â CE = RCT). Este recuento debe realizarse al menos por dos operadores entrenados. Se debe calcular el porcentaje de viabilidad y de cÃĐlulas escamosas,
El porcentaje de cÃĐlulas contaminantes serÃĄ CE/E Ã 100 = %CE.
Calcular el porcentaje de cÃĐlulas viables: V/RCT Ã 100 = %V.
Se considerarÃĄ una muestra de alta calidad cuando presente: una viabilidad âĨ 40% y una concentraciÃģn de cÃĐlulas epiteliales < 20%12, 36-39.
La suspensiÃģn celular filtrada se ajustarÃĄ con PBS para obtener una concentraciÃģn teÃģrica de alrededor de 1 Ã 106cel/ml.
11. Se deberÃĄn colocar en las copas de la citocentrÃfuga, 50 Ξl de la suspensiÃģn celular (â50.000 cÃĐlulas), para la obtenciÃģn de las improntas. Centrifugar a 500 rpm durante 5 minutos.
12. Las improntas se dejarÃĄn secar completamente a temperatura ambiente y se colorearÃĄn con la tinciÃģn de Giemsa.
13. Realizar el recuento celular diferencial contando al menos 400 cÃĐlulas en microscopio Ãģptico con aumento de 100x por al menos dos operadores entrenados.
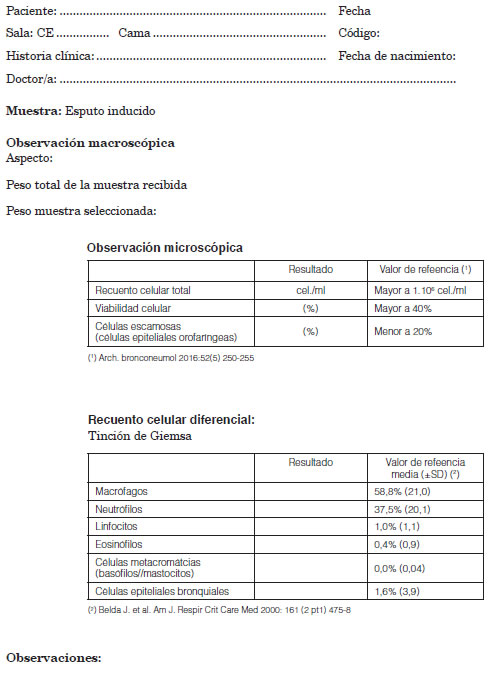
14. RealizaciÃģn del informe (Ver modelo de informe. Anexo II)
3. Utilidad del esputo inducido
La inducciÃģn del esputo es una tÃĐcnica mÃnimamente invasiva y reproducible, que ha sido validada por la Sociedad Europea Respiratoria (ERS8,10-11, y en nuestro paÃs12, permite discriminar diferentes tipos de inflamaciÃģn y ayuda a comprender los procesos inflamatorios subyacentes en pacientes con enfermedad estable y durante una exacerbaciÃģn. Por esta razÃģn, constituye una potencial herramienta para el manejo, optimizaciÃģn de tratamiento y seguimiento de enfermedades inflamatorias broncopulmonares40,41.
Desde hace mÃĄs de una dÃĐcada hay publicaciones que describen que de acuerdo al perfil celular y la evaluaciÃģn de mediadores inflamatorios se puede caracterizar la inflamaciÃģn presente en la vÃa ÃĄrea. Los estudios que comparan el lavado broncoalveolar (LBA) con la tÃĐcnica de esputo inducido en adultos muestran que existe una buena concordancia entre el tipo de cÃĐlulas recuperadas por esputo y muestras de lavado broncoalveolar42, 43. El esputo seleccionado es mÃĄs concentrado que el LBA, tiene una mayor densidad de cÃĐlulas recuperadas y niveles mÃĄs altos biomarcadores en el sobrenadante.
3.1 Valores normales
Los valores del recuento celular diferencial en muestras de esputo inducido en personas sin enfermedades de las vÃas aÃĐreas han sido previamente descriptos9,12. Estudios realizados en pacientes adultos sin enfermedades de la vÃa aÃĐrea y no fumadores demostraron resultados similares, tanto en pacientes con y sin atopia36, 37.
La definiciÃģn de fenotipos inflamatorios de acuerdo al recuento celular diferencial en muestras de esputo44, 45 se describen en la siguiente tabla.
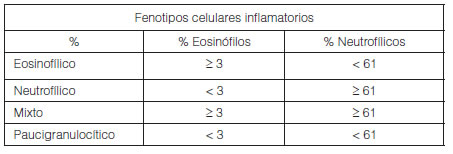
3.2 Valores normales en pediatrÃa
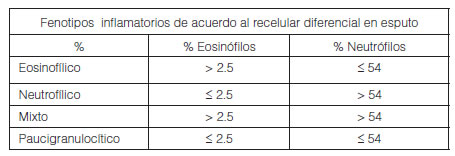
Araujo L34 y Chen46 realizaron estudios a niÃąos sanos demostrando que el recuento celular diferencial en las muestras de esputo no se modifica por la edad, el gÃĐnero o la exposiciÃģn al tabaco (fumadores pasivos). Los rangos normales para los recuentos de cÃĐlulas de esputo en niÃąos estÃĄn bien establecidos47 La cÃĐlula dominante en el esputo de los niÃąos normales es el macrÃģfago (70%), y el lÃmite superior normal para los EosinÃģfilos del esputo es 2,5%48. Los fenotipos inflamatorios de asma en pediatrÃa se detallan a continuaciÃģn39, 49.
Conclusiones
El esputo inducido es una tÃĐcnica que se realiza a nivel mundial con aplicaciones clÃnicas y en investigaciÃģn. Se ha descripto su utilizaciÃģn en adultos y niÃąos mayores de 6 aÃąos, demostrando que el procedimiento es simple y seguro; aunque es necesario realizarlo en centros que cuenten con personal especializado y la infraestructura requerida para el inmediato procesamiento de las muestras. El esputo
inducido constituye una valiosa y Útil herramienta, mÃnimamente invasiva, que posibilita tener una muestra que refleja el perfil inflamatorio de la vÃa aÃĐrea contribuyendo con:
â Pruebas de diagnÃģstico en el asma, EPOC, enfermedades ocupacionales, tos crÃģnica, enfermedad pulmonar intersticial difusa, entre otras.
â SupervisiÃģn de la actividad de la enfermedad
â IndicaciÃģn del inicio y la resoluciÃģn de una exacerbaciÃģn pulmonar aguda
â PrescripciÃģn del tratamiento dirigido e individualizado
â EvaluaciÃģn de la respuesta al tratamiento
â EstratificaciÃģn de los pacientes para los ensayos clÃnicos
â BÚsqueda de nuevos biomarcadores de progresiÃģn o estabilidad de enfermedad
â InvestigaciÃģn FarmacolÃģgica
ANEXOS
ANEXO-1: Consentimiento informado
Practica: inducciÃģn de esputo
Estimado paciente:
El padecimiento respiratorio que Ud. presenta requiere la realizaciÃģn de estudios mÃĄs profundos que permitan conocer el estado de sus vÃas respiratorias, para ayudar a conocer la causa de su enfermedad y poder darle el tratamiento mÃĄs adecuado. Por eso su mÃĐdico ha solicitado la realizaciÃģn de un esputo inducido.
A continuaciÃģn le proporcionamos informaciÃģn respecto al procedimiento de inducciÃģn del esputo, de todos modos el profesional responsable de llevarlo a cabo responderÃĄ cualquier pregunta sobre el mismo. Por favor, sÃrvase leerlo con atenciÃģn y siÃĐntase libre de plantear cualquier duda que le surja. Ud puede negarse a la realizaciÃģn de este estudio, en ese caso su mÃĐdico le indicarÃĄ que otra alternativa existe para el diagnÃģstico.
Esta prÃĄctica permitirÃĄ obtener un mayor conocimiento acerca de su enfermedad respiratoria. El esputo inducido es un procedimiento seguro, de gran utilidad ya que evita la introducciÃģn de instrumental por la vÃa aÃĐrea, como asà tambiÃĐn la realizaciÃģn de punciones o intervenciones quirÚrgicas.
El procedimiento de âinducciÃģnâ consiste en estimular la vÃa aÃĐrea a travÃĐs nebulizaciones con soluciones salinas cada vez mÃĄs concentradas, para provocar tos, y asÃ, recolectar una muestra de esa expectoraciÃģn en un recipiente apropiado. Se le pedirÃĄ que se suene la nariz, se enjuague la boca y expectore, es importante evitar la contaminaciÃģn por secreciÃģn pos nasal o saliva.
El procedimiento puede ser lento, por lo que no debe tener prisa.
Las molestias son mÃnimas, como sentir el sabor salado en la boca. Como evento adverso puede llegar a sentir sensaciÃģn de nauseas, una opresiÃģn torÃĄcica, una sensaciÃģn de falta de aire que generalmente cede sin medicaciÃģn e inmediatamente al suspender la nebulizaciÃģn. Se le administrarÃĄ broncodilatador en forma inhalatoria previo al procedimiento y permanentemente se controlarÃĄ el estado de obstrucciÃģn del bronquio para evitar los sÃntomas adversos.
Una vez obtenido el material, se lo enviara al laboratorio para ser analizado.
El dÃa del estudio le solicitamos que solo tome un desayuno liviano al menos dos horas antes del estudio.

ANEXO 2: Informe
Conflicto de intereses: Los autores declaran no tener conflictos de interÃĐs en relaciÃģn al contenido del presente artÃculo.
Referencias
1. Pavord ID, Sterk PJ, Hargreave FE, et al Clinical applications of assessment of airway inflammation using induced sputum. Eur Respir J Suppl. 2002 ; 37: 40s-43s.
2. Magnussen H, Holz O, Sterk PJ, et al. Noninvasive methods to measure airway inflammation: future considerations. Eur Respir J 2000; 16: 1175-9.
3. Pavord ID, Pizzichini MM, Pizzichini E, et al. The use of induced sputum to investigate airway inflammation. Thorax 1997; 52: 498-501.
4. Gibson PG, Woolley KL, Carty K, et al. Induced sputum eosinophil cationic protein (ECP) measurement in asthma and chronic obstructive airway disease (COAD). Clin Exp Allergy 1998; 28: 1081-8.
5. Gao J, Zhou W, Chen B, et al. Sputum cell count: biomarkers in the differentiation of asthma, COPD and asthma-COPD overlap. Int J Chron Obstruct Pulmon Dis. 2017; 12: 2703- 10.
6. Fahy JV. A safe, simple, standardized method should be used for sputum induction for research purposes. Clin Exp Allergy 1998; 28: 1047-9.
7. OâByrne PM, Inman MD. Induced sputum to assess airway inflammation in asthma. Eur Respir J 1996; 9: 2435-6.
8. Vignola AM, Rennar SI, Hargreave FE, et al. Standardized methodology of sputum induction and processing. Future directions. Eur Respir J Suppl. 2002; 37: 51s-55s.
9. Pin I, Gibson PG, Kolendowicz R, et al. Use of induced sputum cell counts to investigate airway inflammation in asthma. Thorax 1992; 47: 25-9.
10. Djukanovic R, Sterk JV, Fahy JV. 2002 Standardized methodology of sputum induction and processing. Respir J 2002; Suppl. 37,1s-2s.
11. Paggiaro PL, Chanez P, Holz O, et al. Sputum induction. Eur Respir J Suppl. 2002; 37:3s-8s.
12. Uribe EchevarrÃa L, Maldonado C, Uribe Echevarria A, et al. Security, reproducibility and validation of the technique of induced sputum. Arch Allergy Immunol 2003; 34: 41-6.
13. Uribe EcheverrÃa L, Garcia L, Leimgruber C, et al. The induced sputum allows guide a therapeutic strategy to control bronchial asthma. Rev Fac Cien Med Univ Nac CÃģrdoba 2010; 67: 169-76.
14. Uribe EchevarrÃa L, Maldonado CA, Uribe EchevarrÃa AM, et al. Neutrophil predominance in induced sputum from asthmatic patients. Therapeutic implications and role of Clara cell 16-KD protein. Medicine (B Aires) 2011; 71: 343-9.
15. Uribe EchevarrÃa L. Evidencias de la utilidad del esputo inducido en el diagnÃģstico y seguimiento de las enfermedades respiratorias ocupacionales Rev Am Med Resp 2011; 11: 210-2.
16. Uribe EchevarrÃa L. Implicancias de la muerte del neutrÃģfilo por NETtosis en la fisiopatogÃĐnia de la enfermedad pulmonar obstructiva crÃģnica. Rev Am Med Resp 2015; 15: 94-6.
17. Uribe EchevarrÃa L, Leimgruber C, GarcÃa GonzÃĄlez J, et al. Evidence of eosinophil extracellular trap cell death in COPD: does it represent the trigger that switches on the disease? Int J Chron Obstruct Pulmon Dis 2017; 14: 885-96.
18. Uribe EchevarrÃa L, GarcÃa GonzÃĄlez J, Nevado A, et al. Diagrama A-D GOLD 2011 bajo el microscopio. Respondiendo a la fisiopatogÃĐnia de la EPOC con implicancias en el manejo de la enfermedad. Rev Am Med Resp 2017; 17: 71-6.
19. Ernst G, Auteri S, Caro F, et al. Significant Increase of IL-8 Sputum Levels in Treatment Resistant Severe Asthma Compared with Difficult to Treat Severe Asthma Patients. J Genet Syndr Gene Ther 2014; 5: 218.
20. Camargo B, Di Tullio F, Bosio M, et al. Heterogeneidad en los fenotipos inflamatorios de los pacientes con EPOC: rol del recuento celular diferencial en esputo. Rev Am Med Respir 2016; 16: 128-36.
21. Ernst G, Camargo B, Pascua J, et al. Recuento diferencial celular en muestras de esputo inducido de pacientes asmÃĄticos como mediadores inflamatorios de la vÃa aÃĐrea. Rev Front Med 2018; 1: 36-9.
22. Hargreave FE, Pizzichini E. Pizzichini M. Induced sputum examination. J Allergy Clin Immunol 1998; 101: 569-70.
23. Guiot J, Demarche S, Henket M, et al. Methodology for Sputum Induction and Laboratory Processing. J Vis Exp 2017: (130): e56612.
24. Recommended Guidance for Extended Use and Limited Reuse of N95 Filtering Facepiece Respirators in Healthcare Settings. https://www.cdc.gov/niosh/topics/hcwcontrols/recommendedguidanceextuse.html, (consultado 29/03/2018).
25. Pizzichini E, Pizzichini MM, Leigh R, DjukanoviÄ R, Sterk PJ. Safety of sputum induction. Eur Respir J Suppl. 2002; 37: 9s-18s
26. Cianchetti S, Bacci E, Ruocco L, et al. Salbutamol pretreatment does not change eosinophil percentage and eosinophilic cationic protein concentration in hypertonic saline-induced sputum in asthmatic subjects. Clin Exp Allergy 1999; 29: 712-8.
27. Plaza Moral V; ComitÃĐ Ejecutivo de GEMA. GEMA (4.0). Guidelines for Asthma Management. ArchBronconeumol 2015;51 Suppl 1:2-54.
28. Popov TA, Pizzichini MM, Pizzichini E, et al. Some technical factors influencing the induction of sputum for cell analysis. Eur Respir J. 1995; 8: 559-65.
29. Holz O, JÃķrres RA, Koschyk S, et al. Changes in sputum composition during sputum induction in healthy and asthmatic subjects. Clin Exp Allergy. 1998; 28: 284-92.
30. Toungoussova O, Migliori GB, Foschino Barbaro MP, et al. Changes in sputum composition during 15 min of sputum induction in healthy subjects and patients with asthma and chronic obstructive pulmonary disease. Respir Med 2007; 101: 1543-8.
31. Gershman NH, Liu H, Wong HH, Liu JT, Fahy JV. Fractional analysis of sequential induced sputum samples during sputum induction: evidence that different lung compartments are sampled at different time points. J Allergy Clin Immunol 1999; 104(2 Pt 1): 322-8.
32. Gibson PG, Henry RL, Thomas P. Noninvasive assesment of airway inflammation in children: induced sputum, exhaled nitric oxide, and breath condesate. Eur Respir J 2000: 16: 1008-15.
33. Covar RA, Spahn JD, Martin RJ, et al. Safety and application of induced sputum analysis in childhood asthma. J Allergy Clin Inmunol 2004: 114: 575-82.
34. AraÚjo L, Moreira A, Palmares C, et al. Induced sputum in children: success determinants, safety, and cell profiles. J Investig Allergol Clin Immunol 2011; 21: 216-21.
35. Manual de bioseguridad en el laboratorio de tuberculosis 2013. http://www.who.int/tb/publications/2012/tb_biosafety/es/ (consultado el 13/3/2018).
36. Spanevello A, Confalonieri M, Sulotto F et al. Induced sputum cellularity. Reference values and distribution in normal volunteers. Am J RespirCrit Care Med 2000; 162(3 Pt 1): 1172-4.
37. Veras TN, Pizzichini E, Steidle LJ, et al. Cellular composition of induced sputum in healthy adults. J Bras Pneumol. 2011; 37: 348-53.
38. Efthimiadis A, Spanevello A, Hamid Q, et al. Methods of sputum processingfor cell counts, inmunocytochemistry and in situ hybridisation. Eur Respir J Suppl. 2002 Sep; 19s-23s.
39. Lex C, Payne DN, Zacharasiewicz A, Li AM, Wilson NM, Hansel TT, Bush A. Sputum induction in children with difficult asthma: safety, feasibility and inflammatory cell pattern. Pediatric pulmonol. 2005; 39: 318-24.
40. Mazzei JA, Rocher AE, Palaoro L. Valor del estudio celular del esputo en el seguimiento de las enfermedades inflamatorias de la vÃa aÃĐrea. Medicina (B. Aires); 2012; 72: 332-8.
41. Barril S, SebastiÃĄn L, Cotta G et al. Utilidad del esputo inducido en la prÃĄctica clÃnica habitual. ArchBronconeumol 2016;52(5):250-255
42. Grootendorst DC, Sont JK, Willems LN, et al. Comparison of inflammatory cell counts in asthma: induced sputum vs bronchoalveolar lavage and bronchial biopsies. Clin Exp Allergy 1997; 27: 769-779.
43. Pizzichini E, Pizzichini MM, Kidney JC, et al. Induced sputum, bronchoalveolar lavage and blood from mild asthmatics: inflammatory cells, lymphocyte subsets and soluble markers compared. Eur Respir J 1998; 11: 828-34.
44. Baines KJ, Simpson JL, Wood LG, Scott RJ, Gibson PG. Systemic upregulation of neutrophil alpha-defensins and serine proteases in neutrophilic asthma. Thorax. 2011; 66: 942â7.
45. Simpson JL, McElduff P, Gibson PG. Assessment and reproducibility of non-eosinophilic asthma using induced sputum. Respiration. 2010; 79: 147-51.
46. Chen DH, Zhong GY, Luo W, et al. Reference values of induced sputum cytology in healthy children in Guangzhou, southern china. Pediatrics 2013; 131: e518-524.
47. Cai Y, Carty K, Henry RL, Gibson PG. Persistence of sputum eosinophilia in children with controlled asthma when compared with healthy children. Eur Respir J 1998; 11: 848-53.
48. Gibson PG, Henry RL, Thomas P. Noninvasive assesment of airway inflammation in children: induced sputum, exhaled nitric oxide, and breath condensate. Eur Respir J. 2000; 16: 1008-15.
49. Fleming L, Tsartsali L, Wilson N, Regamey N, Bush A. Sputum inflammatory phenotypes are not stable in children with asthma. Thorax. 2012; 67: 675-81.