Autor : Ruiz Vanesa R1, Mayer German F2, Battellini Yulián M3, Peralta Hugo A4, Roux Nicolás G5, Midley Alejandro D6
1 Licenciada en KinesiologĂa y FisiatrĂa, Hospital Italiano de Buenos Aires, Argentina 2 Licenciado en KinesiologĂa y FisiatrĂa, Hospital Italiano de Buenos Aires, Argentina 3 Licenciado en KinesiologĂa y FisiatrĂa, Hospital Italiano de Buenos Aires, Argentina 4 MĂ©dico EmergentĂłlogo, Coordinador de Docencia de la Central de Emergencias de Adultos Hospital Italiano de Buenos Aires 5 Licenciado en KinesiologĂa y FisiatrĂa, Coordinador SecciĂłn Cuidados Respiratorios Hospital Italiano de Buenos Aires 6 Licenciado en KinesiologĂa y FisiatrĂa, Jefe de Servicio de KinesiologĂa, Hospital Italiano de Buenos Aires
Correspondencia : Hospital Italiano, Pres. Tte. Gral. Juan Domingo PerĂłn 4190, Ciudad AutĂłnoma de Buenos Aires, Argentina Contacto: Ruiz, Vanesa. TĂ©lefono: +5491159057497 - e-mail: vanesa.ruiz@hospitalitaliano.org.ar
Resumen
Objetivo: Describir los cambios observados en la frecuencia respiratoria, la frecuencia cardiaca y la puntuación de disnea antes y después de la utilización de un dispositivo alternativo de cánula nasal de alto flujo en pacientes con falla respiratoria aguda hipoxémica en una central de emergencias.
Materiales y método: Estudio cuasi experimental y retrospectivo con pacientes adultos que acudieron a la central de emergencias con signos clínicos de falla respiratoria aguda hipoxémica. Los datos de frecuencia respiratoria, frecuencia cardíaca y la puntuación de disnea se recolectaron de la historia clínica electrónica antes y después de dos horas de haber utilizado un dispositivo Venturi conectado a un sistema de cánula nasal de alto flujo.
Resultado: Se incluyeron 43 pacientes. La media de edad fue de 64.7 (DE 16) años. La principal causa de la falla respiratoria fue la neumonía en 18 pacientes (42%). Se observó que la frecuencia respiratoria disminuyó 8 respiraciones por minuto (p < .001), la frecuencia cardiaca disminuyó 7 latidos por minuto (p < .001) y la puntuación de la disnea disminuyó 2 puntos (p < .001).
Conclusiones: Se observó una disminución significativa de las tres variables estudiadas en los pacientes que acudieron a la central de emergencias con falla respiratoria aguda hipoxémica, con la utilización de un dispositivo de oxigenoterapia no convencional, el cual podría considerarse en países con recursos limitados o en los escenarios de superpoblación, tan frecuentes en las centrales de emergencia.
Palabras claves: Oxigenoterapia; Medicina de emergencia; Modalidades de fisioterapia; Fallo respiratorio; Terapia respiratoria.
Introducción
La falla respiratoria aguda (FRA) es un motivo de ingreso frecuente a las Centrales de Emergencias (CE). Según la etiología y la gravedad de la FRA, los pacientes pueden ser tratados con terapia de oxígeno convencional, con ventilación mecánica no invasiva (VNI) o ventilación invasiva. La terapia de oxígeno convencional presenta ciertas limitaciones, como el bajo flujo de gas aportado, las concentraciones variables de oxígeno medicinal, y el poco calor y humedad que presenta la mezcla de gases entregada1-3.
En relación a la VNI, algunos pacientes muestran una baja adherencia debido a la intolerancia a la interfaz seleccionada, a las fugas excesivas o a la incomodidad por los arneses o sistemas de fijación que suelen estar apretados4. Además, el uso de la VNI en la FRA hipoxémica es un tema controversial cuyo fracaso está asociado a resultados desfavorables5, 6.
La cánula nasal de alto flujo de oxígeno (CNAF) surge como una nueva opción de oxigenoterapia para el tratamiento clínico de pacientes adultos con FRA hipoxémica6. Existen equipos de turbina o microprocesados que son capaces de generar flujos de hasta 50 o 60 litros por minuto (L/min) de mezcla de gases humidificados y calentados a temperatura corporal (37 °C), con una concentración de oxígeno de hasta un 100%. Estos equipos tienen al flujo como una constante, es su variable independiente, esto quiere decir que pase lo que pase en el sistema, el flujo no se debería modificar. Pero también, otros dispositivos son capaces de generar altos flujos, como el sistema WhisperFlow®. Este dispositivo o similares se encuentran disponibles en la mayoría de las CE, y su funcionamiento se basa en el principio Venturi, utilizando un suministro de gas (oxígeno medicinal) y tomando aire ambiente, aumentando el flujo de salida. Es por ello que el flujo final es el resultado de la relación entre el flujo de ingreso del gas y el aire ambiente que ingresa por la caída de la presión dentro del dispositivo, pudiendo llegar hasta 150L/min, con una Fracción Inspirada de Oxígeno (FiO2) entre 0.30 y 1 (30% y 100%).
Existe un interés creciente por el uso de CNAF en pacientes con FRA hipoxémica ya que un ensayo clínico controlado y aleatorizado propuesto por Frat y cols. documentó resultados favorables7. Además, otras dos revisiones han demostrado la eficacia clínica de la CNAF en pacientes con FRA hipoxémica causada por una variedad de afecciones médicas. Los resultados mostraron un alivio de la disnea, una reducción del trabajo respiratorio con mejoras en la oxigenación y el confort del paciente1-5, 7-8. Hay una serie de mecanismos que podrían explicar estos efectos beneficiosos: la generación de niveles bajos de presión positiva en las vías respiratorias al final de la espiración, el acondicionamiento del gas inspirado, la mejora en el aclaramiento mucociliar pulmonar, como así también, la reducción del costo metabólico de la respiración, del espacio muerto anatómico y de la resistencia inspiratoria al igualar o exceder el flujo inspiratorio del paciente9-11.
La mayor parte de la evidencia científica disponible sobre el uso de CNAF se ha realizado en poblaciones de adultos con FRA hipoxémica en Unidades de Cuidados Intensivos (UCI)3, 7, 9, 12-15, sin embargo, su uso ha sido poco investigado en las CE16–20. No hemos encontrado ningún otro trabajo que haya utilizado un dispositivo Venturi para generar altos flujos en una CE por lo que el objetivo de este estudio es describir los cambios observados en la frecuencia respiratoria (FR), la frecuencia cardiaca (FC) y la puntuación en la escala de disnea, antes y después de la utilización un dispositivo alternativo de CNAF en pacientes adultos con FRA hipoxémica en nuestra CE.
Materiales y método
Diseño del estudio: Se realizó un estudio cuasi experimental y retrospectivo. La CE pertenece a un hospital escuela que recibió más de 55000 consultas en el año 2015. Argentina es un país con recursos limitados donde los sistemas convencionales de alto flujo no están disponibles en la mayoría de los centros médicos. En su lugar se utilizó un dispositivo Venturi para generar el alto flujo, el cual normalmente es usado para entregar presión positiva continua en la vía aérea (CPAP). El equipo utiliza un suministro de oxígeno de 60 psi (412 kPa) que en conjunto al aire ambiente que ingresa al dispositivo por mecanismo Venturi, genera el flujo de salida (Whisper Flow®). Puede generar flujos desde 10 hasta 150 L/min y entregar una FiO2 entre 0.30 y 1.0. Además, el seteo de la FiO2 en este equipo, no es independiente al del flujo, por lo que iniciamos la terapia con la mínima FiO2 necesaria para mantener una saturación de oxígeno (SpO2) por encima de 94% con un flujo de gas de 60 L/min, según la tolerancia del paciente9, 15, 21. Se utilizó un sistema de humidificación activa (MR850 con carcasa MR 290) para calentar y humidificar la mezcla de gases, a una temperatura de 37 °C, y entregarla al paciente por un circuito de rama única calentada (RT241) a través de una cánula nasal (Optiflow®). Además se utilizó un sensor de oxígeno (Criterion® Oxicheck, Respironics®) para medir la FiO2 entregada y un monitor de mecánica respiratoria (FluxMed®, MBMed®) para medir el flujo de aire. (Figura 1)
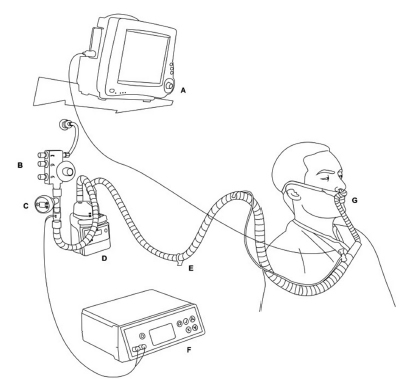
Selección de sujetos
Se incluyeron pacientes mayores de 18 años que ingresaron a la CE con signos clínicos de FRA hipoxémica, con o sin antecedentes de enfermedad pulmonar, con requerimientos de CNAF, y también aquellos con adecuación del tratamiento de soporte vital (ATSV) con FRA hipoxémica durante un periodo de tiempo comprendido entre el 1 de julio del año 2015 y el 31 de enero del 2017.
La decisión de ATSV fue previa al ingreso a la CE y se consensuó entre el equipo médico tratante y el paciente y/o familiares y se consignó en la historia clínica como paciente con directivas anticipadas.
La decisión de comenzar la terapia de alto flujo de oxígeno se basó en los signos y síntomas clínicos del paciente: FR ≥ 25 respiraciones/min, SpO2 < 90% respirando aire ambiente (FiO2 21%) y aumento del trabajo respiratorio (WOB) evidenciado por sensación de disnea, utilización de músculos accesorios o diaforesis, a pesar de la terapia de oxígeno convencional a ≥ 6 L/min16, 18, 22.
En casos de FRA hipercápnica, se utilizó VNI, sin embargo en casos de FRA mixta se consideró la terapia de oxígeno con CNAF, ya que la bibliografía disponible menciona que pacientes con intolerancia a la máscara pueden beneficiarse de una prueba con esta terapia23–25.
Variables y medidas
Los datos se recolectaron desde el registro médico diario en la historia clínica electrónica, incluyendo la FR, FC y la disnea de acuerdo a la puntuación en la escala de Borg modificada. Las variables se recolectaron antes y después de dos horas de utilización de la CNAF. También se recolectó el valor de FiO2 y de flujo utilizado al comienzo de la terapia con CNAF, junto con el tiempo de uso, el éxito o el fracaso del tratamiento y la mortalidad hospitalaria a los 28 días.
La terapia se comenzó con un flujo de 60L/min y se ajustó de acuerdo a la tolerancia del paciente9,15,22. El objetivo fue lograr el mayor flujo posible tolerado por el paciente para poder igualarlo con el flujo inspiratorio del paciente en FRA, que suele alcanzar incluso hasta los 120 L/min14.
La presión parcial de oxígeno (PaO2) y los valores de PaO2/FiO2 y SpO2/FiO2 solo estuvieron disponibles en el período post tratamiento, luego de 2 horas de haber iniciado la terapia con CNAF, ya que en la práctica clínica habitual de nuestra CE, el análisis de gases arteriales se realiza una vez que ha sido colocado el acceso arterial. También se registraron las características basales de la población en relación a la edad, sexo, etiología de la FRA y antecedentes de enfermedad respiratoria o cardiovascular (diagnosticados mediante pruebas de función pulmonar; tomografía axial computarizada, ecocardiografía o ecografía pulmonar, según se haya considerado apropiado).
Definimos éxito de la terapia con CNAF cuando el paciente no requirió escalar a otro tipo de soporte ventilatorio, ya sea invasivo o no invasivo, dentro de las primeras 24 horas de inicio de la terapia con alto flujo. Por el contrario, si el paciente requirió VNI o apoyo ventilatorio invasivo durante las primeras 24 horas luego del inicio de la terapia, se lo consideró como fracaso terapéutico22. Los criterios de destete de la CNAF fueron: FiO2 < 30% para SpO2 ≥ 92% y FR ≤ 25 respiraciones por minuto durante al menos 6 horas7. Las contraindicaciones que se consideraron para recibir la terapia de alto flujo fueron: alteración del nivel de conciencia, claustrofobia, obstrucción de las vías respiratorias, lesión o malformación facial, riesgo de aspiración, arritmia intratable o paro respiratorio26. La intubación se consideró cuando se presentaron dos o más de los siguientes criterios dentro de las primeras dos horas de uso de CNAF: deterioro del estado de conciencia, hipotensión a pesar del tratamiento de reanimación con líquidos, FR > 35 respiraciones por minuto, PaO2/FiO2 < 150, aumento de WOB, SpO2 < 90%, mal manejo de secreciones y disminución del pH sanguíneo27, 28.
Normas éticas
Todos los procedimientos de esta investigación se ajustaron acorde a los principios éticos acorde a la Declaración de Helsinki del año 1964 y su enmiendas posteriores, y recibieron la aprobación del Comité de Ética de Protocolos de Investigación de nuestro Hospital. Para este tipo de estudio no se requirió un consentimiento informado formal ya que ningún dato del paciente se incluyó en el manuscrito.
Análisis estadístico
Las variables continuas fueron presentadas como Media y Desvío Estándar o Mediana y Rango Intercuartil (RIC) según su distribución, mientras que las variables categóricas fueron presentadas en frecuencias absolutas y porcentajes. Para la comparación entre las variables pre-CNAF y post-CNAF, utilizamos la prueba de T pareada. Consideramos un valor de p < 0.05 como estadísticamente significativo. Los datos se analizaron con el software STATA (StataCorp versión 14.2).
Resultados
Se incluyeron un total de 43 pacientes en el estudio, 23 (54.5%) eran hombres, con una media de edad de 64.7 (DE 16) años. Las características basales de los pacientes antes del inicio del tratamiento se resumen en la Tabla 1. El 72% de los pacientes tenía antecedentes clínicos de enfermedades respiratorias. La principal etiología de la FRA hipoxémica fue la neumonía, diagnosticada en 18 pacientes (42%). Diez (23%) pacientes con FRA hipoxémica tenían un estado de ATSV. Ocho pacientes tenían FRA mixta con intolerancia a la VNI y se trataron con CNAF.
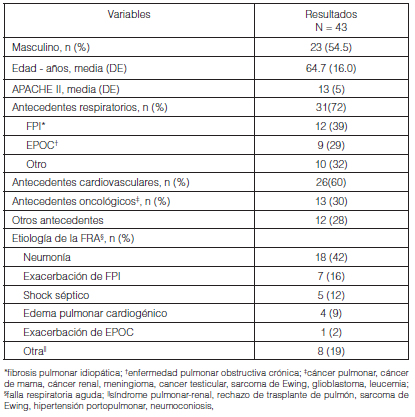
Observamos una reducción significativa de la FR, FC y de la puntuación de la escala de disnea después de dos horas de terapia con CNAF. Cuando estratificamos a la población en estudio, en un grupo FRA y otro grupo FRA con ATSV, se observó una reducción significativa en los tres parámetros estudiados en el grupo FRA. Sin embargo, en el grupo de FRA con ATSV no se observaron cambios significativos en la puntuación de la disnea. Estos resultados se resumen en la Tabla 2.
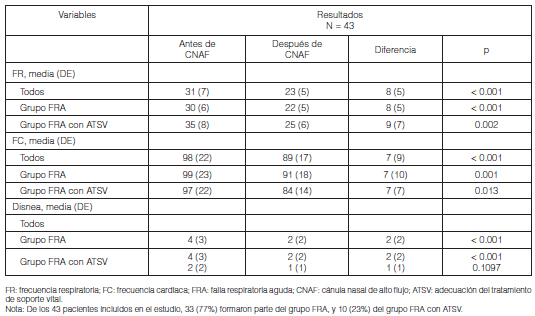
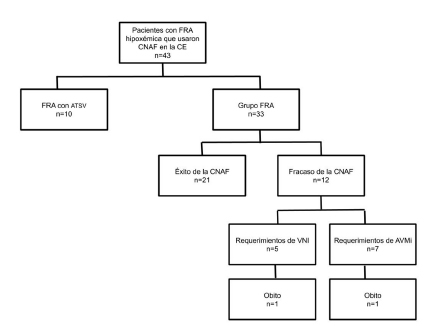
El tiempo de la terapia con CNAF fue de 28.5 (RIQ 13-50) horas. La terapia con CNAF fue exitosa en 21 (63.6%) pacientes. Los resultados se muestran en la Figura 2. Sólo siete pacientes fueron intubados y cinco pacientes requirieron VNI. Dos pacientes murieron en el grupo FRA sin ATSV. Uno de ellos tenía antecedentes de insuficiencia cardíaca congestiva y cáncer de riñón con requerimientos de diálisis crónica y el médico junto con familiares, decidieron limitar el tratamiento. El otro paciente tenía antecedentes de silicosis y hepatitis C crónica y falleció debido a la progresión de esta enfermedad pulmonar en espera de trasplante de pulmón.
El valor de la media de FiO2 administrada al inicio del tratamiento con CNAF fue de 0,46 (DE 0,15) y de la tasa de flujo de gas inicial fue de 59 (DE 16) L/min. La mediana del valor de PaO2 luego de dos horas de iniciada la terapia con CNAF en 20 pacientes del grupo FRA (61%) fue de 122 (RIQ: 113-153) y de PaO2/FiO2 fue de 282 (RIQ: 230-395). La mediana del valor de SpO2 y SpO2/FiO2 luego de dos horas de iniciarse la terapia con CNAF en 31 pacientes del grupo FRA (94%) fue de 97 (RIC: 95-98) y de 220 (RIC: 163-250) respectivamente.
Discusión
En nuestro estudio, encontramos una reducción significativa de la FR, FC y puntuación en la escala de disnea con el uso de la CNAF en pacientes con FRA en la CE. Estos resultados están respaldados por estudios previos que también mostraron reducciones en la FR12, 13, 16, 17, 19, 20, FC7, 12, 17, 19 y la sensación de disnea12, 13, 16 en las UCI y CE utilizando dispositivos de alto flujo convencionales. Con respecto a la FR, nuestro estudio muestra valores similares a los documentados por Rittamayani y cols., o incluso por debajo a la de otros estudios realizados en CE16, 17. Lenglet y cols. observaron una reducción de tres puntos en la FR después de 60 minutos de terapia con CNAF mientras que nosotros observamos unareducción mayor16. Según Sztrymf y cols., la disminución significativa de la FR es un indicador de éxito de la terapia con CNAF3, 16. Con respecto a la puntuación de la disnea, nuestros resultados muestran una disminución de 2 puntos, lo que se traduce en una reducción significativa en la escala de Borg modificada de “Algo severo” a “Leve”. Esta reducción es similar a la reportada por Schwabbauer y cols. y ligeramente inferior a la reportada por Lenglet y cols3. A pesar de que el objetivo de tratamiento en el grupo ATSV fue el alivio paliativo de la disnea, nosotros no encontramos una reducción significativa en la puntuación de la disnea en este grupo de pacientes29. Esto puede deberse a la pequeña cantidad de sujetos y a los bajos puntajes de disnea iniciales. Con respecto a la FC, aunque encontramos una diferencia estadísticamente significativa, no encontramos una reducción clínicamente significativa con la terapia de CNAF, en relación a lo informado por otros autores9.
Con la intención de analizar la tasa de fracaso de la CNAF, excluimos a los pacientes con estado de ATSV que recibieron terapia en el contexto de cuidados paliativos. Encontramos que un tercio de los pacientes presentaron fracaso a la terapia (un 15% de los pacientes requirió VNI y un 21% requirió asistencia ventilatoria mecánica invasiva). A pesar de la severidad medida por un valor de APACHE ≥ 12 puntos ha sido reportada como causa de fracaso de la terapia de CNAF por Rello y cols; fue similar a la reportada por Sztrymf y cols. (24%), Frat y cols. (38%), y Messika y cols. (40%) en UCI3, 7, 15, 27. Sin embargo, dicha tasa fue superior a los demás estudios realizados en las CE, como por ejemplo Lenglet y cols. (11.8%), Hughes y cols. (5.2%) y Jones y cols. (3.6%) en las CE16, 19, 20. Una posible explicación de la elevada tasa de fracaso, puede ser que hubo pacientes que usaron VNI de forma regular (por ejemplo, para el tratamiento del síndrome de apnea obstructiva del sueño) o que seguían protocolos de tratamiento en otras áreas críticas30. Finalmente Hyun Cho y cols. reportaron una asociación entre la puntuación de APACHE II y la tasa de mortalidad en la UCI31, pero nuestra mortalidad hospitalaria para el grupo de FRA fue del 6% a los 28 días, similar a la reportada por Sztrymf y cols. y Jones y cols. en CE (9.1%)3, 20.
Nuestro estudio tiene varios puntos fuertes. Primero, aborda el manejo de pacientes con signos clínicos de FRA hipoxémica en un servicio de urgencias, un área en donde todavía hay mucho conocimiento por generar y profundizar. En segundo lugar, describe el uso de un nuevo dispositivo para generar un alto flujo que cuesta hasta 10 veces menos que los dispositivos convencionales y permite mayores caudales de gases, pudiendo ser un dispositivo alternativo para países de bajos recursos con accesos limitados a dispositivos de CNAF convencionales. Si consideramos que el flujo inspiratorio de un paciente durante la FRA puede alcanzar los 120 L/min, entonces el aporte de un flujo más alto podría ser beneficioso si es tolerado por el paciente14. Por otro lado, la heterogeneidad de presentaciones clínicas de nuestra muestra representa la realidad diaria de consultas en las CE.
El análisis retrospectivo de los datos clínicos de un pequeño número de sujetos, puede limitar la generalización de nuestros hallazgos. Sin embargo, en la Argentina no está permitida la excepción a la firma del consentimiento informado, como pasa en otros países, por lo cual la realización de estudios prospectivos en el ámbito de emergencias se torna poco factible. Además la situación de emergencia dificulta el proceso de explicación del mismo, el paciente no se halla en condiciones clínicas y muchas veces los familiares no se encuentran presentes. Otra limitación que encontramos fue la falta de valores de FiO2 o de gases en sangre arterial antes del inicio de la terapia con CNAF. Además, no pudimos controlar otras variables como el uso de broncodilatadores, antibióticos, diuréticos, hidrocortisona, etc. y, por lo tanto, no podemos atribuirle la total magnitud del efecto, en relación al cambio en los signos vitales o la sensación de disnea, a la terapia de alto flujo. Así mismo, se debe tener en cuenta que la disnea es un parámetro subjetivo y, por lo tanto, es difícil medirla con precisión. Finalmente no hubo grupo control sin CNAF, los pacientes fueron sus propios controles.
Conclusión
En los pacientes que se presentaron en el CE con signos clínicos de FRA hipoxémica, observamos una reducción significativa de la FR, la FC y la puntuación de disnea con un dispositivo de CNAF no convencional. Estos resultados fueron similares a los encontrados en las UCI o CE cuando se utilizan dispositivos de CNAF convencionales. Por lo tanto, este sistema Venturi puede ser una terapia alternativa en entornos de recursos limitados o en situaciones de superpoblación con escasez de equipos, tan frecuentes en las CE. Sin embargo, la eficacia de este equipo debería explorarse con mayor profundidad en ensayos clínicos controlados y aleatorizados.
Conflicto de interés: Los autores declaran que no tienen conflicto de intereses.
1. Roca O, Hernández G, Díaz-Lobato S, Carratalá JM, Gutiérrez RM, Masclans JR; Spanish Multidisciplinary Group of High Flow Supportive Therapy in Adults (HiSpaFlow). Current evidence for the effectiveness of heated and humidified high flow nasal cannula supportive therapy in adult patients with respiratory failure. Crit Care. 2016; 20: 109.
2. El-Khatib MF. High-flow nasal cannula oxygen therapy during hypoxemic respiratory failure. Respir Care. 2012; 57: 1696-8.
3. Sztrymf B, Messika J, Mayot T, Lenglet H, Dreyfuss D, Ricard JD. Impact of high-flow nasal cannula oxygen therapy on intensive care unit patients with acute respiratory failure: a prospective observational study. J Crit Care. 2012; 27: 324.e9-13.
4. Hill NS, Brennan J, Garpestad E, Nava S. Noninvasive ventilation in acute respiratory failure. Crit Care Med. 2007; 35: 2402-7.
5. Ferrer M, Esquinas A, Leon M, Gonzalez G, Alarcon A, Torres A. Noninvasive ventilation in severe hypoxemic respiratory failure: a randomized clinical trial. Am J Respir Crit Care Med. 2003; 168: 1438-44.
6. Keenan SP, Sinuff T, Cook DJ, Hill NS. Does noninvasive positive pressure ventilation improve outcome in acute hypoxemic respiratory failure? A systematic review. Crit Care Med. 2004; 32: 2516-23.
7. Frat JP, Thille AW, Mercat A, et al; FLORALI Study Group; REVA Network. High-flow oxygen through nasal cannula in acute hypoxemic respiratory failure. N Engl J Med. 2015;372: 2185-96.
8. Kernick J, Magarey J. What is the evidence for the use of high flow nasal cannula oxygen in adult patients admitted to critical care units? A systematic review. Aust Crit Care. 2010; 23: 53-70.
9. Vargas F, Saint-Leger M, Boyer A, Bui NH, Hilbert G. Physiologic Effects of High-Flow Nasal Cannula Oxygen in Critical Care Subjects. Respir Care. 2015; 60: 1369-76.
10. Hernández G, Roca O, Colinas L. High-flow nasal cannula support therapy: new insights and improving performance. Crit Care. 2017; 21: 62.
11. Spoletini G, Alotaibi M, Blasi F, Hill NS. Heated Humidified High-Flow Nasal Oxygen in Adults: Mechanisms of Action and Clinical Implications. Chest. 2015; 148: 253-61.
12. Schwabbauer N, Berg B, Blumenstock G, Haap M, Hetzel J, Riessen R. Nasal high-flow oxygen therapy in patients with hypoxic respiratory failure: effect on functional and subjective respiratory parameters compared to conventional oxygen therapy and non-invasive ventilation (NIV). BMC Anesthesiol. 2014; 14: 66.
13. Lemiale V, Mokart D, Mayaux J, et al. The effects of a 2-h trial of high-flow oxygen by nasal cannula versus Venturi mask in immunocompromised patients with hypoxemic acute respiratory failure: a multicenter randomized trial. Crit Care. 2015; 19: 380.
14. Sztrymf B, Messika J, Bertrand F, et al. Beneficial effects of humidified high flow nasal oxygen in critical care patients: a prospective pilot study. Intensive Care Med. 2011; 37: 1780-6.
15. Messika J, Ben Ahmed K, Gaudry S, et al. Use of High-Flow Nasal Cannula Oxygen Therapy in Subjects With ARDS: A 1-Year Observational Study. Respir Care. 2015; 60: 162-9.
16. Lenglet H, Sztrymf B, Leroy C, Brun P, Dreyfuss D, Ricard JD. Humidified high flow nasal oxygen during respiratory failure in the emergency department: feasibility and efficacy. Respir Care. 2012; 57: 1873-8.
17. Rittayamai N, Tscheikuna J, Praphruetkit N, Kijpinyochai S. Use of High-Flow Nasal Cannula for Acute Dyspnea and Hypoxemia in the Emergency Department. Respir Care. 2015; 60: 1377-82.
18. Jeong JH, Kim DH, Kim SC, et al. Changes in arterial blood gases after use of high-flow nasal cannula therapy in the ED. Am J Emerg Med. 2015;33:1344-9.
19. Hughes J, Doolabh A. Heated, humidified, high-flow nasal oxygen usage in the adult Emergency Department. Australas Emerg Nurs J. 2016; 19: 173-8.
20. Jones PG, Kamona S, Doran O, Sawtell F, Wilsher M. Randomized Controlled Trial of Humidified High-Flow Nasal Oxygen for Acute Respiratory Distress in the Emergency Department: The HOT-ER Study. Respir Care. 2016; 61: 291-9.
21. Parke R, McGuinness S, Eccleston M. Nasal high-flow therapy delivers low level positive airway pressure. Br J Anaesth. 2009; 103: 886-90.
22. Parke RL, McGuinness SP, Eccleston ML. A preliminary randomized controlled trial to assess effectiveness of nasal high-flow oxygen in intensive care patients. Respir Care. 2011; 56: 265-70.
23. Lepere V, Messika J, La Combe B, Ricard JD. High-flow nasal cannula oxygen supply as treatment in hypercapnic respiratory failure. Am J Emerg Med. 2016; 34: 1914.e1-2.
24. Plotnikow G, Thille AW, Vasquez D, Pratto R, Desmery P. High-flow nasal cannula oxygen for reverting severe acute exacerbation of chronic obstructive pulmonary disease: A case report. Med Intensiva. 2017; 41: 571-2.
25. Pisani L, Fasano L, Corcione N, Comellini V, Musti MA, Brandao M, et al. Change in pulmonary mechanics and the effect on breathing pattern of high flow oxygen therapy in stable hypercapnic COPD. Thorax. 2017; 72: 373-5.
26. Nishimura M. High-flow nasal cannula oxygen therapy in adults. J Intensive Care. 2015; 3: 15.
27. Rello J, Pérez M, Roca O, et al; CRIPS investigators. High-flow nasal therapy in adults with severe acute respiratory infection: a cohort study in patients with 2009 influenza A/H1N1v. J Crit Care. 2012; 27: 434-9.
28. Frat JP, Brugiere B, Ragot S, et al. Sequential application of oxygen therapy via high-flow nasal cannula and noninvasive ventilation in acute respiratory failure: an observational pilot study. Respir Care. 2015; 60: 170-8.
29. Peters SG, Holets SR, Gay PC. High-flow nasal cannula therapy in do-not-intubate patients with hypoxemic respiratory distress. Respir Care. 2013; 58: 597-600.
30. Brochard L, Mancebo J, Wysocki M, et al. Noninvasive ventilation for acute exacerbations of chronic obstructive pulmonary disease. N Engl J Med. 1995; 333: 817-22.
31. Hyun Cho W, Ju Yeo H, Hoon Yoon S, et al. High-Flow Nasal Cannula Therapy for Acute Hypoxemic Respiratory Failure in Adults: A Retrospective Analysis. Intern Med. 2015; 54: 2307-13.