Autor : Alvarez Bertea Juan Pablo1, Gatica David1, 2, Lisanti Raúl1, 2
1 Hospital Del Carmen. Pcia de Mendoza. Argentina.
2 Instituto de Investigaciones Respiratorias. Mendoza. Argentina
Correspondencia : David Gatica; e-mail drdavidgatica@gmail.com
Introducción
La debilidad del músculo diafragmático es la principal causa de falla respiratoria en los pacientes con enfermedad de Pompe, una miopatía metabólica progresiva que afecta a distintos músculos esqueléticos incluidos los respiratorios. La identificación y valoración funcional temprana de estos pacientes es necesaria para iniciar un tratamiento a tiempo y prevenir, de ser posible, daños irreversibles. La ecografía diafragmática es de gran utilidad para evaluar la anatomía y cinética del diafragma durante la respiración, es una técnica no invasiva la cual puede realizarse en distintos ámbitos e incorporarse al algoritmo de estudio de la disnea e insuficiencia respiratoria.
Caso clínico 1
Paciente de sexo masculino, 45 años de edad en el momento actual.
Consultó a los 28 años de edad por debilidad en cintura escapular y pélvica. Un año después presentó un cuadro de neumonía severa con requerimientos de asistencia mecánica respiratoria no invasiva (VNI), para luego ser dado de alta con VNI modo BiPAP. A los 34 años se confirmó el diagnóstico de Enfermedad de Pompe, en Buenos Aires, por dosaje enzimático y estudio genético. Comenzó el trata miento con reemplazo enzimático.
Caso clínico 2
Paciente de sexo masculino, 48 años de edad en el momento de la consulta.
A la edad de 33 años se le detectó elevación de transaminasas en examen de rutina lo que motivó una biopsia hepática con resultados normales. Años más tarde consultó por debilidad muscular pro gresiva, disfagia a sólidos, disfonía y disnea de clase funcional tres en la escala mMRC. Permaneció en seguimiento por neurología. A la edad de 38 años, en razón del diagnóstico de su hermano (Caso clinico 1) se realizó el dosaje enzimático que confirmó el diagnóstico de Enfermedad de Pompe. Se inició tratamiento de reemplazo enzimático.
Caso clínico 3
Paciente de sexo femenino de 39 años de edad, en el momento actual.
A los 30 años, a raíz del diagnóstico de su hermano (Caso clínico 1) se investigó y diagnosticó Enfermedad de Pompe; en ese momento la paciente estaba asintomática. Tres años más tarde se inició el tratamiento de reemplazo enzimático al comprobarse alteración funcional de los exámenes musculares estandarizados. A los 36 años de edad interrumpió el tratamiento por embarazo, el que retomó. Durante el transcurso de su segundo embarazo continuó el tratamiento; no presentó complicaciones ni efectos secundarios.
Posteriormente desarrolló disnea, ortopnea, ronquidos y apneas referidos por terceros. La espirometría mostró caída de la capacidad vital forzada (CVF) mayor del 25% en decúbito supino. Se indicó VMNI modo BiPAP durante la noche.
Caso clínico 4
Paciente de sexo masculino de 76 años, consultó por renovación de equipo de VMNI (modo BiPAP). Durante la visita refirió disnea de reposo, que aumentaba en decúbito supino por lo que prefería dormir sentado y con el equipo de BiPAP. El paciente tiene diagnóstico de síndrome de apnea hipopnea del sueño (SAHOS) de más de 5 años de evolución, con debilidad muscular de 10 años de evolución. El paciente aporta estudios neurológicos previos: electromiograma de características normales; biopsia de músculo deltoides sin lesiones patológicas; valor de CPK dentro de límites normales; resonancia nuclear magnética de columna lumbar revela captocornia de músculos lumbares.
Al examen físico se constatan alteraciones de la marcha (marcha de ánade), dificultades para incorpo rarse desde la posición sedente (Signo de Gowers positivo) y desde el decúbito supino. Ante la sospecha clínica de Enfermedad de Pompe se realizaron pruebas de función pulmonar y ecografía diafragmática cuyos resultados fueron patológicos. Se complementó el diagnóstico con test de gota seca (cuantificación de la actividad de la alfa-glucosidasa), depósito lisosomal en leucocitos y estudio genético.
Resultados
Pruebas de función pulmonar
Las espirometrías fueron realizadas con el equipo Medgraphics® Elite SeriesM Plethysmograph. Para las mediciones de presiones bucales máximas/mínimas se utilizó el equipo Carefusion MicroRPM® y para la medición del pico flujo tusígeno se utilizó Mini Wright®. Las maniobras se realizaron en decúbito supino y posición sedente (Tabla 1) siguiendo los protocolos expuestos por la Sociedad Europea de Medicina Respiratoria y la Asociación Americana del Tórax.
Según el estadio de la Enfermedad de Pompe, podemos encontrar pacientes con valores normales en las pruebas de función pulmonar. Los valores normales en decúbito sentado son: capacidad vital forzada >80% del predicho y en decúbito supino un valor >80% del obtenido en decúbito sentado. Una CVF < 60% del predicho en supino puede determinar problemas respiratorios durante el sueño; en tanto valores < 40% son fuertes predictores de hipoventilación nocturna y cifras por debajo de 25% indican falla respiratoria1. Además, en pacientes con descenso de la CVF, es frecuente encontrar una incapacidad para toser y aclarar la vía aérea de secreciones. En los pacientes con Enfermedad de Pompe de inicio tardío, sin tratamiento, la insuficiencia respiratoria crónica se desarrolla lentamente en más del 70% de los casos, con una declinación media anual del 1,5% en la CVF. En tres pacientes de nuestra serie observamos una caída de la CVF mayor del 25%, indicadora de debilidad diafragmática en el cambio de decúbito (Tabla 1). Otros autores consideran un descenso en la capacidad vital > 20% con el cambio del decúbito2 como parámetro de debilidad diafragmática.
El pico flujo tusígeno (PFT) puede obtenerse con equipos portátiles. Los adultos sanos presentan un PFT > 400 lts/min. Un valor inferior a 160 lts/min es indicativo de inadecuada capacidad de aclaramiento de la vía aérea y, valores entre 160-270 marcan susceptibilidad a infecciones respiratorias3. Los pacientes presentados superan los 270 lts/min (Tabla 1)
Las presiones bucales espiratorias e inspiratorias máximas (PeMax/PiMax) son mediciones de la fuerza muscular respiratoria. Estos parámetros pueden descender incluso antes que la CVF y son muy útiles para el seguimiento de nuestros pacientes. Se consideran indicadores de debilidad muscular: PeMax < 70 cmH2O en mujeres / 100 cmH2O en hombres y un valor PiMax < 70 cmH2O en mujeres / 70 cmH2O en hombres. Observamos valores inferiores a la normalidad en relación con el grado de afección mus cular y las manifestaciones clínicas. El paciente n°1 presentó el valor más bajo de PeMax: 54 cmH2O con un descenso al cambio del decúbito en un 57% en comparación con los otros pacientes. En cuanto a los valores de PiMax solo un paciente (Caso 2) presentó un valor superior de -70 cmH2O (Tabla 1).
Ecografía diafragmática
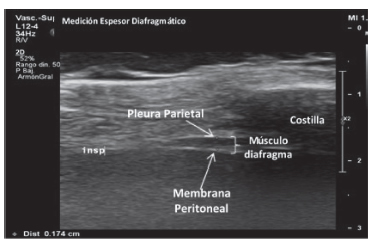
La valoración del diafragma mediante ecografía es una técnica que requiere una mayor validación clínica, pero con un gran potencial. En los pacientes evaluados utilizamos el ecógrafo Philps Affiniti 70G. Para medir el espesor del diafragma, se ubicó el paciente en decúbito dorsal. El transductor linear de 4 a 12 Mhz, fue posicionado por vía intercostal derecha sobre la línea axilar anterior, para obtener una imagen sagital del espacio intercostal entre las 7° y 8° u 8° y 9° costillas. La imagen ideal incluye ambas costillas con su espacio en medio donde se visualiza la zona de aposición diafragmática y permite medir el espesor utilizando el modo bidimensional B. Colocando los calipers por dentro de las 2 líneas fasciales hiperecogénicas que delimitan el músculo, donde están más paralelas, se obtienen las medidas en inspiración y espiración de reposo (Figura 1).
Según el artículo Presentado por Caitlin J. Harper y colaboradores los valores presentados del espesor diafragmático oscilan entre 0.12 a 1.18 cm durante la respiración en reposo. El espesor del hemidiafragma derecho inspiratorio tiene una media = 0.37 ± 0.14 (rango = 0.15-0.81 cm) y el espesor espiratorio tiene una media = 0.32 ± 0.13 (rango = 0.13-0.76 cm)4.
En nuestro hospital está en curso un trabajo de investigación que comprende la realización de pruebas de función pulmonar y ecografías del diafragma derecho. Observamos en la muestra de 32 voluntarios sanos un espesor promedio de inspiración en reposo 0.158 cm (0.074-0.45 cm); espiratorio 0.112 cm (0.05-0.218 cm). Mientras que los pacientes con Enfermedad de Pompe presentan un valor promedio del espesor inspiratorio 0.208 cm (0.174 -0.247 cm), espesor espiratorio promedio 0.170 cm (0.127-0.24 cm) (Tabla 1). En cuanto al espesor se ha descripto que el depósito de glucógeno a nivel muscular puede aumentar el espesor diafragmático. Si bien nosotros encontramos un espesor mayor en la Enfermedad de Pompe, son necesarios más pacientes para validarlo. Por ejemplo, en la enfermedad de Duchenne se ha demostrado un aumento del grosor del músculo diafragma, esto puede ser análogo a la pseudo hipertrofia observada en otros grupos musculares y puede ser usado para predecir falla respiratoria5.
Para medir la excursión diafragmática se utilizó la vía subcostal anterior derecha con un transduc tor de baja frecuencia 1-5 Mhz cardiológico ubicado entre las líneas axilar anterior y medio-clavicular, dirigido cranealmente apuntando al tercio posterior del diafragma derecho. Se visualizó el movimiento del mismo en modo bidimensional B y se cambió a modo M para las mediciones (excursión y velocidad) en las tres modalidades: respiración de reposo, profunda y sniff test. Para esta última se pidió al pa ciente que realizara una inspiración forzada con boca cerrada por ambas coanas. Para la medición de excursión la amplitud de la curva sinusoidal obtenida en modo M de mide de valle a pico.
Distintos autores muestran una relación lineal entre la excursión del hemidiafragma derecho y los diferentes volúmenes inspiratorios6. La excursión diafragmática en reposo presenta un rango de 0.26-2.10 cm (media: 1.50 cm), durante la respiración profunda 1.67 -9.20 (media: 5.69 cm) y en el sniff test 0.48-2.66 (media: 1.66 cm)7. En muestro estudio en voluntarios sanos los valores obtenidos en reposo están en un rango 0.79-3.33 cm (promedio 1.55 cm), durante la respiración profunda 4.88-11.8 cm (promedio: 7.17 cm) y una excursión sniff test 1.91-9.29 cm (promedio: 4.17 cm). En los pacientes con Pompe pre sentan valores de excursión más bajos durante la respiración: en reposo entre 0.489-1.46 cm (promedio 0.911 cm), respiración profunda entre 0.79-4.5 cm (promedio: 2.195 cm) y en sniff test entre 1.16-4.17 cm (promedio: 2.12 cm) (Tabla 1).
La velocidad inspiratoria se define como la relación entre la amplitud de la excursión inspiratoria y el tiempo medido desde el valle al pico inspiratorio expresada en cm/segundos y lo calcula automáti camente el ecógrafo a partir de la medición de modo M de la excursión diafragmática. La velocidad de contracción del músculo diafragma se correlaciona con la fuerza muscular. La velocidad del diafragma medido con modo M durante la maniobra de sniff test ha demostrado aumentar al menos 7 puntos desde 1.52 cm/seg durante la respiración tranquila a 10.4 cm/segundos durante el sniff test5. Nuestros voluntarios sanos tienen en promedio una velocidad durante la respiración tranquila entre 0.43-3.17 cm/ seg (promedio: 1.356 cm/seg), respiración profunda 1.93-8.82 cm/seg (promedio: 4.16 cm/seg) y sniff test 2.29-20.8 cm/seg (promedio: 7.5 cm/seg). Los pacientes presentados muestran valores en promedio más bajos: velocidad de respiración en reposo 0.423-1.49 cm/seg (promedio: 0.991 cm/seg), respiración profunda: 0.55-2.2 cm/seg (promedio: 1.352 cm/seg) y en sniff test: 1.34-12 cm/seg (promedio: 4.3 cm/ seg) (Tabla 1). Además, observamos la disfunción del diafragma constatada mediante la ecografía, caracterizada por debilidad al repetir las maniobras en un paciente y en otro caso por movimiento paradojal, esto se traduce entre otras manifestaciones clínicas en disnea e insuficiencia respiratoria.
Discusión
La enfermedad de Pompe se considera uno de los trastornos por almacenamiento de glucógeno más frecuentes, cuyas manifestaciones pueden iniciarse en cualquier momento de la vida. La prevalencia estimada depende del área geográfica y la etnia, oscila entre 1 cada 40.000 a 1 en 600.000. Estos pacien tes presentan sintomatología variable, con lo cual representa un reto diagnóstico. En su etiopatogenia es determinante la deficiencia de la enzima lisosomal alfa 1,4 glucosidasa (maltasa ácida), ello provoca una acumulación del glucógeno lisosomal en múltiples tejidos y células con afección primordial del músculo esquelético, cardíaco, respiratorio y liso. Esto se traduce clínicamente como debilidad proximal en extremidades, cardiomiopatía, insuficiencia ventilatoria y trastornos gastrointestinales.
La enfermedad de Pompe se puede presentar a cualquier edad con distintos fenotipos, grados de progresión y afección de distintos grupos musculares. Dentro de esta variedad de presentaciones, se reconocen dos formas: una forma infantil con rápida progresión (Enfermedad de Pompe Infantil) y otra de inicio tardío con progresión más lenta (Enfermedad de Pompe de inicio tardío).
La Enfermedad de Pompe infantil presenta síntomas antes del año de vida, el pronóstico es fatal a corto plazo sin el tratamiento correspondiente. La edad de inicio de los síntomas es de 4 meses y
la necesidad de asistencia respiratoria mecánica suele ser a los 5.9 meses. En su presentación clásica tiene miocardiopatía, compromiso muscular rápidamente progresivo, hipotonía severa y dificultad en la deglución. Cuando no hay compromiso cardíaco, se clasifica como forma atípica o variante muscular de la Enfermedad de Pompe infantil, donde la progresión es más lenta. La forma de comienzo tardío de enfermedad de Pompe, es aquella que aparece luego del año de vida. Esto incluye a pacientes cuya sintomatología comienza tanto en la niñez, adolescencia y en la adultez.
En estos casos clínicos expuestos, corresponden a la variante tardía, la cual incluye la presentación juvenil y la forma adulto. La forma del adulto se inicia entre la segunda y la séptima década de la vida, con debilidad de la musculatura proximal de la cintura pélvica y de hombros, músculos paraespinales y del cuello. Se recomienda evaluar la fuerza de la lengua, la flexión del cuello y la cadera en decúbito supino y la extensión del cuello, la cadera y la rodilla en decúbito prono. Los reflejos suelen estar disminuidos y puede observarse pseudohipertrofia muscular en las pantorrillas. Es importante el compromiso diafrag mático y de los músculos accesorios respiratorios, lo cual provoca apnea obstructiva del sueño (SAOS). El paciente n°4 con diagnóstico de SAOS por polisomnografía presentó mala respuesta al tratamiento con ventilación mecánica no invasiva en modo CPAP. En un primer momento se pensó en síndrome de hipoventilación alveolar, pero las características clínicas de afección neuromuscular obligan a descar tar patología asociada, por ejemplo: Enfermedad de Pompe, optando por cambiar el modo ventilatorio a BiPAP con buena respuesta al tratamiento. Otras manifestaciones de esta patología son la fatiga, actividad física disminuida, dolores musculares y calambres. Presentan dificultad para mantenerse de pie, para luego afectar el sistema osteoarticular, con lordosis, cifoescoliosis, deformidades, contracturas musculares y osteoporosis8-10. Los pacientes con Enfermedad de Pompe de inicio tardío variante adulta tienen mejor pronóstico de vida, pero su diagnóstico es más difícil. El retraso en la identificación de esta patología incrementa la mortalidad y la morbilidad ante la falta de tratamiento adecuado.
Los estudios complementarios son útiles para aproximar el diagnóstico. Los valores séricos de CPK, alanina aminotransferasa, aspartato aminotransferasa y deshidrogenasa láctica, se encuentran elevados en el 95% de los casos. El electromiograma puede ser normal en la musculatura de las extremidades, con afección única de los músculos paraespinales, esto es lo que sucedió en el caso clínico n° 4. La cu antificación de la actividad de la alfa-glucosidasa en gotas de sangre seca en papel filtro es un método poco invasivo, no requiere un manejo complejo de la muestra y permite ser enviada a lugares alejados. La actividad enzimática medida en linfocitos es un método que en pocos días brinda un resultado confir¡rmatorio adecuado debido a su sensibilidad y especificidad diagnóstica. La biopsia muscular no es siempre necesaria en la forma clásica si el diagnóstico clínico y bioquímico es concluyente. En la variante tardía puede ser útil, aunque no es infrecuente que el resultado del estudio sea normal; su principal utilidad es en el diagnóstico diferencial con las enfermedades neuromusculares degenerativas. El hallazgo histopatológico sugestivo es la presencia de vacuolas positivas con la prueba del ácido peryódico de Schiff, que corresponden al glucógeno depositado dentro del lisosoma. El porcentaje de afección de las fibras musculares es variable, en la forma tardía es entre 10 y 50%. La enfermedad se hereda en forma autosómica recesiva, donde los antecedentes de consanguinidad o endogamia son importantes sumado a la sospecha clínica. Entre el 10 al 15% de los pacientes puede no detectarse una mutación en el ADN genómico. En las pruebas de función pulmonar la colaboración del paciente es fundamental para obtener resultados con criterios de aceptabilidad y reproducibilidad. En ocasiones el escenario clínico es tan amplio y variado que podemos encontrarnos con situaciones limitantes, por ejemplo: pacientes con afecciones neuromusculares, en el periodo postquirúrgicos o con traumatismos de tórax entre otros casos.
El ultrasonido es de gran utilidad para evaluar la anatomía y cinética diafragmática durante la respiración, la cual es una técnica no invasiva, puede realizarse en la cabecera del paciente y supera muchas limitaciones técnicas de procedimientos de imágenes convencionales5 e incluso de las pruebas de función pulmonar.
Esta enfermedad es un trastorno multisistémico por lo que requiere un manejo interdisciplinario, que incluye: neurólogo, neumonólogo, terapista, fonoaudiólogo, cardiólogo, genetista y kinesiólogo entre otros. La terapia de reemplazo enzimático modifica la historia natural, enlentece la progresión, disminuye las complicaciones a largo plazo e incrementa la supervivencia. Consiste en la administración intravenosa de una forma precursora de la enzima α-1, 4 glucosidasa (recombinante humana GAA), capaz de penetrar en los lisosomas. La dosis terapéutica inicial es de 20 mg/kg por infusión endovenosa, cada dos semanas. En un estudio multicéntrico, aleatorizado, con 90 pacientes con Enfermedad de Pompe de inicio tardío se evaluó la respuesta motora mediante la prueba de marcha de los seis minutos, la CVF y la Pimax y PEmax. Después de la administración de GAA por 78 semanas, se demostró mejoría en la distancia caminada y se estabilizó la función pulmonar11.
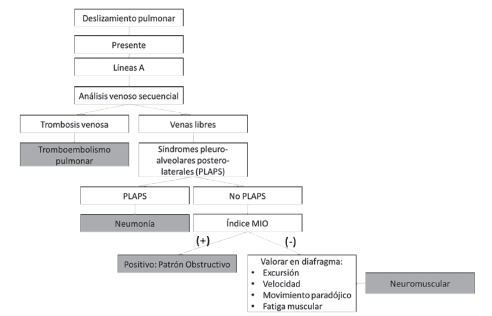
Para finalizar podemos decir que el principal músculo respiratorio –el diafragma– es el responsable del 75% de la inspiración, en condiciones normales y en reposo. Mientras que las pruebas de función pulmonar permiten cuantificar la contribución de todos los músculos implicados en la respiración, la ecografía diafragmática puede resultar más precoz en la detección de patologías con mayor compromiso diafragmático. Asimismo, tienen relevancia cuando las pruebas de función pulmonar no pueden ser realizadas, por ejemplo, en estadios avanzados o en pacientes con asistencia mecánica respiratoria. La ecografía pulmonar tiene un gran potencial12 en la valoración de enfermedades del parénquima pulmonar periférico, pleura, pared torácica y diafragma. La intención de la siguiente explicación es dar a conocer que patologías pueden beneficiarse con el uso de este método complementario. El uso creciente de la denominada “ecografía point of care” en el diagnóstico de la causa de insuficiencia respiratoria en pacientes críticos13 y no críticos con disnea está tomando cada vez más relevancia. El protocolo BLUE14 (Bedside Lung Ultrasound in Emergency), realiza una interpretación de los artefactos producidos por el ultrasonido en la interface pleura-aire (líneas A, líneas B, deslizamiento pleural y punto pulmonar) sumado a la identificación de imágenes más típicas (Por ejemplo: derrame y consolidación) organiza los hallazgos en forma de un árbol de decisiones llegando al diagnóstico preciso en más del 90% de los casos de insuficiencia respiratoria. Por ejemplo: edema pulmonar (sensibilidad: 97% y especificidad: 95%), neumonía (sensibilidad: 89% y especificidad: 94%) y neumotórax (sensibilidad: 80% especificidad: 100%) y al asociar en el algoritmo la ecografía venosa de miembros inferiores se identificó trombosis venosa profunda/tromboembolismo de pulmón (sensibilidad: 81% y especificidad: 99%).
En este árbol de decisiones queremos destacar el grupo de pacientes con disnea y deslizamiento pleural, asociado a un patrón de líneas A (similar al normal) sin evidencia de trombosis venosa profunda por ecografía venosa donde se diagnosticaron como asma/EPOC (sensibilidad 89 % y especificidad 97%). Si bien la sensibilidad es buena, aún queda un 11% de patología obstructiva sin diagnóstico. Esto puede optimizarse utilizando el índice MIO (M-mode Index of Obstruction)15 que evalúa las medidas derivadas de la excursión diafragmática, las cuales se correlacionan muy bien con índices espirométricos obstructivos. Utilizando el método de evaluación ecográfica descripto en nuestros pacientes se detectaría además pacientes con debilidad diafragmática (neuromusculares) sumando nuevas herramientas al protocolo BLUE (Gráfico 1). Estos estudios complementarios se han utilizado en la valoración los pacientes presentados, lo que nos ha permitido mostrar una evaluación integral de los pacientes con enfermedad de Pompe y conocer aún más sobre esta patología.
Conclusión
Hemos descripto cuatro pacientes en quienes la ecografía diafragmática resultó ser una técnica inocua que muestra una gran variedad de parámetros muy útiles para el seguimiento de individuos con pa tologías neuromuscular; en especial en aquellos con alto riesgo de disfunción diafragmática. Conocer las patologías neuromusculares desde el punto de vista neumonológico nos permite diagnosticar precozmente a estos pacientes, realizar una evaluación integral y mejorar la calidad de atención. Proponemos incluir, además de las conocidas pruebas de función pulmonar a la ecografía como estudio complementario en el algoritmo de estudio de patologías respiratorias. Para su aplicación se requiere un periodo de entre namiento y aprendizaje previo por lo que es muy importante su difusión.
Agradecimientos: Fundación Florencio Fiorini, beca 2017.
1. A. Sarwal, F. Walker and M. Cartwright. Neuromuscular Ultrasound for Evaluation of the diaphragm. Muscle Nerve. 2013. 3; 47(3): 319-329.
2. A Oro, B Cortez, A Garcia et al. Diagnóstico y tratamiento en la enfermedad de Pompe. Rev Med Inst Mex Seguro Soc. 2013; 51(5): 536-51.
3. M. Boentert, H. Prigent, K. Vardi et al. Practical recommendations for diagnosis and management of respiratory muscle weakness in late-onset pompe disease. international Journal of Molecular Sciences. 2016; 17: 1735.
4. M. Boertert, S. Wenninger and V. Sansone. Respiratory involvement in neuromuscular disorders. Curr Opin Neurol. 2017; 30: 529-537.
5. A. van der Ploeg and A. Reuser. Pompe´s disease. The Lancet. 2008; 372 (9646): 1342-1353.
6. U. Mellies and F. Lofaso. Pompe Disease: A neuromuscular disease with respiratory muscle involvement. Respiratory Medicine. 2009; 103: 477-484.
7. C. Fromageot, F. Lofaso, D. Anname et al. Supine fallin lung volúmenes in the assessment of diafragmatic weakness in neu romuscular disorders. Archives of Physical medicine and rehabilitation. 2001; 82: 123-128.
8. M. Boentert, H. Prigent, K. Várdi et al. Practical Recommendations for diagnosis and management of respiratory muscle weakness in late onset Pompe disease. Int. J. Mol. Sci. 2016: 17(10). pii: E1735.
9. C.J. Harper, L. Shahgholi, K. Cieslak et al. Variability in diaphragm motion during normal breathing, assessed with B mode ultrasound. Journal of Orthopaedic and Sport Physical Therapy. 2013; 12, 43-931.
10. E. Cohen, A. Mier. P. Heywood et al. Excursion volumen relatio of the right hemidiaphragm measured by ultrasonography and respiratory airflow measurements. Thorax. 1994; 49: 885-889.
11. E. O. Gerscovich, M. Cronan, J. McGahan et al. Ultrasonographic evaluation of diafragmatic motion. J. Ultrasound Med. 2001; 20: 597-604.
12. I. Vollmer and A. Gayete. Ecografía torácica. Archivos de Bronconeumonología. 2010; 46 (1): 27-34.
13. D. Lichtenstein and G. Meziere. Relevance of lungultrasound in the diagnosis of acute respiratory failure: the blue protocol. Chest. 2008; 134: 117-125.
14. D. Lichtenstein. Novel approaches to ultrasonography of the lung and pleural space: where are we now? Breathe. 2017; 13: 100-111.
15. A. Zanforlin, A. Smargiassi, R. Inchingolo et al. Ultrasound analysis of diaphragm kinetics and the diagnosis of airway obstruction: the role of the M-mode index of obstruction. Ultrasound in Med and Biol. 2014; 40 (6): 1065-1071.