Autor :A. BermĂşdez1, V. Moyano2, J. Albiero3, R. Pendito4, J. Casas5, M. Uribe EchevarrĂa6
1 Hospital Italiano de Córdoba;
2 Hospital Italiano de Córdoba - Sanatorio Allende del Cerro;
3 Sanatorio Allende del Cerro;
4 Centro Médico San Andrés;
5 Sanatorio Allende del Cerro;
6 Instituto Modelo de Cardiología - Hospital Italiano de Córdoba (Argentina)
Correspondencia : bermudezanib@gmail.com
Introducción
La neumoconiosis constituye un grupo de enfermedades asociadas con la exposición e inhalación de polvo mineral, de partículas inorgánicas, sílice, berilio, carbón, cobalto, talco, etc. La exposición al polvo de sílice se asocia no sólo con silicosis, sino también con enfermedad pulmonar obstructiva crónica, cáncer de pulmón, insuficiencia renal y riesgo aumentado de tuberculosis pulmonar y enfermedades autoinmunes.
Está bien establecida la asociación entre el contacto con el sílice por vía inhalatoria y enfermedades autoinmunes, particularmente en el contexto de una exposición intensa. La exposición al sílice se ha vinculado con un incremento de la síntesis de anticuerpos y complejos inmunes, aún sin la presencia de características clínicas de enfermedad autoinmune. El riesgo de desarrollar esclerosis sistémica, artritis reumatoidea, lupus eritematoso sistémico, dermatomiositis / polimiositis y anticuerpos anticitoplasmáticos del neutrófilo (ANCA) positivos (vasculitis) esta descripto en varios estudios. En paciente que trabajan en canteras con escasas medidas de prevención el desarrollo de silicosis ha llegado ser tan severo que ha requerido trasplante pulmonar; sobre esta base se recomienda seguirlos con un perfil inmunológico como control o estar atentos a otras manifestaciones de autoinmunidad1, 2.
La esclerosis sistémica es una enfermedad autoinmune definida como un desorden generalizado de la microvasculatura y del tejido conectivo, con engrosamiento y obliteración de los vasos arteriales de piel, pulmón, tracto gastrointestinal, corazón y riñones. Su etiología es desconocida pero probablemente concurren factores endógenos y exógenos. Entre los factores exógenos, la exposición ocupacional juega un rol importante como causa potencial, incluyendo el polvo de sílice, cloruro de vinilo, resina epoxi, bleomicina, hidrocarburos aromáticos, aceites. Excepto el s-lice todos los otros agentes producen cambios reversibles una vez suspendido el contacto con el agente. El polvo de sílice y su inhalación es un factor de riesgo bien reconocido de esclerosis sistémica. Las partículas de cristal de sílice (cuarzo) que miden menos de un micrometro son las más patogénicas ya que al ser inertes pueden permanecer por tiempo indeterminado en el tejido3.
El antecedente de exposición al polvo de sílice y esclerosis sistémica se conoce como Síndrome de Erasmus.
Caso clínico
Paciente 55 años. Sexo masculino
1° consulta febrero 2015. Refiere dolor torácico dorsal tipo pleurítico, de 3 meses de evolución, que no respondió a varios esquemas de AINES. Antecedentes personales: ex-fumador 4 paq/año; abandonó el hábito hace 5 años. Trabajador en molienda de cuarzo, con protección, desde hace 26 años hasta la actualidad. Estudios complementarios: funcional respiratorio dentro de los parámetros de normalidad (espirometría, DLCO y prueba de marcha de seis minutos). La tomografía computada de tórax sin contraste mostró engrosamiento intersticial bilateral, nodulillos pulmonares bilaterales a predominio apical; adenomegalias múltiples retrocavopretraqueales, preaórticas calcificadas, e infracarinal de 35mm no calcificada (Figura 1)
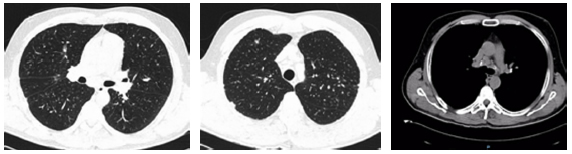
El paciente es derivado, por estos hallazgos a cirugía de tórax para valoración de biopsia pulmonar. Los cirujanos adoptan conducta expectante con nuevo control tomográfico.
2° consulta mayo 2015. El paciente manifiesta astenia, dolor en ambas manos, rigidez, con parestesias e impotencia funcional de un mes de evolución. Las molestias no ceden con AINES. Refiere, también, sensación de sequedad en ojos y boca. En el interrogatorio expresa “me cuesta expandir el tórax”. Al examen físico se observaba edema bilateral de manos, rodillas y tobillos con signos de flogosis. Dedos puffy (edematosos-rígidos) con signo de Raynaud en algunos dedos de las manos. Leve compromiso de la apertura bucal. Expansión torácica disminuida con leve dolor; auscultación pulmonar normal. Resto del examen físico sin particularidades. Exámenes complementarios: el Ecopower muestra cambios inflamatorios en las articulaciones metacarpofalángicas de ambas manos. El ecocardiograma y la ecografía abdominal son normales. Las pruebas de laboratorio revelan eritrosedimentación 72; proteína C reactiva 1.76; anticuerpos antinucleares (ANA) 1-80 con patrón fino y nucleolar; anticuerpos Anti Proteínas Citrulinadas (anti-ACC) < 20. El screening de marcadores sistémicos tumorales resultó negativo. Se solicita valoración al Servicio de Reumatología donde proponen dos diagnósticos diferenciales: artritis temprana o artritis en contexto de un síndrome paraneoplásico. Se inicia tratamiento con metotrexate 500 mg, meprednisona 8 mg y ácido fólico.
3° consulta julio 2015. En esta ocasión el paciente niega dolor torácico. Exámenes complementarios: laboratorio: ANA 1-640 patrón nucleolar; Scl70 positivo. En el Ecopower la capilaroscopía pone en evidencia dilataciones eferentes y arborificaciones; lo que lleva a diagnosticar Raynaud incompleto. Se concluye, conjuntamente con el Servicio de Reumatología, que se trata de un cuadro de esclerodermia temprana con debut como artritis de mano, puffy y síndrome de Raynaud; sin compromiso sistémico. La tomografía computada de alta resolución de trevela imágenes pulmonares persistentes ascomo adenopatías mediastinales, pero no se visualizan las adenopatías calcificadas en mediastino. El diagnóstico presuntivo es: imágenes compatibles con silicosis. Las pruebas funcionales se mantuvieron en rango de normalidad. Para tratar el cuadro reumático se agregó al esquema anterior hidroxicloroquina; en tanto el paciente continuó con metotrexato, ácido fólico, meprednisona 4 mg. Se suspendieron los AINES.
4° visita septiembre 2015. Se trata de un control. El paciente está activo sin astenia, no refiere síntomas. Se constata mejoría articular de manos y rodillas, no se visualiza Raynaud, únicamente se nota una leve esclerosis distal en manos. Se observa buena expansión torácica, no manifiesta dolor al examen. La valoración en el servicio de Cardiología informa parámetros de normalidad; con ecocardiograma normal.
Conclusión: Los antecedentes laborales de este paciente con un cuadro clinico e inmunológico característico de esclerosis sistémica llevan al diagnóstico de “Síndrome de Erasmus”.
Discusión
La silicosis es una neumoconiosis causada por la inhalación de sílice, está asociada a anormalidades de la inmunidad celular y humoral con anticuerpos antinucleares positivos, Factor Reumatoideo positivo, hipergamaglobulinemia y alteraciones de linfocitos T-helper y linfocitos T-supresores4. La silicosis se clasifica según la presentación clínica en aguda, acelerada y crónica. La esclerosis sistémica es una enfermedad autoinmune crónica caracterizada por la excesiva producción de colágeno en diferentes tejidos, que causa fibrosis en los pequeños vasos ante una respuesta inmune específica.
Un metaanálisis, sugiere que la exposición al sílice está asociada con un incremento en la incidencia de ES, especialmente en el sexo masculino5.
Comparado con otras enfermedades del colágeno, la asociación entre exposición al sílice y esclerosis sistémica (S-ES) es relativamente infrecuente, tiene una distribución mundial y sin predilección por las razas pero los datos epidemiológicos disponibles son muy escasos. La esclerosis sistémica es complicación muy rara de la silicosis. En 1914 Bramwell describió esta asociación pero no logró establecer el nexo causal entre el sílice y la esclerosis sistémica. En 1957 Erasmus report-la prevalencia de esclerosis sistémica (32%) en los trabajadores de minas de oro con alta exposición a polvos de sílice; dichos hallazgos fueron confirmados por Rodamn y sus colaboradores quienes comunicaron una exposición intensa y prolongada al polvo de sílice en 60 hombres con esclerosis sistémica (42%)6.
El riesgo de desarrollar S-ES después de la exposición al polvo de sílice es 4 veces mayor que el de la población general. En algunos casos el desarrollo de esclerosis sistémica puede ser consecuencia de la intensidad más que de la duración del contacto con el polvo de sílice7, 3. La S-ES puede aparecer después de mucho tiempo de exposición con una media de rango en años de 16.2 (4 -36 años). En la mayoría de los casos (72%), la silicosis ocurre antes del inicio de la S-ES, los pulmones son por lo general los órganos que más se comprometen con fibrosis pulmonar bi-basal4, 3, 2.
Haustein y colaboradores coinciden con la teoría de una asociación genética (Alelos HLA-A DR3 ) con S-ES, pero una revisión de fechas y edades de inicio sugieren que es más probable la existencia de un disparador ambiental y una codificación genética predisponente8.
Las partículas de sílice con un diámetro menor a 1 micrómetro son las sustancias más patogénicas en la silicosis. La relación entre el sílice y la esclerosis sistémica involucra una respuesta inflamatoria activada por el sílice después de ser fagocitado con la posterior liberación de mediadores inflamatorios. Una hipótesis es que estas partículas son fagocitadas por los macrófagos y transportados a los ganglios linfáticos regionales. Si bien el sílice es clínicamente inerte, cuando el macrófago muere las partículas son liberadas y fagocitadas nuevamente. La estimulación del macrófago produce citoquinas (IL-1, 2 y 6; TNF-β; TNF-α; y otras); cuando esta condición persiste se induce activación de los fibroblastos con incremento de la producción de colágeno y glicosaminoglicanos llevando a la esclerosis cutánea, oclusión vascular y la fibrosis pulmonar4,6. Estas interleuquinas producen la maduración y activación de las células dendríticas en los ganglios regionales, subsiguientemente se produce una activación policlonal y una proliferación de las células T nativas que son las posibles operantes de la oclusión vascular y la esclerosis cutánea9.
Otra teoría sugiere que las partículas de sílice inducen una respuesta inflamatoria con liberación de mediadores inflamatorios por parte de los macrófagos alveolares al fagocitar estas partículas con producción de radicales libres. Cuando la cantidad de radicales libres excede los mecanismos antioxidantes se produce daño de los neumocitos tipo I, una mayor activación de los macrófagos e inducción y proliferación de los neumocitos tipo II. La liberación de las enzimas proteolíticas redunda en un aumento de especies de oxígeno y nitrógeno, más citoquinas (TNF-α; Factor transformador de crecimiento beta, IL-1, IL-1 y 6) y mayor reclutamiento de macrófagos, neutrófilos y linfocitos con alveolitis y pérdida de la integridad de la barrera epitelial. Este es el mecanismo de entrada de las partículas de sílice en el intersticio pulmonar. El resultado neto es la sobreproliferación de fibroblastos y la producción de colágeno con la consecuente fibrosis intersticial10.
Estáestablecido que los pacientes con SES tienen un curso clínico, inmunológico y serológico indistinguible de la forma idiopática de esclerosis sistémica, a pesar que tienen un alto porcentaje de compromiso
pulmonar (fibrosis) y anticuerpos anti Scl-70 positivos. Se ha demostrado que hay dos posibles factores de riesgo adicionales para S-ES: genético (HLA) y estilo de vida (tabaquismo)11. Presumiblemente la esclerosis sistémica y la silicosis son dos distintas enfermedades que comparten un mismo factor ambiental pero con diferente susceptibilidad del huésped. El parénquima pulmonar S-ES puede exhibir un patrón intersticial que puede desarrollar más tarde un patrón de silicosis, esclerodermia o ambos. En la tomografía de tórax se puede observar imágenes lineales, opacidades en vidrio esmerilado, panal de abeja, pequeños nódulos subpleurales, así como cambios indistinguibles de la forma idiopática12. Los cambios radiológicos pueden preceder o seguir al diagnóstico de S-ES después de algunos años. El principal cambio a nivel funcional en la S-ES es la reducción de la DLCO con o sin defecto restrictivo. La histología pulmonar puede demostrar la presencia de características de silicosis y esclerodermia pero éstas no difieren en grados y estadios de desarrollo11. La exposición y la latencia (hasta la aparición de los primeros síntomas) pueden no coincidir con el diagnostico de S-ES; éste puede ser temprano o tardío desde la cesación de la exposición (hasta 15 años en dos series de casos). Consecuentemente, en algunos grupos, la latencia puede ser más larga que el periodo de exposición. En una serie de casos la latencia tenía un rango de 5-48 años11.
Es importante tener presente la silicosis como una comorbilidad en pacientes con un amplio rango de enfermedades autoinmunes como la esclerosis sistémica y la artritis reumatoidea, también en menor prevalencia la enfermedad mixta del tejido conectivo2. El sílice puede actuar como un factor estimulante en la -proteinosis alveolar observándose un patrón heterogéneo de enfermedades autoinmunes indistinguibles. Pacientes con silicoproteinosis pueden presentar un curso clínico de “Silicosis Aguda” y con evolución rápida y desfavorable. La presencia de anticuerpos contra el factor estimulante de colonias de granulocitos (G-CSF) es el nexo para la patogénesis de la proteinosis alveolar y sustenta el concepto de que ésta es también una enfermedad autoinmune4, 12-14.
Conclusión
La exposición aislada al -sílice, en ausencia de silicosis, puede asociarse con un incremento en el riesgo de desarrollar enfermedades autoinmunes. En este caso hemos descripto un Síndrome de Erasmus definido por la asociación de exposición al sílice y esclerosis sistémica.
1. Makol A, Reilly MJ, Rosenman KD. Prevalence of connective tissue disease in silicosis. Am J Ind Med 2011; 54: 255-262.
2. Shtraichman O, Blanc P, Ollecch JE. Outbreak of autoimmune disease in silicosis linked to artificial stone. Occupational Medicine 2015;65: 444-450.
3. Mahendra Kumar Bainara, Manoj Kumar Arya, Bramwell B .Silica Associated Systemic Sclresosis-An uncommon caso report. Int J Resp Med 2013; 2(2): 199-202.
4. Haustein UF. H.Systemic Sclerosis-Sclerodermia. Pub Med Dermatolgy online Journal,21; 1-3.
5. Mc Cormic ZD, Khuder SS, Aryal BK Khuder S. Occupational silica exposure as a risk factor for scleroderma:a meta-analisis. Int Arch Occup Environ Health,2010; 83(7): 763-769.
6. Black CM, Welsh K, . (1994) Genetics Scleroderma.Clin Dermatologic, 12: 337-347.
7. Sanchez Roman J, Wichmann I, Salaberri J. Multiple clinical an biological autoinmune manifestations in 50 workers after occupational exposure to silica. Ann Rheumatology Diseasse, 1993;52: 534.
8. Stephans CO, Briggs DC. Whyte J..Familial Scleroderma evidence for enviromentalverus genetic trigger.Oxford Journals of Rheumatology, 19914;33: 1131-1135.
9. Gross BH, Scheneider HJ, Proto AV. Egg Cell calcificaction of lymph nodes: An update AJR. Am J Roentgenol 1980;135: 1265-1268.
10. Dias J, Santiago MB. Martinez A. Esclerodermia inducida por silice (Sindrome de Erasmus). Journal Lirnne 2005 ;1(3): 79-85.
11. Martin J.R, Griffin E, Moore, J. Systmic sclerosis (scleroderma) in two iron ore mines. Occup Medicine 1999;49: 161-169.
12. Machado de Miranda A A, Carvalho Nascimento A, Lima Peixoto Isy. Erasmus Syndrome -Silicosis and systemic sclerosis. Revista Brasilera de Reumatologia 2013; 53(3): 310-331.
13. Trapnell BC, Whitsett JA, Nakata K. Pulmonary Alveolar Proteinosis. New England J Med 349: 2527-2539.
14. Zaghi G, Koga F, Nisihara RM. Autoantibodies in Silicosis patients an in silica-exposed individuals. Reumatology Int 2010;30(8): 1071-1075.