Autor : Bisero Elsa D.1, Luque Graciela F.2, Framarin Reinaldo G.2
1 Hospital Nacional Prof. A. Posadas. Departamento Materno Infantil. DivisiĂłn PediatrĂa. Servicio de PediatrĂa. SecciĂłn NeumonologĂa Infantil 2 Hospital Nacional Prof. A. Posadas. Departamento Materno Infantil. DivisiĂłn PediatrĂa. Servicio de PediatrĂa. SecciĂłn ClĂnica Pediátrica
Correspondencia : Elsa Bisero e-mail: elsibisero@yahoo.com.ar
Resumen
Se denomina efecto adverso a fármacos antituberculosos (RAFAs), a una respuesta nociva
y no deseada de uno o varios de los fármacos utilizados, para profilaxis, diagnostico
o tratamiento de la enfermedad tuberculosa. Para adjudicarlos a la medicación se debe
tener en cuenta que las dosis sean adecuadas, descartar interacciones medicamentosas
y comorbilidades. Es necesario conocerlos y monitorizarlos, para evitar posibles riesgos
de morbi-mortalidad.
Objetivo: comunicar el caso de 4 hermanos que presentaron RAFAs, a más de 1 fármaco
antituberculoso.
Palabras clave: Tuberculosis; Efectos adversos; Antituberculostaticos; Hepatitis; Agudeza visual; Trombocitopenia; Reintroduction del tratamiento antituberculoso
Adverse Reactions to Antituberculosis Drugs in Pediatrics. Apropos of 4 Brothers
Abstract
It is called tuberculous adverse drug effect (RAFAs), to a noxious response and not desired
to one or more of the drugs used for prophylaxis, diagnosis or treatment of tuberculous
disease. To attribute them to the medication, it is necessary to take into account that doses
should be normal; also dismiss drug interactions and co-morbidities. It is necessary to
know them and monitor them, to avoid possible risks of morbidity and mortality.
Objective: to communicate the case of four brothers who presented RAFAs, to more
than one TB drug.
Key words: Tuberculosis; Adverse effects; Antituberculostatic; Hepatitis; Visual acuity; Thrombocytopenia; Reintroduction of antituberculosis treatment
Introducción
Isoniacida (H), rifampicina (R), pirazinamida (Z),
etambutol (E) y estreptomicina(S), son utilizadas
en el régimen de tratamiento de los pacientes con
tuberculosis1-7.
Las recomendaciones actuales para las dosis de
los agentes antituberculosos derivan de estudios
preclínicos con modelos animales y estudios de
farmacocinética y toxicidad. La Organización
Mundial de la Salud (OMS), entidades como la
Unión Internacional de la Tuberculosis y Enfermedades Respiratorias (UICTER), la Sociedad
Torácica Americana (ATS), el Control y Prevención
de las Enfermedades (CDC), entre otras organizaciones, han revisado de forma exhaustiva las
dosis para los principales agentes.
Se define efecto adverso a fármacos antituberculosos (RAFAs) a cualquier respuesta nociva
y no deseada de un fármaco, a dosis utilizadas
en seres humanos para profilaxis, diagnostico o
tratamiento6.
La frecuencia y naturaleza de las RAFAs sigue
siendo una preocupación en todo tratamiento antituberculoso. Es necesario conocerlos y monitorearlos ya que conllevan mayores gastos en salud,
morbilidad, e incluso riesgo de mortalidad.
Casos clínicos
Presentamos una familia integrada por el padre y
cinco hermanos, quienes han sido abandonados por la
madre. Provenientes de la localidad de La Matanza,
Provincia de Buenos Aires, de extracción socioeconómica baja. Todos están en situación de calle.
Estudio convencional de foco: un tío fallecido con
VIH y TB (bacilífero), padre y hermano de 15 años
cursando tuberculosis (TB), ambos bacilíferos. Los
datos al ingreso pueden verse en la Tabla 1.
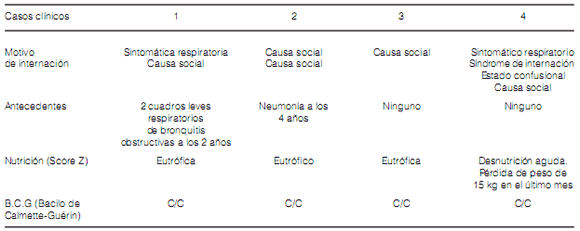
Datos clínicos al ingreso
Al ingreso: el caso 4 requirió transfusión, corrección de hiponatremia e hipocalcemia y si bien se pensó que los trastornos hidroelectrolíticos podrían ser la causa de su estado confusional, se decidió realizar punción lumbar. El líquido cefalorraquídeo (LCR) fue normal con Ziehl-Neelsen (ZN) y cultivo (C) negativos. Imágenes cerebrales normales. Los auxiliares diagnósticos pueden verse en la Tabla 2.
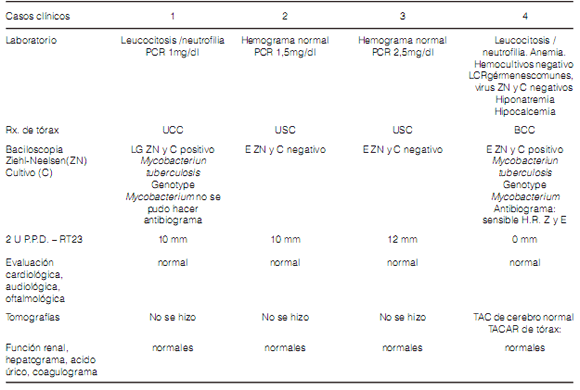
Exámenes complementarios
Se les efectuó evaluación cardiológica, oftalmológica y audiológica siendo normales. Se los trató con H 10 mg/kg/día, R 15 mg/kg/día, Z 25 mg/kg/día y E 20 mg/kg/día, mas vitamina B6 a 25 mg/kg/día en los casos 1 y 4.
Evolución: 4 de los 5 hermanos registraron
RAFAs. Presentaron hepatitis, con elevación de las
transaminasas más de 5 veces su valor normal. En
los pacientes 1, 2 y 3 se suspendieron las drogas hasta la normalización de enzimas y luego administración progresiva comenzando con el 10% de
la dosis, llegando a la dosis total entre los 7 y 10
días. Se colocó primero R, luego H y finalmente Z.
En el caso 4 dada la gravedad clínica y la forma
de TB, se lo mantuvo con S 15 mg/kg/día, E 20 mg/kg/día, levofloxacina 10 mg/kg/día y cicloserina
10mg/kg/día, hasta normalización de las enzimas
ocurrido a los 22 días y luego se procedió igual que
en los otros casos5, 6, 8-11. Ver Tabla 3

RAFAs presentados en la evolución
Los 4 niños presentaron disminución de la
agudeza visual, se les suspendió el E y reemplazó por S. Esta intervención no fue necesaria en el
1er. paciente porque la disminución de la agudeza
visual ocurrió a los 70 días de comenzada la medicación y ya no formaba parte de su esquema de
tratamiento1, 12.
En la evolución del caso 1, la niña presentó petequias y hematomas, con plaquetopenia de
10000/ mm3. Se asumió como purpura trombocitopenica (PTI) por R y se suspendió. Como cuarta.
droga se colocó S. Se efectuó estudio hematológico,
con punción de médula ósea (PAMO), C3 118 mg%
C4 23 mg% Anti MPO negativo, Anti PR3 negativo, ANA negativo. Se asumió como purpura
trombocitopenica (PTI). No se reintrodujo la R.
Se trató con transfusiones de plaquetas en dos
oportunidades. Por persistencia de la trombocitopenia, recibió gammaglobulina1mg/kg/dosis
en tres oportunidades. Quedó rotulada como PTI
refractaria1, 10. Tabla 3
En todos los niños se realizaron serologías
(IgM/IgG) para Toxoplasmosis, Rubeola, Citomegalovirus, siendo negativos. Se descartaron
también: Hepatitis B, Hepatitis C, Chagas, Sífilis,
colagenopatías, diabetes, hipotiroidismo y síndrome
de mala absorción. Se efectuó estudio de poblaciones
linfocitarias el cual fue normal. En los casos 1, 2 y
3 las ecografías hepáticas fueron normales y en el
caso 4 se registró leve hepatomegalia homogénea
que revirtió a los 12 días de suspendido la H, R y Z8.
No se registraron interacciones medicamentosas
Los casos 1 y 4 tuvieron baciloscopìas negativas
al 2do. mes de tratamiento.
La evolución fue buena en los casos 1, 2 y 3
cumpliendo seis meses de tratamiento. El caso 4
presentó a los 6 meses de tratamiento neumotórax
bilateral. Requirió avenamiento pleural. Se resolvió en doce días. Por las características clínicas
de ingreso, los exámenes complementarios y la
complicación con el neumotórax se decidió cumplir
12 meses de tratamiento.
Discusión
La clasificación de los RAFAs comprende:
a. manifestaciones de intolerancia, que son las más
frecuentes;
b. reacciones toxicas: generalmente dosis dependientes;
c. según su relación con la dosis de fármacos: Tipo
I o dosis dependientes y Tipo II o dosis independientes.
A su vez estas se dividen en:
1) idiosincrásicas y
2) reacciones de hipersensibilidad (tipo I, II, III,
y IV);
d. según el tiempo de presentación;
e. según severidad:
1) Leves: manifestaciones clínicas poco significativas o de baja intensidad. Generalmente manejo
sintomático, sin suspender fármacos
2) Moderadas: manifestaciones importantes que
no amenazan la vida pero requieren medidas
terapéuticas y/o suspensión temporal o definitiva del fármaco, y
3) Graves o severas: manifestaciones que amenazan la vida, producen incapacidad permanente,
requieren hospitalización, anomalías congénitas
o procesos malignos o incluso la muerte. Se
deben suspender los fármacos2.
El 69% de las RAFAs se registran en los primeros
15 días de tratamiento, el 19% en el segundo mes
y el 12% en la segunda fase de tratamiento.
Los efectos adversos a drogas de primera línea
representan alrededor del 3% al 13% y a las drogas
de segunda línea entre 59% al 73%10.
El RAFAs más importante producido por la
H es la hepatitis. Se presenta en un 20% de los
pacientes. La H se utiliza en el tratamiento de la
tuberculosis (TB) debido a su eficacia y bajo costo.
Se considera un fármaco de primera elección5,13.
La mayoría de los casos tienen elevaciones
leves, asintomáticas y transitorias de las transaminasas. En estos casos, el tratamiento no debe
ser interrumpido. Se resuelven espontáneamente.
Cuando las transaminasas aumentan más de cinco veces el límite superior normal sin síntomas o
más de tres veces con síntomas o hay aumento de
la bilirrubina, debe suspenderse. Se debe evaluar
enfermedades hepáticas y/o biliares preexistentes, comorbilidades, uso de otros medicamentos,
conductas de riesgo. En nuestros 4 casos las transaminasas aumentaron más de 5 veces, no había
datos de enfermedades previas, las serologías
fueron negativas y las ecografías hepáticas normales excepto en el caso 4 con leve hepatomegalia
homogénea que revirtió13-16.
Como conducta se puede esperar la normalización del hepatograma o administrar por lo menos
tres fármacos no hepatotóxicos. Cuando el hepatograma se normaliza, se administran nuevamente
los fármacos en forma secuencial comenzando con
R. Si no hay aumento de transaminasas, luego de una semana se continúa con H y luego Z. Si aparecen síntomas o aumentan las transaminasas, se
debe suspender la última droga administrada. Si la
tolerancia es buena se continúa con el esquema estándar y se suspenden los fármacos alternativos si
fueron utilizados. Tal cual lo ocurrido en el caso 4.
Como factores asociados para tener una hepatitis se destacan: la edad del paciente, dosificación inadecuada, presencia de infección por el
virus de la hepatitis B, hepatitis C, hepatopatía
previa, administración simultánea de fármacos
potencialmente hepatotóxicos, comorbilidades y
desnutrición. Nuestros pacientes eran eutróficos,
excepto en caso 4 que tenía una desnutrición
aguda, no presentaban comorbilidades, las dosis
fueron adecuadas y no tenían medicaciones hepatotóxicas asociadas8.
La variabilidad genética es posiblemente el factor de riesgo más importante en hepatotoxicidad,
ya que el polimorfismo genético tiene una fuerte
influencia en el metabolismo de los medicamentos
y sustancias ajenas al organismo. El estudio del
genotipo y el fenotipo de la N acetiltransferasa 2
(NAT2) ha revelado alelos diferentes, asociados
con la rapidez o la lentitud de la acetilación. El ser
acetilador lento y el presentar complejo mayor de
histocompatibilidad HLA DQ se asocia con mayor
incidencia de alteraciones hepáticas8.
La R es un derivado semisintético de la rifamicina, antibiótico macrocíclico. Las reacciones adversas
a la R se observan en un 4% de los casos. Los RAFAs
más importantes producidos son la hepatitis y la
trombocitopenia (TCP) definida como el descenso
del número de plaquetas circulantes en la sangre
por debajo de 100.000-150.000/mm3. Se puede manifestar con sangrados espontáneos que van desde
simples equimosis o petequias a hemorragias graves.
Según el recuento plaquetario la trombocitopenia se
clasifica en: leve (> 50.000/mm3), moderada (10.000-50.000/mm3) o grave (<10.000/mm3). Nuestra
paciente osciló entre moderada y grave. Suele ser
más frecuente en los regímenes intermitentes ya
que durante los lapsos sin R se generan anticuerpos
antiplaquetarios sin neutralizar.
La trombocitopenia inducida por R puede ser
establecida utilizando los cuatro criterios de
George JN de relación causa-efecto definida entre
empleo de un fármaco e inducción de trombocitopenia. Estos criterios no requieren la presencia
de anticuerpos antiplaquetarios que ocasionan un
mecanismo de hipersensibilidad17.
Se ha demostrado que la R actúa como hapteno
(inductor de anticuerpos contra plaquetas normales), uniéndose covalentemente a una proteína
transportadora (carrier) de membrana, generando
anticuerpos específicos contra plaquetas normales,
solo en presencia de R. Hay anticuerpos dirigidos
contra un set restringido de neoepítopesIb/IIIa y
complejo Ib/V/IX, glicoproteicos plaquetarios. Los
anticuerpos una vez formados permanecen viables
muchos años, reteniendo su potencial de inducción
de trombocitopenias, si el paciente es sometido
a nuevos regímenes diarios o a re-exposicionesúnicas.
En nuestro caso:
a. la purpura se presentó 10 días después de la
administración de la droga;
b. se excluyó otras causas de trombocitopenia
(Purpura de Schonlein Henoch y Síndrome hemofagocítico (SH) o linfohistiocitosis que es una
enfermedad infrecuente caracterizada por una
proliferación benigna de histiocitos maduros y
una descontrolada fagocitosis de plaquetas).
Cuando el síndrome se asocia a TB los trabajos
refieren hasta un 83% de localización extrapulmonar. No encontrada en nuestro caso. Se ha
comunicado un mal pronóstico del SH asociado a
tuberculosis con una mortalidad aproximada del
50%. En los casos de SH asociado a tuberculosis
la patogenia no está clara, se acepta generalmente
como una respuesta inmunológica anormal a las
proteínas liberadas de los bacilos tuberculosos destruidos. Se recomienda la instauración inmediata
del tratamiento tuberculostático y un tratamiento
inmunomodulador. La paciente 4, no reunía los 5
criterios mencionados por la Sociedad de Histología
y tenía punción aspirativa de médula ósea (PAMO)
normal por lo cual descartamos que esta fuese la
causa de la trombocitopenia y concluimos que fue
efecto RAFA a la R18-21.
El E es un bacteriostático, aunque también
muestra efecto bactericida si las concentraciones
son lo suficientemente elevadas. Actúa inhibiendo
la transferencia de los ácidos micólicos a la pared
celular e inhibe la síntesis de arabinogalactano,
un polisacárido clave en la estructura de la pared
celular de las micobacterias y en donde se forman
las moléculas de ácido micólico22-25.
El efecto adverso más importante es la neuritisóptica, que se manifiesta por una pérdida de la
agudeza visual, estrechamiento del campo visual,
pérdida de discriminación a los colores y escotomas centrales o periféricos. El mecanismo de acción no
es bien conocido, se cree que es debido al efecto
quelante del E sobre el metabolismo del cobre y
zinc en las células ganglionares y bipolares de la
retina y fibras del nervio óptico. El cobre es un
cofactor necesario para la citocromo c oxidasa, una
enzima esencial en el transporte de electrones y
en el metabolismo celular oxidativo de las mitocondrias. La neuritis suele ser proporcional a la
dosis y usualmente reversible cuando se suspende.
La bibliografía refiere que la aparición de los
síntomas visuales puede variar de pocos días a
varios meses de iniciado el tratamiento, como lo
ocurrido en el paciente 1. Oftalmología asumió que las características del examen oftalmológico
con lesión bilateral (agudeza visual derecha: 4/10;
agudeza visual izquierda: 6/10) y asimétrica con
evaluación oftalmológica normal al ingreso, el
responsable del RAFA fue el E y no la H que también puede ocasionarlo ya que a pesar de seguir
recibiendo esta última droga, revirtió la perdida
de la agudeza visual. Resaltamos la importancia
de la exploración oftalmológica previa y durante el
tratamiento con fármacos antituberculosos10, 12, 26.
Frente a un RAFA se debe tener en cuenta:
a. constatar dosis (de acuerdo con el peso);
b. evaluar la suspensión, hospitalización o cambio de
medicación, notificar, establecer un plan, identificar el medicamento posible del RAFA, ver cuando
restaurar el o los medicamentos, consultar con un
experto, descartar comorbilidades o interacciones
medicamentosas, seguir los lineamientos de las
guías, contar con fármacos sustitutos.
Si bien es conocido que todos los fármacos
antituberculosos pueden producir RAFAs, las herramientas fundamentales para el tratamiento de
la tuberculosis siguen siendo la H, R, Z, E y S16,17.
Conclusiones
Creemos que los determinantes genéticos han tenido que ver en los RAFAs encontrados en estos pacientes.
Conflicto de intereses: Los autores declaran no tener conflictos de intereses relacionados con el tema de esta publicación.
Bibliografía
1. García Rodríguez JF. Manejo de los efectos Adversos del tratamiento. Galicia Clin 2008; 69 (1): 21-28.
2. Abbate E H, Palmero J D, Castagnino J, et al. Tratamiento de la tuberculosis. Guía práctica elaborada por la Sección Tuberculosis, Asociación Argentina de Medicina Respiratoria. Medicina (B. Aires) 2007, 67: 295-305.
3. Pere Coll. Fármacos con actividad frente a Mycobacterium tuberculosis. Enferm Infecc Microbiol Clin 2003; 21(6): 299-308.
4. Boldú J, Cebollero P, Abu J, et al. Tratamiento de la tuberculosis pulmonar. Anales Sis San Navarra v.30 supl.2. Pamplona 2007.
5. Silva C, Bermúdez V, Arraiz N, et al.Fármacos de primera línea utilizados en el tratamiento de la tuberculosis. AVFT v.26 n.1 Caracas jun. 2007.
6. Guidance for national tuberculosis programmers on the management of tuberculosis in children. Second edition. WHO/HTM/TB/2014. 03: 1-126.
7. Comité Nacional de Neumonología. Y Comité Nacional de Infectología. Criterios de diagnóstico y tratamiento de la tuberculosis infantil. Resumen ejecutivo. Archivos Argentinos de Pediatría. Abril 2016; 114 (2): 189.
8. Gómez Calzada U E, Agudelo Berruecos Y, Berrouet Mejìa MC, et al. Toxicidad hepática por medicamentos antituberculosos. Iatreia vol.21 no.1 Medellín Jan. /Mar. 2008: 41-48.
9. Reto Valiente VL, Castillo Vergara J, Pichilingue Reto P, et al. Hepatotoxicidad por fármacos antituberculosos en Pediatría. Rev. Gastroenterol. Perú 2005; 25: 362-365.
10. Llerena Zegarra E, De Sosa Márquez Y, Cabrera Rivero JL, et al. Manual de Manejo de reacciones adversas a fármacos antituberculosos. Sociedad Peruana de Neumonologìa. 2010: 1-82.
11. Gholami K, Kamali E, Hajiabdolbagh Mi, et al. Evaluación de las reacciones adversas de los antituberculosos en pacientes hospitalizados. Pharmacy Practice 2006; 4(3): 134-138.
12. Rodríguez-Marco, N.A., Solanas-Álava, S., Ascaso, F.J., et al. (2014). Neuropatía óptica severa y reversible por etambutol e isoniazida. Anales del Sistema Sanitario de Navarra. 2014; 37(2), 287-291.
13. López López, A, Hernández Coronado P. Reacciones Adversas a Fármacos Antituberculosos en Hospitales de III Nivel, Caja Nacional de Salud-Hospital Viedma Abril 2002 a Abril 2005. Rev. Méd. (Cochabamba). 2007, vol.18, n.28: 32-41.
14. Taboada López G, Navarro de Claure ML. Acetilación de isoniacida, su relación con factores genéticos y ambientales de altura. Arch. Biol. Med. Exp.1987; 20: 13-19.
15. Saukkonen JJ, Cohn DL, Jasmer RM, et al. ATS Hepatotoxicity of Antituberculous Therapy Subcommittee. An official ATS statement: hepatotoxicity of antituberculous therapy: American Thoracic Society document. Am J Respir Crit Care Med 2006; 174 (8): 935-952.
16. Zayed M R, Velasco A, Pastrana F, et al. Fenotipo acetilador y su relación con la toxicidad hepática de la isoniazida. MAPFRE Medicina, 2004; vol. 15, n.° 1.
17. Amorosi EL, Ultmann JE. Thrombotic thrombocytopenic purpura: report of 16 cases and review of the literature. Medicine. 1966; 45: 139-159.
18. George JN, Woolf SH, Raskob GE ,et al. Idiopathic thrombocytopenic purpura: a practice guideline developed by explicit methods for the American Society of Hematology. Blood 1996; 88: 3-40.
19. Espinosa Bautista KA, Garciadiego Fossas P y Rodríguez EL. Síndrome hemofagocítico. Conceptos actuales. Gaceta Médica de México. 2013;149: 431-7.
20. Henter JI, Horne A, Arico M, et al. Diagnostic and therapeutic guidelines for hemophagocytic lymphohistiocytosis. Pediatr Blood Cancer, 48 (2007), 124-131.
21. Henter JI, Arico M, Egeler RM, et al . A treatment protocol for hemophagocytic lymphohistiocytosis. HLH Study Group of the Histiocyte Society. Med Pediatr Oncol, 28 (1997), pp. 342-347.
22. Zerbini EV. Programa Nacional de Control de la Tuberculosis: Normas Técnicas 2013. 4ta ed. Santa Fe www.medwave. cl 6 doi: 10.5867/medwave.2015.04.6135
23. WHO. Ethambutol efficacy and toxicity: literature review and recommendations for daily and intermittent dosage in children. Stop TB 2006.
24. Comité de Medicamentos de la Asociación Española de Pediatría. Pediamécum. Edición 2015. Etambutol. Disponible en: http://www.pediamecum.es.
25. American Thoracic Society, Centers for Disease Control and Prevention, and Infectious Diseases Society of America. Treatment of tuberculosis. MMWR. 2003; 52 (RR-11): 1-77.
26. Santaella RM, Fraunfelder FW .Elevada Frecuencia de Efectos Adversos Oculares en Pacientes en Tratamientos Sistémicos. Ocular Adverse Effects Associated with Systemic Medications. Drugs 67(1): 75-93, 2007.