Autor : Santiago Guzmán Córdova
Instituto ClĂnico La Florida, Caracas, Venezuela Hospital JosĂ© Gregorio Hernández IVSS, Caracas, Venezuela
Correspondencia : Santiago Guzmán CĂłrdova Domicilio postal: Instituto ClĂnico La Florida. Final Norte Avenida Los Samanes. La Florida. Caracas. Venezuela. Fax: +582127066010 E-mail: guzsantiago@gmail.com
Introducción
La cronoterapia se define como el tratamiento médico temporalmente adecuado para poder alcanzar su mayor eficacia1. Su concepto está estrechamente unido al de ritmo circadiano, el cual se refiere al ritmo biológico autónomo de un ser vivo, con una duración aproximada de 24 horas, que se acopla a las oscilaciones del ambiente2. El conocimiento de las variaciones fisiológicas que ocurren durante un día, tanto en salud como enfermedad, nos permite una aproximación terapéutica más acertada cuando queremos indicar uno o varios fármacos a un individuo. Para ello, debemos reconocer un ritmo circadiano respiratorio e intentar incidir en las variables más prominentes.
Ritmo circadiano respiratorio
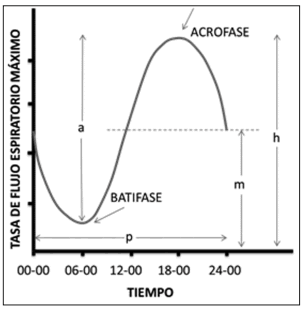
Hace más de medio siglo se estudian los cambios
de la función pulmonar durante las 24 horas del
día3-5 y existe una clara tendencia de reducción
de la capacidad vital forzada (CVF), volumen
espiratorio forzado en 1 segundo (VEF1) y flujo
espiratorio pico (FEP) en las últimas horas de la
noche y primeras de la mañana (batifase); con
aumento de esas variables hacia el final de la mañana y primeras horas de la tarde, que alcanzan
los mayores valores hacia las 4 pm (acrofase). En
pacientes con obstrucción de la vía aérea, estas
fases son más acentuadas, con un cambio mayor
entre la batifase y la acrofase (Fig. 1). Es llamativo que este ritmo persiste independientemente
de la exposición a la luz y del periodo de sueño,
como es evaluado en trabajadores con horarios
nocturnos4, 6.
Etiología del ritmo circadiano respiratorio
Las fluctuaciones circadianas han sido ampliamente evaluadas en asma y algunas variables se
han involucrado en la explicación de los cambios
funcionales7: sistema parasimpático, niveles de
cortisol, catecolaminas, sistema inmunológico.
Sin embargo, estos elementos actúan de manera
coordinada gracias a un control central que se
ubica en el núcleo supraquiasmático en la región
anterior del hipotálamo2, 8, el cual tiene múltiples y
no completamente dilucidadas interacciones con losórganos periféricos, entre ellos, el pulmón. Se han
identificado genes (CLOCK, BMAL1) que controlan
asas de transcripción y traslación rítmicas sobre
genes localizados en tejido pulmonar9, estudios in vitro otorgan un papel relevante a las células claras
del pulmón como “reloj periférico”10, las cuales expresan receptores de glucocorticoides y responden
a la exposición de dexametasona.
Ritmo circadiano en la enfermedad pulmonar
Si existe un ritmo en la función respiratoria,
este debe expresarse también en condiciones de
enfermedad y ante la exposición de sustancias
que producen afectación pulmonar, como lo es el
humo del tabaco. Así lo podemos evidenciar en la
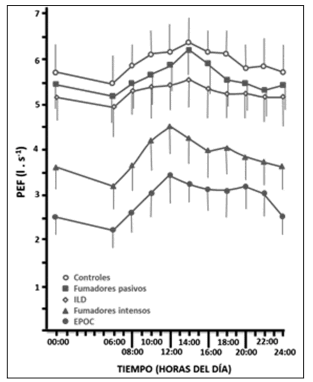
modificación del flujo espiratorio pico en personas
con exposición pasiva al tabaco, fumadores, EPOC,
enfermedad intersticial pulmonar y controles
(Fig. 2). Llama la atención que tanto el fumador
como el paciente con EPOC mantienen el ritmo
común de todos los grupos, pero con oscilaciones
más acentuadas entre la batifase y la acrofase11.
Esta variación de la amplitud es significativamente
mayor comparada con los otros tres grupos y es dependiente de una batifase más pronunciada, es
decir, una mayor caída del flujo pico en el final de
la madrugada y primeras horas de la mañana. Este
aspecto pudiera resultar interesante en la decisión
de la hora adecuada para administrar la terapia
broncodilatadora.
Hay datos experimentales que involucran al humo del tabaco y la inflamación pulmonar en la ruptura del reloj biológico, por modulación genética de la vía SIRT1-BMAL112.
Variabilidad de los síntomas en la EPOC
La información fisiológica, genética, funcional
pulmonar y fisiopatológica, desglosada previamente, pareciera indicar que los pacientes con EPOC
tienen expresiones clínicas de las modificaciones
en el reloj biológico respiratorio. En un estudio
multicéntrico se reportaron encuestas por internet de los síntomas de 803 pacientes con EPOC,
la mañana fue el momento del día en el que los
pacientes refirieron más síntomas, principalmente
disnea, y esto se relaciona con peor desempeño en
las actividades matutinas13. Otro estudio observacional, desarrollado en 17 países europeos, evaluó los síntomas de 2441 pacientes con EPOC (todos
cumplieron consulta médica, entrevista telefónica
y función pulmonar). Disnea fue el síntoma más
reportado con 72,5%. El 62,7% de los pacientes
reconocieron variabilidad de los síntomas, “al
levantarse” y “al final de la mañana” fueron los
momentos del día con mayor reporte; en la suma
de ambos momentos, 55% de los pacientes refirió más disnea, 82,9% flema y 71,2% tos14. Este y
otros estudios destacan el impacto que tienen los
síntomas matutinos en las actividades rutinarias
de los pacientes, que les limitan el uso de escaleras,
bañarse, vestirse, preparar el desayuno, etc.15, 16.
Cronoterapia en la EPOC: evidencia disponible
Desde la década de los 80 existen reportes del
impacto de la farmacoterapia en el ritmo circadiano
de la EPOC. El tratamiento con teofilina de liberación prolongada incrementa flujo espiratorio pico y
genera un cambio significativo del ritmo circadiano
al reducir la caída matutina del mismo17. Similar
hallazgo ocurre con terbutalina oral de liberación
prolongada, aumenta el VEF1 y la presión arterial
de oxígeno durante las 24 horas del día, pero con
un cambio relativo mayor en las últimas horas de
la noche y las primeras de la mañana18. Un aspecto
interesante es la conservación del ritmo pero de
menor amplitud, es decir, la magnitud entre la
acrofase y la batifase se reduce y esto ocurre por el
impacto positivo de la terapia sobre el descenso del
VEF1 en la noche. Esto lo podemos observar en el
estudio con tiotropio administrado en la mañana o en la noche19, que aumenta el VEF1 durante las 24
horas del día independientemente del momento de
aplicación del fármaco y reduce la variabilidad del
VEF1 a expensas del menor descenso en la noche
e inicio de la mañana. Cuando este cambio ocurre,
la curva circadiana se asemeja a la de los controles
de la Figura 2.
Al evaluar el impacto de esta modificación funcional en los síntomas del paciente, encontramos
algunas investigaciones que corroboran la mejoría
en horas matutinas. Partridge y colaboradores
evaluaron 442 pacientes con EPOC y VEF1<50%,
recibiendo formoterol/budesonida 9/320 µg o salmeterol/fluticasona 50/500 µg BID; ambas combinaciones fueron eficaces en reducir los síntomas,
pero formoterol/budesonida fue más efectiva en
mejorar las actividades matutinas, esta diferencia
pudiera estar relacionada al rápido inicio de acción
del formoterol20. También la adición de formoterol/budesonida al tratamiento con tiotropio mejora los
síntomas y las actividades matutinas21.
Conclusiones
La EPOC presenta variabilidad funcional durante las 24 horas del día y esta se relaciona con los síntomas de los pacientes, que reportan mayor severidad y limitación de las actividades al levantarse y en las primeras horas de la mañana. Los tratamientos disponibles inciden positivamente en mejorar función pulmonar, síntomas y actividades diurnas. Es posible que los fármacos con rápido inicio de acción tengan un mayor impacto en el alivio de la disnea cuando el paciente comienza las actividades e incida en un mejor desempeño matutino, sin embargo, esto debería ser comprobado con nuevos ensayos de diseño adecuado que compare medicamentos, tanto b2 agonistas como anticolinérgicos, que alcancen su inicio de acción con diferente rapidez. Los nuevos broncodilatadores de 24 horas de duración podrían representar un objetivo de interés para evaluar estas diferencias.
Conflictos de interés: El autor ha recibido financiación de Novartis, Bayer y Boehringer para asistir a congresos; es médico consultor de Novartis y Bayer; ha hecho declaraciones públicas de temas relacionados al del manuscrito en congresos, simposios y medios de comunicación.
1. Litinski M, Scheer FAJL, Shea SA. Influence of the circadian system on disease severity. Sleep Med Clin 2009; 4: 143-63.
2. Durrington HJ, Farrow SN, Loudon AS et al. The circadian clock and asthma. Thorax 2014; 69: 90-92.
3. Lewinsohn HC, Capel, LH, Smart J. Changes in forced expiratory volumes throughout the day. Br Med J 1960; 1(5171): 460-62.
4. Hetzel MR. The pulmonary clock. Thorax 1981; 36: 481-6.
5. Hetzel MR, Clark TJH. Comparison of normal and asthmatic circadian rhythms in peak expiratory flow rate. Thorax 1980; 35: 732-738.
6. Guberan E, Williams MK, Walford J et al. Circadian variation of FEV in shift workers. Br J Ind Med 1969; 26: 121-5.
7. Barnes PJ. Circadian variation in airway function. Am J Med 1985; 79 (suppl 6A): 5-9.
8. Mortola JP. Breathing around the clock: an overview of the circadian pattern of respiration. Eur J Appl Physiol 2004; 91: 119-129.
9. Sukumaran S, Jusko WJ, DuBois DC et al. Light-dark oscillations in the lung transcriptome: implications for lung homeostasis, repair, metabolism, disease and drug action. J Appl Physiol 2011; 110: 1732-47.
10. Gibbs JE, Beesley S, Plumb L et al. Circadian Timing in the lung; a specific role of bronchiolar epithelial cells. Endocrinology 2009; 150: 268-76.
11. Casale R, Pasqualetti P. Cosinor analysis of circadian peak expiratory flow variability in normal subjects, passive smokers, heavy smokers, patients with chronic obstructive pulmonary disease and patients with interstitial lung disease. Respiration 1997; 64: 251-6.
12. Hwang JW, Sundar IK, Yao H et al. Circadian clock function is disrupted by environmental tobacco/cigarette smoke, leading to lung inflammation and injury via a SIRT1-BMAL1 pathway. FASEB J 2014; 28: 176-94.
13. Partridge MR, Karlsson N, Small IR. Patient insight into the impact of chronic obstructive pulmonary disease in the morning: an internet survey. Curr Med Res Opin 2009; 25: 2043-8.
14. Kessler R, Partridge MR, Miravitlles M et al. Symptom variability in patients with severe COPD: a pan-European cross-sectional study. Eur Respir J 2011; 37: 264-72.
15. Roche N, Small M, Broomfield S et al. Real World COPD: Association of Morning Symptoms with Clinical and Patient Reported Outcomes. COPD 2013; 10: 1-8.
16. O’Hagan P, Chavannes NH. The impact of morning symptoms on daily activities in chronic obstructive pulmonary disease. Curr Med Res Opin 2014; 30 (2):301-14.
17. Rivington RN, Calcutt L, Hodder RV et al. Safety and efficacy of once-daily Uniphyl tablets compared widi twicedaily Theo-Dur tablets in elderly patients with chronic airflow obstruction. Am J Med 1988; 85(suppl lB): 48-53.
18. Postma DS, Koeter GH, van der Mark TW et al. The effects of oral slow release terbutaline on the circadian variation in spirometry and arterial blood gas levels in patients with chronic airflow obstruction. Chest 1985; 87: 653-7.
19. Calverley PM, Lee A, Towse L et al. Effect of tiotropium bromide on circadian variation in airflow limitation in chronic obstructive pulmonary disease. Thorax 2003; 58: 855-60.
20. Partridge MR, Schuermann W, Beckman O et al. Effect on lung function and morning activities of budesonide/formoterol versus salmeterol/fluticasone in patients with COPD. Ther Adv Respir Dis 2009; 3: 1-11.
21. Welte T, Miravitlles M, Hernandez P et al: Efficacy and tolerability of budesonide/formoterol added to tiotropium in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2009; 180: 741-50.