Autor : Mariela Castignola1, Diego Haberman1, Hugo Paladini1, Adriana Martinez1, Juan Ossés2, Jorge Cáneva2
1 DiagnĂłstico por Imágenes, Hospital Universitario FundaciĂłn Favaloro, Bs As, Argentina 2 NeumonologĂa, Hospital Universitario FundaciĂłn Favaloro, Bs As, Argentina
Correspondencia : Mariela Grisel Castignola Domicilio postal: Avenida Belgrano 1746, 2do piso. CABA (CP 1093), Argentina. Tel/fax: (54 - 11) 4378 1200 int. 1221 E-mail: mcastignola@hotmail.com
Resumen
El trasplante pulmonar es una opción terapéutica válida para mejorar la sobrevida de
pacientes con enfermedades respiratorias en fase avanzada. La supervivencia tras el
trasplante de pulmón ha mejorado en gran medida como resultado de los avances en la
técnica quirúrgica, la cuidadosa preservación de órganos de donantes, las mejoras en
la terapia inmunosupresora y el reconocimiento precoz de complicaciones con el uso
de técnicas de imagen.
Nuestro objetivo es proporcionar una guía radiológica del rechazo agudo y crónico del
trasplante pulmonar. Se describirán los hallazgos por tomografía computada multidetector
(TCMD).
Palabras clave: Tomografía computada multidetector; Trasplante pulmonar; Rechazo agudo; Rechazo crónico; Síndrome de bronquiolotis obliterante; Síndrome del injerto restrictivo
Abstract
Lung Transplant Rejection: How to Evaluate by Multidetector Computed Tomography?
Lung transplantation is a valid therapeutic option to prolong survival in patients with
end-stage pulmonary disease. Survival after lung transplantation has greatly improved
as a result of advances in surgical techniques, careful preservation of donor organs,
progress in immunosuppressive therapy, and the use of imaging techniques for an early
recognition of complications.
Our goal is to provide a radiology guide of acute and chronic rejection of lung transplants.
The fndings of multidetector computed tomography (MDCT) studies are described.
Key words: Multidetector computed tomography; Acute rejection; Chronic rejection; Obliterans bronchiolitis syndrome; Restrictive allograft syndrome
Introducción
El estadio avanzado de las enfermedades pulmonares con insuficiencia respiratoria es una condición
devastadora, sin tratamiento médico efectivo. El
trasplante pulmonar es una opción terapéutica
mundialmente aceptada1.
El número de trasplantes realizados anualmente y la cantidad de centros que realizan trasplantes
de pulmón continúan aumentando.
En Argentina, según cifras del INCUCAI, en
el 2004 se realizaron 26 trasplantes pulmonares,
mientras que en el 2013 el número ascendió a 36.
Nuestra institución realizó el 70% de los mismos2.
La supervivencia tras el trasplante de pulmón ha
mejorado en gran medida como resultado de los
avances en la técnica quirúrgica, la cuidadosa preservación de órganos de donantes, las mejoras en la
terapia inmunosupresora y el reconocimiento precoz
de complicaciones con el uso de técnicas de imagen3.
Dentro del espectro de complicaciones postrasplante se encuentra el rechazo del injerto donde
juega un rol fundamental el diagnóstico por imágenes. En el presente artículo se describirán los
hallazgos por tomografía computada multidetector
(TCMD) torácica del rechazo agudo y crónico de los
trasplantes pulmonares. El reconocimiento precoz
de estas complicaciones contribuye a las mejoras
en la supervivencia a mediano y largo plazo.
Técnica de adquisición de imágenes
El estudio de pacientes trasplantados pulmonares
es ideal realizarlo en tomógrafos multi detectores
debido a dos razones: en primer lugar, estos equipos permiten adquisiciones rápidas, fundamental
en estos pacientes que pueden presentar disnea y
dificultad para mantener apenas prolongadas (lo
que podría generar artificios de movimientos respiratorios si se adquiere el estudio en tomógrafos
helicoidales); en segundo lugar la resolución espacial es superior a la de los equipos de generaciones
anteriores, lo que facilita evaluar la totalidad del
pulmón en alta resolución. En nuestra institución,
se utiliza un tomógrafo multicorte de 64 hileras
de detectores (Toshiba, Aquilion). Se obtienen
imágenes de 0,5 mm de espesor con 0,3 mm de intervalo de reconstrucción, en máxima inspiración.
Se adicionan imágenes en espiración forzada sólo
cuando se desea descartar rechazo crónico, situación que suele presentarse en 3 escenarios: cuando
existe sospecha clínica y espirométrica de rechazo,
a los 6 meses o más de antigüedad de trasplante y
cuando existen evidencias de rechazo crónico en
fase inspiratoria.
No es necesaria la administración de contraste
intravenoso, ya que no aporta datos y se trata de
un fármaco potencialmente nefrotóxico. Dicho
comentario no es menor, teniendo presente que
muchos de los pacientes padecen enfermedades
sistémicas o eventos adversos farmacológicos que
pueden comprometer la función del riñón.
Rechazo agudo
Se presenta con mayor frecuencia en los primeros
seis meses del trasplante.
La importancia del rechazo agudo radica en que
es considerado el factor de riesgo más importante
para el desarrollo de rechazo crónico. Es por eso
que se recomienda realizar periódicamente biopsias de vigilancia en los primeros meses luego del
trasplante8.
Para el diagnóstico contamos con la evaluación
clínica, las pruebas funcionales, la TCMD y la
broncoscopía. La evaluación clínica es inespecífica
y muchas veces puede mimetizar una infección. Es
así como el rol de la espirometría es controversial
ya que no distingue entre rechazo o infección.
En la TCMD, el signo más frecuentemente
descripto es la presencia de opacidad en vidrio
esmerilado de localización focal o difusa. Este
signo es tan sensible (65%) que se considera que
su ausencia es casi excluyente del diagnóstico de
rechazo agudo4, 5, 7 ,9.
Otros signos presentes son las consolidaciones
del espacio aéreo de localización basal, engrosamiento peribroncovascular (conocido como el “cuff
sign” en la bibliografía anglosajona) a predominio
de los lóbulos inferiores, engrosamientos septales,
pérdida de volumen y derrame pleural nuevo o el
aumento de uno preexistente (Figuras 1 y 2).
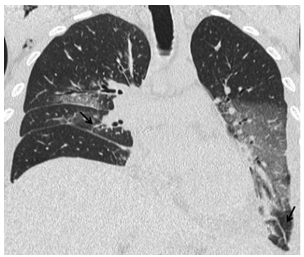
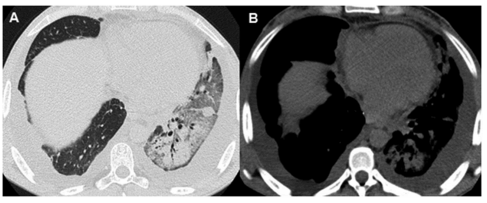
No hay un signo que por sí solo sea significativo
para el diagnóstico de rechazo agudo, sin embargo la
combinación de pérdida de volumen y engrosamiento
septal parecería ser un hallazgo bastante específico4.
A pesar de que la TCMD no puede discriminar
por sí sola entre rechazo y otras complicaciones durante los primeros meses del postoperatorio, cabe
señalar que es muy útil para guiar al broncoscopio
hacia las áreas pulmonares con mayor compromiso
del espacio aéreo.
El diagnóstico definitivo de rechazo agudo
se hace con la histología, obtenida a través de
la biopsia transbronquial (BTB), que tiene una
sensibilidad de aproximadamente 70-90%, y una
especificidad que oscila entre 90-100%8.
Rechazo crónico
La disfunción del injerto pulmonar crónica (DIPC)
es la principal limitación para el éxito del trasplante pulmonar a largo plazo. Ocurre aproximadamente luego de 6 meses del trasplante. A los 5
años del trasplante el 50-60% de los receptores
desarrollan rechazo crónico, independientemente
de si presentan o no factores de riesgo7.
El principal factor de riesgo es la frecuencia
y severidad de episodios de rechazo agudo. En
segunda instancia están las infecciones, el reflujo
gastroesofágico, denervación pulmonar, edad avanzada del donante, entre otros.
Los pacientes se presentan con disnea, tos crónica y fundamentalmente una caída de la función
respiratoria sostenida en el tiempo, la cual puede
mejorar con el tratamiento adecuado y temprano,
aunque nunca llegan a recuperar la función respiratoria que tenían antes del rechazo.
Anteriormente se consideraba que el DIPC era
sinónimo de síndrome de bronquiolitis obliterante
(SBO). Actualmente hay evidencia que demuestra
que el DIPC es una condición heterogénea con
diferentes mecanismos implicados.
DIPC se define como una caída persistente del
FEV1 > 20%, comparado con el promedio de los dos mejores resultados de FEV1 post-trasplante16.
Una vez hecho el diagnóstico de DIPC, tenemos dos
grandes grupos: los pacientes con mejora parcial
del FEV1 y los pacientes con caída irreversible del
mismo. En el primer grupo se encuentra la disfunción del injerto neutrofílica reversible (DINR); y
en el segundo grupo se encuentran el síndrome de
bronquiolitis obliterante (SBO) y el síndrome del
injerto restrictivo (SIR)16.
Disfunción del injerto neutrofílica reversible
La disfunción del injerto neutrofílica reversible
DINR se caracteriza por presentar neutrofilia
en la vía aérea (diagnosticado a través del lavado
bronquioloalveolar) y mejoría funcional (> 10%
del FEV1) tras el tratamiento con azitromicina16.
En la TCMD, se observa el signo de árbol en
brote, caracterizado por nódulos centrolobulillares
conectados con estructuras lineales que representan a los bronquiolos engrosados. Estos hallazgos
se resuelven después del tratamiento.
Síndrome de bronquiolitis obliterante
Histológicamente se manifiesta como bronquiolitis obliterante (BO), que es la inflamación de las
vías respiratorias de pequeño calibre que produce
obstrucción y destrucción de los bronquiolos pulmonares, lo que genera enfermedad respiratoria
obstructiva grave. Sin embargo, con frecuencia
la BO tiene una distribución heterogénea, lo que
genera que la BTB no sea un método diagnóstico
suficientemente sensible. Es por eso que en 1993
la Sociedad Internacional de Trasplante Cardíaco y Pulmonar propuso una descripción clínica para
la BO, denominada síndrome de bronquiolitis
obliterante (SBO), que se basa en detectar la
disminución de la función respiratoria a través de
la espirometría8,13,17.
La TCMD es un método simple y reproducible
con una alta precisión para el diagnóstico de SBO,
que además permite diferenciar las áreas de mayor
compromiso de las áreas libres de enfermedad.
Como mencionamos, es fundamental estudiar a
estos pacientes con fases en inspiración y espiración ya que cada una nos brindará diferentes signos que nos ayudarán a aproximar el diagnóstico. Las imágenes en inspiración presentan dos
hallazgos típicos: las anormalidades bronquiales y la atenuación en mosaico.
Las dilataciones bronquiales son un buen indicador de SBO, que se encuentran presentes en el
80% de los pacientes. El diámetro de los bronquios
aumenta con el empeoramiento de la función pulmonar, de esta manera se pudo correlacionar
el grado de dilatación con el grado de SBO y ser
un signo útil para la vigilancia de la enfermedad.
(Tabla 1)6,15.

Otros signos asociados son el engrosamiento parietal de los bronquios y taponamientos mucosos de bronquiolos centrolobulillares (Figura 3).
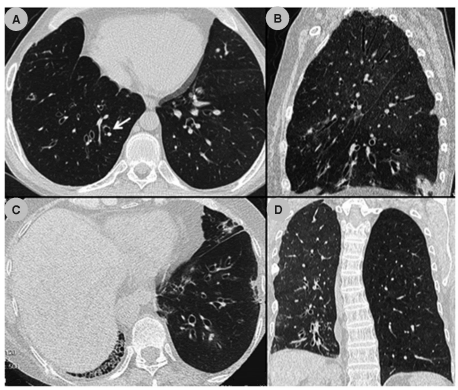
Es recomendable buscar las dilataciones de los
bronquios en los lóbulos inferiores para no confundirlas con bronquiectasias por tracción secundarias
a fibrosis del lóbulo superior7.
La atenuación en mosaico se produce como
consecuencia de la disminución de la perfusión
en áreas distales a la obstrucción bronquiolar con
redistribución vascular hacia zonas de pulmón no
afectado (Figura 4). Este signo tiene un valor diagnóstico limitado porque es frecuente encontrarlo
en pacientes sanos y en pacientes trasplantados
sin SBO4.
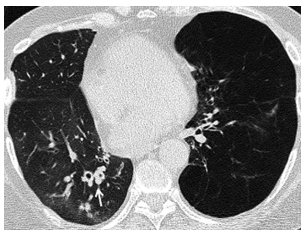
En cuanto a la fase en espiración, se busca detectar la presencia de atrapamiento aéreo, que es el signo más indicativo de rechazo crónico. Se produce por la obstrucción parcial de la vía aérea, donde hay facilidad para la entrada del flujo aéreo al pulmón, pero dificultad en su salida, lo que genera retención del aire. Dicha dinámica se verá representada en la TCMD por una falta de aumento homogéneo de la atenuación pulmonar en espiración (Figura 5). Se debe tener presente que cuando se encuentra este hallazgo en aislados lobulillos secundario, no se considera criterio diagnóstico de SBO ya que puede verse normalmente en personas sanas.
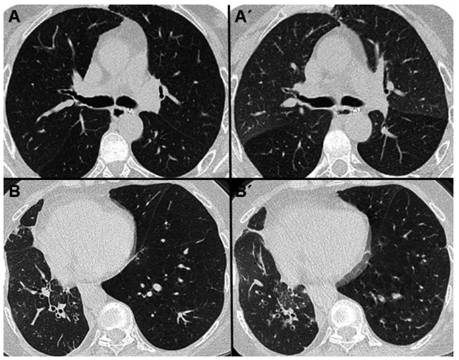
No existe una correlación entre el porcentaje de atrapamiento aéreo y los diferentes grados de rechazo crónico. No obstante, algunos autores sugieren que un porcentaje mayor o igual a 32% de atrapamiento aéreo (porcentaje evaluado mediante escalas visuales, sin mediciones cuantitativas) es lo suficientemente sensible y específico para SBO14.
Síndrome del injerto restrictivo
Representa el 25-35% de las DIPC y se define como
un declive irreversible de la capacidad pulmonar
total (FVC) <90% de la línea de base, junto con la
caída irreversible del FEV118
.
Se caracteriza histológicamente por presentar
una secuencia temporal de daño alveolar difuso
seguido por el desarrollo de fibrosis pleuroparenquimatosa17,18.
Los hallazgos en TCMD se correlacionan significativamente con el descenso de la FVC. En las
etapas tempranas de SIR predominan las opacidades en vidrio esmerilado centrales y periféricas.
Mientras que en estadios tardíos, los signos más
predominantes son las bronquiectasias por tracción, las consolidaciones centrales y periféricas, la
alteración de la arquitectura parenquimatosa, la
pérdida de volumen y la retracción hiliar16.
La supervivencia del paciente con RAS es significativamente peor que SBO17.
Conclusión
Tanto el rechazo pulmonar agudo como el crónico
tienen un impacto en la sobrevida a mediano y
largo plazo.
La TCMD intenta satisfacer la creciente expectativa de los neumonólogos, participando del
diagnóstico preciso en los pacientes con rechazo de
los trasplantes pulmonares, y además brindando
la posibilidad de un seguimiento de la enfermedad.
Conflictos de interés: Los autores declaran no tener conflictos de intereses relacionados con esta publicación.
1. WorldHealthOrganization. 112th edición. 2003. p. 1.
2. INCUCAI. Procuración y trasplante de órganos, tejidos y células en Argentina. En: http://sintra.incucai.gov.ar/
3. Naidich D, Webb R, Müller N et al. Tórax TC y RM. 3era Ed. Madrid: Marbán, 2000, pp. 278-280.
4. Gotway M, DawnS, Sollami D et al. Acute rejection following lung transplantation: limitations in accuracy of thinsection CT for diagnosis. Radiology 2001; 221: 207-212.
5. Loubeyre P, Revel D, Delignette A et al. High-resolution computed tomographic findings associated with histologically diagnosis acute lung rejection in heart-lung transplant recipients. Chest 1995; 107; 132-138.
6. Lentz D, Bergin C, Berry G et al. Diagnosis of obliterans in heart-lung transplantation patients: importance of bronchial dilatation on CT. AJR 1992; 159: 463-467.
7. Krishnam M, Suh R et al. Postoperative complications of lung transplantation: radiologic findings along a time continuum. RadioGraphics 2007; 27: 957-974.
8. Ossés JM. Fibrobroncoscopia en trasplante pulmonar. En: Aráoz L. Broncoscopia para clínicos y neumonólogos. Buenos Aires: Publicaciones Latinoamericanas, 2008, pp. 171-178.
9. Hochhegger B, Loureiro K et al. Computed tomography findings of postoperative complications in lung transplantation. J Bras Pneumol 2009; 35: 266-274.
10. Siegel M, Bhalla M, Gutierrez F. Post–Lung Transplantation Bronchiolitis Obliterans Syndrome: Usefulness of Expiratory Thin-Section CT for Diagnosis. Radiology 2001; 220: 455-462.
11. Konen E, Gutiérrez C et al. Bronchiolitis Obliterans Syndrome in Lung Transplant Recipients: Can Thin-Section CT Findings Predict Disease before Its Clinical Appearance? Radiology 2004; 231: 467-473.
12. Stewart S, Fishbein M, Snell G et al. Revision of the 1996 Working Formulation for the Standardization of Nomenclature in the Diagnosis of Lung Rejection. J Heart Lung Transplant 2007;12: 1229-1242.
13. Estenne M, Maurer J, Boehler A et al. Bronchiolitis Obliterans Syndrome 2001: An Update of the Diagnostic Criteria. J Heart Lung Transplant 2002; 21: 297-310.
14. Bankier A, muylem A, Knoop C et al. Bronchiolitis Obliterans Syndrome in Heart-Lung Transplant Recipients: Diagnosis with Expiratory CT. Radiology 2001; 218: 533-539.
15. Choi Y, Rossi S, Palmer S et al. Bronchiolitis Obliterans Syndrome in Lung Transplant Recipients: Correlation of Computed Tomography Findings With Bronchiolitis Obliterans Syndrome Stage. Journal of Thoracic Imaging 2003; 18: 72-79.
16. Verleden SE, de Jong PA, Ruttens D et al. Functional and computed tomographic evolution and survival of restrictive allograft syndrome after lung transplantation. J Heart Lung Transplant 2014.
17. Sato M, Waddell TK, Wagnetz U et al. Restrictive allograft syndrome (RAS.: a novel form of chronic lung allograft dysfunction. J Heart Lung Transplant 2011; 30(7): 735-42.
18. Ofek E, Sato M, Saito T et al. Restrictive allograft syndrome post lung transplantation is characterized by pleuroparenchymal fibroelastosis. Mod Pathol 2013; 26(3): 350-6.