Autor :Jefferson Antonio BuendĂa
Departamento de FarmacologĂa y ToxicologĂa. Facultad de Medicina, Universidad de Antioquia UdeA, Calle 70 No. 52-21, MedellĂn, Colombia. Departamento de FarmacologĂa. Facultad de Farmacia y BioquĂmica, Universidad de Buenos Aires, Argentina. SecciĂłn de NeumonologĂa Pediátrica. Departamento de PediatrĂa. Hospital Italiano de Buenos Aires, Argentina.
Correspondencia : Jefferson Antonio BuendĂa Departamento de FarmacologĂa y ToxicologĂa, Facultad de Medicina, Universidad de Antioquia Domicilio postal: Carrera 51d No. 62-83, MedellĂn, Colombia. Telefax: (+574) 219-6022. E-mail: toxicologia@medicina.udea.edu.comÂ
Las evaluaciones económicas de tecnologías sanitarias (EETS) son estudios comparativos entre los beneficios en salud y los costos de una o más tecnologías en salud1. Durante los últimos años, el número de EETS publicadas se ha incrementado2, e incluso existen países como Australia, Canadá o Reino Unido con agencias públicas encargadas de promover EETS como parte del desarrollo de guías nacionales de práctica clínica3. El campo de la medicina respiratoria no ha sido ajeno a dicho desarrollo ya que existen numerosas guías de práctica clínica que incorporan la información proveniente de EETS como sustrato para la generación de recomendaciones basadas en la evidencia4.
Existen 4 tipos clásicos de análisis en las EETS que se diferencian en la forma de medir los beneficios clínicos, como se puede ver en la Tabla 1. A continuación presentaremos 2 EETS en medicina respiratoria donde detallaremos algunos aspectos básicos en la interpretación de los estudios de costo-efectividad y costo-utilidad.

¿Cómo se comparan los beneficios en salud y los costos?: la razón de costo efectividad
Una evaluación de costo-efectividad implica comparar para cada tratamiento o prueba diagnóstica los costos médicos que implica el manejo de la enfermedad, frente al beneficio clínico (en unidades de morbilidad o mortalidad). Dicha comparación es expresada como un cociente conocido como razón de costo-efectividad. Por ejemplo, Ya-Chen y colaboradores evaluaron 4 terapias controladoras de primera línea (salmeterol/fluticasona, fluticasona inhalada, corticoides inhalados distintos a fluticasona (n-Fluti) y modificadores de leucotrienos) en asma moderada5. En dicha evaluación, los autores expresaron la razón de costo-efectividad en términos de costo (US$) por día libre de síntomas. Como puede verse, los autores eligieron expresar el beneficio en unidades de morbilidad como lo fueron días libres de síntomas; así mismo dependiendo de la información disponible, el beneficio clínico se puede expresar en unidades de morbilidad como días libres de exacerbación severa, o en medidas de mortalidad como años de vida ganados a consecuencia de cada uno de los tratamientos.
¿De dónde se genera la información de costos y beneficios clínicos?
La calidad de la EETS será proporcional a la transparencia y exhaustividad en la búsqueda de información de costos y de efectividad6. La información de beneficio clínico puede generarse prospectivamente durante un ensayo clínico controlado o puede recabarse retrospectivamente a partir de fuentes secundarias de datos como revisiones sistemáticas o estudios epidemiológicos. Es fundamental que dicha información provenga no sólo de una población similar a la cual desea inferir resultados; sino que en el caso de utilizarse fuentes secundarias, dicha información sea recabada a partir estudios con el menor riesgo de sesgos2. En el caso del estudio de Ya-Chen, la información de efectividad se derivó de una revisión de estudios epidemiológicos, y no a partir de revisiones sistemáticas o prospectivamente durante un ensayo clínico controlado, lo cual, por ejemplo, puede ser una debilidad del estudio en la medida que el autor no demuestre el bajo riesgo de sesgo de la información incluida.
Para generar los costos totales de cada alternativa a evaluar, se debe recabar información tanto de la frecuencia de utilización de los recursos consumidos por cada paciente (tratamientos, pruebas diagnósticas, etc.) como de los costos directos de cada uno7. Por ejemplo, durante el tratamiento de un paciente con fluticasona se deberá costear además de los costos por tratamiento farmacológico, costos por pruebas diagnósticas durante el seguimiento de los pacientes. En este caso, se debe estimar no solo qué pruebas diagnósticas se le practican a cada paciente si no con qué frecuencia se realizan durante el periodo de evaluación; siendo el costo final el resultado del múltiplo entre el costo de cada prueba diagnóstica (ejemplo: US$ 50 por espirometría) y la frecuencia de su utilización (ejemplo: 2 espirometrías por año). Este tipo de información es derivada prospectivamente de ensayos clínicos controlados, fuentes secundarias como guías de práctica clínica locales, o en el caso de no existir guías que reflejen las prácticas locales, a partir del consenso de expertos locales8. Este ejercicio de costeo se realiza para todos los recursos consumidos por el paciente como tratamientos, pruebas diagnósticas, hospitalizaciones, etc.
El tipo de costos a incluir va a depender de la perspectiva del estudio o punto de vista (ejemplo pagador u obra social, ministerio de salud) desde el cual se quiere contestar la pregunta en el análisis. Por ejemplo, una evaluación económica desde el punto de vista del individuo tendrá en cuenta además de los costos directos por la atención en salud, gastos incurridos por el paciente como por ejemplo los desplazamientos en transporte; mientras que si se trata de una evaluación desde la perspectiva del pagador u obra social se consideran usualmente sólo los costos directos por la atención que son facturados por el prestador del servicio (hospital, clínica, etc)9. A su vez, cuando se considera la perspectiva de la sociedad, se incluyen todos los costos tanto incurridos por el paciente, el prestador, como aquellos costos por ausentismo laboral, pérdida de productividad, etc. En el caso del estudio de Ya- Chen solo incluye costos directos relacionados con la atención del asma (ejemplo, costos por día-cama de hospitalización, pruebas diagnósticas, medicamentos, cuidados de enfermería, etc.) y no costos indirectos (aquellos indirectamente relacionados con la alternativa que se estudia, como costos por ausentismo laboral o productividad) o intangibles (aquellos de muy difícil traducción monetaria, como el dolor y sufrimiento del paciente y su familia debido a la enfermedad). Es tan importante incluir todos los costos que atañen a la atención médica como es obtenerlos de una fuente que sea válida, idealmente de listados públicos de precios emitidos por agencias reguladoras o en su defecto manuales tarifarios sometidos a algún tipo de arbitraje10.
Expresando los resultados: la razón de costo-efectividad incremental
En el estudio de Ya-Chen encontraron que al comparar n-fluti con fluticasona, esta última no sólo resultaba en costos más bajos sino también en mayor efectividad en términos de días libres de enfermedad y número de recaídas (Tabla 2). Cuando esto ocurre, se denomina como estrategia dominada a la alternativa con mayores costos y menor efectividad; en este caso n-fluti fue dominada por la alternativa fluticasona. Así mismo los modificadores de leucotrienos resultaron ser dominados por la opción salmeterol/ fluticasona; con lo que al final del análisis solo dos estrategias fueron elegidas para la comparación final: salmeterol/ fluticasona y fluticasona.
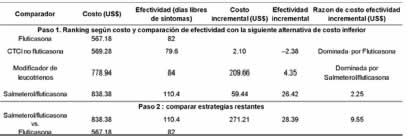
Costo incremental: diferencia de costos entre las alternativas comparadas.
Efectividad incremental: diferencia en términos efectividad (en este caso días libres de síntomas) entre las alternativas comparadas.
CTCI no fluticasona: corticoides inhalados distintos a fluticasona.
La estrategia salmeterol/ fluticasona si bien es más efectiva que fluticasona, resulta también en mayores costos (Tabla 2). Cuando esto ocurre es importante saber cuánto dinero adicional se debe pagar por cada unidad extra de beneficio clínico (valor llamado razón de costo efectividad incremental o RCEI) con el fin de que el decisor en salud (médico, administrador, ministerio, obra social, etc.) pueda optar si paga dinero extra para obtener más beneficio clínico o prefiere quedarse con una estrategia más económica pero con menor efectividad al no tener dicha disponibilidad de pago2. En el caso del estudio de Ya-Chen estimaron que la RCEI del salmeterol/ fluticasona respecto a la fluticasona es de US$ 9.55 por día libre de enfermedad y US$ 8.92 por día libre de medicación de rescate
Las evaluaciones de costo-utilidad: incorporando la calidad de vida
A diferencia de las evaluaciones de costo-efectividad, las evaluaciones de costo utilidad requieren obtener medidas de preferencias que tienen los propios pacientes por cada estado de salud posible durante la enfermedad. Es decir, ponderan la medida del beneficio clínico (ejemplo años de vida ganados) por una medida de preferencia como por ejemplo calidad de vida2,3.
Norman y colaboradores, por ejemplo, evaluaron el costo- utilidad del omalizumab en pacientes con asma severa respecto al tratamiento estándar11. En dicha evaluación, encontraron que el costo por año de vida ganado ajustado por calidad de vida (en inglés quality-adjusted life years o QUALY) que brinda dicho medicamento es de £83,822 en adultos y £78,009 en niños. A diferencia de los estudios de costo-efectividad, sí existen parámetros con los cuales comparar el costo por QUALY y definir si una tecnología es o no costo-útil. A este respecto algunos países tienen determinado cuánto sería el máximo valor a pagar por una QUALY ofrecida por una tecnología; de tal suerte que si dicho valor supera el costo por QUALY definido por el país dicha tecnología se declara como no costo efectiva. Por ejemplo, Reino Unido ha establecido que una tecnología es costo-efectiva siempre y cuando el costo por QUALY no supere los £ 20.000 a £ 30.00012; siendo entonces claro que el omalizumab no es un medicamento costo-efectivo al superar dicho umbral para este país. En el caso de EEUU, este umbral de pago es de USD 50.000 por QUALY13, y de USD 60.000 a 75.000 por QUALY en Japón14. Para países que no han definido dicho umbral, como ocurre en Latinoamérica, la OMS recomienda que el costo por QUALY para que una tecnología sea considerada costo-efectiva no supere 2-3 veces el PIB per cápita15.
Otros aspectos básicos en la interpretación de las EETS
Otros aspectos básicos en la interpretación de las EETS son: el horizonte temporal del estudio y el análisis de sensibilidad.
El horizonte temporal se refiere al periodo de tiempo considerado dentro del análisis, el cual debe ser especificado en una EETS dada su implicancia en los ajustes temporales o descuentos que deben hacérsele a los datos incluidos. Este período de observación debe ser suficiente para poder observar todos los efectos de las diferentes estrategias terapéuticas analizadas. En el caso de que este tiempo sea prolongado, será necesario aplicar ajustes o factores de descuento a los costos y beneficios durante el período estudiado3,16. Por ejemplo, en la evaluación de Ya-Chen, toman un horizonte temporal de 1 año lo cual implica que sólo en este periodo de tiempo se pueden aplicar las conclusiones de la evaluación; siendo desconocido si el costo-efectividad de la fluticasona se extiende más allá de 1 año después de iniciarse como terapia de primera línea.
El análisis de sensibilidad implica la variación de uno o varios parámetros de los costos o beneficios dentro de un rango de valores preestablecido, normalmente el intervalo de confianza de cada estimación, y la estimación nuevamente de los resultados ante los distintos valores que puede tomar cada parámetro2,3,6. En síntesis, los resultados de la EETS no deben cambiar en la medida en que se modifican los parámetros del modelo; si esto se cumple se dice que los resultados de las EETS son robustos. Estos análisis pueden ser univariantes o probabilísticos de acuerdo a si se permite no solo variar más de un parámetro al mismo tiempo sino también si se le permite oscilar dentro de una distribución de valores predefinidos3,6,9. Así mismo también permite evaluar el modelo a través del cálculo del impacto que sobre el resultado tiene la variación en distintos escenarios.
En conclusión, aquí se han presentado algunos conceptos básicos respecto a la interpretación de EETS. Las evaluaciones económicas son una herramienta más en la toma de decisiones y cuyo objetivo es mejorar la salud del paciente maximizando la eficiencia en el uso de recursos.
Conflictos de interés: El autor declara no tener conflictos de interés.
Agradecimientos: Universidad de Antioquia, Estrategia de Sostenibilidad (2012-2013).
1. Augustovski F, Garay OU, Pichon-Riviere A, Rubinstein A, Caporale JE. Economic evaluation guidelines in Latin America: a current snapshot. Expert Rev Pharmacoecon Outcomes Res 2010;10(5): 525-37.
2. Drummond MF, Schwartz JS, Jönsson B, et al. Key principles for the improved conduct of health technology assessments for resource allocation decisions. Int J Technol Assess Health Care 2008; 24(3): 244-58.
3. Harris A, Buxton M, O’Brien B, Drummond FR. Using economic evidence in reimbursement decisions for health technologies: experience of 4 countries. Expert Rev Pharmacoecon Outcomes Res 2001; 1(1): 7-12.
4. O’Reilly J, Jones MM, Parnham J, Lovibond K, Rudolf M. Management of stable chronic obstructive pulmonary disease in primary and secondary care: summary of updated NICE guidance. BMJ 2010; 340: c3134.
5. Shih Y-CT, Mauskopf J, Borker R. A cost-effectiveness analysis of first-line controller therapies for persistent asthma. Pharmacoeconomics 2007; 25(7): 577-90.
6. Husereau D, Drummond M, Petrou S, et al. Consolidated Health Economic Evaluation Reporting Standards (CHEERS) statement. Int J Technol Assess Health Care 2013; 29(2): 117-22.
7. Weiss KB, Sullivan SD. The economic costs of asthma: a review and conceptual model. Pharmacoeconomics 1993; 4(1): 14-30.
8. Weiss KB, Sullivan SD. The health economics of asthma and rhinitis. I. Assessing the economic impact. J Allergy Clin Immunol 2001; 107(1): 3-8.
9. Sculpher MJ, Price M. Measuring costs and consequences in economic evaluation in asthma. Respir Med 2003; 97(5): 508-20.
10. Heyland DK, Gafni A, Kernerman P, Keenan S, Chalfin D. How to use the results of an economic evaluation. Crit Care Med 1999; 27(6): 1195-202.
11. Norman G, Faria R, Paton F, et al. Omalizumab for the treatment of severe persistent allergic asthma: a systematic review and economic evaluation. Health Technol Assess 2013; 17(52): 1-342.
12. McCabe C, Claxton K, Culyer AJ. The NICE cost-effectiveness threshold: what it is and what that means. Pharmacoeconomics 2008; 26(9): 733-44.
13. Bridges JFP, Onukwugha E, Mullins CD. Healthcare rationing by proxy: cost-effectiveness analysis and the misuse of the $50,000 threshold in the US. Pharmacoeconomics 2010; 28(3): 175-84.
14. Shiroiwa T, Igarashi A, Fukuda T, Ikeda S. WTP for a QALY and health states: More money for severer health states? Cost Eff Resour Alloc 2013; 11(1): 22.
15. WHO | Table: Threshold values for intervention cost-effectiveness by Region. World Health Organization; [citado 2014 Jan 5]; Disponible: http://www.who.int/choice/costs/CER_levels/en/index.html
16. Kumar S, Williams AC, Sandy JR. How do we evaluate the economics of health care? Eur J Orthod 2006; 28(6): 513-9.