Autor : CĂ©sar Delgado Viteri1, Raquel Aguirre1, Juan C. Spina2, Juan Barreira3, MartĂn Bosio1, Silvia Quadrelli1
1 Servicio de NeumonologĂa 2 Servicio de DiagnĂłstico por Imágenes 3 Servicio de ReumatologĂa Hospital Británico de Buenos Aires
Correspondencia : Dr. Delgado Viteri E-Mail: cdelgadoviteri@gmail.com
Presentación del caso
Dr. César Delgado: Un hombre de 42 años de edad,
no fumador, fue evaluado en la consulta externa
de Neumonología por tos y disnea que en los últimos seis meses había progresado hasta hacerse
evidente en reposo.
Aproximadamente un año antes, el paciente
había notado un descenso en su tolerancia a las
actividades diarias. En los últimos seis meses
desarrolló disnea de esfuerzo que progresa al
reposo y se acompaña de tos con expectoración
hialina escasa, y sibilancias. Un mes antes de
esta evaluación, el paciente había consultado a
un especialista en otro centro. En la auscultación
pulmonar se encontraron sibilancias 4/6 difusas,
y una espirometría reveló una alteración ventilatoria obstructiva en grado muy severo. Por este
motivo inició tratamiento con broncodilatadores
de acción prolongada asociados a corticoides inhalados en dosis altas, así como broncodilatadores de
acción corta en nebulización a demanda, pero no
encontró cambios en su condición clínica.
Hace 20 años fue diagnosticado de artritis
reumatoide (RA) seropositiva con erosión severa
en manos. Desde hace cinco años estaba en tratamiento regular con sulfasalazina 2 gramos por día,
prednisona 10 mg por día, y AINEs (ibuprofeno
400 a 800 mg por día). Negó uso de otros DMARD
o tratamiento inmunomodulador en el pasado. Sus
síntomas habituales consistían en rigidez matutina de 30 a 60 minutos de duración y artralgias en
rodillas y articulaciones metacarpo falángicas de
leve a moderada intensidad. Pese a tener movilidad limitada en sus manos, se desempeñaba como
cajero en un restaurante. Vivía solo en una casa
que contaba con todos los servicios.
El paciente no tenía antecedentes de alergias,
asma, y consumo de drogas o exposición a tóxicos.
No reportó fiebre o equivalentes, dolor torácico,
hemoptisis, lesiones cutáneas, o aumento de los
síntomas relacionados a la AR
El paciente medía 171 cm y pesaba 74 Kg (IMC
de 25,3 kg/m2). Su presión arterial era 110/70
mmHg, la frecuencia cardíaca era 105 latidos por
minuto, y la frecuencia respiratoria 20 ciclos por
minuto. Su temperatura corporal era de 36,5 °C, y la
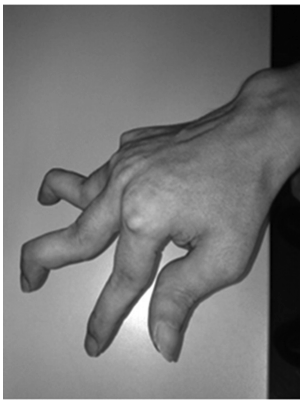
saturación de oxígeno era 94% en reposo respirando aire ambiente. Se observaron deformidades en
cuello de cisne y subluxación metacarpo falángica.
(Fig. 1). La auscultación pulmonar reveló estridor
inspiratorio y sibilancias 5/6 de forma difusa. No
se auscultaron rales. Los ruidos cardíacos eran
normales. En el cuello no se observaban venas
yugulares distendidas y no se encontró edema en
miembros inferiores. Tampoco presentaba hipocratismo digital. El resto de la exploración no mostró otros hallazgos patológicos.
El análisis de laboratorio mostró un perfil inmunológico negativo excepto por un FAN en títulos
bajos y eritrosedimentación de 30 mm/h. Los estudios de función hepática, renal y hematológica
se encontraban dentro de parámetros normales.
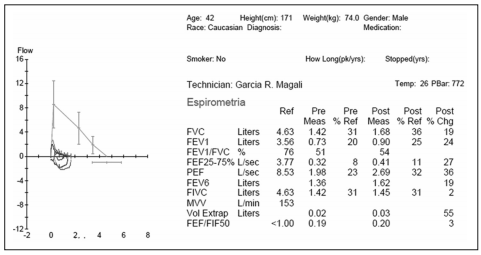
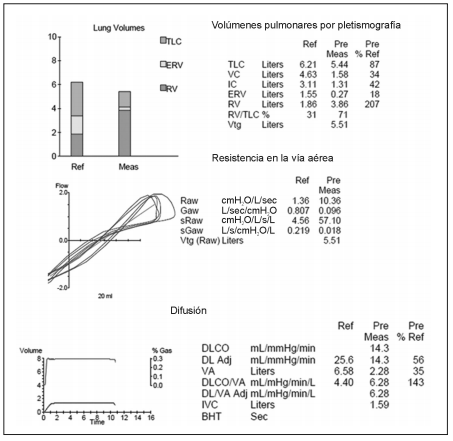
En un estudio funcional respiratorio se observa un
patrón obstructivo muy severo (FEV1 900 ml, 25%
del predicho) con respuesta no significativa al broncodilatador, TLC normal con RV aumentada (207%),
y DLCO disminuida en grado moderado (56%) que
corrige al VA (KCO de 84%). En la prueba de caminata
de 6 minutos recorre 330 metros con disminución de
la saturación basal de 94% a 86%. (Figs 2 y 3).
En la radiografía de tórax frente se encontraron
signos de hiperinsuflación con aplanamiento diafragmático bilateral. La silueta cardíaca se encontraba dentro de los límites normales.
Se realizó una tomografía computarizada con
cortes de alta resolución (Fig. 4).
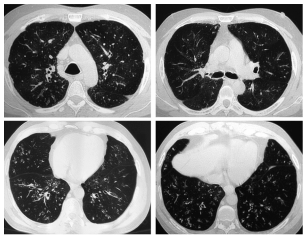
Dr. Spina: Se observó un patrón bronquiolar
difuso con bronquiolectasias, bronquiectasias y
tapones mucosos a predominio de los lóbulos infe riores. Adicionalmente se encontró engrosamiento
de las paredes bronquiales acompañadas de áreas
de disminución de la atenuación con patrón en
mosaico, indicadores de atrapamiento aéreo. No
se evidenció compromiso pleural ni lesiones ocupantes del espacio aéreo.
Se realizó la evaluación diagnóstica.
Discusión
Dr. Delgado: Con los hallazgos radiológicos y las
alteraciones de la fisiología pulmonar descriptas
anteriormente, y asociando al antecedente de AR,
se propuso como diagnóstico presuntivo la bronquiolitis obliterante (BO).
Dra. Aguirre: En la literatura hay varios reportes de prevalencia de obstrucción bronquial
en artritis reumatoidea de hasta el 60%1. Por otro
lado, la BO es una condición rara, usualmente fatal
caracterizada por estrechamiento concéntrico progresivo de los bronquiolos reportada en pacientes
con AR tratados con penicilamina, sulfasalazina, y
sales de oro. La severidad del patrón obstructivo,
la rápida progresión del cuadro, el estridor inspiratorio del examen físico, y el antecedente del tratamiento hacen posible el diagnóstico en este caso.
Dr. Spina: En una serie de casos que incluía 25
pacientes con BO-AR reportada por Devouassoux,
los hallazgos radiológicos más comunes de la BO
fueron engrosamiento de la pared bronquial,
enfisema centrolobulillar, patrón en mosaico, y
bronquiectasias, presentes en 96%, 56%, 42%, y
40% respectivamente2. Otros hallazgos comunes incluyen áreas parchadas en vidrio esmerilado,
opacidades reticulares de predominio basal, en menor medida asociación con otros síndromes clínicos como derrame pleural, nódulos reumatoideos, y
fibrosis pulmonar.
Dra. Quadrelli: En primer lugar creo que es necesario clarificar la nomenclatura. Hay que tener
en cuenta que muchos patrones histopatológicos de
enfermedades bronquiolares son bastante específicos pero otros pueden corresponder a muy variadas
etiologías y patogénesis. Si bien no hay una única
clasificación, en general se acepta que existen
tres grandes grupos: (1) aquellas enfermedades
en que el trastorno bronquiolar es la anormalidad predominante (enfermedades bronquiolares
primarias) (2) aquellas en que el trastorno es
predominantemente parenquimatoso con participación bronquiolar secundaria (3) y aquellas con
participación bronquiolar de la vía aérea grande.
La enfermedad primaria incluye la bronquiolitis
constrictiva (bronquiolitis obliterativa u obliterante), la bronquiolitis aguda, la pan bronquiolitis
difusa, la bronquiolitis respiratoria, la enfermedad
de la vía aérea por polvo mineral, la bronquiolitis folicular y algunas otras muy raras. El compromiso secundario se puede ver en una serie de
enfermedades intersticiales como la neumonitis
por hipersensibilidad, la neumonía criptogénica
en organización, la bronquiolitis respiratoria asociada a enfermedad intersticial y la histiocitosis.
Creo que en este caso estamos hablando de BO en
tanto una enfermedad bronquiolar primaria. La
artritis reumatoide es una causa posible al igual
que lo son las infecciones, la injuria por inhalación,
las drogas, y por supuesto el trasplante. En la AR
probablemente haya grados mínimos de BO de
manera mucho más frecuente que lo que es obvio
clínicamente, y está poco claro si están directamente relacionadas con la enfermedad o con el uso de
ciertas drogas como la penicilamina.
Dr. Bosio: De todas maneras la bronquiolitis
no asociada a COP no es una forma frecuente de
compromiso pulmonar de la AR. El trabajo de
Akira que se mencionó en alguno de los ateneos
pasados mostró tres patrones predominantes en la
AR: reticulación con o sin panalización (el más frecuente), consolidación e imágenes lineales con o sin
dilatación bronquial. Pero estas imágenes centro
lobulares lineares histopatológicamente correspondían a BOOP o sea a lo que hoy llamamos COP y no
a bronquiolitis pura sin compromiso interstricial3.
Estas son las imágenes que más frecuentemente
originan las bronquiectasias en la AR.
Dra. Quadrelli: Coincido en que es importante
hacer la diferencia. En el trabajo creo que más numeroso, de Pérez y Remy-Jardin4, el 23% de los pacientes tenían bronquiectasias o bronquiolectasias.
Sin embargo, como no tenían anatomía patológica
no queda claro a qué tipo de enfermedad bronquiolar pertenecían. También en la serie de Colby5 del
2005 que tenía anatomía patológica, la enfermedad
bronquiolar estaba asociada a COP en un par de
casos pero había una bronquiolitis folicular y una“inespecífica”. De hecho sus pacientes tenían un
patrón restrictivo, lo cual hace pensar que también
tenían neumonía en organización (OP).
Dr. Bosio: Esta confusión fue la razón para que
la BTS primero y el consenso después decidieran
reemplazar el término BOOP por el de COP, enfatizando que el trastorno principal en el COP es
el compromiso acinar y que la bronquiolitis puede
estar ausente. Efectivamente en este paciente es
clave para hacer el diagnóstico, la presencia de un
trastorno más obstructivo que restrictivo.
Dra. Quadrelli: Exacto, el BOOP (ahora COP) no debe confundirse con la bronquiolitis obliterativa que tiene este paciente. El BOOP o COP es una
enfermedad parenquimatosa y no de la vía aérea,
sin sibilancias y con rales, y con patrón restrictivo
o normal, mientras que la bronquiolitis obliterativa se caracteriza por la obstrucción De hecho
el criterio de inclusión en el trabajo de BO en la
AR del grupo de enfermedades huérfanas francés
tenía como criterio de inclusión el diagnóstico de
AR y la presencia de obstrucción bronquial y/o
atrapamiento aéreo severo.2
Dra. Aguirre: Además, en las imágenes el COP
tiene infiltrados alveolares en forma de condensación y la BO tiene signos de atrapamiento aéreo
sin infiltrados, como por otra parte se ve en los
trasplantes.
Dra. Quadrelli: Efectivamente, las principales
alteraciones de la fisiología respiratoria en BO
son obstrucción del flujo aéreo e hipoxemia. Un
estudio que compara las características de pruebas
funcionales pulmonares entre varios patrones tomográficos en AR (UIP, NSIP, BO y OP) encuentra
que los índices que muestran obstrucción (VEF1/CVF y FEF 25%) están significativamente mas
disminuidos en BO en relación con los otros patrones tomográficos. Asimismo, la CVF y DLCO
están menos alteradas en BO en comparación
con todos los otros patrones tomográficos.4 El
atrapamiento aéreo (VR/CPT mayor a 140%) es
una característica que se destaca frecuentemente
en esta patología.
Dr. Delgado: En este caso, considerando la limitación funcional pulmonar, ¿es necesario confirmar
el diagnóstico con biopsia pulmonar?
Dra. Quadrelli: En la serie de Devouassoux los
dos únicos requisitos para definir BO-AR fueron
cumplir con los criterios diagnósticos para artritis
reumatoidea de la Sociedad Americana de Reumatología, y tener un patrón obstructivo severo
caracterizado por una relación VEF1/CVF menor
al 50% o una relación VR/CPT mayor al 140%. Sin
embargo, para considerar enfermedad pulmonar
obstructiva relacionada a AR debe tenerse en cuenta
la presencia del tabaquismo como factor confundente.6 La decisión de biopsia pulmonar en este tipo de
patologías debe tomarse caso por caso en función de
las características individuales del paciente.
Dr. Bosio: ¿El diagnóstico de AR es inequívoco? ¿Ahora está en actividad? ¿Es de esperar que la BO
aparezca tan tardíamente? ¿Se puede explicar la
obstrucción bronquial por otra causa?
Dra. Quadrelli: Como decíamos, la información
específica sobre BO en AR es escasa. Hasta donde
yo conozco la única serie que diferencia bien este
tipo de trastorno bronquiolar y que incluye sólo pacientes no fumadores con obstrucción severa (y por
tanto presumiblemente) es la de Devouassoux que
incluyó sólo 25 pacientes. En esa serie el tiempo
previo de la AR era de 7 u 8 años pero con algunos
pacientes que tenían más de 30 años de AR. En un
caso, la BO precedió a la AR. En cuanto a otras
causas, el paciente no tenía criterios de bronquitis
crónica, no es fumador, no tiene enfisema en la
TAC, no tiene antecedentes de asma. Además está desarrollando una enfermedad progresiva. Creo
que todo parece indicar que la AR es la causa y que
se puede aceptar que esto es una BO.
Dra. Aguirre: Y no todos los pacientes de esa
serie estaban sintomáticos de su AR. Así que eso no
parecería un requisito para aceptar el diagnóstico.
Dr. Delgado: Al paciente se le suspendió el tratamiento con sulfasalazina y se inició con corticoides
orales (prednisona a 1 mg/Kg por día). Debido a
que el pronóstico y la respuesta es pobre, ¿podría
considerarse adicionar terapia inmunosupresora
concomitante?
Dra. Quadrelli: No está claro cuál es el papel de
la terapia inmunosupresora en esta enfermedad.
El grueso de pacientes con BO en la literatura es
el secundario a transplante de pulmón. Esos casos
se tratan generalmente con corticoides, más tacrolimus y azatioprina o micofenolato. Actualmente
se está evaluando la utilidad de la azitromicina
aprovechando su efecto anti-inflamatorio. Pero
claro, no sabemos si la patogénesis de este grupo
de BO es la misma que en la AR. Los corticoides e
inhibidores de la síntesis de las purinas (sea ciclosporina o tacrolimus) también se usan en la BO del
transplante de MO y de células madre. En la serie
del grupo de enfermedades huérfanas, casi todos
los pacientes recibieron corticoides generalmente
asociados con inmunosupresores (metotrexto,
leflunomide, ciclofosfamida, hidroxicloroquina o
anti-TNF)
Dr. Delgado: Al no ser un estudio prospectivo, es
difícil extraer conclusiones de la utilidad de cada
tratamiento. Podría decirse que existen reportes de
casos favorables con metotrexato, ciclofosfamida,
macrólidos, e incluso etarnecept. Sin embargo, el
nivel de evidencia es limitado en la actualidad.
Dr. Barreira: El paciente tiene las características
clínicas de una enfermedad articular establecida activa con factores de mal pronóstico7. El no
haber recibido metotrexate en dosis plenas, como
sería la indicación habitual, o bien la combinación
de dos drogas inductoras de remisión para controlar la actividad de la misma ocasionan como
resultado el deterioro estructural que condiciona
su capacidad funcional. Por la persistencia de la
sinovitis como consecuencia de una enfermedad
inflamatoria articular no controlada se establecen
deformidades articulares, daño estructural articular como presenta el paciente y manifestaciones
extra-articulares como por ejemplo el compromiso
intersticial (ILD). ILD es la más frecuente manifestación del compromiso pulmonar en la AR
observada hasta en un 80% de las biopsias, 50%
de las tomografías y solo en el 5% de las radiografías de tórax8,9. Generalmente son pacientes con
antecedentes de tabaquismo, nodulares, seropositivos para factores reumatoideos, anticuerpos
anti citrulina o antinucleares quienes tienen un
mayor riesgo de desarrollar ILD10. En realidad,
no existen reportes sólidos que justifiquen el uso
de drogas anti-TNF para el manejo de manifestaciones extrapulmonares en AR. Podríamos discutir
la necesidad o no de metotrexato, pero sería muy
prudente en esta condición que le otorgaría mayor
toxicidad pulmonar. La ciclofosfamida es la mejor
opción como tratamiento adyuvante a los corticoides para este caso.
Dr. Bosio: En el grupo de pacientes que estamos
citando desde hoy, casi la mitad empeoraron y
muchos de ellos terminaron en falla respiratoria
aguda pese a los distintos tratamientos.
Dra. Quadrelli: Exactamente. Debido al mal
pronóstico de la enfermedad, deben considerarse
los aspectos no farmacológicos del tratamiento
como la inclusión de un especialista en Cuidados
Integrales al equipo multidiciplinario, así como la
evaluación temprana para transplante pulmonar.
Dr. Delgado: En conclusión podemos decir que
la BO es un hallazgo histológico poco común caracterizado por alteraciones en la pared de los bronquiolos respiratorios. La severidad depende de la
causas subyacentes que incluyen: enfermedad del
tejido conectivo como artritis reumatoidea, toxinas
inhaladas (dióxido de nitrógeno, sulforos, amonio),
y receptores de transplante de médula, corazón y
pulmón. La BO relacionada a AR probablemente
está asociada con el uso de medicamentos como
penicilamina, sulfasalazina y oro. Cualquier agente
potencialmente culpable debe ser discontinuado.11
1. Tanaka N, Sook Kin J, Newell J, et al. Rheumatoid Arthritis related lung diseases: CT Findings. Radiology 2004; 232:81
2. Devouassoux G, Cottin V, Lioté H, et al. Characterization of severe obliterative bronchiolitis in rheumatoid arthritis. Eur Respir J 2009; 33: 1053.
3. Akira M, Sakatani M, Hara H. Thin-section CT findings in rheumatoid arthritis–associated lung disease: CT patterns and their courses. J Comput Assist Tomogr 1999; 23: 941-948.
4. Pérez T, Remy-Jardin M, Cortet B. Airways involvement in rheumatoid arthritis: clinical, functional, and HRCT findings. Am J Respir Crit Care Med 1998; 157(5 Pt 1):1658-65.
5. Lee HK, Kim DS, Yoo B, Seo JB, Rho JY, Colby TV, Kitaichi M. Histopathologic pattern and clinical features of rheumatoid arthritis-associated interstitial lung disease. Chest 2005; 127(6): 2019-27.
6. Fuld JP, Johnson MK, Cotton MM, et al. A longitudinal study of lung function in nonsmoking patients with rheumatoid arthritis. Chest 2003; 124:1224.
7. Quinn MA, Green MJ, Marzo-Ortega H, et al. Prognostic Factors in a Large Cohort of Patients With Early Undifferentiated Inflammatory Arthritis After Application of a Structured Management Protocol. Arthritis & Rheum 2003; 48 (11); 3039-3045.
8. Bilgici A, Ulusoy H, Kuru O, Çelenk C, Ünsal M, Danaci M. Pulmonary involvement in rheumatoid arthritis. Rheumatology International 2005;25(6):429-435.
9. Gochuico BR, Avila NA, Chow CK, et al. Progressive preclinical interstitial lung disease in rheumatoid arthritis. Archives of Internal Medicine 2008;168(2): 159-166.
10. Lamblin C, Bergoin C, Saelens T, Wallaert B. Interstitial lung diseases in collagen vascular diseases. European Respiratory Journal, Supplement. 2001;18(supplement 32): 69s-80s.
11. Cannon GW. Antirheumatic drug reactions in the lung. Baillieres Clin Rheumatol 1993; 7:147.