Autor : Jorge Pedro Castagnino, Rosa MarĂa Musella, Domingo Palmero
DivisiĂłn NeumotisiologĂa, Hospital Francisco Javier Muñiz. Ciudad de Buenos Aires, Argentina.
Correspondencia : Dr. Jorge P. Castagnino Domicilio Postal: Núñez 2241 - 7° A CP 1429 - C.A.B.A. Correo electrónico: jcastag@intramed.net
Resumen
Presentamos cuatro pacientes con tuberculosis pulmonar y reacciones adversas graves a los fármacos antituberculosis. Estos pacientes tuvieron farmacodermia, hepatitis, eosinofilia, fiebre y uno de ellos insuficiencia renal, constituyendo el SĂndrome DRESS. Este sĂndrome es una reacciĂłn grave de hipersensibilidad a diferentes fármacos. Suele ser producido por los anticonvulsivantes, las sulfonamidas, algunos fármacos antivirales, entre otros. Los fármacos anti tuberculosis tambiĂ©n pueden producir este sĂndrome potencialmente fatal. Se destaca la importancia de la farmacovigilancia para su detecciĂłn y tratamiento precoz.
Palabras clave: Reacciones adversas a fármacos; DRESS; Eosinofilia; Tuberculosis.
Abstract
DRESS syndrome induced by anti-tuberculosis drugs
We present four patients with pulmonary tuberculosis and severe adverse reactions to antituberculosis drugs. These patients had skin rash, hepatitis, eosinophilia, fever, and one of them had renal failure; all these signs conform the diagnosis of DRESS syndrome. This syndrome is caused by a severe hypersensitivity reaction to different drugs. It is usually caused by anticonvulsants, sulfonamides, some antiviral drugs, among others drugs. Anti-tuberculosis drugs can also cause this potentially fatal syndrome. The importance of surveillance for early detection and treatment of adverse drug reactions is emphasized.
Key words: Adverse drug reactions; DRESS; Eosinophilia; Tuberculosis.
IntroducciĂłn
El sĂndrome DRESS, asĂ llamado por las iniciales en inglĂ©s (Drug Rash with Eosinophilia and Systemic Symptoms) fue descrito por primera vez por Bocquet et al en 19961. Es una farmacodermia grave, potencialmente fatal, de etiologĂa desconocida, caracterizada por fiebre, exantema, adenopatĂas, alteraciones hematolĂłgicas y afectaciĂłn visceral2, 3. El Ăłrgano más frecuentemente afectado es el hĂgado, seguido por riñones y pulmones. Suele ser producido por anticonvulsivantes, sulfonamidas y algunos antivirales, entre otros. La fisiopatologĂa no se conoce, pero podrĂan intervenir diferentes mecanismos: predisposiciĂłn genĂ©tica, defectos en la eliminaciĂłn de los fármacos implicados, alteraciones inmunolĂłgicas e infecciones, tales como el herpes virus tipo 6 (HHV6). La mortalidad es del 8 al 10% y ocurre en pacientes con severo compromiso multiorgánico4.
Presentamos cuatro pacientes con sĂndrome DRESS inducido por fármacos anti tuberculosis.
Caso 1: 27 años, argentina. Diagnóstico de tuberculosis (TB) pulmonar muy avanzada. (Figura 1) Comenzó tratamiento con isoniacida (H), rifampicina (R), etambutol (E) y pirazinamida (Z).

No tenĂa antecedentes de enfermedades. Negaba drogadicciĂłn y alcoholismo.
Treinta dĂas despuĂ©s de iniciado el tratamiento presentĂł fiebre, rash eritematoso y pruriginoso, náuseas, vĂłmitos, epigastralgia y aumento de transaminasas (TGO: 135 U/l, TGP: 61 U/l). Se suspendiĂł el tratamiento.
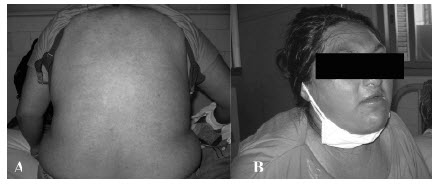
En los dĂas siguientes, aumentĂł el exantema comprometiendo todo el cuerpo y tambiĂ©n mucosas oral y genital. Fue evaluada por dermatologĂa,donde diagnosticaron eritema polimorfo (Figuras 1B y D). Le indicaron meprednisona 0,5 mg/k/d y antihistamĂnicos. TambiĂ©n presentĂł hepatomegalia dolorosa y edemas en miembros inferiores y sacro (Figura 1C).
Una ecografĂa mostrĂł hepatomegalia con aumento de la ecogenicidad compatible con esteatosis, fibrosis o granulomatosis y ascitis moderada con vena porta permeable y con flujo. Se intentĂł obtener el lĂquido ascĂtico pero no se pudo. Hepatograma: bilirrubina total: 4,5 mg/dl, bilirrubina directa: 4 mg/dl, TGO: 465 U/l, TGP: 543 U/l, fosfatasa alcalina: 370 UI/l, tiempo de protrombina: 30%, APTT: 54 segundos, Factor V: 42%, Factor II: 24%, Factor VII-X: 21%, albĂşmina: 1,8 g/dl, Na: 136, K: 5 mmol/l, proteinuria de 24 h: 0.48 g, creatinina 8 mg/dl, urea: 110 mg/dl, glĂłbulos blancos: 48.000/mm3, eosinĂłfilos 6% (2.880/mm3), eritroblastos, mielocitos, neutrĂłfilos en banda y formas inmaduras. EvaluaciĂłn de hematologĂa: sin blastos, reacciĂłn leucemoide probablemente secundaria a insuficiencia hepática. No tenĂa signos de insuficiencia cardiaca.
SerologĂa para VIH, para hepatitis A, B, C y autoanticuerpos: no reactivas.
Se le indicó corticoides, ranitidina, lactulosa, albúmina y furosemida, pero la paciente falleció por insuficiencia hepática, renal y, finalmente, sepsis.
Caso 2: 31 años, boliviana. Diagnóstico: derrame pleural TB.
Antecedentes: pancreatitis, colecistectomĂa por litiasis vesicular, obesidad. Estuvo en tratamiento psiquiátrico por ataques de pánico y depresiĂłn, actualmente no recibĂa psicofármacos.
ComenzĂł tratamiento con HREZ. Veinte dĂas despuĂ©s, presentĂł vĂłmitos, fiebre (39°C), anorexia, eritrodermia, prurito generalizado, edema en cara y lesiones mucosas en boca. Los exámenes complementarios anormales fueron TGO: 183 U/l, TGP: 187 U/l, bilirrubina total: 1,5 mg/dl, tiempo de protrombina: 78%, glĂłbulos blancos: 12.800/mm3, eosinĂłfilos: 13% (1.664/mm3), plaquetas: 191.000/ mm3. Se suspendiĂł el tratamiento y se indicaron corticoides y antihistamĂnicos.
La Figura 2 muestra las lesiones cutáneo mucosas.
A las 48 h. de suspendido el tratamiento: bilirrubina total: 1.8 mg/dl, bilirrubina directa: 1.2 mg/ dl, TGO: 501 U/l, TGP: 668 U/l, fosfatasa alcalina: 666 UI/l, tiempo de protrombina: 58%, Factor V: 119%, Factor II: 63%. SerologĂa para VIH, marcadores para hepatitis A, B y C y auto anticuerpos no reactivos.
EcografĂa abdominal: hĂgado tamaño conservado, con leve aumento de la ecogenicidad. Páncreas de tamaño conservado, hiperecogĂ©nico, resto del abdomen de caracterĂsticas normales. Luego de normalizarse la funciĂłn hepática y desaparecer las lesiones cutáneas (40 dĂas despuĂ©s de suspendido el tratamiento), se comenzĂł con dosis bajas y progresivas de H y R. Cuando recibiĂł 150 mg de R presentĂł disnea, fiebre, hipoxemia, leucocitosis de 13.600/mm3 con eosinofilia 38% y aumento de TGO: 405 U/l y TGP: 815 U/l. MejorĂł con la suspensiĂłn del tratamiento, oxigenoterapia, altas dosis de corticoides y antihistamĂnicos.
Finalmente, se esperĂł nuevamente la normalizaciĂłn de las transaminasas y se comenzĂł con etambutol, estreptomicina y levofloxacina, sin efectos adversos.
Caso 3: 32 años, boliviana. TB pulmonar. Treinta dĂas despuĂ©s de comenzado el tratamiento con HREZ presentĂł epigastralgia, náuseas, fiebre, eritrodermia y prurito generalizado.
Cuatro hermanos tuvieron TB, 3 de ellos presentaron reacciones adversas a los fármacos similares a la paciente.
Al examen fĂsico presentaba: mal estado general, fiebre (39°C), eritrodermia y prurito, edema en miembros inferiores y cara, hepatomegalia dolorosa.
Al ingreso presentaba aumento de las transaminasas (TGO: 716 U/l, TGP: 470 U/l), tiempo de protrombina: 75%, serologĂa para VIH y para hepatitis A, B y C: no reactivas. Se suspendieron los fármacos anti TB y se administrĂł hidrataciĂłn parenteral, dexametasona 16 mg/d IV, hidroxicina 30 mg/d, ranitidina 300 mg/d IV.
Luego de 48 h presentĂł aumento del prurito y del edema en cara y fiebre (39°C). Los estudios complementarios demostraron aumento de las enzimas hepáticas: TGO: 646 UI/l, TGP: 902 UI/l, disminuciĂłn del tiempo de protrombina: 50% y leucocitosis 29.600/mm3. La gasometrĂa arterial revelĂł hipoxemia (paO2: 65 mmHg).
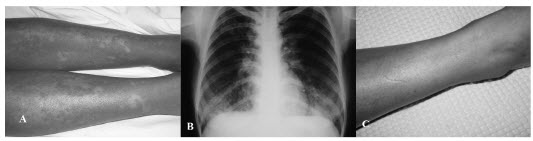
En la Figura 3 pueden observarse las lesiones cutáneas y la apariciĂłn de opacidades nuevas alveolares bibasales en la radiografĂa de tĂłrax (A y B).
La paciente pasa a Unidad de Terapia Intensiva (UTI) y evoluciona estable con descenso progresivo de transaminasas.
En la ecografĂa abdominal pudo observarse hepatomegalia homogĂ©nea, vesĂcula pequeña con paredes engrosadas de aspecto edematoso y escasa luz. MĂnima ascitis. En un nuevo hemograma los glĂłbulos blancos fueron de 28.900/mmÂł, con eosinofilia de 14.6%.
Pasa nuevamente a sala general con descenso de las enzimas hepáticas: TGO: 77 UI/l, TGP: 183 UI/l. ContinuĂł con mejorĂa progresiva de las lesiones cutáneas hasta la desapariciĂłn de las mismas y normalizaciĂłn total del hepatograma (Figura 3 C). En ese momento, comienza tratamiento antiTB con dosis bajas y progresivas de R. Cuando se alcanzĂł la dosis plena, presentĂł edema bipalpebral y en labios y se suspendiĂł definitivamente. Al mejorar el edema, comenzĂł con H, luego E y por Ăşltimo estreptomicina en dosis progresivas con buena tolerancia.
El comienzo de tratamiento efectivo antituberculosis se produjo 50 dĂas despuĂ©s del ingreso hospitalario.
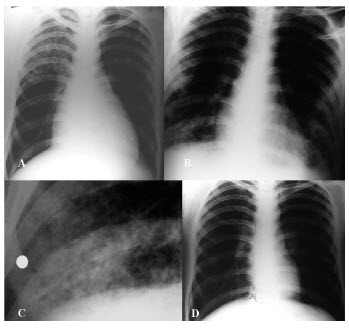
Caso 4: 23 años, boliviano. TB pulmonar, VIH negativo. Comienza tratamiento con HREZ. DespuĂ©s de 40 dĂas presenta exantema generalizado, enantema, fiebre, eosinofilia, hepatitis e hipoxemia. Se interna en UTI con aumento de las transaminasas: TGP: 688 U/l, TGO: 152 U/l, tiempo de protrombina: 60%, Factor V: 80%, eosinĂłfilos: 3.042(18%), pH: 7.47, PaO2: 49.9 mmHg, (FIO2: 0.21), PaCO2: 29.1 mmHg. En la Rx de tĂłrax se observaron opacidades bibasales que no estaban en Rx de ingreso (Figura 4 B y C).
Se suspendieron los fármacos anti-TB y se administraron corticoides, antihistamĂnicos, vitamina K y oxigenoterapia.
Cuando mejoraron las lesiones cutáneas y se normalizĂł la funciĂłn hepática, se introdujeron en forma secuencial y en dosis progresivas R, E, S, H. Veinticuatro horas despuĂ©s de recibir H, presentĂł fiebre (39°C), y rash leve. Se suspendiĂł definitivamente H y continuĂł con R, E, S con buena evoluciĂłn y sin nuevos efectos adversos. En la Rx tĂłrax del alta se observĂł mejorĂa de las lesiones (Figura 4 D).
DiscusiĂłn
Los pacientes que describimos presentaron: fiebre, exantema, enantema, hepatitis, y esosinofilia mayor de 1.500/mm3. Uno presentĂł, además, insuficiencia renal (caso 1) y dos pacientes opacidades nuevas en la Rx de tĂłrax que podrĂan corresponder a eosinofilia pulmonar o neumonitis por hipersensibilidad (Casos 3 y 4). La evoluciĂłn fue favorable en 3, aunque se debiĂł modificar el tratamiento inicial y una paciente tuvo insuficiencia hepática, renal y sepsis que le ocasionaron la muerte (Caso 1). El compromiso multiorgánico, el intervalo prolongado (3 a 4 semanas) desde la iniciaciĂłn del tratamiento y la apariciĂłn de los sĂntomas, son compatibles con el diagnĂłstico de sĂndrome DRESS. Los criterios clĂnicos para hacer el diagnĂłstico son1:
1. Erupción cutánea.
2. Alteraciones hematolĂłgicas: eosinofilia >1.500/
mmÂł y/o presencia de linfocitos atĂpicos.
3. Compromiso sistĂ©mico: adenopatĂas (>2 cm. de diámetro) y/o hepatitis (elevaciĂłn de transaminasas al menos 2 veces de los valores normales) y/o nefritis intersticial, y/o neumonitis intersticial, y/o carditis.
4. Fiebre.
Todos los fármacos antituberculosis pueden producir reacciones adversas (RAFA). La mayorĂa son leves y autolimitadas, pero a veces pueden ser graves e incluso mortales.
Las RAFA más frecuentes y potencialmente graves son la hepatotoxicidad y las reacciones cutáneas. La frecuencia de hepatotoxicidad varĂa del 5 al 33%5. Esta amplia variaciĂłn se debe a diferentes poblaciones estudiadas, mĂşltiples esquemas de tratamiento realizados, variaciones en la definiciĂłn de hepatotoxicidad y en el monitoreo de las mismas. En nuestra experiencia, la incidencia de hepatotoxicidad durante el tratamiento de la TB es del 8%6.
Las reacciones cutáneas graves que requieren la suspensión del tratamiento se observan entre el 0,6 y 8%. Nosotros la observamos en el 2% de los pacientes y etambutol fue la causa más frecuente7. A diferencia de la hepatotoxicidad cualquier fármaco puede producir reacciones adversas cutáneas.
Los fármacos probablemente responsables de este sĂndrome de hipersensiblidad generalizada fueron rifampicina e isoniacida. En un paciente (caso 1), no pudimos establecer el o los fármacos implicados.
La rifampicina es habitualmente bien tolerada, aunque puede producir manifestaciones de hipersensibilidad, especialmente cuando se administra en forma intermitente, dos veces por semana y a dosis alta. Más raramente ocurren con administraciĂłn diaria. Algunos enfermos presentan fiebre, escalofrĂos, cefalea, dolores osteoarticulares y malestar general (sĂndrome pseudo gripal o flu- like). Son reacciones frecuentemente leves y autolimitadas. Sin embargo, otras son más graves y potencialmente fatales, por ejemplo: pĂşrpura trombocitopĂ©nica, anemia hemolĂtica, glomerulonefritis, insuficiencia renal, hipotensiĂłn, disnea y shock anafiláctico. Los mecanismos patogĂ©nicos no se conocen con exactitud, aunque podrĂan ser causados por anticuerpos anti-rifampicina, los cuales fijan complemento. Sin embargo, su presencia no siempre implica el desarrollo de sĂntomas y por el contrario, puede haber sĂntomas en ausencia de estos anticuerpos.
La isoniacida tambiĂ©n puede producir reacciones de hipersensibilidad generalizada como rash, fiebre, sĂndrome de Steven-Johnson, anemia hemolĂtica, vasculitis y neutropenia. Pero son muy raros.
Manifestaciones clĂnicas
Las manifestaciones clĂnicas del sĂndrome DRESS suelen aparecer a las 2-8 semanas de la exposiciĂłn al fármaco responsable, lo que supone un perĂodo de latencia más largo que el observado en otras toxicodermias agudas8. En nuestros pacientes, el perĂodo de latencia fue de 20 a 40 dĂas. En pacientes sensibilizados o que ya han padecido un sĂndrome DRESS, la instauraciĂłn del cuadro es mucho más precoz.
En más del 90% de los casos se presentan manifestaciones cutáneas. Pueden ir desde un exantema máculo papular confluente y pruriginoso, cĂ©falocaudal, descamativo, hasta la confluencia de las lesiones y eritrodermia. Estas lesiones pueden evolucionar a la dermatitis exfoliativa. El edema facial periorbitario es frecuente y, junto con la fiebre, son signos iniciales del sĂndrome DRESS4. El compromiso mucoso es poco frecuente, y se manifiesta con queilitis, conjuntivitis, erosiones orales y genitales.
Entre las manifestaciones no dermatolĂłgicas del sĂndrome DRESS se destacan, además de la fiebre y las adenopatĂas, las alteraciones hematolĂłgicas y el daño visceral.
• Las adenopatĂas, localizadas o generalizadas, son una manifestaciĂłn clĂnica muy frecuente (hasta en el 75% de los pacientes). El examen patolĂłgico de las mismas suele mostrar una hiperplasia linfoide benigna con cambios reactivos4.
• HematolĂłgicamente, se presentan leucocitosis con linfocitos atĂpicos (30%), eosinofilia (más de 1.500/mmÂł) en el 70% de los pacientes, y en algunos, anemia hemolĂtica con Coombs negativo e hiperglobulinemia policlonal8.
• Hepatitis (50%). Se han descrito también nefritis túbulo-intersticial, distrés respiratorio, miocarditis, tiroiditis, pancreatitis, miositis, meningitis, parotiditis, hepato-esplenomegalia y shock12.
Patogenia
La patogenia del sĂndrome DRESS no se conoce con exactitud, aunque se cree que intervienen factores hereditarios, metabĂłlicos, inmunolĂłgicos e inflamatorios9. PodrĂa deberse a un exceso de metabolitos tĂłxicos originado por alteraciones genĂ©ticas o ambientales. Estos metabolitos tĂłxicos desencadenan una respuesta inmune celular. Al actuar como haptenos o al ocasionar un daño oxidativo a las cĂ©lulas, producen señales que activan la producciĂłn de citoquinas. El sĂndrome DRESS secundario a sulfonamidas ocurre en pacientes que son acetiladores lentos, generando aumento de metabolitos tĂłxicos. Algo similar podrĂa ocurrir con la isoniacida.
La predisposiciĂłn hereditaria parece ser un factor muy importante. Una de las pacientes tenĂa antecedentes familiares de reacciones adversas a fármacos anti TB.
La infecciĂłn y reinfecciĂłn por el herpes virus 6 (HHV 6) ha sido implicada en el desarrollo de este sĂndrome10. Si bien no se ha podido demostrar el mecanismo patogĂ©nico del virus, se cree que los fármacos podrĂan producir cierto grado de inmunosupresiĂłn, la cual genera reactivaciĂłn de virus latentes y una respuesta inmune masiva. Los sĂntomas probablemente son producidos por linfocitos T antivirales que reaccionan en forma cruzada con el fármaco11.
Fármacos que más frecuentemente producen sĂndrome DRESS12
Abacavir, dapsona, nevirapine, allopurinol, diltiazem, oxicam, atenolol, sales de oro, fenobarbital, azatioprina, isoniacida, fenitoĂna, captopril, lamotrigina, sulfasalazina, carbamazepina, sulfonamidas, clomipramina, minociclina, trimetoprima.
DiagnĂłstico diferencial
El diagnĂłstico diferencial del sĂndrome DRESS incluye numerosas enfermedades:
SĂndrome de Steven Johnson y necrĂłlisis epidĂ©rmica tĂłxica: ambas ocurren 1 a 3 semanas despuĂ©s de la administraciĂłn del fármaco. Hay fiebre y compromiso multiorgánico pero sin eosinofilia ni linfocitosis atĂpica.
Enfermedad de Kawasaki: se presenta con fiebre, linfoadenopatĂas y rash, pero no es inducida por fármacos ni tiene eosinofilia.
Enfermedad de Still: es una enfermedad autoinmune, caracterizada por fiebre, erupción máculo-papulosa, adenomegalias. No tiene relación con fármacos.
Infecciones virales: EBV, HIV, CMV, hepatitis.
Sepsis, linfomas, leucemias, colagenosis, vasculitis, sĂndrome hipereosinĂłfilico.
Tratamiento
La primera medida es suspender el fármaco sospechoso de haber provocado el sĂndrome. Pero hay que recordar que algunos pacientes tienen empeoramiento paradojal de los sĂntomas despuĂ©s de la suspensiĂłn del fármaco, como ocurriĂł en los cuatro pacientes descritos.
Los glucocorticoides sistĂ©micos constituyen el tratamiento más aceptado, atribuyĂ©ndose su efecto beneficioso a la inhibiciĂłn de la interleukina 5 en el proceso de acumulaciĂłn de eosinĂłfilos, como se ha demostrado en el sĂndrome hipereosinĂłfilico. Sin embargo, existen controversias sobre su utilidad13. Ayudan a la resoluciĂłn de los sĂntomas, pero el rash y la hepatitis pueden persistir por varias semanas. Cuando se retiran pueden producir recaĂdas. Están indicados cuando hay severo compromiso sistĂ©mico.
La inmunoglobulina endovenosa (1mg/k/d) por 2 dĂas fue beneficiosa en un niño de 6 años con sĂndrome DRESS por fenitoĂna14.
La N-acetilcisteĂna es eficaz en farmacodermias secundarias a anticonvulsivantes y ha sido empleada en el tratamiento de sĂndrome DRESS8. Es un precursor del glutation, molĂ©cula implicada en la vĂa de detoxificaciĂłn de mĂşltiples fármacos y además, tiene un efecto inmunomodulador al inhibir la producciĂłn de citoquinas inflamatorias y la expresiĂłn de ICAM-1 en los queratinocitos.
Los miembros de la familia del paciente deberĂan ser advertidos, porque el riesgo de DRESS es mayor en los familiares de primer grado.
Conclusiones
El sĂndrome DRESS es una reacciĂłn adversa grave a fármacos y potencialmente fatal. Los fármacos anti TB pueden producir el sĂndrome DRESS. Las manifestaciones clĂnicas suelen ser tardĂas. Hay que sospecharlo cuando despuĂ©s de 2 a 3 semanas de iniciado el tratamiento, el paciente presenta rash, fiebre, eosinofilia, hepatitis o afectaciĂłn de otros Ăłrganos. Es muy importante suspender precozmente el tratamiento. Es muy difĂcil identificar el fármaco responsable, porque todos pueden producirlo. Puede ocurrir empeoramiento paradojal luego de suspender los fármacos. La resoluciĂłn del rash y la hepatitis pueden requerir semanas y en algunos casos, meses. Si bien es poco frecuente, su apariciĂłn implica internaciones prolongadas, riesgo de resistencia bacteriana, necesidad de uso de fármacos de segunda lĂnea, mayor riesgo epidemiolĂłgico y costo sanitario. Es importante realizar farmacovigilancia para su detecciĂłn y tratamiento precoz.
1. Bouquet H, Bagot M, Roujeau JC. Drug induced pseudolymphoma and drug hypersensitivity syndrome (Drug Rash with Eosinophilia and Systemic Symptoms: DRESS). Semin Cutan Med Surg 1996; 1: 250-7.
2. Amante MF, Filippini AV, Cejas N, Lendoire J, Imventarza O, Parisi C. Dress syndrome and fulminant hepatic failure induced by lamotrigine. Ann Hepatol. 2009; 8: 75-7.
3. Severe acute hepatitis in the DRESS syndrome: Report of two cases. Ann Hepatol 2010; 9: 198-201.
4. Walsh SA, Creamer D. "Drug reaction with eosinophilia and systemic symptoms (DRESS): a clinical update and review of current thinking". Clinical and Experimental Dermatology 2011; 36: 6-11.
5. An Official ATS Statement: Hepatotoxicity of Antituberculosis Therapy. Am J Crit Care Med 2006; 174: 935-52.
6. Musella RM, Castagnino JP, Baldini M, Abbate EH. Frecuencia de Reacciones Adversas Severas durante el tratamiento de la Tuberculosis en pacientes hospitalizados en un Centro de Referencia de Buenos Aires. Revista Argentina de Medicina Respiratoria. Suplemento 2006: S62.
7. Castagnino JP, Saab MA, De Stéfano G, Musella RM, Brea A, Abbate E. Impacto de la Farmacodermia en el tratamiento de la tuberculosis. Revista Americana de Medicina Respiratoria. Suplemento 2008.
8. Tas S, Simonart T. Management of Drug Rash with Eosinophilia and Systemic Symptoms (DRESS Syndrome): An Update. Dermatology 2003; 206: 353-6.
9. Sullivan JR, Shear NH. The drug hypersensitivity syndrome: What is the pathogenesis? Arch Dermatol 2001; 137: 357-64.
10. Descamps V, Valance A, Edlinger C, et al. Association of human herpes virus 6 infection with drug reaction with eosinophilia and systemic symptoms. Arch Dermatol 2001; 137: 301-4.
11. Ichiche M, Kiesch N, De Bels D. DRESS syndrome associated with HHV-6 reactivation. Eur J Intern Med 2003; 14: 498- 500.
12. Wolkenstein P, Revuz J. Drug-induced severe skin reactions - incidence, management and prevention. Drug Safety 1995; 13: 56-68.
13. Ganeva M et al. "Carbamazepine-induced drug reaction with eosinophilia and systemic symptoms (DRESS) syndrome: report of four cases and brief review". International Journal of Dermatology 2008, 47: 853-60
14. Scheuerman O, Nofech-Moses Y, Rachmel A, Ashkenazi S. Successful treatment of antiepileptic drug hypersensitivity syndrome with intravenous immune globulin. Pediatrics 2001; 107: 14.