Autor :FSĂvori MartĂn1, Pascansky Daniel1
1 Centro Universitario de NeumonologĂa, Fac. Medicina, UBA, Unidad de NeumotisiologĂa, Hospital Gral. Agudos "Dr. J. M. Ramos Mejia", CABA, Argentina
Correspondencia :
Resumen
En los últimos años, la aparición de
anticuerpos monoclonales (Biológicos) para el tratamiento del asma grave
T 2 alto nos permitió palear las pocas herramientas terapéuticas
que teníamos para tratar a este grupo de pacientes, que, aunque
pequeño, difiere al manejo del resto de los asmáticos.
Al momento, existen diversos trabajos publicados que dieron
soporte a las normativas como a las guías de manejo de asma grave en el
mundo y fueron tomados por las diferentes sociedades científicas en la
elaboración de estas.
A pesar de ello, la lectura minuciosa de los mismos deja ver que
existen diferencias claras en cuanto a metodología, toma de variables e
interpretación de resultados.
Con esta premisa, este trabajo permite realizar un análisis
crítico de los estudios clínicos de desarrollo Fase III de
biológicos en asma grave, tomando en cuenta metodología y
diversas variables que conllevan a los resultados publicados.
Palabras claves: Asma grave eosinofílica; Th2
alto; Biológicos; Anticuerpos monoclonales; Adherencia
Abstract
In the last years, the appearance of new monoclonal antibodies
(biologics) for the treatment of T2-high severe asthma allowed us to use the
few therapeutic tools we had to treat this group of patients, which is small
but differs from the rest of the asthmatics in its management.
So far there are various publications supporting certain rules
such as the Guidelines for Severe Asthma Management on a worldwide level, which
were used by the different scientific societies for the development of those
guidelines.
But the thorough reading of cited publications reveals clear
differences regarding the methodology, use of variables and interpretation of
the results.
Based on these premises, this work allows us to conduct a critical
analysis of the phase III clinical studies of the development of biologics for
severe asthma, taking into account the methodology and different variables that
entail the published results.
Key words: Eosinophilic severe asthma; T2-high; Biologics;
Monoclonal antibodies; Adherence
Es patrimonio del
pensamiento científico
y filosófico la
duda sobre la veracidad
y la validez de las
afirmaciones con la
convicción que
la duración de las interpretaciones
consideradas verdaderas
es
limitada y que
también es aún más limitado
el ámbito de
validez de esas verdades.
La verdad que no acepte
esta condición
pertenece al reino de
las creencias y
no al de la ciencia…
Creo que el
escepticismo es hijo del
espíritu
crítico, algo que comienza con
una credulidad ingenua
pero madura que
significa que la
aceptación es provisoria,
que está
sometida a evidencias demostrativas
y que las evidencias
demostrativas
permiten predicciones
que obedecen a
principios
probabilísticos. No se trata aquí
del escepticismo que
cuestiona la posibilidad
de llegar a la verdad
sino el que
enfatiza la necesidad
de la cautela.
Agrest A. Reflexiones
sobre el espíritu crítico en Medicina (Arch Argent Pediatr 2008;
106: 193-5)
Introducción
El asma bronquial es una enfermedad heterogénea,
inflamatoria de la vía aérea caracterizada por episodios
recurrentes de broncoespasmo, hiperreactividad bronquial y aumento de las
secreciones bronquiales1.
Afecta aproximadamente a 300 millones de personas en todo el mundo; en
Latinoamérica existe una gran heterogeneidad en cuanto a la prevalencia
dependiendo de cada país, con una fluctuación del 5 al 24% como
ocurre en Costa Rica2.
En Argentina se estima que 9.36% de la población tiene asma
(aproximadamente 2.5 millones) según referencia de pacientes de
diagnósticos médicos3.
El asma grave constituye el 3 al 5% de la población con
asma; caracterizado por persistencia de síntomas, mayores consultas a la
emergencia o consultorios ambulatorios no programadas, mayores
hospitalizaciones, aumento en el uso de medicación de rescate,
corticoides sistémicos, antibióticos; con el consiguiente impacto
en el mayor uso de recursos en salud y aumento en la mortalidad4-8.
La evaluación de este grupo de pacientes a fin de caratularlos como
graves; constituye un desafío en el que se deben considerar varias
variables como son: determinar una buena adherencia, manejo de los inhaladores,
presencia o no de comorbilidades. El concepto del asma de difícil
control (ADC) se centra en descartar estas variables y a partir de allí
poder definir con claridad la definición de asma grave6-8.
El asma grave constituye un síndrome heterogéneo con
múltiples variantes clínicas. En las últimas dos
décadas, se han estudiado intensamente y se han definido diferentes
fenotipos11, 12. Establecer
el fenotipo de asma en los pacientes con asma grave no controlada constituye
parte de la acción diagnóstica o evaluativa a realizar en dichos
enfermos, pues puede conllevar un tratamiento diferencial y tener implicancias
pronósticas6.
Se han definido dos patrones fenotípicos inflamatorios: T2 alto
(presente en el asma alérgica y eosinofílica) y no T2, o
también llamado T2 bajo. Ambos fenotipos T2 alto suelen mostrar cierto
grado de superposición. La fracción de óxido
nítrico exhalado, la eosinofilia y la IgE son buenos biomarcadores del
fenotipo T2 “elevada”. El asma T2 alérgica representa el 40-50% del asma
grave y tiene una base atópica, orquestada por la activación de
las células T colaboradoras tipo 2 (Th2), la producción de
interleuquinas (IL) 4, IL-5 e IL-13 y el cambio de isotipo en los linfocitos B
hacia la producción de IgE. El asma T2 eosinofílica representa
más del 25% del asma grave y se caracteriza por la presencia de
eosinófilos en las biopsias bronquiales y en el esputo, inclusive en los
que reciben trataÂmiento con altas dosis de glucocorticoides. Pueden asociarse
con rinosinusitis crónica y pólipos nasales. El asma grave con T2
bajo se caracteriza por eosinófilos bajos en sangre periférica y
en esputo, con un perfil paucigranulocítico o con neutrofilia y niveles
bajos de fracción espirada de óxido nítrico (FENO) con
baja respuesta a los glucocorticoides. En un porcentaje de casos se asocia a
limitación crónica del flujo aéreo con atrapamiento y
asociación con tabaquismo13, 14.
El primer anticuerpo monoclonal desarrollado para el fenotipo
alérgico mediado por IgE fue omalizuÂmab, el cual fue aprobado por la
FDA en 2003 y la EMEA en 2005, y es utilizado en nuestro país15. Más
próximo en el tiempo, se han desarrollado los nuevos biológicos
que suprimen la respuesta eosinofílica en pacientes con asma grave como
los inhibidores de la IL4, 5 y 13. El mepolizumab y reslizumab son inhibidores
de la IL 5, el benralizumab es un inhibidor del receptor α de la IL 5, y
el dupilumab es un inhibidor de la subunidad α del receptor de IL4 que
interfiere la acción de las IL 4 y IL 1316-18.
En nuestro país se comercializan el mepolizumab y benralizumab, y
dupilumab. El dupilumab ha sido deÂsarrollado en el fenotipo T2 alto y como
criterio de inclusión es el único de los nuevos biológicos
que no ha incluído a la eosinofilia. El tezepelumab es el primer anticuerpo
que inhibe la linfoproteína estromal tímica (TSLP), una citoquina
alarmina originalmente conocida como factor de crecimiento linfocitario, que se
une al complejo TSLP receptor (que incluye el receptor α IL- 7), y activa
al linfocito T helper 2 y con ello una gran variedad de células inmunes
y no inmunes19.
Su programa de estudio clínico en fase III está muy avanzado y
pendiente de resultados22, 23.
Si bien existen en desarrollo clínico diferentes moléculas para
tratar los pacientes con fenotipo T2 bajo, aún no han avanzado a etapas
de desarrollo clínico fase III, por lo que no existe ninguno disponible
comercialmente.
El objetivo de esta revisión es analizar
críticamente aspectos metodológicos de los estudios de desaÂrrollo
clínico Fase III de los nuevos anticuerpos monoclonales
(biológicos) para tratar el asma grave T2 alto en algunos aspectos
relevantes que podrían influenciar la comparación de sus
resultados. A saber:
1. Características generales de las poblaciones estudiadas
2. Medicaciones controladoras de base (nivel mínimo
requerido)
3. Comorbilidades
4. Definición de exacerbación severa
5. Eosinofilia como criterio de inclusión
6. Adherencia y su impacto en las variables de las ramas placebo
1. Características generales de la población
estudiada de los estudios fase III
En general los estudios fase III han enrolado una muestra de
pacientes en general con asma grave eosiÂnofílica en estudios
prospectivos, randomizados, doble ciegos y controlados a un año de
duración, pero algunos con objetivos primarios tomadas a mediano plazo
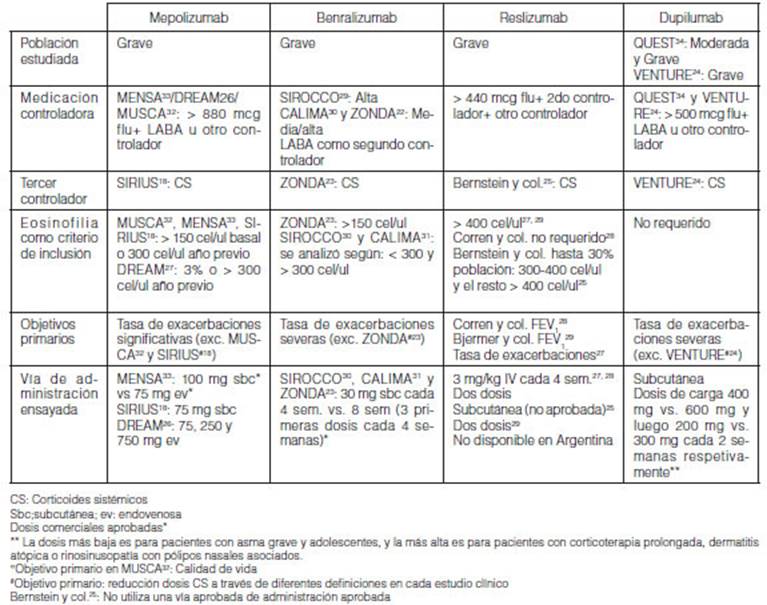
(Tabla 1)18, 23-34. Sin
embargo, hay excepciones. Los estudios Fase III que enrolaron población
con asma grave eosinofílica corticodeo-dependiente han sido de menor
duración, aproximadamente 6 meses (SIRIUS, ZONDA, VENTURE)18, 23, 24. El estudio
QUEST de dupilumab enroló pacientes con asma moderada y grave, y no
requirieron el criterio de inÂclusión de eosinofilia al ingreso (Tabla
1)24, 34. Todas las
moléculas han sido desarrolladas en población de adolescentes
(12-17 años) y adultos (>18 años).
Dentro de un mismo programa de desarrollo de una molécula,
debemos observar en la fase III de los nuevos biológicos que las
conclusiones a las que arriban, están afectadas por diversos factores
que hacen a no generalizar ni extrapolar sus conclusiones. Analizaremos a
continuación los principales factores, sin dejar de considerar que se
han usado diferentes vías de administración, dosis y
posologías diferentes a las posteriormente aprobadas por autoridades
regulatorias de referencia. Por ejemplo, si bien la vía de
administración aprobada para mepolizumab es la subcutánea, en el
estudio fase III DREAM se ha usado en una de las ramas la endovenosa, y a diferentes
dosis además de la posteriormente aprobada y disponible comercialmente26. Reslizumab ha sido
estudiado en el programa BREATH de estudios clínicos fase III usando la
vía intravenosa (formulación aprobada y comercializada, pero no
disponible en Argentina), pero existió posteriormente un nuevo programa
de desarrollo con una formulación subÂcutánea (no aprobada)25, 27-29. Con respecto a
la posología, por ejemplo, con benralizumab se han usado diferentes
esquemas posológicos: en tres estudios SIROCCO, CALIMA y ZONDA se han
comparado la administración cada 4 versus 8 semanas23,
30-31. En general la mayoría ha tenido como objetivo
primario la reducción de la tasa de exacerbaciones severas, pero ha
habido algunos estudios que han evaluado el FEV1
(para reslizumab), otro la calidad de vida (MUSCA), y otros la
reducción en términos generales del uso de corticosteroides
sistémicos (Tabla 1)18, 23-34.
2. Medicaciones controladoras de base (nivel mínimo
requerido)
Cuando se compara las recomendaciones de la indicación de
biológicos en las guías internacionales y nacionales, se observa
la necesidad de estar “intensamente tratados” (además de resolver
primero el problema de la adherencia). La definición de que
medicación controladora basal es muy diferente, no sólo en la
dosis, sino en la cantidad de controladores requeridos a lo largo de los
estudios clínicos fase III de biológicos5.
Si bien hay que tener en cuenta que el programa de estudios
clínicos Fase III de los nuevos biológicos han empezado en 2012,
cuando no se habían consensuado aún los criterios actuales de
asma grave; los diferentes estudios incluían población moderada y
severa no controlada y por ende las dosis o números de controladores
dependen de los criterios basales de inclusión acerca de la severidad.
En general todos los estudios clínicos han enrolado
pacientes con dosis media/alta o alta con medicación preventiva (dos o
más controladores). También dependerá del objetivo que se
busque demostrar, por ejemplo, en un estudio de reducción de corticoides
orales la dosis de corticoides inhalados forzosamente debe ser máxima y
no así en un estudio de función pulmonar. No todos los estudios
requirieron de un tercer controlador antes de ingresar a un estudio de un nuevo
biológico (Tabla 1).
Corticoides inhalados, β 2 de acción
prolongada (LABA) y tercer controlador
Para mepolizumab, se requirieron dosis altas de fluticasona >
880 mcg/día asociado a un segundo controlador (LABA o cualquier otro) en
SIRIUS, DREAM y MUSCA18, 26, 32.
Para SIRIUS el tercer conÂtrolador debía ser corticoides
sistémicos (CS)18.
Para benralizumab, explícitamente el segundo controlador
debía ser LABA. La dosis de corticoides inhalados fue alta en SIROCCO y
medias a altas en CALIMA30, 31.
Se usaron dosis altas de corticoides inhalados en los seis meses previos al
ingreso al estudio ZONDA23.
El tercer controlador en ZONDA fue el CS, y en SIROCCO y CALIMA debía
ser usado por lo menos tres meses antes de la visita de enrolamiento23, 30, 31.
Para reslizumab, no se requería tercer controlador, y la
dosis de corticoide inhalado era media a alta (fluticasona
>440mcg/día)27-29.
El segundo controlador fue LABA en 80%25,
27-29.
Para dupilumab en sus dos estudios de fase III, se requirió
hasta uno o dos controladores más (LABA o inhibidor de leucotrienos)24, 34. La dosis de
corticoide inhalado era media a alta > 500 mcg fluticasona/ día24, 34. El tercer
controlador en VENTURE fue los CS24.
Inhibidores de leucotrienos
Si bien el efecto terapéutico como controlador o preventivo
en adultos de los inhibidores de leucotrieÂnos es discutible, se sabe que en
los pacientes con asma desencadenado por AINES y con componente inflamatorio de
la vía aérea superior (rinosinusopatía crónica
alérgica) está avalado su uso5-8.
El uso de inhibidores de leucotrienos en MUSCA como controlador fue de 39-41%
similar en rama intervención y placebo32.
Anticolinérgicos antimuscarínicos de acción
prolongada (LAMA)
Los broncodilatadores anticolinérgicos fueron de los primeros
grupos farmacológicos para tratar el asma, en sus componentes naturales
de la belladona. Más allá de la acción
broncodilatadora, los antiÂcolinérgicos de acción prolongada
presentan acciones antinflamatorias por vía neuronal y no neuronal,
actuando sobre células inflamatorias y moléculas35-37.
Tiotropio ha sido estudiado en niños, adolescenÂtes y adultos35-37. En el estudio
PrimoTinA en adultos con asma no controlada a pesar de corticoide inhalado+LABA
en niveles GINA 4/5, tiotropio mejoró el pico de FEV1
0,110 L (p < 0,0001) y el FEV1
valle (p < 0,0001) y prolongación al tiempo de la
primera exacerbación severa(hazard ratio 0,79,
p = 0,03) y el tiempo al primer episodio de empeoramiento del asma(hazard ratio
0,69, p < 0,001) y con un adecuado perfil de seguridad38.
Otros LAMA están en desarrollo clínico en fase III y pendiente de
aprobación posterior. Recientemente se han publicado cinco estudios
clínicos (CAPTAIN, IRIDIUM, TRIMERAN, TRIGGER, ARGON) sobre el impacto
clínico de la triple terapia en un solo inhalador de tres grupos
farmacológicos (LAMA, LABA y corticoides inhalados) en pacientes con
asma moderada y severa no controlados con CI/LABA39-42.
En general, estos estudios han demostrado consistentemente que la triple
terapia mejora la función pulmonar sobre la terapia CI/LABA, mientras
que la eficacia sobre la reducción sobre las exacerbaciones es
sólo encontrada en dos estudios. Podría considerarse que la
adición de los LAMA debiera ser considerada en pacientes con
obstrucción bronquial persistente y sintomáticos, no
exacerbadores frecuentes, independientemente del grado de eosinofilia y FeNO39-42. La guía GINA
recomienda su uso en pacientes que permanecen con exacerbaciones a pesar del
tratamiento intensivo con dos controladores (corticoides inhalados y LABA), en
estadío 4 o 57. La
guía de la ATS/ ERS los recomienda en niños, adolescentes y
adultos con asma grave no controlada a pesar del trataÂmiento controlador del
nivel GINA 4/55. Ninguno de los estudios
clínicos con los nuevos biológicos, ha requerido el uso de
anticolinérgicos como criterio de inclusión. A manera de ejemplo,
el uso de LAMA en MUSCA como tercer controlador fue entre 19-23%29.
3. Comorbilidades
En todas las recomendaciones de asma de difícil control y
asma grave, se detalla de la importancia de la evaluación de las
comorbilidades en un paciente con asma de difícil control4-8.
Por otra parte, la deÂfinición de asma grave implica que se hayan
revisado todas las posibles comorbilidades que afecten el control del asma, para
definir con claridad asma grave. Se entiende que esto ha sido un paso necesario
en los centros de investigación reconocidos en todo el mundo y que han
participado del desarrollo de los nuevos biológicos. Se resumen las
comorbilidades nombradas más frecuentes (Tabla 2), así
como las principales características demográficas y de la
historia de asma.
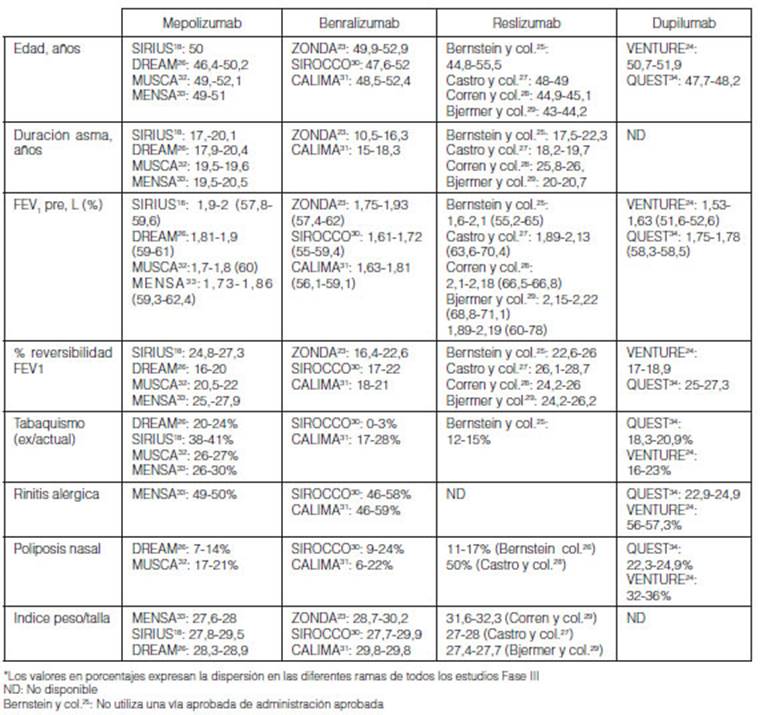
Tabaquismo
Es reconocido el impacto deletéreo del tabaquismo en el
control del asma4-8.
El tabaquismo activo es criterio de exclusión en los estudios de
biológicos, y en general se incluyeron ex fumadores con menos de 10
paquetes-año. La prevalencia de exposición al tabaquismo
varía de manera importante de estudio a estudio y entre las drogas entre
sí. A manera de ejemplo, dentro del desarrollo de mepolizumab la
prevalencia de antecedente de tabaquismo fue en el estudio DREAM entre 20 y 24%
en las diversasramas, hasta casi el doble en SIRIUS (38 a 41%)18, 26. Se observa exposición
intermedia en los estudios de reslizumab (12-15%), benralizumab (20% en
promedio) y dupilumab (de 16 a 23%)24, 25, 27-31,
34. La carga tabáquica fue menor a 5
paquetes-año en los fumadores actuales (dupilumab y benralizumab)24, 30-31, 34.
Rinitis alérgica
La prevalencia fue muy alta en todos los estudios entre 46-59% en
mepolizumab y benralizumab23, 26, 30-33.
Poliposis nasal
Hay mucha heterogeneidad en la prevalencia de poliposis nasal en
los estudios fase III de los nuevos biológicos. La prevalencia es baja
en las diferentes ramas del estudio DREAM (7-14%), CALIMA (6- 17%) y reslizumab
(estudio de Bernstein y col. 11-17%), intermedia en MUSCA (17-21%), SIROCCO
(9-24%) y QUEST (23-24.9%), y más alta en reslizumab (estudio de Castro
y col. 50%), y VENTURE (32-34%)24-27, 30-32,
34. La poliposis nasal está entre los factores
predictivos para la respuesta a los inhibiÂdores de interleuquinas 5, 4 y 137, 44, 45. Además
están ya finalizados los desarrollos clínicos y aprobadas
regulatoriamente por FDA y EMEA para tratamiento de la poliposis nasal del
dupilumab,omalizumab, mepolizumab45-47.
Sobrepeso
En general en todos los estudios fase III de todas las
moléculas se observa sobrepeso con índice peso/ talla entre 27,4
y 29,918, 23-27, 29-34.
Con reslizumab en el estudio de Corren y col. se observó índices
peso/ talla entre 31 y 3228.
4. Definición de exacerbación severa o
clínicamente significativa de asma
4.a. Como criterio de inclusión
Los nuevos biológicos determinaron criterios similares para
definir a la cantidad y definición de exaÂcerbaciones severas en el
año previo al enrolamiento. En los estudios fase III de mepolizumab
DREAM, MENSA y SIRIUS, se usaron similares criterios de enrolamiento: dos o
más exacerbaciones severas en el año previo que requirieran de CS18, 26, 33. En el otro
estudio fase III, MUSCA, los pacientes que estaÂba con CS de mantenimiento,
requirieron dos o más veces de incremento de la dosis de la
medicación controladora31.
En los estudios fase III con benralizumab SIROCCO y CALIMA, se usaron los
mismos criterios de inclusión con respecto a las exacerbaciones: dos
documentadas en el año previo, tratadas con CS o aumento temporario en
comparación al de base en el año previo30,
31. En el estudio ZONDA (asma grave corticodeo-dependiente),
se definió exacerbación de asma como el empeoramiento temporario
determinado por el aumento transitorio de la dosis de CS por lo menos por tres
días para controlar los síntomas, visita a emergencias, con el
agregado a la medicación de mantenimiento, u hospitalización por
asma23. En uno de los
tres estudios fase III de reslizumab, Bjermer y col., la exacerbación
fue definida como una de los siguientes criterios: reducción mayor o
igual al 20% del volumen espiratorio forzado del primer segundo (FEV1), una hospitalización
debido a asma, tratamiento en emergencias, o uso de CS por igual o mayor a 3
días29.
En uno de los dos estudios de Bernstein y col. se consideró similares
criterios excepto no se tuvo en cuenta el FEV125. En los otros estudios
fase III, las exacerbaciones no fueron tenidas en cuenta como criterio de
inclusión, aunque si como variable de impacto como veremos más
adelante 27-28. En el estudio
fase III de dupilumab QUEST se definió como la que lleva a hospitalizaÂción,
visita a emergencias o tratamiento con CS por tres días o más34. En el estudio VENTURE
en asma corticoideo-dependiente, se agrega en la definición la
duplicación de la dosis de CS de mantenimiento por más de tres
días24.
4.b. Como definición de impacto
Los nuevos biológicos determinaron similares definiciones
para las exacerbaciones severas o clínicaÂmente significativas como
objetivo primario y detallaron a las exacerbaciones moderadas como objetivos
secundarios de eficacia o seguridad.
Mepolizumab
Se usó una definición similar de exacerbaciones
clínicamente significativas en los estudios Fase III18,26,32-
33. En DREAM, se definió una exacerbación
clínicamente significativa a aquella que requiriera el uso de CS por
tres o más días, visitas a emergencias u hospitalización;
disminución de pico flujo espiratorio por debajo de su límite
inferior normal; 50% incremento de medicación rescate por 2-3
días consecutivos; aumento de la frecuencia de despertares nocturnos 2
de 3 noches consecutivas; escala de síntomas de asma de 5 puntos en dos
de tres días consecutivos27.
Para pacientes con corticodeoterapia crónica, se la definió como
la duplicación de la dosis de mantenimiento por lo menos 3 días18. Pero tanto en MENSA
como en SIRIUS esta consideración no fue tenida en cuenta y se
determinó el 50% de aumento de meÂdicación de rescate por 2-3
días consecutivos17, 32.
En el estudio MUSCA se usaron criterios similares a MENSA, pero se
agregó que se enrolaría con una sóla dosis intramuscular
de CS, aunque también se evaluaron como objetivos secundarios
exacerbaciones moderadas en todos los estudios 26,32-33.
Benralizumab
En los estudios fase III, SIROCCO y CALIMA se definió como
objetivo primario a la exacerbación asmática como el deterioro
del asma que lleva a uso de CS, o cambios temporarios del tratamiento de CS por
tres días o más, o una sóla inyección de CS, u
hospitalización (> 24 h), o visita a emergencias (< 24 h) que
requiera de uso de CS 30-31.
En ambos estudios se evaluaron como objetivos secundarios las exacerbaciones
moderadas 30-31.
En el estudio fase III ZONDA, se definió como objetivo primario a la
exacerbación asmática como el deterioro del asma que lleva a
cambios del tratamiento temporario de CS por tres días o más, u
hospitalización o visita a emergencias que requiera de uso de CS23.
Reslizumab
En los dos de los estudios fase III, la definición de
exacerbación clínicamente significativa (severa) fue
homogénea e incluía empeoramiento del asma que resulta en el uso
de CS que no los recibían, o incremento de dos o más veces de los
corticoides inhalado o CS en tres o más días, o la necesidad de
tratamiento en emergencia (visitas a guardias, hospitalizaciones, o visitas no
programadas en consulÂtorio ambulatorio para tratar la urgencia)27-28.
Se tiene que demostrar descenso del FEV1 de
20% o más con respecto al basal, reducción del pico flujo
espiratorio de 30% o más con respecto al basal por 2 días
consecutivos, o peoría de los síntomas evaluados por un
médico27-28.
Dupilumab
En el estudio VENTURE se definió como objetivo secundario a
la exacerbación grave como el deterioro del asma que lleva a cambios del
tratamiento por tres días o más días, o doble dosis de CS
de mantenimiento, u hospitalización o visita a emergencias que requiera
de uso de CS24.
En el estudio QUEST se definió como objetivo primario a la
exacerbación grave como el deterioro del asma que lleva a cambios del
traÂtamiento por tres días o más días, u
hospitalización o visita a emergencias que requiera de uso de CS34.
5. Eosinofilia como criterio de inclusión
El eosinófilo como célula está involucrado en
complejas funciones de la inmunidad innnata y adaptatiÂva a infecciones
(bacterias, virus, hongos y parásitos), e involucrado en la
patogénesis de neoplasias y enfermedades alérgicas48.
Es una célula multifuncional que interactua con variadas células
(linfocitos TH0, basófilos, endoteliales, macrófagos, plaquetas,
fibroblastos y mastocitos), liberando moléculas y mediadores variados,
con propiedades pro-inflamatorias, citotóxicas, quimioatractivas, pro-adherentes,
regulación de la permeabilidad vascular y broncoconstrictoras48-50.
El patrón oro para el diagnóstico de asma
eosinofílico es la biopsia bronquial o la eosinofilia en esputo
determinado por el método del esputo inducido6-8.
Sin embargo por estar tan alejados de la vida real y práctica
clínica cotidiana, y requerir de un entrenamiento especial, la
eosinofilia periférica ha surgido como un biomacador subrogado
útil y con predicción superior a otros biomarcadores6-8,48. La eosinofilia
periférica tiene buena especificidad para determinar la eosinofilia en
la vía aérea histológica5-8,43.
Existen diferentes criterios usados en el punto de corte para considerar los
valores normales de eosinófilos en sangre y a partir de que umbral se
debe considerar eosinofilia. Las guías GINA y GEMA recomiendan puntos de
corte mayor a 150 eosinófilos/uL en valores absolutos o mayor a 3% en
valor relativo para considerar eosinofilia 6,7.
Recientemente el estudio austríaco sobre más de 30.000 personas
consideran para el hombre un valor superior normal de hasta 100 y 120 en las
mujeres51.
Mepolizumab
En los estudios fase III (MUSCA, MENSA y SIRIUS), en la visita de
enrolamiento se definió un valor basal mayor o igual a 150
células/ul, o mayor o igual a 300 células/ul en el año
previo18, 32, 33. En
DREAM, el otros estudio Fase III, se definió en
el año previo, más de 3% de eosinofilia, o más de 300/uL,
o más de 50 partes por millón de óxido nítrico en
aire espirado26.
Benralizumab
En sus estudios fase III, se definieron diferentes criterios para
considerar la eosinofilia. En el estudio ZONDA (los pacientes venían
recibiendo corticoides orales) se tomó un valor basal mayor o igual a
150 células/μL23.
En los estudios SIROCCO y CALIMA, se randomizaron por estratificación 2:
1 por eosinofilia igual o mayor a 300 cel /μL y menor a 300 cel /μL
en laboratorios locales30-31.
Reslizumab
Es la molécula que sus estudios fase III, definió
puntos de corte para la eosinofilia más altos (>400
células/ul)27, 29.
Corren y col. estudiaron a una población asmática
independientemente de su fenotipo. Se determinó la eficacia en un
análisis post-hoc tomando como punto de corte de 400 eosinófilos28. Bernstein y col.
(vía de administración subcutánea no aprobada) definieron
una randomización esÂtratificada donde hasta el 30% de los pacientes
enrolado debían tener entre 300 y 400 eosinófilos y el resto
más de 400/uL25.
Dupilumab
En los dos estudios fase III VENTURE y QUEST los pacientes fueron
enrolados sin tener en cuenta el valor basal de eosinófilo 24,34.
Variabilidad y otras causas de eosinofilia
El eosinófilo como célula está sujeto en su
determinación hematológica a múltiples factores que deÂterminan
su variabilidad importante52-53.
Los posibles factores que pueden afectarla se resumen en la Tabla 3.
Debido a la gran variabilidad intra-individual, la guía GEMA sugiere
determinar en tres ocasiones (una de ellas durante una exacerbación de
asma) para certificar la eosinofilia, y la guía GINA hasta en tres
ocasiones, y en los pacientes corticoideo-dependientes tomar los valores
históricos previo al tratamiento6,
7. Existe un ritmo circadiano del conteo de
eosinófilos en sangre52-53.
Es máximo a la medianoche y el valle es al mediodía (inversa del
cortisol plasmático). La técnica “patrón oro” para la
determinación es la manual. Si el procesamiento es superior a las tres
horas, el recuento puede ser menor al verdadero. También el ejercicio en
las dos horas previas y la ingesta de una comida liviana en las cuatro horas
previas puede reducir hasta un 25% el conteo de eosinófilos52-53. El tratamiento
previo de hasta cuatro semanas de corticoides sistémicos puede reducir
su recuento52-53.

Antes de adjudicar la eosinofilia a un fenotipo de asma grave T2
alto, se deben estudiar exhaustivaÂmente y descartar otras causas de
eosinofilia según se resume en la Tabla 450,
54, 55. Más de cuarenta drogas han sido denunciadas
por generar eosinofilias55.
En algunas regiones del mundo con alta preÂvalencia de parasitosis se debe
considerar su diagnóstico diferencial antes de adjudicarlo a un fenotipo
de asma grave5.

6. Adherencia y su impacto en diferentes variables en las ramas
placebo
La palabra placebo deriva del verbo latín placere,
que significa complacer56.
En la Edad Media se usó para nombrar a las mujeres pagas que lloraban en
los funerales. La Real Academia Española la define como la “Sustancia
que, careciendo por sí misma de acción terapéutica,
produce algún efecto curativo en el enfermo, si este la recibe
convencido de que esa sustancia posee realmente tal acción”57. Su uso ha sido aplicado
por la medicina china, hindú, sumeria, asiria y babilonia. Se lo nombra
en el Papiro egipcio Ebers y en el Corpus Hipocrático, y fue
utilizado por Galeno56.
En investigación clínica, LilienÂfeld lo aplicó por
primera vez en un estudio en tuberculosis investigando el sanocrysin con agua
desÂtilada56.
Desde 1964, su uso ha sido regulado por la Declaración de Helsinski de
Investigación Clinica en seres humanos. El uso de placebo es entendido
en los estudios de fase III de los nuevos biológicos como rama
comparadora donde se agrega una sustancia inerte similar a la medicación
activa “add-on” a la medicación preventiva de base en comparación
con la rama intervención de la droga en estudio “add-on” a la
medicación preventiva. Se asume que las diferencias encontradas entre
ambas ramas estarán vinculadas a la droga experimental, dado que reciben
similar combinación de controladores del asma58.
Hay que evaluar si los cambios determinados en las variables de impacto
además de tener significancia estadística, cumplen con las
diferencias clínicas mínimamente significativas (DCMS) que son
las que tienen para el paciente significancia clínica real59. Un factor común
a casi todos los estudios del desarrollo clínicos de los nuevos
biológicos, es la observación de un “efecto Estudio
clínico” en las ramas placebo y su impacto en la reducción de
las exacerbaciones severas, mejoría del FEV1,
control del asma y calidad de vida. Es llamativo en los tres estudios que
investigan en pacientes corticoideo-dependientes (SIRIUS, ZONDA y VENTURE),
como se consiguen llamativas reducciones de los CS e incluso suspensiones
totales18, 23, 24. Las
razones hipotéticas de este resultado se podrían fundamentar en
que los pacientes ingresados a los estudios estaban probablemente sub-tratados
o mal adherentes, con mal control del asma, y lo que se observó en el
estudio, al mejorar la adherencia al tratamiento, normatizado su tratamiento y
debidamente seguidos, el asma se controló, y el impacto arriba
detallado. Es muy reconocido que la falta de adherencia es muy frecuente entre
los pacientes con asma bronquial, y de múltiples causas. La falta de
adherencia ha sido informada entre el 30-70% de los pacientes. Los factores
psicosociales del paciente, inherentes a la propia enfermedad, de la
relación médico-paciente hasta el acceso a los medicamentos han
sido ampliamente determinados en los estudios. En las varias definiciones de
“asma mal controlada”, el chequear los problemas de adherencia y actuar sobre
ella, antes de caratular un paciente como asma grave, es un paso obligatorio en
las recomendaciones de las diferentes guías internacionales y
nacionales. Es de suponer que los pacientes enrolados en los estudios
clínicos también la hayan observado. Pero por protocolo, en los
estudios clínicos se requieren garantizar una adherencia al tratamiento
mayor al 80% de los días, y esto se logra no sólo con el
auto-reporte del paciente de toma de la medicación, sino con el conteo
de dosis de las drogas en estudio y dispositivos electrónicos de dosis en
cada visita, o telemedicina. Por lo tanto, es probable que el mejor control del
asma se logre en estos pacientes sólo por mejorar la adherencia. Se
podría suponer que este “efecto protocolo” sobre la adherencia se
daría por igual en las ramas placebo o control y en las ramas de investigación,
con lo cual se igualaría este efecto, y no intervendría en la
observación de diferencias en el impacto de las variables de
observación de resultados60.
A continuación, se revisan los principales impactos de la
mejoría de la adherencia en las diferentes variables en las ramas
placebo de los estudios clínicos citados.
6.a. Impacto de la adherencia sobre exacerbaciones severas (Tabla
5)
En la mayor parte de los estudios el objetivo primario de impacto
fue la tasa de exacerbaciones. Bonini y col. consideraron que una diferencia
mínima clínicamente significativa (DMCS) para esta variable es
una sóla exacerbación severa y reducción del 20-40% en
valor relativo59.
El impacto de la adherencia en las ramas placebo para los estudios de
mepolizumab se observa en el estudio DREAM (35% de reducÂción,
año previo 3,7 exacerbaciones (3,8) y al año 2,4 (0-11)); en el
estudio MENSA (reducción de 51%, en el año previo exacerbaciones
3,6 ± 2,8; al año 1.75); en el estudio MUSCA (reducción de 55,1%,
en el año previo 2,7 ± 1,5; al año 1,21) y en el estudio SIRIUS
(reducción de 26,8%, en el año previo de 2,9 exacerbaciones ±
2,8; al año 2,12)18,26,32-33.
En los estudios con benralizumab se observó el impacto de la adherencia
en las ramas placebo con reducción de las exacerbaciones severas:
SIROCCO 55,6% y 59,6% respectivamente (con eosinóflos > 300: en el
año previo de 3 (1-8) al año a 1,33 (1,12-1,58) y de 1,21
(0,96-1,52) con eosinófilos< 300). En CALIMA se observó
reducción de 65,5% (en el año previo de 2,7 (1-6) al año a
0,93 (0,77-1,12) y en ZONDA se redujo 26,8% (en el año previo de 2,5 ±
1,8 al año a 1,83 en ambas dosificaciones)23,
30, 31. En el estudio de Castro y col. se observó
una reducción vinculada probablemente a mayor adherencia de 10% (en el
año previo 2,1 ± 2,3 al año 1,81)27.
Con dupilumab se observó una reducción del 40% en el estudio
QUEST (en el año previo 2,07 ± 1,58 a 0,87 y 2,31 ± 2,07 a 0,97) (Tabla
5)34.
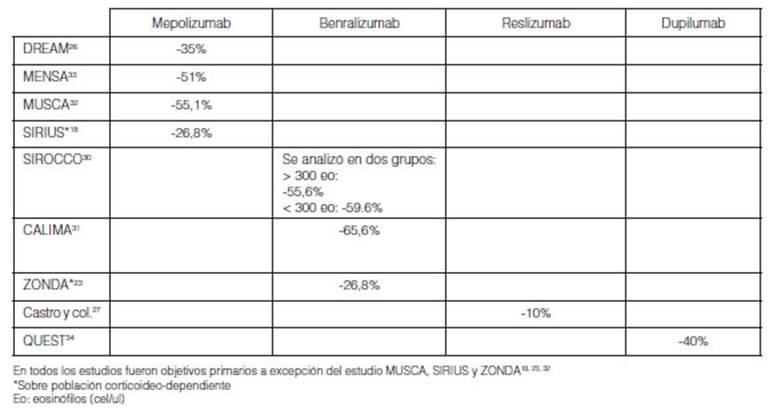
El impacto de mejor adherencia se observó en todos los
estudios clínicos en las ramas placebo, pero menos evidentes en los
estudios de asma grave corticoideo-dependientes debido probablemente al efecto
prolongado antinflamatorio de los corticoides sistémicos.
6.b. Impacto de la adherencia sobre FEV1
pre-broncodilatador (Tabla 6)
En la mayoría de los estudios la evaluación de la
función pulmonar fue considerada como objetivo seÂcundario, excepto en
el desarrollo de reslizumab25, 27-29.
El tiempo de evaluación del objetivo primario difirió en cada
estudio (16 a 24 semanas en general). Bonini y col. consideraron que una DMCS
para esta variable es mejoría de 100 ml en valor absoluto y 15% para
estudios cortos y 20% para estudios prolongados en valor relativo59. En general, el impacto
de la adherencia fue mejorías menores al 20% en las ramas placebos de
los estudios clínicos (Tabla 6).
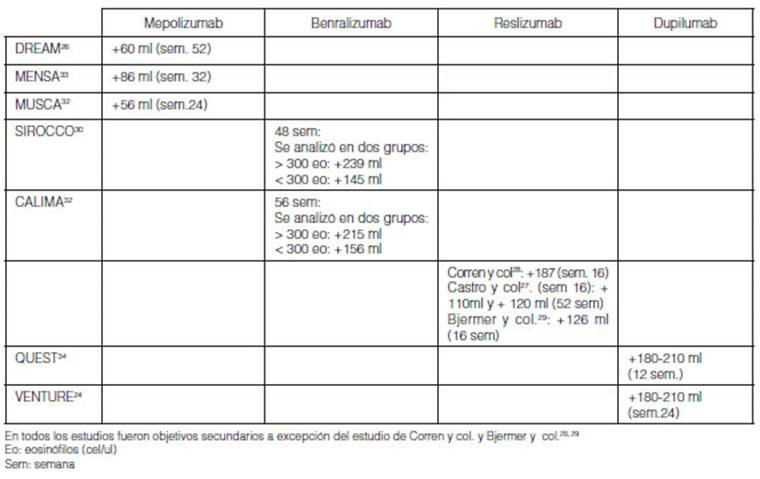
El impacto de la adherencia en las ramas placebo de los estudios
de mepolizumab se observó con mejorías del FEV1
prebroncodilatador en DREAM 60 ml, MENSA 86 ml y MUSCA 56 ml26, 32, 33. Con
benralizumab se observaron mejorías en SIROCCO de + 239 ml con
eosinófilos > 300 y 145 ml con eosinófilos <300, y en
CALIMA en el grupo > 300 eosinófilos +215 ml y +156 ml en la rama
<300 eosinófilos30, 31.
Con reslizumab se observaron en las ramas placebo mejorías a las 16
semanas de 120 ml a 230 ml25, 27-29.
Con dupilumab se observó mejorías vinculadas a mejor adherencia
en el estudio VENTURE de 180 ml a 210 ml a la semana 24 (Tabla 6)24.
6.c. Impacto de la adherencia sobre el uso de corticoides
sistémicos (Tabla 7)
El impacto de la adherencia en las ramas placebo en los cuatro
estudios que se detallan a continuación en pacientes con asma grave
corticoideo dependientes, fue evaluada la reducción de corticoides
sistéÂmicos especialmente como objetivos primarios (Tabla 7).
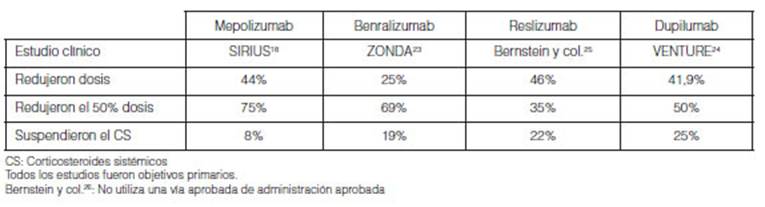
SIRIUS: Del total que redujeron la dosis (44%), Âľ partes lo hizo
más de 50% las dosis de CS. 8% de los pacientes con placebo suspendieron
los CS a la semana 2418.
ZONDA: reducción con placebo 25% promedio a la semana
24,69% de los pacientes redujeron más del 50% la dosis de CS. 19%
pacientes con placebo suspendieron totalmente los CS 23.
Bernstein y col. informaron en dos estudios la reducción con
placebo fue 46% a la semana 16 y disÂcontinuación 22%. 35% de los
pacientes redujeron 50% de la dosis. Independientemente de la cantidad de
eosinófilos25.
VENTURE: la reducción con placebo fue 41,9 ± 4,6% a la
semana 24 y discontinuación 25%. 50% de los pacientes redujeron 50% de
la dosis. Independientemente de la cantidad de eosinófilos24.
El impacto de la adherencia es muy importante en la
reducción a lo largo de todas las moléculas de las dosis promedio
y una significativa reducción definitiva de los CO en los estudios de
asma grave corticoideo-dependientes.
6.d. Impacto la adherencia sobre calidad de vida (Tabla 8)
Se consideraron diferentes herramientas que evalúan la
calidad de vida en asma en el desarrollo de los diferentes programas de estudios
clínicos como el AQLQ y el SGRQ. El uso de SGRQ es tardío y se
hizo cuando se advirtió que era más sensible60. Bonini
y col. consideraron que una DMCS para esta variable es una reducción de
4 puntos en el Cuestionario de Calidad de Vida de St.George
(SGRQ) y mejoría de 0.5 puntos en el Cuestionario de Calidad de Vida en
Asma (AQLQ)59. El impacto de la adherencia observó una
significativa mejoría de la calidad de vida por arriba del umbral de
DMCS a lo largo de todos los estudios clínico fase III.
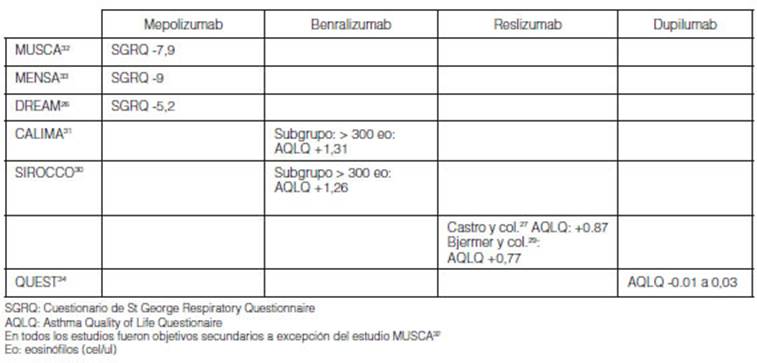
El impacto de la adherencia sobre la calidad de vida evaluando las
ramas placebo con mepolizumab, se observó en MUSCA como objetivo
primario, una reducción de 7,9 puntos en el SGRQ32. Como obÂjetivos
secundarios se observó en SIRIUS reducción de 5,2 puntos y 9 puntos
en MENSA del SGRQ18, 32, 33. La adherencia en los estudios con
benralizumab se observaron en las ramas placebo de CALIMA (con
eosinófilos > 300 cel/ul) +1,31 puntos del AQLQ y en SIROCCO +1,26,
ambos como objetivos secundarios. En los grupos < 300 eosinófilos no
fue informada la calidad de vida en ambos estudios 39-31. Con reslizumab se
observó el beneficio de la mayor adherencia mejoría de +0,77
puntos en el AQLQ (objetivo secundario) a +1,06 puntos (estudio de Bernstein y
col.)25. Con dupilumab la tasa de respuesta de la variable secundaria AQLQ se
analizó a las 24 semanas (VENTURE) y a las 52 semaÂnas (QUEST)24,
34. La tasa de pacientes que responden al tratamiento se definió
como una mejora en la puntuación de 0,5 o más puntos (rango 1-7
para AQLQ). Se observó mejoría en AQLQ a partir de la semana 2 y
se mantuvieron durante 52 semanas en el estudio QUEST34. Se
observaron resultados similares en VENTURE25. El impacto fue similar
en los que tenían recuento de más de 150 eosinófilos como
en los de más 300 (Tabla 8)24.
6.e. Impacto de la adherencia sobre control del asma (Tabla 9)
En todos los estudios clínicos se lo consideró al
control del asma como objetivo secundario. Se usaron diferentes versiones del
Cuestionario de Control del Asma (ACQ). Bonini y col. consideraron que una DMCS
para esta variable es la reducción de 0,5 puntos en la escala del
Cuestionario de Control del Asma (ACQ)59.
La adherencia generó una significativa mejoría del control del
asma por arriba del umbral de DMCS a lo largo de todos los estudios fase III.
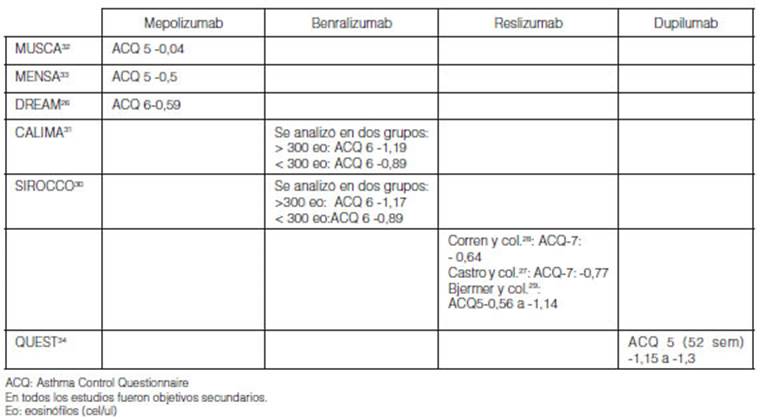
El impacto de la adherencia en las ramas placebo de los estudios
clínicos MENSA y MUSCA con mepolizumab se observó una
reducción de -0,5 y -0.4 respectivamente32,
33 En
MUSCA 42% de los paÂcientes mejoraron significativamente el control del asma en
la rama placebo32.
En DREAM se observó una reducción del ACQ de -0,59 por mejor
adherencia26.
Con benralizumab, se observaron en las ramas placebo de CALIMA en el grupo >
300 eosinófilo, reducción del ACQ de -1,19 y en el grupo de <
300 eosinófilos de -0,8931.
Con reslizumab, se observaron en las ramas placebo reducciones de -0,56 a -1,14
del ACQ25, 27-29. Con
dupilumab, la tasa de respuesta del ACQ-5 se analizó a las 24 semanas
(VENTURE) y a las 52 semanas (QUEST)24, 34.
Se observaron mejoras en ACQ-5 a partir de la semana 2 y se mantuÂvieron 52
semanas en el estudio QUEST34.
Se observó resultados similares en VENTURE24.
El impacto fue similar en los que tenían recuento de más de 150
eosinófilos como en los mayores a 300 (Tabla 9).
Conclusiones
Se ha analizado críticamente algunas de los criterios
metodológicos de los estudios fase III de desarrollo clínico de
los nuevos biológicos para tratar el asma moderada y grave T2 alto. La
heterogeneidad de las poblaciones incluídas determina que no
necesariamente las muestras poblacionales de asma moderado y grave hayan sido
iguales entre los estudios, más allá que se han usado diferentes
vías de adminisÂtración, posología y dosis en algunos
estudios clínicos fase III a las autorizadas posteriormente para su
comercialización. No es recomendable por lo tanto establecer
comparaciones entre las moléculas respecto a la eficacia y seguridad, ya
que se han usado definiciones diversas en los criterios de incluÂsión en
cuanto a intensidad del tratamiento preventivo (dos o más
controladores), y en las definiciones de exacerbaciones moderadas y severas61-72. Por otra parte, no
queda claro si los diversos factores que afectan la etiología y el
conteo de eosinófilos, han sido profundamente evaluados, sabiendo del
sesgo que ello implica en la inclusión de pacientes a estos estudios. A
pesar de ello, numerosos estudios de análisis en red indirectos han sido
publicados para establecer comparaciones entre las moléculas, pero deben
ser tenidos en cuenta las consideraciones revisadas en este artículo61-72.
En las ramas placebo de los estudios fase III, se ha demostrado el
impacto real de la adherencia. La adherencia e intensidad del tratamiento
preventivo en la vida real, es pobre, y que el estudio clínico al
permitir al paciente el acceso total a la medicación preventiva diaria y
en forma controlada, la mejora. Al mejorar la adherencia se ha conseguido mejor
control del asma, mejor calidad de vida, una reducción significativa de
las exacerbaciones severas y llamativa disminución de la cantidad de CS,
por encima de la DMCS. Acreditar una buena adherencia siempre es el primer paso
en un paciente con mal control del asma, y mejorarla, resulta en un impacto
beneficioso en la calidad de vida y control del asma, reducción de
exacerbaciones y consumo de corticoides sistémicos además de
ahorrar recursos al sistema de salud.
Conflicto de intereses: Dr. Martin Sívori ha
participado en conferencias y programas de educación médica
continua en asma para Astra Zéneca, Novartis y Glaxo SmithKlane.
Dr. Daniel Pascansky ha participado en conferencias, asesoramiento
para Asma en Astra Zeneca, Glaxo SmithKline, Boehringer Ingelheim, Elea,
Casasco, así como programas de educación médica
continua en asma para Novartis.
Bibliografía
1. Reddel HK, Boulet LP. Global Initiative for Asthma
.GINA Update 2020. Acceso el 2 de Marzo de 2021
en www.ginasthma.org
2. Forno E, Gogna M, Cepeda A, et al. Asthma in Latin America.
Thorax 2015; 70: 898-905.
3. Arias S, Neffen H, Bossio JC, et al. Prevalence and features of
asthma in Young adults in urban areas of Argentina. Arch Bronconeumol 2018; 54:
134-9.
4. Colodenco D, Neffen H, Baena-Cagnani C, et al. Recomendaciones
para el diagnóstico y tratamiento del asma de difícil control
(ADC). Rev Arg Med Respir 2006: 15-36.
5. Holguin F, Cardet JC, Chung KF, et al. Management of severe
asthma: a European Respiratory Society/American Thoracic Socienty guideline.
Eur Respir J 2020; 55
6. Alobid I, Alvarez Rodriguez C, Blanco Aparicio M, et al.GEMA 5.0. Guía Española para el manejo del
asma. Acceso el 2 de Marzo de 2021en www.gema.com
7. Global Initiative for Asthma. Difficult to treat & Severe
Asthma in adolescent and adult patients: Diagnosis and Treatment Version 2.
2019. Acceso el 2 de Marzo de 2021 en
www.ginasthma.org
8. Moore WC, Meyers DA, Wenzel SE, et al. National Heart, Lung,
and Blood Institute’s Severe Asthma Research Program. Identification of asthma
phenotypes using a clustering analysis in the Severe Asthma Research Program.
Am J Respir Crit Care Med 2010; 181: 315-23.
9. Wenzel S. Asthma phenotypes: the evolution from clinical to
molecular approaches. Nat Med 2012; 18: 716-25.
10. Agache IO. From phenotypes to endotypes to asthma treatment.
Curr Opin Allergy Clin Immunol 2013; 13: 249-56.
11. Fitzpatrick AM, Moore WC. Severe asthma phenotypes - how
should they guide evaluation and treatment? J Allergy Clin Immunol Practice
2017; 5: 901-8.
12. Shaw DE, Sousa AR, Fowler SJ, Fleming LJ, Roberts G, Corfield
J, et al; U-BIOPRED Study Group. Clinical and inflammaÂtory characteristics of
the European U-BIOPRED adult severe asthma cohort. Eur Respir J 2015; 46(5):
1308-21.
13. Kuo CS, Pavlidis S, Loza M, Baribaud F, Rowe A, Pandis I, et
al; U-BIOPRED Study Group. T-helper cell type 2 (Th2) and non-Th2 molecular
phenotypes of asthma using sputum transcriptomics in U-BIOPRED. Eur Respir J
2017; 49: 1602135.
14. Xolair [omalizumab] full prescribing information. July 2008.
Acceso el 2 de Marzo de 2021 en
www.xolair.com/prescribÂing_information.html.
15. Manka LA, Weschler ME. Selecting the right biologic for your
patients with severe asthma. Ann Allergy Asthma Immunol 2018; 121 : 406-13.
16. Walsh GM. Recent developments in the use of biologics
targeting IL-5, IL-4or IL-13 in severe refractory asthma. Expert Rev Respir Med
2018; 12: 957-63.
17. Busse WW. Biological treatments for severe asthma
: a major advance in asthma care. Aller Inter 2019; 68: 154-66.
18. Bel EH, Wenzel S, Thompson PJ, et al. Oral
glucocorticoid-sparing effect of mepolizumab in eosinophilic asthma. N Engl J Med
2014; 371: 1189-97.
19. Marfone G, Spadaro G, Braile M, et al. Tezepelumab: a novel
biological therapy for the treatment of severe uncontrolled asthma. Exp Op
Invest Drugs 2019; 28: 931-40.
20. Menzies-Gow A, Colice G, Griffiths JM, et al. NAVIGATOR: a
phase 3 multicentre, randomized, double-blind, placebo controlled,
parallel-group trial to evaluate the efficacy and safety of tezepelumab in
adults and adolescents with severe, uncontrolled asthma. Respir Research 2020;
21: 266.
21. MenziesGow A, Ponnarambil S, Downie J, et al. DESTINATION: a
phase 3, multicentre, randomized, doubleblind, placeÂbocontrolled,
parallelgroup trial to evaluate the longterm safety and tolerability of
tezepelumab in adults and adolescents with severe, uncontrolled asthma Respir
Research 2020; 21: 279
22. Wechsler ME, Colice G, Griffiths JM, et al. SOURCE: a phase 3,
multicentre, randomized, double-blind, placebo controlled, parallel group trial
to evaluate the efficacy and safety of tezepelumab in reducing oral
corticosteroid use in adults with oral corticosteroid dependent asthma. Respir
Research 2020; 21: 264.
23. Parameswaran N, Wenzel, Rabe K, et al. Oral
Glucocorticoid-Sparing Effect of Benralizumab in Severe Asthma. N Engl J Med
2017; 376: 2448-58.
24. Rabe K, Parameswaran N, Brusselle G, et al. Efficacy and
safety of dupilumab in glucocorticoid-dependent severe asthma. N Engl J Med
2018; 378: 2475-85.
25. Bernstein JA, Virchow JC, Murphy K, et al. Effect of
fixed-dose subcutaneous reslizumab on asthma exacerbations in patients with
severe uncontrolled asthma and corticosteroid sparing in patients with oral
cortiosteroid-dependent asthma: results from two pase 3 randomised,
double-blind, placebo-controlled trials. Lancet Respir Med 2020
26. Pavord ID, Korn S, Howarth P, et al. Mepolizumab for severe
eosinophilic asthma (DREAM): a multicentre, double-blind, placebo-controlled
trial. Lancet 2012; 380: 651-59.
27. Castro M, Zangrilli J, Wechsler ME, et al. Reslizumab for
inadequately controlled asthma with elevated blood eosinophil counts: results
from two multicentre, parallel, double-blind, randomised, placebo-controlled,
phase 3 trials. Lancet Respir Med 2015; 3: 355–66.
28. Corren J, Weinstein S, Janka L, Zangrilli J, Garin M. Phase 3
study of reslizumab in patients with poorly controlled asth,a:
effects across a broad range of eosinophil counts. Chest 2016; 150: 799-810.
29. Bjermer L, Lemiere C, Maspero J, et al. Reslizumab for
inadequately controlled asthma with elevated blood eosinophil levels: a
randomized phase 3 study. Chest 2016; 150: 789-98.
30. Bleecker ER, FitzGerald JM, Chanez P, et al. Efficacy and
safety of benralizumab for patients with severe asthma uncontrolled with
high-dosage inhaled corticosteroids and long-acting beta2-agonists (SIROCCO): a
randomised, multicentre, placebo-controlled phase 3 trial. Lancet 2016; 388:
2115-27.
31. FitzGerald JM, Bleecker ER, Nair P, et al. Benralizumab, an
anti-interleukin-5 receptor amonoclonal antibody, as add-on treatment for
patients with severe, uncontrolled, eosinophilic asthma (CALIMA): a randomised,
double-blind, placebo-controlled phase 3 trial. Lancet 2016; 388: 2128-41.
32. Chupp GL, Bradford ES, Albers FC, et al. Efficacy of
mepolizumab add-on therapy on health-related quality of life and markÂers of asthma
control in severe eosinophilic asthma (MUSCA): a randomised, double-blind,
placebo-controlled, parallel-group, multicentre, phase 3b trial. Lancet Respir
Med 2017; 5: 390–400.
33. Ortega HG, Liu MC, Pavord ID, Brusselle GG, Fitzgerald JM,
Chetta A, et al. Mepolizumab treatment in patients with severe eosinophilic
asthma. N Engl J Med 2014; 371: 1198-208.
34. Castro M, Corren J, Pavord ID, et al. Dupilumab efficacy and
safety in moderate to severe uncontrolled asthma. N Engl J Med 2018; 378:
2486-96.
35. Guyer AC, Long AA. Long-acting anticholinergics in the
treatment of asthma. Curr Opin Allergy Clin Immunol 2013; 13: 392-8.
36. Wessler I, Kirkpatrick CJ. Acetylcholine beyond neurons: the
non-neuronal cholinergic system in humans. Brit J Pharmacol 2008; 154: 1558-71.
37. Halpin D. Tiotropium in asthma: what is the
evidence and how does it fit in? World Allergy Org J 2016; 9: 29.
38. Kerstjens HAM, Engel M, Dahl R, et al. Tiotropium in asthma
poorly controlled with standard combination therapy. N Engl J Med 2012; 367:
1198-207.
39. Lee LA, Bailes Z, Barnes N, et al. Efficacy and safety of
once-daily single-inhaler triple therapy (FF/UMEC/VI) versus FF/ VI in patients
with inadequately controlled asthma (CAPTAIN): a double-blind, randomised,
phase 3A trial. Lancet Respir Med 2021; 9: 69-84.
40. Kerstjens HAM, Maspero J, Chapman KR, et al. Once-daily,
single-inhaler mometasone–indacaterol– glycopyrronium versus
mometasone–indacaterol or twice-daily fluticasone–salmeterol in patients with
inadequately controlled asthma (IRIDIUM): a randomised, double-blind,
controlled phase 3 study. Lancet Respir Med 2020; 8: 1000-12.
41. Virchow JC, Kuna P, Paggiaro P, et al. Single inhaler
extrafine triple therapy in uncontrolled asthma (TRIMARAN and TRIGÂGER): two double-blind,
parallel-group, randomised, controlled phase 3 trials. Lancet 2019; 394:
1737–49.
42. Gessner C, Kornmann O, Maspero J, et al. Fixeddose combination
of indacaterol/glycopyrronium/mometasone furoate once-daily versus
salmeterol/fluticasone twice-daily plus tiotropium once-daily in patients with
uncontrolled asthma: A randomised, Phase IIIb, non-inferiority study (ARGON).
Respir Med 2020; 170: 106021.
43. British Thoracic Society. Sign 158: British Guideline on the
management of asthma. 2019.
44. FitzGerald JM, et al. Predictors of enhaced response with
benralizumab for patients with severe asthma: pooled analysis of the SIROCCO
and CALIMA studies. Lancet Respir Med 2018; 6: 51-4.
45. Bachert C, Han JK, Desrosiers M, Hellings PW, Amin N, Lee SE,
et al. Efficacy and safety of dupilumab in patients with severe chronic
rhinosinusitis with nasal polyps (LIBERTY NP SINUS-24 and LIBERTY NP SINUS-52):
results from two multicentre, randomised, double-blind, placebo-controlled,
parallel-group phase 3 trials. The Lancet 2019; 394: 1638-50.
46. Harrison TW, Chanez P, Menzella F, et al. Onset of effect and
impact on health-related quality of life, exacerbation rate, lung function, and
nasal polyposis symptoms for patients with severe eosinophilic asthma treated
with benralizumab (ANDHI): a randomised, controlled, phase 3b trial. Lancet
Respir Med 2021;9:260-4.
47. Han JK, Bachert C, Fokkens W, et al. Mepolizumab for chronic
rhinosinusitis with nasal polyps (SYNAPSE): a randomised, double-blind, placebo-controlled,
phase 3 trial. Lancet Respir Med; 2021;9:1141-53.
48. Cottin V. Eosinophilic Lung Diseases. Clin Chest Med 2016:
1-22.
49. Asano K, Ueki S, Tamari M, et al. Adult-onset eosinophilic
airway diseases. Allergy 2020; 75: 3087-99.
50. Tefferi A. Blood eosinophilia: a new paradigm in disease,
classification, diagnosis and treatment. Mayo Clin Proc 2005; 80: 75-83.
51. Hartl S, Breyer MK, Burghuber OC, et al. Blood eosinophil
count in the general population: typical values and potential confounders. Eur
Respir J 2020; 55: 1901874.
52. Gibson,P.G.Variability of blood
eosinophils as a biomarker in asthma and COPD. Respirology 2018
; 23 : 12–3.
53. Rakowski E, Zhao S, Liu M, et al. Variability of blood
eosinophils in patients in a clinic for severe asthma. Clin Exp Allergy 2019;
49: 163-70.
54. Spector SL, Tan RA. Is a single blood eopsinophil count a
reliable marker for eosinophilic asthma ? J Asthma
2012; 49: 607- 10.
55. Camus P, The Drug-Induced Respiratory Disease Website. Acceso
el 2 de Marzo de 2021 en www.pneumotox.com
56. Oken B. Placebo effects: clinical aspects and neurobiology.
Brain 2008; 131: 2812-23.
57. Real Academia Española. Placebo. Acceso el 2 de Marzo de 2021 en www.dle.rae.es/placebo.
58. Moerman DE, Meaningful Placebos-Controlling the
Uncontrollable. New Engl J Med 2011; 365: 171-2.
59. Bonini M, De Paolo M, Bagnasco D, et al. Minimal clinically
important difference for asthma endpoints: an expert consensus report. Eur
Respir Rev 2020; 29: 190137.
60. Costello RW, Cushen B. Looking back to go forward: adherence
to inhaled therapy before biologic rherapy in severe asthma Eur Respir J 2020;
55: 20000954.
61. Bourdin A, Husereau D, Molinari N, et al. Matching-adjusted
indirect comparison of benralizumab versus interleukin-5 inhibitors for the
treatment of severe asthma: a systematic review. Eur Respir J 2018; 52:
1801393.
62. Henriksen DP, Bodtger U, Sidenius K,et al.
Efficacy adverse events and inter-drug comparisons of mepolizumab and resliÂzumab
anti IL5 treatments of severe asthma: a systematic review. Eur Clin Respir J
2018; 5: 1536097.
63. Nachef Z, Kirschman A. Omalizumab versus mepolizumab as add-on
therapy in asthma patients. J Asthma 2018; 55: 89-100.
64. Cockle SM, Stynes G, Gunsoy NB, et al. Comparative effectiveness
of mepolizumab and omalizumab in severe asthma: An indirect treatment
comparison. Respir Med 2017; 123: 140-8. 114 115
65. Cabon Y, Molinari N, Marin G, et al. Comparison of
anti-interleukin-5 therapies in patients with severe asthma: global and
indirect meta-analyses of randomized placebo controlled trials. Clin Exp
Allergy 2017; 47: 129-38.
66. Casale TB, Pacou M, Mesana L, Farge G, Sun SX, Castro M.
Reslizumab Compared with Benralizumab in Patients with Eosinophilic Asthma: A
Systematic Literature Review and Network Meta-Analysis. J Allergy Clin Immunol
Pract 2019; 7: 122-30.
67. Signorovitch JE, Sikirica V, Erder MH, et al.
Matching-adjusted indirect comparisons: a new tool for timely comparative
effectiveness research. Value Health 2012; 15: 940-7.
68. Bucher HC, Guyatt GH, Griffith LE, Walter SD. The results of
direct and indirect treatment comparisons in meta-analysis of randomized
controlled trials. J Clin Epidemiol 1997; 50: 683-91.
69. Farne HA, Wilson A, Powell C, Bax L, Milan SJ. Anti-IL5
therapies for asthma. Cochrane Database Syst Rev 2017; 9: CD010834.
70. Agache I, Beltran J, Akdis C, et al. Efficacy and safety of
treatment with biologics (benralizumab, dupilumab, mepolizumab, omalizumab and
reslizumab) for severe eosinophilic asthma. Allergy 2020; 75: 1023-42.
71. Mauger D, Apter AJ. Indirect treatment comparisons and
biologics. J Allergy Clin Immunol 2019; 143; 84-6.
72. Edris A, De Feyter S, Maes T, Joos G, Lahousse L. Monoclonal
antibodies in type 2 asthma: systematic review and network meta-analysis.
Respiratory Research 2019; 20: 179.