Autor :CalderÃģn Juan C.1 * Nazzo MarÃa V.1 PÃĐrez PÃĄez Martha I. 1 Virhuez Yblin1 Balcazar Jonathan1 Vicente Luis1 Ahumada RosalÃa1 OssÃĐs Juan M. 1 Vigliano Carlos1 Bertolotti Alejandro1 CÃĄneva Jorge O.1
1Hospital Universitario FundaciÃģn Favaloro, CABA, Argentina
Correspondencia :Juan Carlos CalderÃģn Soriano, jcaldero@ffavaloro.org
Resumen
La
hipertensión arterial pulmonar (HAP) representa el 2,6% de los
trasplantes pulmonares (TP), con una mediana de supervivencia condiÂcional
(desde los 30 días del TP) de 9,8 años. Son frecuentes, el
rechazo celular agudo (ACR) y la disfunción crónica del injerto
(CLAD), mientras que es infrecuente el rechazo mediado por anticuerpos (AMR).
El retrasplante pulmonar (RTP) constituye el 4% del TP mundial, debido a
complicaciones en la vía aérea, disfunción primaria del
injerto, ACR y CLAD. Mujer de 22 años, portadora de HAP
idiopática (HAPI) desde el año 2013, trasplantada bipulmonar (TBP) en enero de 2018. A los 16 meses
presentó neumonía adquirida en la comuniÂdad. En una
internación posterior, presentó ACR y a pesar de pulsos de metilprednisolona, progresó a requerimientos de
cánula de alto flujo y ventilación mecánica no invasiva
hospitalaria, caída del VEF1,
y tomografía de tórax con vidrio esmerilado difuso y
engrosamiento irregular reticular del intersticio subpleural;
interpretándose como CLAD a predominio de síndrome de
bronquiolitis obliterante (BOS), con presencia de anticuerpos
específicos contra el donante (DSA). En enero de 2020 se realizó
nuevo TP y ante cross-match positivo, se
realizó plasmaféresis y
reposición de IgG. Al mes del egreso, no se
observaron signos de rechazo en control de biopsias transbronquiales.
Entre 2 y 10% de los pacientes con indicación primaria de TP por HAPI
son sometidos a retrasplante pulmonar (RTP). La presencia de DSA y el
miss-match de HLA, no son contraindicaciones para el RTP.
Palabras
clave: Trasplante
pulmonar; Retrasplante pulmonar; Rechazo mediado por anticuerpos;
Síndrome de bronquiolitis obÂliterante; Cross-match positivo;
Hipertensión arterial pulmonar idiopática
Abstract
Pulmonary arterial hypertension
(PAH) represents 2.6% of lung
transplantations (LT), with
a conditional median survival
(from 30 days after LT) of 9.8 years. Acute cellular rejection (ACR) and chronic lung allograft dysfunction (CLAD) are common; whereas the antibody-mediated
rejection (AMR) is not. Lung retransplantation
(LR) accounts for 4% of
global LTs for complications in the airways, primary allograft dysÂfunction, ACR and
CLAD. 22-year-old woman with
idiopathic PAH (IPAH) since
2013, who underwent a double-lung transplantation (DLT)
in January 2018. 16 months after transplantation she presented community-acquired
pneumonia. During a subsequent hospitalization, she presented ACR. Despite the fact
that she received pulse methylprednisolone,
she required high-flow cannula therapy and hospital non-invasive
mechanical ventilation; the FEV1 was reduced and she underwent a chest tomography with diffuse ground
glass opacities and
irregular reticular thickening of the
subpleural interstitium; interpreting the predominance of BOS (bronchiolitis
obliterans syndrome) as
CLAD, with presence of donor-specific antibodies (DSA).
In January 2020, she received a new DLT and due to a
positive crossmatch, she was treated with
plasmapheresis and IgG replacement. One month after hospital discharge, no signs of rejection were observed at the BTB (bone-patellar tendon-bone)
control. Between 2 to 10% of patients
with primary indication of LT for IPAH are subjected to lung retransplantation (LR). The presence of DSA and HLA (human leucocyte
antigen) mismatch arenât contraindications to LR.
Key
words: Lung transplantation,
Lung retransplantation, Antibody-mediated rejection, Bronchiolitis obliterans syndrome, Positive cross-match, Idiopathic pulmonary arterial hypertension
Introducción
Los
pacientes portadores de hipertensión arterial pulmonar (HAP) pueden
calificar para trasplante pulmonar (TP) si la condición clínica y
el cumplimiento de determinados criterios lo ameritan. En este contexto, dichos
pacientes son derivados a evaluación como candidatos potenciales para TP
si se encuenÂtran en una estratificación del riesgo intermedio o elevado1, según guías
europeas, o un riesgo > 7 puntos según el score REVEAL (Registry to Evaluate
Early and Long-Term Pulmonary Arterial Hypertension Disease Management)
habiendo cumplido con óptimo tratamiento, enfermedad rápidamente
progresiva o reciente hospitalización por progresión, uso de prostaglandina
endovenosa o subcutánea, signos de disfunción de otros
órganos y hemoptisis recurrente2.
Mientras que el ingreso a lista de trasplante se considera en aquellos
pacientes con un riesgo elevado1,
o un score de riesgo > 10 puntos del REVEAL, hipoxemia progresiva y
signos progresivos de insuficiencia cardíaca derecha con
disfunción (reversible) de otros órganos o hemoptisis
potencialmente grave2. El
2,6% de los trasplantes pulmonares son por HAP como indicación, con una
mediana de supervivencia de 6,3 años y una supervivencia condicional, a
partir de los 30 días del TP, de 9,8 años3.
El
rechazo pulmonar (RP) puede ser de tipo celular agudo (ACR, por sus siglas en
inglés, acute ceÂllular
rejection), mediado por anticuerpos (AMR, por sus
siglas en inglés, antibody-mediate rejection) y por disfunción crónica del
injerto (CLAD, por sus siglas en inglés, chronic
lung allograft disfunction)4.
El ACR puede presentarse en el primer año postrasplante
(17,1%-28%) de forma asintomática o sintoÂmática con disnea, tos,
expectoración y febrícula, y su diagnóstico es
histopatológico5.
El AMR puede ser clínico o subclínico (función normal del
injerto pulmonar) con presencia de anticuerpos anti-HLA específicos
contra el donante (DSA, por sus siglas en inglés, Donor-specific
anti-human leukocyte antigen
(HLA) antibodies), histopatología, y
tinción con C4d positiva, en ausencia de otras causas4.
El CLAD es la principal causa de mortalidad posterior al primer año del
TP, en parte por susceptibilidad del inÂjerto a daño e infecciones como
consecuencia de su exposición constante al medio ambiente4.
A su vez, el CLAD puede ser de tipo BOS (por sus siglas en inglés, bronchiolitis obliterant
syndrome, síndrome de bronquiolitis
obliterante)6 o de tipo RAS (por sus siglas en
inglés, restrictive allograft syndrome,
síndrome restrictivo del aloinjerto)7.
El
tratamiento de RP no se encuentra estandarizado. En nuestro centro, el ACR se
trata con pulÂsos de metilprednisolona, el AMR
mediante plasmaféresis y el CLAD con montelukast, corticoides y agonistas beta-2 inhalados, azitromicina, y la adición de rapamicina
al esquema de inmunosupresión habitual (tacrolimus,
corticoides con o sin micofenolato sódico).
Por otra parte, el retrasplante pulmoÂnar es considerado como una opción
terapéutica al existir complicaciones en la vía aérea,
disfunción primaria del injerto, RP por ACR refractario y RP por CLAD,
representando un 4% a nivel de todo el trasplante pulmonar mundial3, 8.
Caso clínico
Mujer
de 22 años, con diagnóstico de HAP idiopática (HAPI) desde
el año 2013, sin embarazos previos. Derivada a nuestra
institución en enero de 2018, para su evaluación para trasplante
pulmonar, enconÂtrándose bajo tratamiento crónico con triple
terapia específica (macitentán, sildenafil y epoprostenol
endovenoso) y reciente desarrollo de un síndrome de bajo volumen minuto
con requerimientos de milÂrinona. Calificando en
carácter de emergencia, se realizó TP bilateral a menos de 48
horas del ingreso, habiendo requerido la asistencia de dispositivo de
sostén vital (ECMO V-A, extracorporeal
membrane oxygenation veno-arterial) en el posoperatorio inmediato y por 72
horas. Sin intercurrencias notables, egresó al
mes de la cirugía. A las 72 horas del egreso hospitalario,
reingresó por síndrome comicial haciéndose el
diagnóstico de glioma frontoparietal izquierdo
de bajo grado, medicándose con levetiraÂcetam
y disminuyendo la inmunosupresión para evitar progresión del
tumor, a la espera de resolución neuroquirúrgica.
Dieciséis
meses después se internó por neumonía adquirida en la
comunidad con un diagnóstico bacteriológico de Bordetella bronchiséptica,
obtenido mediante fibrobroncoscopía (FBC)
en la muestra del lavado broncoalveolar (LBA). Un mes
más tarde, fue nuevamente internada por disnea rápidamente progresiva
en clase funcional IV y requerimientos de oxígeno suplementario con
valores de pulsioxiÂmetría de 95% respirando
una fracción inspirada de oxígeno (FiO2) de 32%; el cuadro fue
inicialmente interpretado como neumonía intrahospitalaria
indicándosele tratamiento antibiótico empírico y, dada su
falta de respuesta, a las 48 horas posteriores al ingreso, se realizó fibrobroncoscopía y lavado bronÂcoalveolar
(FBC y LBA) y biopsias transbronquiales (BTB) con
tinción de Gram directo negativo en LBA y rechazo A2 B0 en la
histopatología de las BTBs,
interpretándose el cuadro como ACR, indicándosele tratamiento con
metilprednisolona 1 g endovenoso/día por 3
días consecutivos. La paciente evolucionó con empeoramiento
clínico en los meses subsiguientes, varias internaciones en unidad de
cuidados inÂtensivos, tratada en varias de esas ocasiones con cánula de
alto flujo de oxígeno (flujo 50 l/min y FiO2
50%) e incluso terapia de sostén ventilatorio con
ventilación mecánica no invasiva. La espirometría
en ese momento mostraba un franco y permanente deterioro de su función
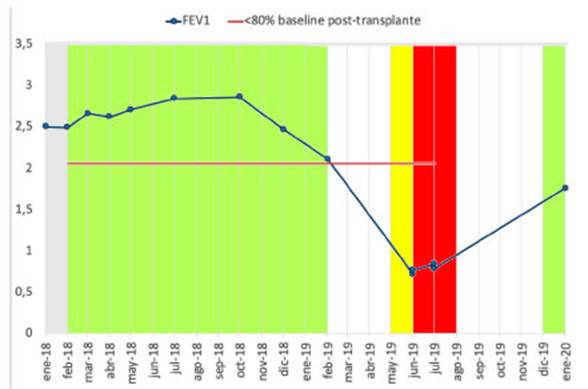
pulmonar, valorada por el VEF1 (0.79
L; 23% del valor de referencia) (Figura 1), así como la
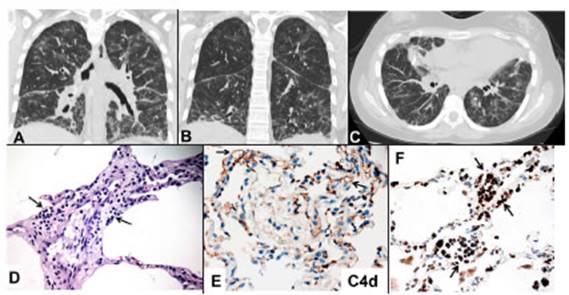
tomografía computarizada de tórax (Figura 2, A-C),
estableciéndose el diagnóstico de CLAD a predominio de BOS.
Dada
la rápida evolución del CLAD, se solicitó anticuerpos HLA
durante la evaluación para retrasÂplante bipulmonar,
arrojando ausencia de IgG anticlase
I y presencia de IgG anticlase
II (50%) tipo antiHLA-DQ fijadora de C1q.
En
enero del 2020, la paciente fue sometida a retrasplante bipulmonar
electivo. En recuperación postrasplante la
paciente fue extubada y desvinculada del ECMO V-V (veno venoso) a las 24 horas de la cirugía ante
mejoría de la insuficiencia respiratoria hipoxémica.
En un contexto de cross-match positivo
para linfocitos B y T del donante, se realizaron tres sesiones de plasmaféresis con reposición de IgG para profilaxis de rechazo mediado por anticuerpos
existentes previamente. El reporte anatomopatológico
de los pulmones explantados informó rechazo
crónico del injerto pulmonar, patrón predominante restrictiÂvo y
bronquiolitis obliterante (CLAD: RAS + BOS); rechazo A1 B1R C1 (rechazo agudo
mínimo âA1â, inflamación de vía aérea de bajo grado
âB1Râ, y rechazo crónico de vía aérea/bronquiolitis
obliterante âC1â) y rechazo vascular crónico. Los hallazgos
histopatológicos (capilaritis) y de inmunohistoquímica (C4d positivo) fueron compatibles
con rechazo mediado por anticuerpos (Figura 2, D-E).
En
el posoperatorio, la paciente no presentó complicaciones,
externándose en menos de 30 días de la cirugía. En el
control broncoscópico al mes del egreso, las BTBs mostraban parénquima pulmonar sin signos de
rechazo (A0 B0, y C4d negativa).
Discusión
Aunque
infrecuente, como en nuestro caso, los pacientes con indicación primaria
de TP por HAPI son sometidos a retrasplante pulmonar (2,6% a 10,3%)8-11. El Registro
Internacional de la Sociedad Internacional de Trasplante Corazón
Pulmón (ISHLT, por sus siglas en inglés, International Society of Heart and Lung Transplantation)
reportó que la mediana en años de supervivencia en el
retrasplante pulmonar (2,5 años) fue inferior al trasplante primario
(5,7 años) (p < 0.0001) pero con una superviÂvencia condicional a un
año de 6,3 años11.
Los predictores independientes de mortalidad reportados por retrasplante han
sido el menor volumen de trasplante en el centro (< 10/año), soporte
ventilatorio con severidad en variables de la enfermedad,
hospitalización prolongada, mayor edad del receptor y retrasplante
temprano (< 2 años)8, 10-12.
Si
bien dicho registro muestra una evolución desfavorable para los retrasplantados, los centros con mayor volumen de
trasplantes como el nuestro reportan una supervivencia similar al trasplante
priÂmario. En años recientes en EE.UU., la tasa de supervivencia al
año y a los cinco años en el grupo de retrasplante de 89,2% y
64,3% respectivamente, sin diferencias significativas comparado con el trasÂplante
primario (89,7%, y 58,2% respectivamente) (p = 0,79)8.
En contraste, otro estudio mostró una supervivencia al año y 5
años en los retrasplantados (64% y 21%
respectivamente) menor al grupo de trasplante primario (84% y 61%
respectivamente, p < 0,0001)10.
En otro estudio, la supervivencia en el grupo retrasplantado
fue significativamente menor comparado con el trasplante primario desde los 6
meses, siendo al año de 62,3% y a los cinco años de 41,8%
comparado con el grupo de trasplante primario (81,9% y 66,5% respectivamente)
(p < 0,001)9.
En Canadá, la supervivencia entre los retrasplantados
fue menor comparado con los trasplantados primarios, pero sin significancia
estadística (p = 0,39)12.
En Europa, la supervivencia al año y cinco años en el grupo de
retrasplante fue de 76% y 55%, comparado con el grupo de trasplante primario de
82% y 61% respectivamente (p > 0,05); siendo el HR ajustado por sexo, edad,
diabetes, función renal, ARM previo a retrasplante y ECMO, de 1,43 (IC
95% 0,90 a 2,26)13.
En otra serie europea, la supervivencia al año del trasplante primario
(73%) fue mejor que la del retrasplante (58%) con una mediana de supervivencia
en el retrasplante 74 Âą 36,9 meses14.
La
presencia de RP es una complicación bastante frecuente, con una menor
prevalencia de ACR posterior a la introducción de inmunosupresores e
inicio de esquema que incluyera inhibidores de calÂcineurina
(p.e. tacrolimus). En
nuestro centro, se encuentra protocolizada la realización
sistemática de espirometría y FBC con
BTB para el monitoreo y detección oportuna de rechazo del injerto, que
bien puede presentarse de manera asintomática. Aunque la presencia de
CLAD (previamente conocido exclusivamente como BOS) ha disminuido
también como consecuencia de la prevención de rechazo agudo, la
CLAD fue la principal complicación del trasplante pulmonar y la
indicación para el retrasÂplante. Los pacientes con BOS reportaron mejor
supervivencia que los pacientes con RAS (mediana de 7,4 años vs 2,1
años, respectivamente. p = 0,0001), o por otras indicaciones12; y en otro estudio fue
de 63,4 meses vs 19,5 meses14.
Sin embargo, en otra serie de pacientes, la diferencia en supervivencia no fue
significativa (2,7 años vs 0,9 años, p = 0,055)10.
Puesto
que el retrasplante pulmonar no se encuentra exento de complicaciones, es
esperable que CLAD también se desarrolle en el retrasplante. En un
estudio, cuatro pacientes retrasplantados desaÂrrollaron
CLAD (28,6%, de los cuales uno desarrolló RAS), con un tiempo medio al
diagnóstico de 30 Âą 19,6 meses14.
Por otra parte, el desarrollo de BOS a 5 años en el trasplante primario
fue del 40,3% vs 53,4% en el retrasplante (p < 0,001)11;
aunque en otro estudio el desarrollo de BOS en el retrasplante fue similar (p =
0,58)12. Aunque a
diferencia de otros trasplantes de órgano sólido, ni la presencia
de DSA ni el miss-match de HLA es una contraindicación para el
retrasplante9, 12.
En nuestro caso, pese al rechazo mediado por anticuerpos confirmado en la explantectomía, y el cross-match
positivo al momento de retrasplante, la evolución durante el
posoperatorio del retrasplante fue favorable, lo cual puede ser adjudicado a la
realización de plasmaféresis. La
presencia de anticuerpos HLA tipo II es más frecuente en candidatos a
retrasplante comparado con el trasplante inicial (12,1 vs 5,41, p = 0,002), lo
cual muchas veces aumenta el tiempo en lista de espera aguardando donantes
viables, sin impacto en la mortalidad (HR 0,95, IC 05% 0,89-1,01)8. En el caso de nuestra
paciente, el principal factor de riesgo sospechado para sensibilización
de HLA fue la disminución en la inmunosupresión en el postransplante primario inmediato en contexto de glioma de
bajo grado. Otro factor conocido de sensiblización
como embarazo fue desestimado en base a su historial clínico; y si bien
la exposición a múltiples transfusiones es otro desencadenante,
en nuestra institución se realiza de manera rutinaria en estos pacientes
la transfusión de unidades leucodepletadas e
irradiadas con el fin de disminuir los riesgos de sensibilización.
En
conclusión, consideramos que el retrasplante es una opción terapeútica viable aún presencia de DSA,
siempre teniendo en cuenta factores clínicos, edad del paciente,
condiciones socioeconómicas y experiencia del centro de trasplante, que
aseguren una supervivencia en el retrasplante de al menos 5 años desde
la ejecución del trasplante.
Bibliografía
1.
Galiè N, Humbert M, Vachiery JL, et al. 2015 ESC/ERS Guidelines
for the diagnosis and treatment of pulmonary hypertenÂsion. Eur Heart J. 2016; 37(1): 67-119.
2.
Benza RL, Gomberg-Maitland
M, Miller DP, et al. The REVEAL registry
risk score calculator in patients newly diagnosed with pulmonary arterial hypertension. Chest. 2012; 141(2): 354-62.
3.
Chambers DC, Cherikh WS, Goldfarb SB, et al. The
International Thoracic Organ
Transplant Registry of the International Society for Heart and Lung
Transplantation: Thirty-fifth
adult lung and heart-lung transplant
report-2018; Focus theme: Multiorgan Transplantation. J Hear Lung Transplant.
2018; 37(10): 1169-83.
4.
Parulekar AD, Kao CC. Detection, classification, and management of rejection after lung transplantation.
J Thorac Dis. 2019; 11(3):
S1732-9.
5.
Stewart S, Fishbein MC, Snell GI, et al. Revision of the 1996 Working Formulation for the Standardization
of Nomenclature in the
Diagnosis of Lung Rejection.
J Heart Lung Transplant. 2007; 26(12): 1229-42.
6.
Estenne M, Maurer JR, Boehler
A, et al. Bronchiolitis obliterans
syndrome 2001: An update of the diagnostic
criteria. Vol. 21, Journal
of Heart and Lung Transplantation. J Heart Lung Transplant; 2002; 21:
297-310.
7.
Sato M, Waddell TK, Wagnetz
U, et al. Restrictive allograft
syndrome (RAS): A novel form
of chronic lung allograft dysfuncÂtion. J Hear Lung Transplant
[Internet]. 2011; 30(7): 735â42. http://dx.doi.org/10.1016/j.healun.2011.01.712
8.
Biswas Roy S, Panchanathan
R, Walia R, et al. Lung Retransplantation for Chronic Rejection: A
Single-Center Experience. Ann Thorac
Surg. 2018; 105(1): 221-7.
9.
Ren D, Kaleekal TS, Graviss EA, et al. Retransplantation
outcomes at a large lung transplantation program. Transplant Direct. 2018; 4(11): 1-8.
10.
Hall DJ, Belli EV, Gregg JA, et al. Two Decades of Lung Retransplantation: A
Single-Center Experience. Ann Thorac
Surg. 2017; 103(4): 1076-83.
11.
Yusen RD, Edwards LB, Kucheryavaya
AY, et al. The registry of the international society for heart
and lung transplantation: Thirty-first adult lung and heart-lung transplant report - 2014; Focus theme: Retransplantation.
J Hear Lung Transplant. 2014; 33(10): 1009-24.
12.
Halloran K, Aversa M, Tinckam K, et al. Comprehensive outcomes after lung retransplantation: A
single-center review. Clin Transplant. 2018; 32(6): 0-2.
13.
Wallinder A, Danielsson C, Magnusson J, Riise GC, Dellgren G. Outcomes and Long-term Survival After
Pulmonary RetransÂplantation:
A Single-Center Experience. Ann Thorac
Surg. 2019; 108(4): 1037-44.
14.
Revilla-López E, Berastegui C,
Sáez-Giménez B, et al. Resultados del retrasplante pulmonar por
disfunción crónica del injerto pulmonar en un centro
trasplantador: Hospital Vall DâHebron
de Barcelona. Arch Bronconeumol.
2019; 55(3): 134-8.