Autor : Suárez Susana VerĂłnica1,2, Siroti Catalina3, Steiner Sabine2, Yampolsky Julieta1, RamĂrez Ilene1, MartĂn Carlos1, Montiel Guillermo4
1ClĂnica Bazterrica 2ClĂnica del Sol 3Hospital Dr. Antonio Cetrángolo 43 OMI
Correspondencia :Verónica Suárez draveronicasuarez@gmail.com
Resumen
Se presenta el caso de un paciente con fibrosis quística, insuficiencia respiratoria crónica tipo II, en tratamiento con solución hipertónica, DNAsa, salbutamol, VNI nocturna y oxigenoterapia 24 horas, quien consulta por presentar desaturación y cefalea en el contexto de cambio de equipo de VNI.
Se inicia tratamiento con HFNC y AVAPS presentando mejoría clínica, disminución de los requerimientos de oxígeno, descenso de la PaCO2, disminución de los tapones mucosos en la tomografía y fluidificación de las secreciones respiratorias.
Se plantea al HFNC como posible estrategia de tratamiento en los pacientes con FQ. Al prevenir el daño de la mucosa, disminuir la inflamación y las infecciones podría enlentecer el deterioro de la función pulmonar.
Palabras clave: Alto flujo termo humidificado; Fibrosis quística; Hipercápnia.
Abstract
We present the case of a patient with cystic fibrosis and type II chronic respiratory failure under treatment with hypertonic solution, DNAse, salbutamol, night NIV and 24-hour oxygen therapy. The patient consults for desaturation and cephalea in the context of changing NIV equipment.
The patient begins treatment with HHHF and AVAPS and shows clinical improvement, decrease in oxygen requirements, decrease in PaCO2, less mucous plugging on the tomography and fluidifying of respiratory secretions.
The HHHF is proposed as possible treatment strategy for patients with CF. By preventing damage to the mucosa and reducing inflammation and infections it could slow down impairment of the lung function.
Key words: Heated humidified high flow; Cystic fibrosis; Hypercapnia.
Introducción
La fibrosis quística (FQ) es una enfermedad hereditaria debida a mutaciones de la proteína reguladora de la conductancia transmembrana de la FQ (CFTR) localizada en el cromosoma 7. Es un trastorno autosómico recesivo, multisistémico y la principal causa de morbimortalidad es el compromiso respiratorio1, 2. Según el Registro Nacional de FQ de Argentina en 2014 había en el país un total de 692 pacientes con FQ, sólo el 22,5% eran mayores de 18 años3.
Las alteraciones en la reología del moco y en la función ciliar condicionan un estado de inflamación crónica y predisposición a infecciones. Estas alteraciones pueden resultar a largo plazo en bronquiectasias, insuficiencia respiratoria crónica, alteraciones en la calidad de vida y eventual requerimiento de trasplante pulmonar. Recientes publicaciones han demostrado que la reología del moco se encuentra directamente relacionada al deterioro de la función pulmonar4. Debido a esto es menester la pesquisa neonatal con el objetivo de iniciar tratamientos dirigidos a evitar el daño pulmonar irreversible.
El Alto Flujo Termo Humidificado (AFTH) mejora la reología del moco y el clearence ciliar entre otras cosas5, 6. Siendo demostrado su beneficio en pacientes con bronquiectasias, EPOC y bronquitis crónica, disminuyendo las exacerbaciones y el deterioro de la función pulmonar y mejorando la calidad de vida7, 8.
Caso clínico
Paciente de 17 años con antecedentes de FQ (mutación heterocigota G542X, segunda mutación desconocida), insuficiencia pancreática exocrina, IMC 14 kg/m² e insuficiencia respiratoria crónica tipo II. En el año 2016 entra en lista para trasplante pulmonar teniendo que dejar de asistir a la escuela y mudarse a Buenos Aires. Presentaba en ese momento un trastorno obstructivo con disminución de la capacidad vital, VEF1/CVF 70% (LIN 75,5), VEF1 0,56 L (21%) y CVF 0,91 L (29%).
Refiere múltiples internaciones por exacerbaciones con diferentes gérmenes resistentes, requiriendo antibióticos endovenosos e inhalatorios en diferentes oportunidades.
Actualmente en tratamiento con enzimas pancreáticas, nebulizaciones con solución hipertónica, DNAsa, salbutamol a demanda, oxigenoterapia permanente (oximetría habitual: 85% en reposo con FiO2 0,21 y 90% con cánula nasal a 3L/min con concentrador estacionario) y VMNI nocturna (Stellar 150, se desconoce modo y parámetros).
Debido a inconveniente burocrático entre la obra social y la empresa de internación domiciliaria 15 días previos a la consulta se cambia el respirador a un Quantum en modo S/T EPAP 6 cmH2O, IPAP 16 cmH2O, FR 10. Evoluciona con cefalea intermitente asociada a saturación del 80% en los últimos dos días a pesar del uso de cánula nasal y concentrador a 3 L/min.
Al ingreso se constatan signos vitales alterados, FC 130 lpm, FR 38 rpm y oximetría 0,21/reposo 60% y con cánula nasal a 10 L/min: 90%. El resto del examen físico presenta como hallazgos patológicos roncus y crepitantes generalizados, acropaquia y acrocianosis.
Peso 37 kg, talla 150 cm, IMC 16,4 kg/m².
Se realiza gasometría arterial que evidencia acidosis respiratoria y alcalosis metabólica asociada (con oxígeno, FiO2 desconocida): pH 7.35, PaCO2 71 mmHg, PaO2 106 mmHg, EB 9.4, HCO3 38 mEq, Sat 97%, GAP 6; Hto 39% GB, 12400/mm³ (68% N); Plt 355000/mm³.
Se realiza radiografía (Rx) y tomografía (TC) de tórax que no presentan cambios respecto a estudios previos. Ver Figura 1. En la TC de tórax se evidencian múltiples bronquiectasias diseminadas algunas con contenido denso en su interior y áreas de vidrio esmerilado a predominio bibasal. Cultivo de esputo con desarrollo de flora habitual de vías aéreas superiores. Espirometría de ingreso con trastorno obstructivo: CVF disminuida, VEF1/CVF 70% (LIN 74,3), VEF1 0,60 L (21%), CVF 0,87 L (26%).
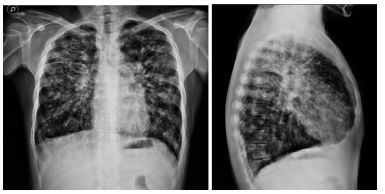
Se interpreta el cuadro clínico como insuficiencia respiratoria crónica reagudizada secundaria a cambio de ventilador y tratamiento insuficiente.
Se inicia tratamiento con Oxigenoterapia de Alto Flujo Termo Humidificado (OAFTH) con cánula nasal (AIRVO 2: flujo 32 L/min, FiO2 37%, T 34 °C) y VMNI nocturna en modo AVAPS con humidificador activo (Stellar 150 y Fisher & Pykel 850). Inicia rehabilitación física con OAFTH (se aumenta el flujo y la FiO2 acorde a la demanda).
Evoluciona con resolución de la cefalea, refiriendo mayor confort y tolerancia al tratamiento y al ejercicio, presenta franca fluidificación de las secreciones respiratorias y descenso de la PaO2. Gasometría control (con OAFTH) con descenso de la hipercapnia: pH 7,40, PaCO2 62 mmHg, PaO2 80 mmHg, EB 9.8, HCO3 37 mEq/L, Sat 97%. Se realiza TC de tórax luego de 15 días del tratamiento implementado con disminución del vidrio esmerilado y los tapones mucosos endobronquiales. (Figura 2).
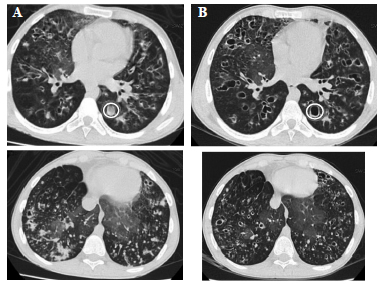
Cuando se decide egreso sanatorial con indicación de continuar con igual tratamiento en domicilio es derivado por obra social a centro de referencia para trasplante. Continuó con igual tratamiento internado durante 6 meses. Presentó una única exacerbación leve (esputo purulento y taquipnea, afebril, sin disnea, cultivo de esputo sin rescate microbiológico). Se realizó trasplante pulmonar con buena evolución.
Discusión
Se ha demostrado que el AFTH otorga niveles de FiO2 estables, disminuye la PaCO2, tiene efecto CPAP, disminuye la resistencia de la vía aérea, disminuye el esfuerzo respiratorio, y mejora tanto la función ciliar como la reología del moco5, 8. El tratamiento con AFTH puede o no asociarse a oxigenoterapia (OAFTH) acorde al requerimiento del paciente que es dinámico. Su uso en patologías tanto agudas o crónicas en domicilio demostró ventajas con impacto a corto y largo plazo9-11.
Son conocidos los efectos adversos de la oxigenoterapia crónica sobre la mucosa respiratoria, debido a su baja temperatura y falta de humedad12. Con la OAFTH se pueden lograr niveles óptimos de temperatura y humedad5, 8.
Si bien hay trabajos que demuestran que la viscoelasticidad del moco en los pacientes con FQ no es mayor que la de pacientes sanos o EPOC13, ésto se refiere a momentos fuera de la exacerbación. Durante la exacerbación si se encuentra aumentada, teniendo impacto en el deterioro de la función pulmonar4. La viscoelasticidad no es la única característica del moco que se encuentra alterada en los pacientes con FQ. Algunos otros condicionantes implicados en la alteración de las características del moco son su composición molecular y la del líquido periciliar, el pH, la deshidratación celular y el biofilm bacteriano14
Uno de los pilares fundamentales del tratamiento de estos pacientes es la mejoría del clearence mucociliar que incluye la fisioterapia respiratoria, la solución hipertónica inhalada (SH) y los mucolíticos como dornasa-alfa que escinde los polímeros de ADN, produciendo una disminución significativa en la viscosidad del esputo mucopurulento. La acción de la SH es la rehidratación del moco por efecto osmótico impulsando el agua desde el interior de la célula hacia la capa superficial. Su efecto máximo está limitado al tiempo que dura la nebulización15 teniendo acción en la vía aérea superior y estimulando la tos de manera irritativa.
La terapia de AFTH hidrata el epitelio bronquial a través de la entrega de vapor de agua en forma continua durante todas las horas de uso, observándose macroscópicamente un cambio en la morfología del moco con mayor fluidificación, menor adherencia y mayor volumen de esputo con menor esfuerzo tusígeno y de tipo no irritativo. Resultando en nuestro caso en una visible disminución de la presencia de tapones mucosos en la TC de tórax y refiriendo el paciente disminución del esfuerzo tusígeno.
Al prevenir el daño de la mucosa, disminuir la inflamación y las infecciones se enlentece el deterioro de la función pulmonar y se podrían mejorar la calidad de vida y la morbimortalidad.
Si bien no hay aún estudios a largo plazo se plantea el AFTH como una estrategia en el tratamiento de la fibrosis quística.
Conflicto de intereses: Los autores declaran no tener conflictos de interés con la industria.
1. Ong T, Ramsey BW. Update in cystic fibrosis 2014. Am J Respir Crit Care Med. 2015; 192: 669-75.
2. Stoltz DA, Meyerholz DK, Welsh MJ. Origins of cystic fibrosis lung disease. N Engl J Med. 2015;372: 351-62.
3. Grupo Registro Nacional de Fibrosis Quística. Registro Nacional de fibrosis Quística Argentina [Internet]. 2014. Available from: http://www.sap2.org.ar/newsletter/enviados/informe fq.pdf
4. Ma JT, Tang C, Kang L, Voynow JA, Rubin BK. Cystic Fibrosis Sputum Rheology Correlates With Both Acute and Longitudinal Changes in Lung Function. Chest. 2018; 154: 370-7.
5. Gotera C, Díaz Lobato S, Pinto T, Winck JC. Clinical evidence on high flow oxygen therapy and active humidification in adults. Rev Port Pneumol. 2013; 19: 217-27.
6. Nishimura M. High-flow nasal cannula oxygen therapy in adults. J Intens Care. 2015; 3: 15.
7. Rea H, McAuley S, Jayaram L, Garrett J, et al. The clinical utility of long-term humidification therapy in chronic airway disease. Respir Med. 2010; 104: 525-33.
8. Nishimura M. High-flow nasal cannula oxygen therapy in adults: Physiological benefits, indication, clinical benefits, and adverse effects. Respir Care. 2016; 61: 529-41.
9. Hasani A, Chapman TH, McCool D, Smith RE, Dilworth JP, Agnew JE. Domiciliary humidification improves lung mucociliary clearance in patients with bronchiectasis. Chron Respir Dis. 2008; 5: 81-6.
10. Storgaard LH, Hockey HU, Laursen BS, Weinreich UM. Long-term effects of oxygen-enriched high-flow nasal cannula treatment in copd patients with chronic hypoxemic respiratory failure. Int J COPD. 2018; 13: 1195-1205.
11. Nagata K, Kikuchi T, Horie T, et al. Domiciliary high-flow nasal cannula oxygen therapy for patients with stable hypercapnic chronic obstructive pulmonary disease a multicenter randomized crossover trial. Ann Am Thorac Soc. 2018; 15: 432-9.
12. Sottiaux TM. Consequences of Under- and Over-humidification. Respiratory Care Clinics of North America. 2006; 12: 233-52.
13. Serisier DJ, Carroll MP, Shute JK, Young SA. Macrorheology of cystic fibrosis, chronic obstructive pulmonary disease & normal sputum. Respir Res. 2009; 10: 63.
14. Rubin BK. Mucus structure and properties in cystic fibrosis. Paediatric Respiratory Reviews. 2007; 8: 4-7.
15. Goralski JL, Wu D, Thelin WR, Boucher RC, Button B. The in vitro effect of nebulised hypertonic saline on human bronchial epithelium. Eur Respir J. 2018: 51: 1702652.278