Autor : Di Tullio Fernando, Borsini Eduardo
Centro de Medicina Respiratoria, Hospital Británico de Buenos Aires. Unidad de Sueño y Ventilación. Hospital Británico de Buenos Aires
Correspondencia : Dirección postal: Fernando Di Tullio, Laboratorio Pulmonar, Hospital Británico de Buenos Aires, Perdriel 74, 1280 Buenos Aires, Argentina - E-mail: fer_dit@hotmail.com
Resumen
La posición del cuerpo influye en la frecuencia y duración de apneas e hipopneas en los individuos con apneas obstructivas del sueño. La posición en decúbito supino es en la que más frecuentemente se registran eventos obstructivos y por lo tanto mayores valores en los indicadores de severidad.
Aunque existen diferentes definiciones y clasificaciones, el síndrome de apneas del sueño posicional representa el 60% de todos los pacientes evaluados en una unidad de sueño, y su diferenciación tiene por objetivo determinar cuáles serán los candidatos que se beneficiarían de terapia posicional. Hasta el momento no hay una definición aceptada universalmente y la evidencia del beneficio clínico del rol de clasificar a los pacientes con apneas posicionales es aún controvertida en numerosos aspectos.
La terapia posicional se basa en disminuir el tiempo en supino y la severidad de los eventos obstructivos, herramienta de la que se beneficiaría una importante proporción de los pacientes. La CPAP es el tratamiento más eficaz y se recomienda en formas severas y moderadas con manifestaciones clínicas y antecedentes cardiovasculares. En este grupo la terapia posicional podría recomendarse como tratamiento coadyuvante.
Palabras clave: Síndrome de apneas del sueño; Posición corporal; Severidad.
Abstract
Body position during sleep time influences the frequency and duration of apneas and hypopneas in individuals who suffer from obstructive sleep apnea. Individuals in supine position show higher frequency of obstructive events and therefore, higher values in severity indexes.
Though there are different definitions and classifications, the positional sleep apnea syndrome represents 60% of all patients evaluated in a sleep unit, and differentiating it aims to determine which candidates will benefit from positional therapy. There is no universally accepted definition and the evidence of the clinical benefit of classifying patients with positional sleep apnea is still controversial in many aspects.
Positional therapy has the purpose of decreasing supine time and the severity of obstructive events. A significant proportion of patients would benefit from this treatment. The continuous positive airway pressure (CPAP) is the most effective treatment and is recommended for severe and moderate forms with clinical manifestations and cardiovascular history. In this group, positional therapy could be recommended as adjuvant treatment.
Key words: Sleep apnea syndrome; Body position; Severity.
Introducción
El síndrome de apneas e hipopneas obstructivas del sueño (SAHOS) se define como la presencia de períodos de cesación o reducción del flujo de aire durante el sueño acompañado por desaturación del oxígeno sanguíneo y/o microdespertares (arousals)1. Este trastorno es el resultado de una alteración de la anatomía (estrechamiento de la vía aérea) sumada a la atonía muscular que ocurre durante el sueño2. El SAHOS es la patología del sueño obstructiva más frecuente y está subdiagnosticada3, su prevalencia es variable dependiendo del punto de corte utilizado para su definición en los indicadores respiratorios, el método diagnóstico empleado y la población estudiada, ya que la prevalencia aumenta con; la edad, el sexo masculino y el sobrepeso u obesidad4, oscilando entre 1.2 a 71.9%1. La prevalencia de SAHOS definida por un índice de apneas e hipopneas (IAH) > 5 eventos por hora (ev/h) en población general de Latinoamérica se ha estimado en el 32.8% de los individuos4. La comunidad científica debe hallar estrategias pragmáticas para diagnosticar y tratar a un billón de personas con apneas del sueño alrededor del mundo5.
El SAHOS produce como consecuencias a corto plazo; excesiva somnolencia diurna y trastornos neurocognitivos debido a los microdespertares que determinan la pérdida de la arquitectura normal del sueño6. A largo plazo debido a la hipoxemia, aumento de la presión parcial de dióxido de carbono y daño endotelial se relaciona con hipertensión arterial7, isquemia cardíaca, arritmias, insuficiencia cardíaca8, accidente cerebro vascular1, síndrome metabólico9 e insulino-resistencia10, considerándose que esta enfermedad respiratoria del sueño es un factor de riesgo cardiovascular.
Una de las formas en la que se estima la severidad del SAHOS es mediante el índice de apneas e hipopneas (IAH), es decir; el número de eventos obstructivos registrados en un estudio de sueño dividido por las horas de sueño1. El documento de consenso vigente de la Asociación Argentina de Medicina Respiratoria sugiere una clasificación de severidad utilizando este índice y considera formas moderadas cuando se halla > 15 ev/h y severo cuando es > 30 ev/h1.
La posición del cuerpo durante el sueño influye en la frecuencia y duración de apneas e hipopneas en los individuos con SAHOS. La posición en decúbito supino es en la que más frecuentemente se registran eventos obstructivos y por lo tanto mayor IAH11.
Definición
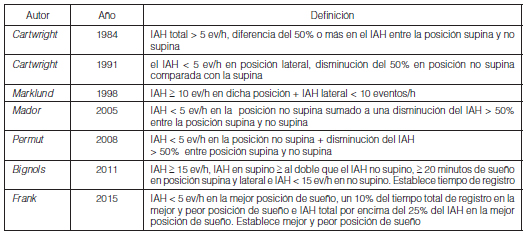
En 1984 Cartwright sugirió el término de SAHOS posicional (SAHOSP) para diferenciarlo del SAHOS no posicional (SAHOS-NP), es decir, discriminar aquellos pacientes en el que la severidad aumentaba significativamente durante la posición supina, con el objetivo de determinar cuáles serán los pacientes que se beneficiarían con terapia posicional11. Originalmente se describió que deberían tener un IAH total mayor a 5 eventos/hora (ev/h) y como punto de corte arbitrario, una diferencia del 50% o más en el IAH entre la posición supina y no supina (Figura 1 y 2). Posteriormente este grupo de trabajo ha sugerido un criterio más estricto en el que el IAH sea menor a 5 ev/h en posición lateral sumada a la disminución del 50% en posición no supina comparada con la supina, de esta manera, hay mayor probabilidad que se obtenga un mayor beneficio con la terapia posicional12.
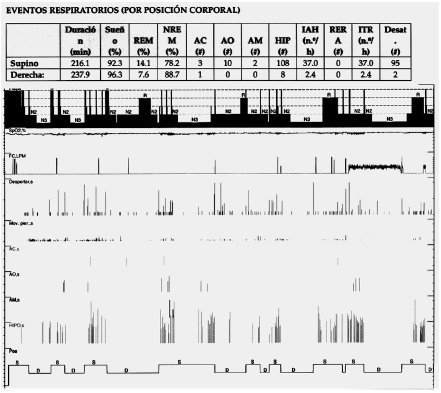
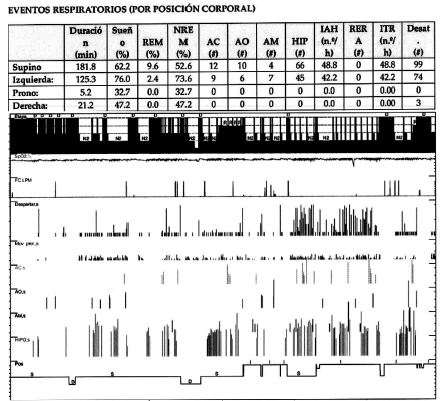
Pese a ser la definición más utilizada, han aparecido modificaciones en los criterios de Cartwrigth (Tabla 1). En 1998 Marklund y col. definieron los síndromes apneas obstructivas dependientes de posición supina como un IAH ≥ 10 ev/h en dicha posición, junto con un IAH lateral < 10 ev/h13. Los grupos de Mador y Permut definieron al SAHOSP como un IAH < 5 ev/h en la posición no supina sumado a una disminución del IAH > 50% entre la posición supina y no supina11, 14. Bignols y cols., definieron a los pacientes con SAHOSP según los siguientes criterios; IAH ≥ 15 ev/h, IAH en supino ≥ al doble que el IAH no supino, ≥ 20 minutos de sueño en posición supina y lateral e IAH < 15 ev/h en no supino, siendo este el primer autor en definir un tiempo mínimo de evaluación en cada posición15. La clasificación de SAHOSP de Ámsterdam propone una definición en términos de mejor y peor posición de sueño y determinan que el supino no necesariamente debe ser la peor posición (Figura 3). Sus criterios diagnósticos son los siguientes; IAH < 5 ev/h en la mejor posición de sueño, un 10% deltiempo total de registro en la mejor y peor posición de sueño e IAH global por encima del 25% del IAH en la mejor posición de sueño16.
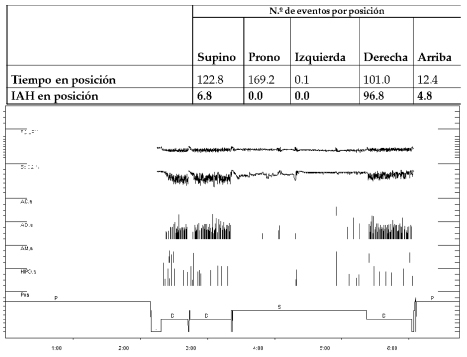
A partir de estas definiciones surge el término SAHOS predominantemente supino, en el cual IAH total es > 5 ev/h y el IAH en posición supina es dos veces mayor que en posición no supina. Finalmente, el SAHOS exclusivamente supino es aquel en el cual el IAH global es > 5 ev/h, el IAH en supino es el doble o más que en no supino y el IAH en no supino es < 5 ev/h (normal)17.
Hasta el momento no hay una definición aceptada universalmente de SAHOSP y la evidencia del beneficio clínico del rol de clasificar a los pacientes con apneas posicionales es aún controvertida en numerosos aspectos.
Prevalencia
La prevalencia de SAHOSP se encuentra entre un 50 al 60%2, 18, 19, mientras que la prevalencia de SAHOS exclusivamente posicional es del 20 al 35%11, 20, 21. La mayoría de los datos de prevalencia fueron obtenidos en estudios realizados en laboratorios de sueño con polisomnografía (PSG). En concordancia hemos hallado una prevalencia similar de alrededor del 50 al 60% de SAHOS posicional en pacientes estudiados con poligrafía respiratoria ambulatoria22.
Tiempo de registro en posición supina
El tiempo que pasa el paciente en una determinada posición durante un estudio de sueño es un determinante de la severidad evaluada mediante el IAH23. La mayoría de los estudios relacionados al SAHOSP establecen arbitrariamente que tiene que existir un tiempo mínimo en posición supina entre 15 y 30 min como criterio de inclusión11, 15, 19. Es importante aclarar que en las definiciones utilizadas para categorizar este síndrome no se tienen en cuenta las etapas del sueño. El IAH en posición supina aumenta durante la fase REM (rapid eye movement) comparado con el resto de las etapas del sueño24. De esta afirmación se puede interpretar si durante un estudio diagnóstico un paciente permanece la mayor parte del sueño REM en supino aumentará las posibilidades de ser clasificado como SAHOSP, aun cuando la relación del IAH entre supino y no supino en el sueño NREM (la mayor parte de la noche) sea menor al 50%. Debido a este fenómeno, se recomienda que el paciente sea estimulado para adoptar diferentes posiciones, incluyendo decúbito supino y no supino en etapa REM, cuando se realiza un estudio supervisado.
El tiempo en que un paciente con SAHOSP permanece en supino es similar al de los pacientes con SAHOS-NP encontrándose en alrededor del 40% del tiempo total de registro20, 21, 25. En la población sana26 esa proporción es de aproximadamente 30%. Llamativamente, la edad y el género no parecen ser determinantes del tiempo en que el paciente permanece en supino26.
Los estudios clínicos realizados con polisomnografía (PSG) inducen al paciente a dormir en supino entre 46-51% del tiempo total de registro27, por lo que este fenómeno aumentaría la severidad del SAHOS. Sin embargo, comunicaciones locales utilizando poligrafía respiratoria ambulatoria describen que el tiempo en supino corresponde al 45% del tiempo de registro, similar al hallado en los laboratorios de sueño22. Adicionalmente, los estudios simplificados subestiman el valor del IAH debido a que no permiten discriminar si el paciente está despierto o dormido y no permiten registrar los arousals10, y dificultando la comparación entre diferentes estrategias de diagnóstico.
Los valores de IAH varían noche a noche. Sin embargo, no hay variaciones significativas del IAH en una posición determinada o en las diferentes etapas de sueño, por lo que esta variación estaría determinada por el tiempo en que el paciente permanece en supino28.
Fisiopatología
Anatomía de la vía aérea
La porción más angosta de la vía aérea tanto en pacientes sanos como en pacientes con SAHOS es la orofaringe y la velofaringe29, 30. Los factores que contribuyen a disminuir el calibre de la vía aérea durante el sueño en sujetos con SAHOS son; la lengua, el paladar blando y las almohadillas de grasa laterales de la faringe31, 32. Debido a la propensión al colapso en posición supina durante el sueño, se han evaluado varios estudios que investigaron los efectos de la gravedad en las estructuras blandas en relación a las estructuras óseas como consecuencia de las diferentes posiciones. La literatura es contradictoria en cuanto al análisis de estos estudios17, no existiendo un patrón de colapso típico para los SAHOSP.
Los sujetos normales tienen una disminución significativa en el área de la faringe cuando pasan de la posición erguida a la posición supina, pero esto no ocurre cuando pasa del decúbito lateral al decúbito supino33. Cuando pacientes SAHOS no seleccionados rotan del decúbito lateral al supino, algunos
estudios demostraron un cambio significativo en el área de sección de la vía aérea mientras que otros no lo han hecho33,31. Esto podría explicarse debido a las diferencias metodológicas (pacientes anestesiados, estudios endoscópicos y estudios por imágenes). Safiruddin y cols., en un estudio prospectivo evaluaron a 100 pacientes con diagnóstico de SAHOS en los que se les realizo endoscopía durante el sueño (Drugs Induced Sleep Endoscopy), en posición lateral y en decúbito supino, evidenciando colapso a nivel del velo del paladar, base de la lengua y epiglotis, no habiendo encontrado diferencias entre la posición lateral derecha y la izquierda34.
Se ha demostrado que pacientes con SAHOSP presentan un volumen craneofacial relativamente menor en comparación con pacientes con SAHOS-NP agrupados por edad e índice de masa corporal (IMC) evaluados mediante reconstrucciones tridimensionales por resonancia magnética (RM). Esto se explica por la posición más retraída de la mandíbula y la relación entre las estructuras óseas que conforma el lumen de la vía aérea, pudiendo variar durante la flexión del cuello o durante la apertura de la mandíbula35, 36.
Influencia del volumen pulmonar
Los volúmenes pulmonares se reducen significativamente cuando aumenta el índice de masa corporal (IMC) y cuando se adopta la posición supina. Cuando un sujeto pasa de la posición de pie a la posición en decúbito dorsal hay una caída de la capacidad residual funcional (CRF)37, 38, capacidad pulmonar total (CPT), volumen de reserva espiratoria (VRE) y capacidad vital (CV) sin cambios en el volumen residual39. Pocos trabajos han evaluado el efecto del decúbito lateral en los volúmenes pulmonares, pero en sujetos normales la CRF y el VRE caen y la compliance dinámica pulmonar aumenta cuando se pasa de la posición lateral a la supina38, 40, 41.
En posición supina, la capacidad residual funcional cae en pacientes con sobrepeso y SAHOS42. El volumen de reserva espiratoria y la CRF disminuyen exponencialmente con el aumento del IMC sobre 25-30 kg/m2, que corresponde al IMC medio que se observa en pacientes con SAHOS posicional43, por lo que este trabajo sostiene una relación dependiente entre el IMC mayor a 30 kg/m2 y los volúmenes pulmonares.
Los cambios en los volúmenes pulmonares podrían ser secundarios a un aumento de la presión intrabdominal, lo que ha demostrado que influye en la CRF en paciente obesos anestesiados44. Por el contrario, la CRF no cae en obesos mórbidos (IMC > 40 kg/m2) cuando pasan de la posición de pie a la supina45. En estos pacientes la CRF y VRE están disminuidos en comparación con los valores de referencia en posición erguida, pero cambian menos comparados con controles no obesos cuando adoptan la posición supina46, mientras que los obesos mórbidos están respirando en el VR o cerca de este en la posición de pie. Cambios en los volúmenes pulmonares cuando al pasar del decúbito lateral al supino no han sido suficientemente estudiados17.
Algunos estudios han examinado los efectos en el cambio de los volúmenes pulmonares y su relación con la estabilidad de la vía aérea durante el sueño46, 47. Stanchina y cols. demostraron en 19 adultos jóvenes normales que una reducción de 600 ml al final del volumen espiratorio, aumenta el punto crítico de cierre faríngeo en 1.1 cm H2O y determina que la vía aérea se vuelva colapsable pese a un aumento en la activación del geniogloso47. Tagaito y cols. demostraron que el aumento en el volumen de fin de espiración en 750 ml reduce el punto crítico de cierre faríngeo en 1.2 cm H2O48. Stadler y cols., evidenciaron que el aumento de la presión intrabdominal durante el sueño (utilizando un manguito alrededor del abdomen) en obesos con una media de IMC de 34.5 kg/m2, produce una caída del volumen al final de la espiración de 530 ml y aumento en el punto crítico de cierre faríngeo en 1.4 cm H2O49. Así demostraron la interacción entre el aumento del IMC, disminución de volúmenes pulmonares y aumento de la colapsabilidad de la vía aérea superior.
Hasta el momento no hay estudios que comparen los cambios del volumen al final de la espiración y el punto crítico de cierre faríngeo en el SAHOS en general o en fenotipos seleccionados como el SAHOS posicional.
Función de los músculos dilatadores de la vía aérea
El geniogloso es uno de los principales músculos dilatadores de la vía aérea. Los pacientes con SAHOS tienen un aumento de la actividad de este músculo, que probablemente se deba a lo ya expuesto: forma de la luz de la vía aérea desfavorable y reducción de volúmenes pulmonares con consecuente aumento de punto crítico de cierre faríngeo50. La actividad de este músculo decrece con el comienzo del sueño y subsiguientes activaciones durante el sueño son protectoras frente a eventos obstructivos. La variable actividad de este músculo durante el sueño ayuda a explicar por qué algunos pacientes experimentan eventos obstructivos en diferentes momentos de la noche51.
La actividad del geniogloso aumenta en la posición supina para proteger la vía aérea cuando se está en la posición más vulnerable con aumento al máximo del calibre de la vía aérea. El mecanismo por el cual se activa el geniogloso en posición supina no está aclarado. La actividad de este músculo es mayor en supino comparado con la posición erguida y lateral en sujetos normales y con diagnóstico de SAHOS52-54. La magnitud de su respuesta compensadora no ha sido cuantificada en pacientes con SAHOS posicional en comparación con otros pacientes SAHOS-NP17. Tampoco se conoce con detalle si la respuesta del geniogloso está atenuada en pacientes con SAHOSP cuando se encuentran en posición supina comparados con SAHOS-NP52-54.
Características clínicas del síndrome posicional
Los principales factores de riesgo asociados al desarrollo de SAHOS son la obesidad, el sexo masculino, el incremento de la edad, la menopausia, las alteraciones de la anatomía craneofacial y del cuello, el hipotiroidismo, los antecedentes familiares de ronquidos y SAHOS y el uso de drogas con efecto relajante muscular, así como el consumo de tabaco y alcohol55.
Las manifestaciones clínicas relacionadas al síndrome de apneas e hipopneas obstructivas durante el sueño son consecuencia de las apneas, hipopneas y episodios de hipoxia intermitentes, y por otro lado, a la pérdida de la arquitectura normal del sueño55, 56.
El SAHOSP es más frecuente en hombres con una relación hombre-mujer de 11.1:1 para formas severas, mientras que para las formas leves o moderadas la relación es de 2.6:120, 56.
Los pacientes con SAHOSP tienen menor IMC en comparación con los SAHOS-NP. Éste se encuentra en un rango entre 30.3 ± 0.9 vs. 35.3 ± 1.0 kg/m2 (p < 0.0001)17, 18, 22 y suelen ser más jóvenes17, 18, aunque no todos los estudios han informado esta diferencia; edad promedio de 49.7 ± 1.3 vs. 52.5 ± 1.5 años (p = 0.1)22.
Al igual que en el SAHOS clásico, los pacientes con SAHOSP consultan frecuentemente por ronquido, aunque característicamente suele empeorar en posición supina17. Con respecto a la somnolencia diurna medida en forma subjetiva por el cuestionario de Epworth57, algunos trabajos comunican que el SAHOSP presenta síntomas de mayor jerarquía que el SAHOS-NP20, mientras que otros no han demostrado diferencias11, 22. Utilizando test de latencia múltiple se ha demostrado una menor somnolencia en SAHOSP. Habitualmente las formas no posicionales suelen ser más severas lo que explicaría la mayor somnolencia18.
En lo que respecta a los datos del estudio de sueño, los eventos obstructivos observados en la PSG son más severos (mayor grado de desaturación de oxígeno y mayor duración) en la posición supina en pacientes con SAHOS-NP58. Los SAHOSP suelen tener menor IAH, índice de desaturaciones (IDO), menor desaturación nocturna y la proporción de formas severas de la enfermedad es mayor en el grupo no posicional16, 22.
Tratamiento del síndrome posicional
El enfoque terapéutico del SAHOSP puede ser dividido en dos categorías: tratamiento dirigido al manejo del SAHOS en general y tratamiento específico destinado a evitar la posición supina17.
Evitación o reducción de la posición supina
Estas terapias tienen el objetivo evitar la posición supina por lo que mejoraría el IAH especialmente en pacientes en los cuales el IAH es normal en posición lateral. Múltiples técnicas han demostrado reducir el tiempo en supino, mejorar el IAH, el IDO, la oxigenación durante la noche, calidad de vida y somnolencia59.
La técnica de la pelota de tenis (TPT) está descripta como una técnica relativamente simple que consiste en colocar una bola de tenis en la espalda con una manga, bolsillo o un cinturón, con el objetivo de generar disconfort cuando el paciente gira en la cama hacia la posición supina, llevándolo a rotar nuevamente a una posición lateral. Oksenberg y cols. demostraron en 12 pacientes con SAHOSP una reducción del 79% al 12.3% del tiempo en posición supina acompañado de disminución del IAH58 de 46.5 ev/h a 17.5 ev/h. Este mismo grupo de trabajo utilizó la misma técnica para evitar la posición en supino por 6 meses en 78 pacientes consecutivos con SAHOSP y evaluaron los resultados mediante un cuestionario, encontrando que únicamente el 38% continuaba utilizando esta técnica con alta tasa de abandonos debido a incomodidad60.
Bignold y cols. realizaron en un seguimiento a 2.5 años con el objetivo de evaluar adherencia al tratamiento con la TPT; únicamente el 6% lo continuaba utilizando y el motivo más frecuente de abandono fue la incomodidad referida, concluyendo que si bien es una técnica simple de implementar y económica, pierde adherencia con el tiempo61.
Heinzer y cols. realizaron un estudio de 3 meses de seguimiento con 16 pacientes con SAHOSP que no toleraban el tratamiento con CPAP. En estos pacientes se colocó un dispositivo alrededor del tórax con aun actígrafo (sensor de movimiento y almacenamiento de datos) incorporado que hacía la posición supina incómoda. Los autores evidenciaron una disminución del IAH en comparación con el estudio diagnóstico de 26.7 ± 17.5 a 6.0 ± 3.4 ev/h, asociado a reducción del IDO de 18.4 ± 11.1 a 7.1 ± 5.7 ev/h y del tiempo en supino de 42.8 ± 26.2% a 5.8 ± 7.2% del tiempo de registro. También se evidenció disminución en la escala de Epworth de 9.4 ± 4.5 a 6.6 ± 4.7 con una adherencia del 73% a los 3 meses62.
Recientemente se han desarrollado dispositivos vibratorios que se colocan en el cuello o en el tórax que se activan cuando el paciente adopta la posición supina, generando que el paciente rote hacia un lateral y disminuyendo el tiempo en decúbito dorsal. Estos métodos reducen el tiempo en supino, el IAH y la somnolencia diurna subjetiva. Sin embargo la mayoría de estos estudios no han sido comparados con grupos control, participaron un escaso número de pacientes y por el momento no hay datos que evalúen adherencia a largo plazo15, 62, 63. Un ejemplo es el estudio realizado por Van Maanen y cols. en el que evaluaron en 145 pacientes a 6 meses (mediano plazo), los resultados de un dispositivo vibrador como terapia posicional y encontraron disminución del tiempo en posición supina, mejoría de la somnolencia diurna y mejoría en la calidad de vida en pacientes con SAHOSP moderados a severos, con una adherencia del 64% definida como el uso de 4 horas diarias63.
En pacientes con SAHOSP con anatomía favorable para el uso de dispositivos intraorales (adelantamiento mandibular), la aplicación de ambos tratamientos adicionados a la pérdida de peso han sido sugeridas como opción terapéutica, incluso en quienes no toleran la CPAP64.
Uno de los principales limitantes del uso de las terapias posicionales en la práctica clínica es la falta de herramientas validadas para medir la adherencia en forma objetiva. Tampoco existen guías aceptadas universalmente que determinen si estas terapias posicionales pueden ser utilizadas en como única terapia o como adyuvante de otros tratamientos65.
Tratamiento con presión positiva continua en la vía aérea (CPAP)
El CPAP es el tratamiento de elección para los pacientes con diagnóstico de SAHOS y su eficacia es superior a otras terapias. Demostró suprimir los eventos obstructivos respiratorios, corregir las desaturaciones y los ronquidos, mejorar la calidad del sueño, la somnolencia diurna, la calidad de vida y el deterioro cognitivo y reducir el riesgo de accidentes de tránsito, laborales, complicaciones cardiovasculares y la mortalidad relacionada al SAHOS55.
La indicación del tratamiento con CPAP66-69 se reserva para el SAHOS de grado moderado (IAH ≥ 15 y < 30 ev/h), SAHOS leve (IAH entre 5 y 14.9 ev/h) asociado a somnolencia diurna excesiva y/o
deterioro cognitivo y/o comorbilidades cardiovasculares o cerebrovasculares y en los SAHOS severos (IAH ≥ 30 ev/h). Estas recomendaciones basadas en el IAH no toman en cuenta la posición corporal.
Skinner y cols. realizaron un estudio en el que se comparó terapia posicional (TP) en contraposición al tratamiento con CPAP en 20 pacientes con SAHOSP de grado leve a moderado. Si bien no hubo diferencias en la somnolencia subjetiva, medida por el cuestionario de Epworth, la CPAP fue más efectiva en reducir el IAH con una media de 22.9 ev/h y reducción a 4.9 ev/h con CPAP comparado con 12.0 ev/h con terapia posicional70.
Permmut y cols. compararon la efectividad de la TP contra el CPAP en 35 SAHOSP leve a moderado con IAH < 5 evento/h en posición no supina (posicional exclusivo) divididos aleatoriamente en dos ramas, y concluyeron que las dos terapias son igualmente efectivas en normalizar el IAH con efectos similares en la oxigenación nocturna y calidad de sueño medido por cuestionarios14.
Un meta-análisis realizado por Stanley y col. evaluó 3 estudios que incluyeron 71 pacientes divididos en forma aleatoria a recibir TP o terapia con CPAP y observaron que el IAH fue menor para el grupo de CPAP, la oxigenación durante la noche fue menor en el grupo de TP, sin encontrar diferencias significativas entre la eficacia del sueño, tiempo de sueño e índice de microdespertares Así concluyeron que la terapia con CPAP fue superior a la TP71.
Otras terapias que han probado utilidad en los pacientes con SAHOSP son los dispositivos intraorales72, 73. El mecanismo por el cual se logra mejoría se debe a que estos dispositivos mejoran la forma de la vía aérea a nivel de la velofaringe y aumentan la actividad del geniogloso74. La pérdida de peso es beneficiosa para todos los pacientes con SAHOS al reducir el IAH, sin embargo, no se ha analizado el efecto de la pérdida de peso en los eventos obstructivos en la posición supina75.
Conclusiones
Aunque existen diferentes definiciones y clasificaciones, el SAHOSP representa el 60% de todos los pacientes con apneas obstructivas del sueño, y su diferenciación tiene por objetivo determinar cuáles serán los candidatos que se beneficiarían de terapia posicional.
La terapia posicional se basa en disminuir el tiempo en supino y por ende la severidad, herramienta de la que se beneficiara una importante proporción de pacientes.
La CPAP es el tratamiento más eficaz y se recomienda en formas severas y moderadas con manifestaciones clínicas o antecedentes cardiovasculares. En este grupo la terapia posicional podría recomendarse como tratamiento coadyuvante.
Conflictos de intereses: Los autores declaran no tener conflictos de interés en el tema relacionado al manuscrito.
Este trabajo fue llevado a cabo sin financiación.
1. Nogueira F, Borsini E, Cambursano H, et al. Guías prácticas de diagnóstico y tratamiento del síndrome de apneas e hipopneas obstructivas del sueño: Actualización 2019: Sección Sueño, Oxigenoterapia y Tratamientos Crónicos Domiciliarios. Asociación Argentina de Medicina Respiratoria. Rev Am Med Respir. 2019; 19: 59-90.
2. Richard W, Kox D, den Herden C, Laman M, de Vries N, et al. The role of sleep position in obstructive sleep apnea syndrome. Eur. Arch. Otorhinolaryngol. 2006; 263:946-50. doi:10.1007/s00405-006-0090-2
3. Young T, Peppard PE, Gottlie DJ. Epidemiology of Obstructive Sleep Apnea: A Population Health Perspective. Am J Respir Crit Care Med 2002; 165:1217-39. doi:10.1164/rccm.2109080
4. Tufik S, Santos-Silva R, Taddei JA, Bittencourt LR. Obstructive Sleep Apnea Syndrome in the Sao Paulo Epidemiologic Sleep Study. Sleep Med. 2010; 11: 441-6. doi:10.1016/j.sleep.2009.10.005
5. Benjafield AV, Ayas NT, Eastwood PR, et al. Estimation of the global prevalence and burden of obstructive sleep apnoea: a literature-based analysis. Lancet Respir Med. 2019; 7: 687-98.
6. Peppard PE, Szklo-Coxe M, Hla KM. Longitudinal association of sleep-related breathing disorder and depression. Arch Intern Med 2006; 166:1709-15. doi:10.1001/archinte.166.16.1709
7. Nieto FJ, Young TB, Lind BK, et al. Association of sleep-disordered breathing, sleep apnea, and hypertension in a large community-based study. Sleep Heart Health Study [published correction appears in JAMA 2002; 288(16): 1985]. JAMA. 2000; 283(14): 1829-36. doi:10.1001/jama.283.14.1829
8. Shamsuzzaman AS, Gersh BJ, Somers VK. Obstructive sleep apnea: implications for cardiac and vascular disease. JAMA. 2003;290(14): 1906-14. doi:10.1001/jama.290.14.1906.
9. Coughlin SR, Mawdsley L, Mugarza JA, Calverley PM, Wilding JP. Obstructive sleep apnoea is independently associated with an increased prevalence of metabolic syndrome. Eur Heart J. 2004; 25(9): 735-41. doi:10.1016/j.ehj.2004.02.021
10. Araújo Lda S, Fernandes JF, Klein MR, Sanjuliani AF. Obstructive sleep apnea is independently associated with inflammation and insulin resistance, but not with blood pressure, plasma catecholamines, and endothelial function in obese subjects. Nutrition. 2015; 31(11-12): 1351-7. doi:10.1016/j.nut.2015.05.017
11. Mador MJ, Kufel TJ, Magalang UJ, Rajesh SK, Watwe V, Grant BJ. Prevalence of positional sleep apnea in patients undergoing polysomnography. Chest. 2005; 128(4): 2130-7. doi:10.1378/chest.128.4.2130
12. Cartwright RD, Diaz F, Lloyd S. The effects of sleep posture and sleep stage on apnea frequency. Sleep. 1991; 14(4): 351-3. doi:10.1093/sleep/14.4.351
13. Marklund M, Persson M, Franklin KA. Treatment success with a mandibular advancement device is related to supine-dependent sleep apnea. Chest. 1998; 114(6): 1630-5. doi:10.1378/chest.114.6.1630
14. Permut I. Comparison of a new positional device to CPAP therapy in patients with positional obstructive sleep apnea [Abstract]. Sleep 2008.
15. Bignold JJ, Mercer JD, Antic NA, McEvoy RD, Catcheside PG. Accurate position monitoring and improved supine-dependent obstructive sleep apnea with a new position recording and supine avoidance device. J Clin Sleep Med. 2011; 7(4): 376-83. doi:10.5664/JCSM.1194
16. Frank MH, Ravesloot MJ, van Maanen JP, Verhagen E, de Lange J, de Vries N. Positional OSA part 1: Towards a clinical classification system for position-dependent obstructive sleep apnoea. Sleep Breath. 2015; 19(2): 473-80. doi:10.1007/s11325- 014-1022-9.
17. Joosten SA, O’Driscoll DM, Berger PJ, Hamilton GS. Supine position related obstructive sleep apnea in adults: pathogenesis and treatment. Sleep Med Rev. 2014; 18(1): 7-17. doi:10.1016/j.smrv.2013.01.005
18. Oksenberg A, Silverberg DS, Arons E, Radwan H. Positional vs nonpositional obstructive sleep apnea patients: anthropomorphic, nocturnal polysomnographic, and multiple sleep latency test data. Chest. 1997; 112(3): 629-39. doi:10.1378/ chest.112.3.629
19. Young T, Palta M, Dempsey J, Skatrud J, Weber S, Badr S. The occurrence of sleep-disordered breathing among middle-aged adults. N Engl J Med. 1993; 328(17): 1230-5. doi:10.1056/NEJM199304293281704
20. Joosten SA, Hamza K, Sands S, Turton A, Berger P, Hamilton G. Phenotypes of patients with mild to moderate obstructive sleep apnoea as confirmed by cluster analysis. Respirology. 2012; 17(1): 99-107. doi:10.1111/j.1440-1843.2011.02037.x
21. Gillman A, Roebuck T, Ho S, van Braak E, Naughton MT. Comparison of supine-only and REM-only obstructive sleep apnoea. Sleep Med. 2012; 13(7): 875-78. doi:10.1016/j.sleep.2012.01.016
22. Di-Tullio F, Ernst G, Robaina G, et al. Ambulatory positional obstructive sleep apnea syndrome. Sleep Sci. 2018;11(1):8-11. doi:10.5935/1984-0063.20180003
23. Eiseman NA, Westover MB, Ellenbogen JM, Bianchi MT. The impact of body posture and sleep stages on sleep apnea severity in adults. J Clin Sleep Med. 2012; 8(6): 655-66A. Published 2012 Dec 15. doi:10.5664/jcsm.2258
24. Oksenberg A, Arons E, Nasser K, Vander T, Radwan H. REM-related obstructive sleep apnea: the effect of body position. J Clin Sleep Med. 2010; 6(4): 343-8.
25. Pevernagie DA, Shepard JW Jr. Relations between sleep stage, posture and effective nasal CPAP levels in OSA. Sleep. 1992; 15(2): 162-7. doi:10.1093/sleep/15.2.162
26. De Koninck J, Lorrain D, Gagnon P. Sleep positions and position shifts in five age groups: an ontogenetic picture. Sleep. 1992; 15(2): 143-9. doi:10.1093/sleep/15.2.143
27. Metersky ML, Castriotta RJ. The effect of polysomnography on sleep position: possible implications on the diagnosis of positional obstructive sleep apnea. Respiration. 1996; 63(5): 283-7. doi:10.1159/000196561
28. Bittencourt LR, Suchecki D, Tufik S, et al. The variability of the apnoea-hypopnoea index. J Sleep Res. 2001;10(3):245-251. doi:10.1046/j.1365-2869.2001.00255.x
29. Schwab RJ, Gupta KB, Gefter WB, Metzger LJ, Hoffman EA, Pack AI. Upper airway and soft tissue anatomy in normal subjects and patients with sleep-disordered breathing. Significance of the lateral pharyngeal walls. Am J Respir Crit Care Med. 1995; 152(5 Pt 1): 1673-89. doi:10.1164/ajrccm.152.5.7582313
30. Ciscar MA, Juan G, Martínez V, et al. Magnetic resonance imaging of the pharynx in OSA patients and healthy subjects. Eur Respir J. 2001; 17(1): 79-86. doi:10.1183/09031936.01.17100790
31. Isono S, Tanaka A, Nishino T. Lateral position decreases collapsibility of the passive pharynx in patients with obstructive sleep apnea. Anesthesiology. 2002; 97(4): 780-5. doi:10.1097/00000542-200210000-00006
32. Schwab RJ, Pasirstein M, Pierson R, et al. Identification of upper airway anatomic risk factors for obstructive sleep apnea with volumetric magnetic resonance imaging. Am J Respir Crit Care Med. 2003; 168(5): 522-30. doi:10.1164/rccm.200208- 866OC
33. Jan MA, Marshall I, Douglas NJ. Effect of posture on upper airway dimensions in normal human. Am J Respir Crit Care Med. 1994; 149(1): 145-8. doi:10.1164/ajrccm.149.1.8111573
34. Safiruddin F, Koutsourelakis I, de Vries N. Analysis of the influence of head rotation during drug-induced sleep endoscopy in obstructive sleep apnea. Laryngoscope. 2014; 124(9): 2195-9. doi:10.1002/lary.24598
35. Saigusa H, Suzuki M, Higurashi N, Kodera K. Three-dimensional morphological analyses of positional dependence in patients with obstructive sleep apnea syndrome. Anesthesiology. 2009; 110(4): 885-90. doi:10.1097/ALN.0b013e31819b5d57
36. Ono T, Lowe AA, Ferguson KA, Fleetham JA. Associations among upper airway structure, body position, and obesity in skeletal Class I male patients with obstructive sleep apnea. Am J Orthod Dentofacial Orthop. 1996; 109(6): 625-34. doi:10.1016/ s0889-5406(96)70074-4
37. Ibáñez Juvé J, García Moris S, Marsé Milla P, et al. Diferencias en la función pulmonar de sujetos sanos secundarias al cambio postural [Pulmonary function differences in healthy subjects according to postural changes (author’s transl)]. Med Clin (Barc). 1979; 73(4): 149-52.
38. Behrakis PK, Baydur A, Jaeger MJ, Milic-Emili J. Lung mechanics in sitting and horizontal body positions. Chest. 1983; 83(4): 643-6. doi:10.1378/chest.83.4.643
39. Navajas D, Farre R, Rotger MM, Milic-Emili J, Sanchis J. Effect of body posture on respiratory impedance. J Appl Physiol (1985). 1988; 64(1): 194-9. doi:10.1152/jappl.1988.64.1.194
40. Tanskanen P, Kyttä J, Randell T. The effect of patient positioning on dynamic lung compliance. Acta Anaesthesiol Scand. 1997; 41(5): 602-6. doi:10.1111/j.1399-6576.1997.tb04750.x
41. Barnas GM, Campbell DN, Mackenzie CF, et al. Lung, chest wall, and total respiratory system resistances and elastances in the normal range of breathing. Am Rev Respir Dis. 1992; 145(1): 110-3. doi:10.1164/ajrccm/145.1.110
42. Shore ET, Millman RP. Abnormalities in the flow-volume loop in obstructive sleep apnoea sitting and supine. Thorax. 1984; 39(10): 775-9. doi:10.1136/thx.39.10.775
43. Jones RL, Nzekwu MM. The effects of body mass index on lung volumes. Chest. 2006; 130(3): P827-833. doi:10.1378/ chest.130.3.827
44. Pelosi P, Croci M, Ravagnan I, et al. Respiratory system mechanics in sedated, paralyzed, morbidly obese patients. J Appl Physiol (1985). 1997; 82(3): 811-8. doi:10.1152/jappl.1997.82.3.811
45. Watson RA, Pride NB. Postural changes in lung volumes and respiratory resistance in subjects with obesity. J Appl Physiol (1985). 2005; 98(2): 512-7. doi:10.1152/japplphysiol.00430.2004
46. Squier SB, Patil SP, Schneider H, Kirkness JP, Smith PL, Schwartz AR. Effect of end-expiratory lung volume on upper airway collapsibility in sleeping men and women. J Appl Physiol (1985). 2010; 109(4): 977-85. doi:10.1152/japplphysiol.00080.2010
47. Stanchina ML, Malhotra A, Fogel RB, et al. The influence of lung volume on pharyngeal mechanics, collapsibility, and genioglossus muscle activation during sleep. Sleep. 2003; 26(7): 851-6. doi:10.1093/sleep/26.7.851
48. Tagaito Y, Isono S, Remmers JE, Tanaka A, Nishino T. Lung volume and collapsibility of the passive pharynx in patients with sleep-disordered breathing. J Appl Physiol (1985). 2007; 103(4): 1379-85. doi:10.1152/japplphysiol.00026.2007
49. Stadler DL, McEvoy RD, Sprecher KE, et al. Abdominal compression increases upper airway collapsibility during sleep in obese male obstructive sleep apnea patients. Sleep. 2009; 32(12): 1579-87. doi:10.1093/sleep/32.12.1579
50. Mezzanotte WS, Tangel DJ, White DP. Waking genioglossal electromyogram in sleep apnea patients versus normal controls (a neuromuscular compensatory mechanism). J Clin Invest. 1992; 89(5): 1571-9. doi:10.1172/JCI115751
51. Younes M. Contributions of upper airway mechanics and control mechanisms to severity of obstructive apnea. Am J Respir Crit Care Med. 2003; 168(6): 645-58. doi:10.1164/rccm.200302-201OC
52. Takahashi S, Ono T, Ishiwata Y, Kuroda T. Effect of changes in the breathing mode and body position on tongue pressure with respiratory-related oscillations. Am J Orthod Dentofacial Orthop. 1999; 115(3): 239-46. doi:10.1016/S0889-5406(99)70324-0
53. Otsuka R, Ono T, Ishiwata Y, Kuroda T. Respiratory-related genioglossus electromyographic activity in response to head rotation and changes in body position. Angle Orthod. 2000; 70(1): 63-9. doi:10.1043/0003-3219(2000)070<0063:RRGEAI> 2.0.CO;2
54. Malhotra A, Trinder J, Fogel R, et al. Postural effects on pharyngeal protective reflex mechanisms. Sleep. 2004; 27(6): 1105- 12. doi:10.1093/sleep/27.6.1105
55. Nogueira F, Nigro C, Cambursano H, Borsini E, Silio J, Avila J. Guías prácticas de diagnóstico y tratamiento del síndrome de apneas e hipopneas obstructivas del sueño [Practical guidelines for the diagnosis and treatment of obstructive sleep apnea syndrome]. Medicina (B Aires). 2013; 73(4): 349-62.
56. O’Connor C, Thornley KS, Hanly PJ. Gender differences in the polysomnographic features of obstructive sleep apnea. Am J Respir Crit Care Med. 2000; 161(5):465-72. doi:10.1164/ajrccm.161.5.9904121
57. Johns MW. Daytime sleepiness, snoring, and obstructive sleep apnea. The Epworth Sleepiness Scale. Chest. 1993; 103(1): 30-6. doi:10.1378/chest.103.1.30
58. Oksenberg A, Khamaysi I, Silverberg DS, Tarasiuk A. Association of body position with severity of apneic events in patients with severe nonpositional obstructive sleep apnea. Chest. 2000; 118(4): 1018-24. doi:10.1378/chest.118.4.1018
59. Jackson M, Collins A, Berlowitz D, Howard M, O’Donoghue F, Barnes M. Efficacy of sleep position modification to treat positional obstructive sleep apnea. Sleep Med. 2015; 16(4): 545-52. doi:10.1016/j.sleep.2015.01.008
60. Oksenberg A, Silverberg D, Offenbach D, Arons E. Positional therapy for obstructive sleep apnea patients: A 6-month follow-up study. Laryngoscope. 2006; 116(11): 1995-2000. doi:10.1097/01.mlg.0000237674.66716.a7
61. Bignold JJ, Deans-Costi G, Goldsworthy MR, et al. Poor long-term patient compliance with the tennis ball technique for treating positional obstructive sleep apnea. J Clin Sleep Med. 2009; 5(5):428-30.
62. Heinzer RC, Pellaton C, Rey V, et al. Positional therapy for obstructive sleep apnea: an objective measurement of patients’ usage and efficacy at home. Sleep Med. 2012; 13(4): 425-8. doi:10.1016/j.sleep.2011.11.004
63. van Maanen JP, Meester KA, Dun LN, et al. The sleep position trainer: a new treatment for positional obstructive sleep apnoea. Sleep Breath. 2013; 17(2): 771-9. doi:10.1007/s11325-012-0764-5
64. Ramar K, Dort LC, Katz SG, et al. Clinical Practice Guideline for the Treatment of Obstructive Sleep Apnea and Snoring with Oral Appliance Therapy: An Update for 2015. J Clin Sleep Med. 2015; 11(7): 773-827. Published 2015 Jul 15. doi:10.5664/jcsm.4858
65. Omobomi O, Quan SF. Positional therapy in the management of positional obstructive sleep apnea-a review of the current literature. Sleep Breath. 2018; 22(2): 297-304. doi:10.1007/s11325-017-1561-y
66. Quintano Jimenez JA. Consenso nacional sobre el síndrome de apneas-hipopneas durante el sueño. Semergen 2007; 33(1): 17-20. doi:10.1016/S1138-3593(07)73838-8
67. Fleetham J, Ayas N, Bradley D, et al. Canadian Thoracic Society 2011 guideline update: diagnosis and treatment of sleep disordered breathing. Can Respir J. 2011; 18(1): 25-47. doi:10.1155/2011/506189
68. Chai CL, Pathinathan A, Smith B. Continuous positive airway pressure delivery interfaces for obstructive sleep apnoea. Cochrane Database Syst Rev. 2006; (4): CD005308. Published 2006 Oct 18. doi:10.1002/14651858.CD005308.pub2
69. Loube DI, Gay PC, Strohl KP, Pack AI, White DP, Collop NA. Indications for positive airway pressure treatment of adult obstructive sleep apnea patients: a consensus statement. Chest. 1999; 115(3): 863-6. doi:10.1378/chest.115.3.863
70. Skinner MA, Kingshott RN, Filsell S, Taylor DR. Efficacy of the ‘tennis ball technique’ versus nCPAP in the management of position-dependent obstructive sleep apnoea syndrome. Respirology. 2008; 13(5): 708-15. doi:10.1111/j.1440-1843.2008.01328.x
71. Ha SC, Hirai HW, Tsoi KK. Comparison of positional therapy versus continuous positive airway pressure in patients with positional obstructive sleep apnea: a meta-analysis of randomized trials. Sleep Med Rev. 2014; 18(1): 19-24. doi:10.1016/j. smrv.2013.05.003
72. Itasaka Y, Miyazaki S, Tada H, Ishikawa K, Togawa K. Effectiveness of prosthetic mandibular advancement for obstructive sleep apnea: analysis by sleep position. Psychiatry Clin Neurosci. 1998; 52(2): 225-7. doi:10.1111/j.1440-1819.1998.tb01044.x
73. Yoshida K. Influence of sleep posture on response to oral appliance therapy for sleep apnea syndrome. Sleep. 2001; 24(5): 538-44. doi:10.1093/sleep/24.5.538
74. Gale DJ, Sawyer RH, Woodcock A, Stone P, Thompson R, O’Brien K. Do oral appliances enlarge the airway in patients with obstructive sleep apnoea? A prospective computerized tomographic study. Eur J Orthod. 2000; 22(2): 159-68. doi:10.1093/ ejo/22.2.159
75. Kansanen M, Vanninen E, Tuunainen A, et al. The effect of a very low-calorie diet-induced weight loss on the severity of obstructive sleep apnoea and autonomic nervous function in obese patients with obstructive sleep apnoea syndrome. Clin Physiol. 1998; 18(4): 377-85. doi:10.1046/j.1365-2281.1998.00114.x