Autor : Marco Antonio GarcĂa Choque
Servicio de broncoscopĂa, Instituto Nacional de TĂłrax, La Paz- Bolivia
Correspondencia : E-mail: marcoantoniogar@hotmail.com
Resumen
La leishmaniasis mucocutánea tiene una presentación relativamente frecuente en las zonas tropicales de Bolivia. Coexiste con otra enfermedad endémica de la zona: la tuberculosis. Esta también afecta frecuentemente la vía aérea superior. Ambas pueden ser confundidas, por tanto el tratamiento también podría ser erróneo. Presentamos un caso de leishmaniasis con características de afectación propia a la tuberculosis.
Palabras clave: Leishmaniasis mucocutánea; Úlcera tropical; Espundia
Abstract
Leishmaniasis with Involvement of Upper and Lower Airways without Skin Lesions
Mucocutaneous leishmaniasis is relatively frequent in the tropical regions of Bolivia. It coexists with another endemic disease of the region: tuberculosis. Tuberculosis frequently affects the upper airways, too. Leishmaniasis may be confused with tuberculosis, thus, its treatment can be erroneous. We report a case of leishmaniasis whose involvement profle is typical of tuberculosis.
Key words: Mucocutaneous leishmaniasis; Tropical ulcer; Espundia
Introducción
Veintiún especies de leishmania han sido identificadas como patógenos humanos. Se clasifican
sistemáticamente en cuatro complejos. Dos complejos de especies de leishmania del Nuevo Mundo
están constituidos por complejo L. mexicana (que
contiene también L. amazonensis) y complejo L.
brazilensis (que contiene L. panamensis y L. guyanensis), mientras que los dos complejos del Viejo
Mundo leishmania son complejo L. principal (que
contiene L. trópica) y complejo L. donovani (que
contiene también L. infantum, incluso conocido
como L. chagasi)16-17.
A nivel mundial, más de 12 millones de personas están infectadas por la leishmaniasis y 350
millones están en riesgo. La leishmaniasis es, en
general, endémica en 98 países y territorios, y es
responsable de una carga de la enfermedad de
2,35 millones de AVAD (años de vida ajustados
por discapacidad), de los cuales 2,3% ocurren en
las américas. Se estima que el 75% de todos los casos de leishmaniasis cutánea se concentran en 10
países, cuatro de los cuales están en las américas:
Brasil, Colombia, Perú y Nicaragua. Quince de las
22 especies de leishmania que causan enfermedades
en los seres humanos se han identificado en las
américas y 54 especies diferentes de vectores están
potencialmente implicadas en su transmisión. En
las américas, se diagnostica cada año un promedio
de 60.000 casos de leishmaniasis cutánea y de mucosa, y 4.000 casos de leishmaniasis visceral, con
una tasa de mortalidad del 7%. (Fig. 1)
En Bolivia, hasta la fecha, se ha podido certificar
que circulan 4 especies parasitarias de leishmaniasis:
leishmania (V) braziliensis; leishmania (L) amazonensis; leishmania (L) chagasi y L. (V) lainsoni.
La primera especie es agente de la leishmaniasis
cutáneo mucosa (LCM); la segunda de leishmania
cutánea (LC) y leishmania cutáneo difusa (LCD).
Estas dos especies tienen un claro predominio en los índices epidemiológicos nacionales para la enfermedad; la tercera es agente de leishmaniasis visceral
(LV) y la cuarta produce raros casos de leishmaniasis cutánea (LC), estas dos últimas especies generan
casos clínicos esporádicos3, 4.
En Latinoamérica, el 90% de los casos de leishmaniasis mucocutánea ocurren en Bolivia, Brasil
y Perú, y se presentan como complicación en el
5 al 20% de las leishmaniasis cutáneas. Generalmente, se produce por diseminación hematógena
del parásito luego de una lesión cutánea, aunque
también puede diseminarse por vía linfática o
por extensión directa de lesiones producidas en
el rostro. El compromiso de mucosas puede verse
simultáneamente a la lesión en piel, o presentarse
meses y hasta décadas luego de ocurrida la lesión
primaria. La mucosa que se encuentra afectada
con mayor frecuencia es la nasal, con compromiso del septum hasta en un 90% de los casos. La
leishmaniasis mucocutánea también puede comprometer paladar, faringe, laringe y labio superior.
Las lesiones de paladar tienen aspecto vegetante.
La afectación laríngea consiste en la presencia de
lesiones de aspecto granulomatoso que infiltran
mucosa y cuerdas vocales, que puede llevar a la
muerte por sobreinfección u obstrucción15.
A la fecha, más de 112 especies de flebótomos
han sido descritas en Bolivia, dentro de estas se
ha comprobado 5 especies como vectores de algún
tipo de parásito.
En la zona de los valles interandinos (Yungas-La Paz), dos especies de las 17 antropofílicas que
se encontraron tienen un papel vectorial importante: lutzomyia longipalpis (especie dominante
en peri domicilio), como vector de leishmania (L)
chagasi) y lutzomyia nuneztovari anglesi (especie predominante en los cafetales y foresta residual)
en la transmisión de L.(L) amazonensis y L. (V)
braziliensis9, 10.
En Bolivia, la enfermedad fue descrita desde la
antigüedad en un único foco, el de los Yungas del
Departamento de La Paz; en la actualidad en las
poblaciones “urbanas” de Yungas se observa un incremento de reporte de los casos (antropización del
ciclo); las nuevas regiones de colonización, donde
se realizan importantes proyectos estratégicos de
desarrollo con masivas migraciones poblacionales,
han extendido la enfermedad a 6 Departamentos
(La Paz, Cochabamba, Santa Cruz, Beni, Pando,
Tarija)12.
(Fig. 2)
La prevalencia global de la enfermedad se estima
en 12 millones de casos en todo el mundo, con una
incidencia de 2 millones de casos nuevos al año.
La leishmaniasis mucocutánea fue descrita
por primera vez en Bolivia por el Dr. Manuel Antonio Vaca Diez en 1.876; se la comenzó a estudiar en
la guerra del Acre, cuando se observaron muchos
casos en el Río Mapiri y el territorio de Colonias.
Elías Sagárnaga (1.904), Adolfo Flores (1.904),
Arturo Ballivian Otero (1.905), Jaime Mendoza
(1.906) utilizaron el término ESPUNDIA para
identificar la “úlcera tropical” de cualquier origen;
años después, Escomel (1.911) verificó la presencia
del parásito amastigote en algunos pacientes que
tenían “Espundia”, privatizando este término
para referirse a la leishmaniasis tegumentaria
americana14-16.
La leishmaniasis es una zoonosis producida
por la leishmania (V) braziliensis (Vianna 1.911); de amplia distribución geográfica desde América
Central hasta el norte de la Argentina que se
caracteriza por presentar una inmunidad celular
exacerbada, traducida clínicamente en lesiones
cutáneo mucosas destructivas y desfigurantes
de la región oral y nasofaríngea, que aparecen
tardíamente, después de haber cicatrizado las úlceras primarias (puerta de entrada del parásito).
Estas formas presentan un granuloma que está constituido por macrófagos y linfocitos con muy
pocos parásitos15.
A continuación se presenta un caso de leishmaniasis mucocutánea con afectación desde la vía
aérea superior hasta la división traqueal.
Caso clínico
Paciente varón, de 50 años de edad, oriundo de
Palca (zona altiplánica de Bolivia), trabajó en
mina aurífera en zona tropical por 20 años hasta
hace 8 años. Hace 2 años acudió a este hospital
(Instituto Nacional de Tórax-La Paz- Bolivia) por
presentar tos productiva y disfonía. El examen
laringoscópico reportaba una epiglotis amputada
parcialmente, valléculas no valorables; la región
glótica ocupada por lesiones nodulares de aspecto
granulomatoso. La impresión diagnóstica fue de
tuberculosis laríngea y “probable” leishmaniasis.
El informe anatomopatológico reportó “laringitis
crónica específica”. La baciloscopía de esputo fue
negativa. Fue derivado al servicio de otorrinolaringología de otro centro hospitalario donde por
epidemiología, examen clínico y nueva laringoscopía concluyen en “laringitis tuberculosa”. Se inició tratamiento antituberculoso, el que abandonó al
mes, por intolerancia gástrica.
Por decisión propia, permaneció sin atención
médica por dos años al cabo de los cuales acudió nuevamente a este hospital por tos con expectoración mucopurulenta crónica y disfonía.
Nunca había presentado lesiones cutáneas. El
examen físico mostró roncus en ambas bases pulmonares. Las serologías para HIV, VDRL, PPD,
baciloscopia, cultivo para BAAR, bacteriológico
y micosis profundas de muestras de lesiones laríngeas y BAL fueron todas negativas. En la
radiografía de tórax se observó infiltrado alveolar
paracardíaco y supradiafragmático bilateral. Se
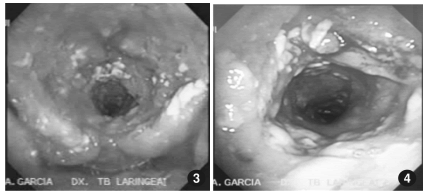
realizó una fibrolaringo-traqueobroncoscopía que
mostró ambas fosas nasales con edema de la mucosa y múltiples úlceras; la faringe mostraba pérdida de su morfología y su conversión en un canal
estrecho con lesiones granulomatoides, secreción
purulenta y fibrina adherida a sus paredes. Las
mismas lesiones se extendían hasta la tráquea en
toda su extensión.
La laringe mostraba amputación parcial de la
epiglotis y lesiones granulomatoides en toda su
extensión. Solo con la fonación se identificaban las
cuerdas vocales. La subglotis y luz traqueal tenían
disminución del diámetro en un 25%, con similares
lesiones, en la proximidad de la carina se observaban lesiones de aspecto caseoso. La estructura
bronquial estaba conservada, pero en bronquio
fuente izquierdo existía abundante cantidad de
secreción purulenta.
El informe histopatológico de nueva biopsia
lesional informó “proceso infamatorio crónico
granulomatoso no específico”. La baciloscopía de
muestras de laringe y tráquea fue negativa. Frotis
por escarificado y tinción con Giemsa negativo.
Serología: anticuerpos antileishmania brazilensis
por técnica ELISA POSITIVO. La prueba de Intradermorreacción de Montenegro (IDRM) observada
a las 48 horas tenía una reacción de 8 × 11 mm
(IDRM positiva).
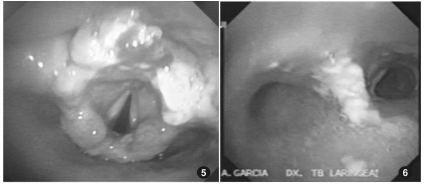
Con la confirmación de las pruebas inmunológicas y los antecedentes epidemiológicos, se decidió iniciar tratamiento con antimoniato de meglumine (Glucantime®) a dosis de 20 mg/kg día por 30 días. El paciente manifestó mejoría a partir de la primera semana de iniciado el tratamiento. Los controles clínicos posteriores a la conclusión del tratamiento confirmaron la evolución favorable del cuadro, una mejora en la voz y la dificultad respiratoria. Un nuevo estudio endoscópico de control a los 6 meses mostraba la epiglotis aun decapitada pero menos edematizada, ya se visualizaban las cuerdas vocales con movilidad conservada. Las paredes traqueales y bronquiales sin lesiones de aspecto nodular, pero aun con secreciones patológicas19-25.
Discusión
La leishmaniasis se inicia generalmente con la aparición de una lesión ulcerativa cutánea en el lugar
de la inoculación de los parásitos y es menos frecuente con lesiones mucosas por diseminación hematógena. El presente caso describe a un paciente
procedente de una zona altiplánica, zona endémica
de tuberculosis, y que trabajó en el trópico donde
además de ser zona endémica de leishmaniasis,
también es epidémica la tuberculosis.
Si bien la clínica y la epidemiología pueden sugerir la presencia de leishmaniasis mucocutánea,
el diagnóstico definitivo se basa en la identificación
del parásito que no ocurrió en el caso relatado. El
frotis por escarificado y tinción con Giemsa presenta una sensibilidad del 75%, la cual disminuye
con la evolución, llegando al 20% luego de los 6
meses. El aislamiento en cultivo y la inoculación
en hamsters presentan una sensibilidad del 30 y
el 50%, respectivamente. La negatividad de estas
pruebas en el caso descrito se explicaría por el
tiempo transcurrido desde el inicio del cuadro
hasta su diagnóstico final (más de 2 años). La
PCR es una técnica molecular de elevada sensibilidad, de gran utilidad en lesiones mucosas donde
suelen haber escasas formas amastigotas, aunque
de difícil disponibilidad en la mayor parte de las
zonas endémicas. En nuestro caso no se identificó el germen, pero el diagnóstico clínico epidemiológico fue corroborado por serología y la reacción
de Montenegro. La confirmación del diagnóstico
procede en realidad de la respuesta terapéutica.
Los casos de leishmaniasis se han informado en
diferentes partes del mundo y en casi todos consiste
en compromiso de la mucosa oral. La Organización
Mundial de la Salud (OMS) estima que el 2-3% de
los pacientes con SIDA han desarrollado la leishmaniasis como infección oportunista. La leishmaniasis mucosa causada por leishmania braziliensis
se sabe que afecta al 1-10% de los casos.
Aproximadamente, el 90% de los pacientes
presentan cicatriz cutánea previa. En ocasiones,
las lesiones mucosas también pueden aparecer en
los pacientes sin lesiones cutáneas anteriores. La
participación exclusiva de la mucosa es muy rara20.
En la serie publicada en 2003 por Aliaga y col.,
en 31 pacientes con leishmaniasis mucosa (42%
sin enfermedad subyacente, 58% con otras varias
condiciones médicas), la ubicación principal de las
lesiones fue la laringe (35%), mucosa oral (32%)
y la nariz (16%). No se describieron las lesiones
traqueales. Como en nuestro paciente, las lesiones mucosas se presentaron sin dolor en todos
los pacientes. Las ulceraciones se informaron en
6 pacientes. De forma parecida a los hallazgos de
la biopsia en nuestro paciente, patológicamente,
las lesiones mostraron un infiltrado inflamatorio
crónico con granulomas.
Los parásitos se identifican fácilmente en frotis
de Giemsa o tinción hematoxilina-eosina. Pero el
crecimiento del parasito en cultivos se presenta
sólo en el 60% de los pacientes1.
Una revisión reciente de literatura (1950 a
2013), de los casos de pacientes con manifestaciones primarias de leishmaniasis mucosa de cabeza y
cuello, identificó solamente 13 pacientes y mostró que las localizaciones más frecuentes fueron la
laríngea (54%) oral, 31% faríngea 23% y endonasal
15%, siendo la presentación clínica más frecuente
la lesión exofítica (69%)18.
Hasta nuestro conocimiento, no más de cuatro
casos de localización traqueal han sido previamente relatados en la literatura, lo que demuestra la
naturaleza excepcional del presente caso. Probablemente la demora en el diagnóstico (siendo el
caso inicialmente interpretado como tuberculosis)
justifique la progresión hacia la vía aérea inferior,
aún en ausencia de inmunocompromiso23-25.
El tratamiento de elección en todas las formas
clínicas de leishmaniasis es la administración de
medicamentos antimoniales como antimoniato de
meglumina (Glucantime) y estibogluconato sodio
(Pentostam). La meglumine se administra en dosis de 20 mg/ kg de peso corporal/ día, a través de la
vía intramuscular o intravenosa, a un máximo de
850 mg/ día, durante al menos 20 días. Los posibles
efectos adversos de estos fármacos son dolores
musculares, dolor en las articulaciones, anorexia,
náuseas, vómitos, dolor de cabeza, hipertransaminasemia, pancreatitis química, trombocitopenia
y neutropenia. Los pacientes con leishmaniasis
mucocutánea deben ser tratados con 20 mg de
antimonio pentavalente (0,2 ml pentostam) por
kg de peso corporal al día, por vía intramuscular o
por vía intravenosa durante 30 días y la inyección
intralesional de estibogluconato de sodio (0,5 a
1,0 ml) puede ser eficaz. Ofrece alternativa menos
costosa y bajos efectos secundarios11-18.
Como conclusión, la leishmaniasis es una parasitosis endémica cuya incidencia se encuentra en
aumento. Este caso enfatiza que es importante
tenerla en cuenta como diagnóstico diferencial
ante un paciente con lesiones en mucosas, incluso
cuando no presente antecedentes de enfermedad
cutánea, ya que la lesión primaria en algunos casos
puede pasar desapercibida. Pese a su similitud
macroscópica con la tuberculosis, este diagnóstico
debe ser siempre sospechado en lesiones mucosas
del árbol traqueo bronquial en zonas endémicas.
Conflicto de intereses: el autor declara no tener conflictos de intereses.
1. Aliaga L, Cobo F, Mediavilla JD et al. Localized mucosal leishmaniasis due to leishmania infantum: clinical and microbiologic findings in 31 patients. Medicine (Baltimore) 2003; 82(3): 147-58.
2. Angles R, Le Pont F, Desjeux P. Visceral canine leishmaniasis in Bolivia. Trans R Soc Trop Med Hyg 1982; 76: 704.
3. Balcazar JM. Epidemiología en Bolivia. La Paz: Ediciones Juventud, 1955.
4. Balcazar JM. Historia de la medicina en Bolivia. La Paz: Ediciones Juventud, 1956
5. Costa JWJr, Milner DAJr, Maguire JH. Mucocutaneous leishmaniasis in a us citizen. Oral surgery, oral medicine, oral pathology, oral radiology, and endodontics 2003; 96(5): 573-577.
6. Delgado O, Feliciangeli MM, Gómez B, Alvarado J, García L, Bello C. The re-emergence of American visceral leishmaniasis in an old focus in Venezuela: present situation of human and canine infections. Parasite 1998; 5(4): 317-323.
7. Desjeux P, Aranda E, Aliaga O, Mollinedo S. Human Visceral Leishmaniasis In Bolivia; First proven autochthonous case from los Yungas. Trans R Soc Trop Med Hyg 1983; 77(6): 851-852.
8. Martínez E, Le Pont F, Mollinedo S, Cupolillo E. A first case of cutaneous leishmaniasis due to Leishmania (Viannia) lainsoni in Bolivia. Trans R Soc Trop Med Hyg 2001; 95 (4): 375-377.
9. Desjeux P, Mollinedo S, Le Pont F, Paredes A, Ugarte G. Cutaneous Leishmaniasis In Bolivia. A Study of 185 human cases from Alto Beni (La Paz Department) isolation and isoenzyme characterization of 26 strains of leishmania brasiliensis. Trans R Soc Trop Med Hyg 1987; 81, 742-746.
10. Croft SL, Dye C, Kahl LP. Leishmaniasis: The first centenary (1885-1985) new strategies for control. Parasitology Today 1988; 4 (2): 51-53.
11. Faris RM, Jarallah JS, Khoja TA, Al-Yamani Mj. Intralesional treatment of cutaneous leishmaniasis with sodium stibogluconate antimony. International Journal of Dermatology 1993; 32(8): 610-612.
12. Forero M, Pérez A, Barajas NC, Leyva YA, Zamora C. Nasolaryngotracheal mucosal leishmaniasis in an Adolescent. Arch Argent Pediatr 2014; 112(3): E101-4.
13. Garret Aillon J. La espundia en Bolivia, observaciones del Dr. Manuel Antonio Vaca Diez. Comentario histórico. Boletín Informativo de CENETROP. IX, 1-5, 1983.
14. Gatti G, Boggino J, Prieto C. Un nouveau foyer de leishmaniose viscerale en Amerique du sud. Bulletin de la Societe de Pathologie Exotique 1939; 67, 387- 395.
15. La Fuente C, Recacochea M, Tybayrenc M, Urjel R, Darras C, Cardozo L. Leishmaniasis en Bolivia: Presencia de dos complejos en los llanos orientales del departamento de Santa Cruz-Bolivia. Boletín científico del CENETROP, vol. XII, 1-15, 1986.
16. Le Pont F, Desjeux P. Leishmaniasis In Bolivia II. The involvement of psychodopygus yucumensis and psychodopygus llanos martinsi in the selvatic transmission cycle of leishmania braziliensis in a lowland subandean region; mem. Río de Janeiro: Inst. Oswaldo Cruz, 1986, pp. 311-318.
17. Le Pont F.; Mollinedo S.; Mouchet J.; Desjeux P. Leishmaniose en Bolivie. IV. Le chien dans les cycles des leishmanioses en Bolivie. Rio de Janeiro: Inst. Oswaldo Cruz, 1989 pp 417-421.
18. Leishmania species of all major complexes may be responsible for ml over the world. World health organization, “world health organization working to overcome the global impact of neglected tropical disease,” first who report on neglected disease, World Health Organization, Geneva, Switzerland, 2010.
19. Marshall BG, Kropf P, Murray K et al. Bronchopulmonary and mediastinal leishmaniasis: an unusual clinical presentation of Leishmania donovani infection. Clin Infect Dis 2000; 30(5): 764-9.
20. Mignogna MD, Celentano A, Leuci S et al. Mucosal leishmaniasis with primary oral involvement: a case series and a review of the literature. Oral Dis 2015; 21(1): e70-8.
21. Mollinedo S, Muñoz M, Hervas D et al. Leishmaniasis visceral y tegumentaria en niños en dos zonas endémicas de Bolivia. Parasitología al día 1992; 16: 11-120.
22. Murray HW, Berman JD, Davies CR, Saravia NG. Advances in Leishmaniasis. Lancet 2005; 366(9496): 1561–1577.
23. Piens MA, Arpin D, Rabodonirina M, Loire R, Brune J. Tracheal stenosis of inflammatory aspect. Rev Pneumol Clin 1997; 53(3): 150-2.
24. Valda l. Leishmaniasis cutáneo difusa: informe del segundo caso boliviano; Cuadernos del Hospital de Clínicas 1980; 31: 1.
25. Viglianesi A, Di Mauro D, Petrillo G. Multidetector computed tomography aspects of tracheal mucosal leishmaniasis localization Jpn J Radiol 2011;29(1): 59-62.