Autor : Glenda Ernst1, 2, Alejandro Salvado1, MartĂn Bosio1, Tamara Decima1, Fernando Grassi1, Fernando Di Tullio1, MagalĂ Blanco1, JerĂłnimo Campos1, Miguel Blasco11, Eduardo Borsini1, 2
1 Servicio de Medicina Respiratoria 2 Grupo Argentino de Investigación en Apneas del Sueño (GAIAS) Hospital Británico de Buenos Aires
Correspondencia : Eduardo Borsini Domicilio postal: Perdriel 74. CABA - CP: 1280. Argentina. Tel.: +54-11-4309-6400 Ext. 2808 E-mail: borsinieduardo@yahoo.com.ar
Resumen
Introducción: Obesidad, sexo y edad constituyen factores que predisponen a padecer
SAHOS. Con el objeto de conocer su impacto en los indicadores tradicionales de la poligrafía respiratoria (PR) se evaluaron las relaciones del índice de apneas/hipopneas (IAH), índice de desaturación (IDO) y el tiempo con menos de 90% de satuarción (T = < 90%)
en pacientes clasificados según el índice de masa corporal (IMC), sexo y edad.
Métodos: Estudio retrospectivo en 635 pacientes con SAHOS. Las variables IAH, IDO
y T < 90% y sus relaciones en pacientes obesos y no obesos se analizaron utilizando el
test de Kruskal-Wallis y el test de comparaciones múltiples de Dunns.
Resultados: Se encontró un incremento en el IAH, relacionado con la edad en las mujeres, mientras que en los hombres fue dependiente del IMC. El tiempo de desaturación
menor al 90% (T < 90%) se asoció a la obesidad en ambos sexos. La concordancia entre
IAH e IDO fue mayor en aquellos pacientes con IMC < 30 y fue disminuyendo proporcionalmente al incremento del IMC tanto en hombres como en mujeres. La escala de Epworth
reveló resultados similares en todos los grupos; sin embargo, el porcentaje de pacientes
con alto riesgo en el cuestionario de Berlín resultó mayor en los obesos (p < 0.05).
Conclusiones: Este estudio permitió comprender las diferencias del SAHOS entre hombres y mujeres, y reveló hallazgos que sugieren la importancia del rol de la oximetría en
obesos. La relación entre los indicadores de la PR podría contribuir con la comprensión
de la severidad del SAHOS y la obesidad.
Palabras clave: Obesidad; Apneas obstructivas de sueño; Poligrafía respiratoria.
Abstract
Relationship between Body Mass Index, Sex, Age and Respiratory Abnormalities during Sleep
Introduction: Obesity, sex and age are factors that predispose to obstructive sleep apnea
(OSA). In order to understand its impact on the indicators of respiratory polygraphy (RP),
this study evaluated the relationship of the apnea/hypopnea index (AHI), the desaturation
index (ODI) and time of less than 90% saturation (T < 90%) in patients classifed by body
mass index (BMI), sex and age.
Methods: Retrospective study of 635 patients with OSA. The values of IAH, ODI and
T <90% and their relationships in obese and non-obese patients were analysed using
Kruskal-Wallis and Dunn’s multiple comparisons tests.
Results: We found an increase in the AHI, which was related to age in women and related
to BMI in men. The T < 90% was associated with obesity in both, females and males.
The agreement between IAH and IDO was higher in patients with BMI < 30 and it was
decreasing proportionally with the increase of BMI, in both sexes. Epworth scale revealed
similar results in all groups; however the percentage of high-risk obese patients in the
Berlin questionnaire was higher than in non-obese patients (p < 0.05).
Conclusions: This study contributes to understand the OSA differences between men and women, and the findings suggest the important role of oximetry in obese patients.
The relationship between the indicators could contribute to better understand OSA
severity and obesity.
Key words: Obesity; Obstructive sleep apnea; Respiratory polygraphy
Introducción
La obesidad es uno de los principales factores que
predispone a las apneas obstructivas de sueño; la
misma se encuentra en una fase exponencial de
crecimiento en las últimas décadas1. Esta condición
aumenta la morbilidad de quienes la padecen ya
que se relaciona con un mayor riesgo de hipertensión arterial, diabetes, eventos cardiovasculares y
alteraciones respiratorias2-3. Más de mil millones
de personas en el mundo presentan sobrepeso,
siendo la prevalencia de obesidad en los países
occidentales actualmente superior al 20%3-5. Datos
de Argentina, relevados a través de las encuestas
nacionales de factores de riesgo, mostraron que el
18% de los individuos entre 34 y 65 años tenían
obesidad en el 20096,7.
Ha sido previamente demostrado que las variaciones moderadas en el peso estarían asociadas al
incremento en la severidad del SAHOS, aunque
esta relación presentaría gran variabilidad en los
pacientes con un índice de masa corporal (IMC)
mayor a 408, 9. Este problema ha sido abordado por
diferentes trabajos; Serafini y sus col. han descripto una pobre correlación entre el IMC y el índice
de apneas/hipopneas (IAH) en pacientes obesos
derivados para cirugía bariátrica10. El grupo de
Lings ha postulado que el índice de desaturación
(IDO) podría incrementarse a medida que aumenta
el valor del IMC, siendo este indicador más sensible
que el IAH para detectar los disturbios del sueño
en pacientes con obesidad11. Finalmente Gabbay
y su equipo, recientemente, han descripto que la
obesidad sería un factor modificador de efecto
independiente del sexo y de la edad12.
Otro factor que podría modificar la interpretación de los resultados de los estudios de sueño es
la edad. La pirámide poblacional está cambiando
en los países con estilo de vida occidental, con un
progresivo incremento de la población anciana.
Estudios realizados en población añosa han demostrado que el 20% de los mayores de 60 años y casi
el 70% de los individuos de > de 75 años tienen un
IAH > 10 hora. Diferentes modelos teóricos han sido propuestos para explicar estos hallazgos13,14.
Adicionalmente, estudios transversales han descripto que uno de cada cuatro estudios de sueño
ha sido realizado en mayores de 65 años y que el
70% de los mismos habría recibido la indicación
de usar CPAP14.
El efecto del sexo en los trastornos respiratorios
vinculados al sueño también ha sido motivo de
análisis. Estudios epidemiológicos han demostrado que el SAHOS es más prevalente en hombres,
esto podría relacionarse con el efecto de hormonas
sexuales, cambios en la distribución de la grasa, perímetro del cuello, colapsabilidad de la vía aérea15
y el control central de la ventilación16-18. Sin embargo, la posición al dormir afectaría la interpretación de estos resultados y se ha descripto que los
hallazgos polisomnográficos podrían mostrar un
perfil con predominio de eventos obstructivos en
sueño REM con formas menos severas de SAHOS
en las mujeres en la posición supina19.
Finalmente, el grado de concordancia entre indicadores tradicionales (IAH e IDO) para evaluar
evolución o severidad permanece pobremente
comprendido en los pacientes obesos, en especial en
mujeres. Más aún, el peso de la evidencia es todavía
menor cuando se utilizan métodos simplificados
de diagnóstico.
Con el propósito de conocer el desempeño de los
parámetros tradicionales para detectar anormalidades respiratorias durante el sueño y describir
el impacto de las variables obesidad, edad y sexo,
se evaluaron el IAH, IDO, tiempo de saturación < 90% y la relación entre ellos, con un modelo de
utilización domiciliaria de poligrafía respiratoria
de nivel III auto-administrada.
Materiales y métodos
Diseño
Estudio retrospectivo sobre una base de datos de
recolección sistemática en pacientes con anormalidades respiratorias durante el sueño diagnosticada
mediante PR ambulatoria analizada en la Unidad
de Sueño del Hospital Británico de Buenos Aires durante dos años. El protocolo fue aprobado por el
comité de ética y revisión institucional de acuerdo
a los principios de Helsinki.
Población
Se incluyeron pacientes consecutivos mayores de
20 años con IAH > 5/h. Se excluyeron aquellos
que requerían uso de oxígeno o ventilación no
invasiva al momento de la realización de la PR.
También fueron excluidos pacientes con diagnóstico conocido de EPOC, síndrome de obesidad e
hipoventilación, insuficiencia cardíaca crónica,
enfermedad neuromuscular, parasomnias, clínica
de movimientos periódicos de los miembros y
narcolepsia.
Cuestionarios aplicados
Al momento de entregarse el equipo de PR, se
recolectaron los datos demográficos (edad y sexo),
antropométricos como el IMC (kg/m2), nivel educativo, datos clínicos y de somnolencia subjetiva.
Se clasificaron los pacientes según la definición
de la Organización Mundial de la Salud20 (OMS)
como: normopeso (IMC< 25); sobrepeso; IMC
entre 25.0 y 29.9 kg/m2; obesos grado I cuando el
IMC fue de 30 a 34.9; obesos de grado II entre 35
y 39.9; y finalmente obesidad severa o de grado
III, a aquellos con IMC ≥ 40. Todos los pacientes
completaron la escala de somnolencia de Epworth
(ESS) en versión validada traducida al español21,
y los cuestionarios de riesgo de Berlín y de STOP-BANG22, 23.
Poligrafía respiratoria
Los registros fueron tomados con dispositivos
portátiles Apnea Link Plus (ResMed. Australia)
con sensado de presión nasal, esfuerzo torácico con
banda cualitativa, oximetría (tiempo de promediación de la señal < 1 segundo) mediante sensor tipo
dedal (XPod, Nonin. USA).
Los pacientes fueron instruidos por personal
técnico acerca del uso y montaje del equipo de PR
el mismo día en que se realizaron los registros
nocturnos con la técnica de auto-colocación en
domicilio. La demostración incluyó un simulacro
de instalación y de encendido del polígrafo. Los
registros fueron descargados, editados y analizados manualmente (scoring manual secuencial)
utilizando el software Apnea Link® 9.0. La edición
manual de eventos se realizó desde el registro
automático por el equipo de médicos neumonólogos entrenados bajo las normas de la Asociación Americana de Medicina del Sueño (AASM)24. Los
registros fueron aceptados cuando la edición del
registro incluyó más de cuatro horas de señales
(TTR) de adecuada calidad. Cuando la calidad
de las señales no permitió un TTR > 4 horas, se
repitió el registro una segunda noche.
Se estableció que un evento respiratorio fue una
apnea, cuando el flujo nasal se redujo en más de
un 90% y una hipopnea cuando se redujo más del
50% asociada a una caída en la saturación de ≥ 3%, en ambos casos durante al menos 10 segundos
(criterio Chicago)24.
El IAH se definió como el número de eventos
respiratorios (apneas + hipopneas) sobre el tiempo
total de registro habilitado para el análisis. Según
la puntuación (scoring) final los pacientes fueron
clasificados como; normales (IAH < 5/h), leves
(IAH entre 6 y 14.9 eventos por hora), moderados
(IAH entre 15 y 29.9/hora) y severos (IAH > 30
hora). El índice de desaturaciones (IDO) se calculó de igual manera sobre el TTR y el T90 se consideró en minutos y en porcentaje del TTR válido. El
IDO se definió según el criterio de desaturación
de 3% respecto del valor basal inmediatamente
precedente y se definieron las mismas categorías
de severidad que para el IAH (leve, moderado y
severo).
Análisis estadístico
Los resultados se presentaron como porcentajes en
las variables categóricas o media, y desvío estándar
en las variables numéricas. Para comparar las diferencias entre dos grupos se utilizó el test de Mann
Withney o χ2 para variables cuantitativas y cualitativas, respectivamente, y cuando se compararon
los resultados de tres o más grupos se utilizó el test
no paramétrico de Kruskall Wallis junto con el test
de comparaciones múltiples de Dunn´s. El análisis
de los datos se realizó utilizando el software Prism
5 software (Graph Pad, La Jolla, CA).
Resultados
Características de la población
A partir de 869 registros de pacientes elegibles para
el estudio por alta probabilidad clínica de padecer
apneas de sueño durante dos años, se analizaron
los datos de pacientes mayores de 20 años con
apneas de sueño definidas por un IAH mayor a 5
ev/h. De esta manera se incluyeron 635 pacientes
agrupados por edad, IMC y sexo. Las características demográficas se observan en la Tabla 1.
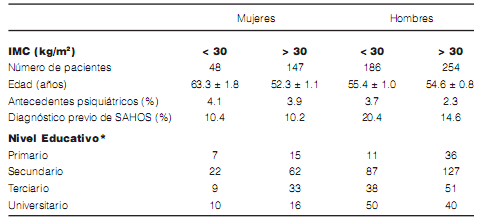
(* Número de pacientes)
Los cuestionarios no permitieron encontrar diferencias significativas en los síntomas relacionados con el SAHOS entre mujeres y hombres. La escala de Epworth (ESS) reveló resultados similares en todos los grupos (entre un 20 y 30% de los pacientes alcanzaron valores mayores a >11 puntos). Sin embargo, el porcentaje de cuestionarios de Berlín de alto riesgo resultó proporcionalmente mayor en los hombres obesos en comparación con los hombres no obesos (p < 0.05) (Tabla 2). Más aún, el reporte de cansancio (T: Tired en el cuestionario STOP-BANG) fue similar en los grupos estudiados; 68% de las mujeres obesas y no obesas dijeron sentirse cansadas durante el día; mientras que en los hombres se observó una ligera predominancia en los sujetos obesos (74% de los pacientes obesos vs 66% no obesos).

(* p < 0.05)
Poligrafía respiratoria
El tiempo medio de análisis manual de los registros fue de 6.1 horas. No existieron diferencias en el TTR ni en la tasa de repetición de registros
(3%) entre los grupos. Tal como se observa en la Tabla 3, el perfil de los eventos respiratorios fue
fundamentalmente de naturaleza obstructiva (índices de apneas centrales y mixtas < 5/hora). La
observación de respiración periódica fue mayor en
hombres obesos (p<0.05).
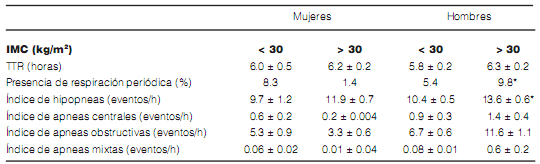
(* p < 0.05)
Influencia del IMC
El análisis de los registros de las poligrafías en
los pacientes de sexo masculino mostró un significativo incremento del IAH y el IDO (umbral
de desaturación de 3%) en los pacientes obesos
en comparación con los pacientes no obesos (29.9 ±1.3 y 33.5 ± 1.3 vs 19.6 ± 0.9 y 20.2 ± 0.9; p < 0.001). El tiempo de saturación debajo de 90% se
incrementó en forma significativa tanto en hombres como mujeres obesos (Tabla 4). Más aún,
la Figura 1 muestra que las mujeres no obesas
presentaron mayormente formas leves de SAHOS,
con un IAH que se incrementó proporcionalmente a la edad (Figura 1A); sin embargo, en los pacientes
hombres se observaron valores mayores de IAH,
pero estos no fueron dependientes de la edad (Figura 1B). La obesidad fue un factor que influyó en
el incremento del IAH sobre todo en los hombres, independientemente del rango etario (Figuras 1
C y D).
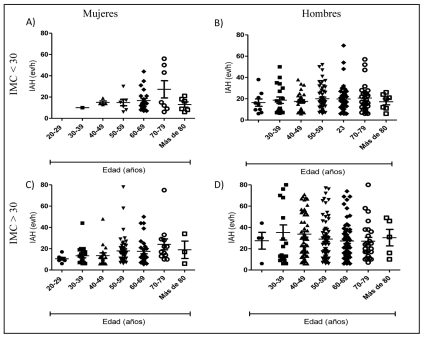
Las hipopneas fueron los eventos respiratorios más frecuentemente observados (todos los grupos) y fue posible apreciar un incremento del índice de hipopneas (IH) relacionado al incremento del IMC (Tabla 3) que alcanzó significación estadística en los varones (13.6 ± 0.6 vs 10.4 ± 0.5; p < 0.05).

Influencia de la edad
Tal como se describió previamente, se observó que
uno de los indicadores de severidad tradicionales,
el IAH, mostró una tendencia a incrementar sus
valores de manera proporcional al aumentar la
edad, y se observó una meseta en este comportamiento en el grupo de pacientes mayores de 80
años. Se observaron diferencias en la influencia de
la edad entre hombres y mujeres; tal como muestra
la Tabla 5, en las mujeres el incremento del IAH
estuvo relacionado con la edad, mientras que en los
hombres fue dependiente del IMC (> o < de 30).
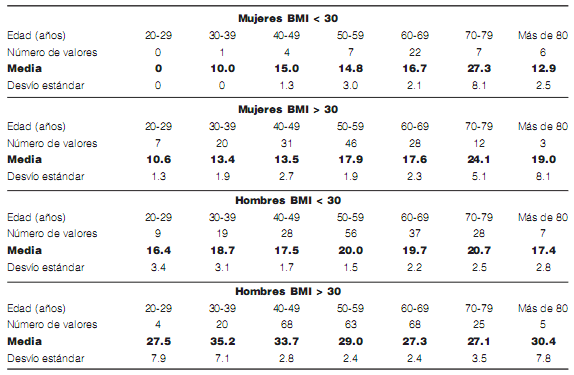
Relación entre los indicadores dependientes del flujo
respiratorio y de la oximetría
Para evaluar la relación entre los eventos identificados en el flujo (apneas/hipopneas) y las desaturaciones (criterio de caída de la saturación de 3%)
se calcularon las relaciones entre ambos (cociente
IAH/IDO). Tal como se observa en la Figura 2, los
pacientes con IMC < 30 mostraron mayor concordancia, con un cociente medio de 0.98 ± 0.04 en mujeres y 0.97 ± 0.02 en hombres en comparación
con aquellos pacientes con obesidad; 0.82 ± 0.02
y 0.86 ± 0.01, respectivamente (p < 0.001). Esta
diferencia casi cercana a cero en los pacientes no
obesos disminuyó proporcionalmente al incremento del IMC (por incremento en los valores del IDO).
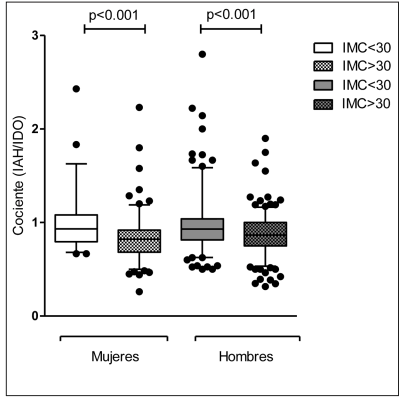
Los valores extremos (outliers) defnidos como aquellos valores que se encuentran por fuera del intervalo de confanza (95-5%) se observan como círculos rellenos en los extremos de cada grupo.
Discusión
Diferentes mecanismos han sido propuestos para
comprender cómo la edad, el sexo y la obesidad
se asocian a las apneas de sueño. Entre ellos, se
destacan la disminución de la compliance tóracopulmonar, la longitud de la tráquea, cambios en
los volúmenes pulmonares, variaciones en el control ventilatorio16, como así también los cambios
hormonales vinculados al metabolismo del tejido
adiposo y al envejecimiento, que podrían influir
en la aparición de eventos respiratorios anormales
durante el sueño25-26.
La técnica de referencia para el diagnóstico
de SAHOS es la polisomnografía (PSG), aunque
también ha sido aceptada la utilización de la poligrafía respiratoria27-30. Más aún, recientemente
ha sido validada la utilización de la PR utilizando
equipos registradores similares al de este trabajo, en pacientes con obesidad severa, considerada una
comorbilidad que puede limitar el desempeño de
los estudios simplificados31.
Datos provenientes de estudios con PSG han
demostrado que los indicadores de severidad comúnmente utilizados para evaluar el SAHOS se
comportan de manera diferente en los sujetos con
obesidad y que podrían modificarse en pacientes
de edad avanzada13, 14, 16.
Nuestros hallazgos mostraron que, a pesar
de ser una población con alto riesgo de padecer
alteraciones del sueño, esta se manifestó poco
sintomática. Sólo una cuarta parte de los pacientes
presentó un ESS mayor a 11 (valores patológicamente elevados). Estos resultados coincidieron con
otros datos similares previamente publicados32.
ESS es un método validado para la evaluación de
la somnolencia subjetiva en pacientes con sospecha
clínica de SAHOS, aunque su sensibilidad es constantemente baja a través de numerosos trabajos
científicos que han testeado su desempeño33, 34.
Estas validaciones han sido realizadas en diferentes etnias, regiones geográficas, rangos etarios y culturas; aunque en general se han comparado
utilizando PSG33-36. Nuestros hallazgos han sido
corroborados utilizando un método abreviado de
diagnóstico (PR) con tres señales básicas (flujo,
esfuerzo y oximetría) mediante el equipo Apnea
Link Plus (ALP).
Este estudio ha incluido en forma sistemática
los registros de pacientes con apneas de sueño obtenidos mediante ALP y el 63.1% de los pacientes
analizados presentaban obesidad en algún grado.
En acuerdo a los hallazgos descriptos por Mathew y
colaboradores37, hemos encontrado un incremento
significativo de hipopneas en pacientes obesos,
siendo este tipo de evento respiratorio y las modificaciones oximétricas los hallazgos predominantes,
aunque no existieron diferencias en el perfil de
eventos entre hombres o mujeres.
Se encontró un incremento significativo del IAH
en varones con obesidad, comparado con los otros
sub-grupos. Este resultado podría resultar controversial, ya que podría estar influenciado por la
reserva funcional respiratoria previa, por la saturación basal y la saturación media durante el sueño, e incluso por la herramienta utilizada para evaluar
el fenómeno (PSG, PR u oximetría nocturna) y
por el criterio usado para definir hipopneas; sin
embargo, resultados similares han sido descriptos
previamente11, 38, 39. Gabbay y sus colaboradores han
descrito que el IMC, la severidad según el IAH y la
edad son factores independientes que determinan
la desaturación nocturna (T < 90%) y que no habría diferencia entre géneros12. Los hallazgos aquí mostrados y los antecedentes podrían contribuir a
jerarquizar el rol de la oximetría en el diagnóstico
de los trastornos respiratorios del sueño en sujetos
con IMC >2511, 12.
Dentro de las limitaciones de nuestro estudio,
una ha sido que no se incluyó la realización de
gases en sangre arterial para la medición de CO2 y HCO3, ni tampoco capnografía para descartar
eventos de hipoventilación, por lo que no es posible
descartar pacientes con síndrome de obesidad e
hipoventilación, entidad con características particulares que podría modificar el comportamiento
oximétrico y cuya prevalencia se estima 3 a 8%
de los obesos derivados a centros de medicina del
sueño11. Otra limitación para la interpretación
de los resultados de este estudio radica en que
los mismos podrían diferir dependiendo del método diagnóstico utilizado. Se ha descripto una
subestimación en el IAH obtenido mediante PR
comparado con el obtenido por PSG, que oscilaría
entre 10 al 15 %27-29. Finalmente, una limitación
obvia de la PR es que no permite ver “sueño” y, por
lo tanto, los microdespertares. En consecuencia,
no permite definir eventos de obstrucción incompleta con fragmentación del sueño denominados “microdespertares relacionados a incremento del
esfuerzo respiratorio” (RERA´S por sus siglas en
inglés) que se describen más frecuentemente en
mujeres41, 42. Sin embargo, el IAH es el parámetro más comúnmente utilizado para clasificar la
severidad de los desórdenes usando como método
diagnóstico PSG o PR27, 28, 30.
Tradicionalmente, las apneas se calculan como
la cantidad de eventos en los cuales el flujo de aire
se interrumpe durante 10 segundos y este es un fenómeno que no requiere desaturación concomitante para su identificación. Sin embargo, la definición
de hipopneas requiere una desaturación asociada
o un microdespertar (arousal en la PSG) lo que ha
generado numerosos criterios24,42-44. En acuerdo a
los lineamientos de la AAMS23, contabilizamos los
eventos de hipopnea cuando la caída ostensible en el flujo aéreo fue ≥ 50% por ≥ 10 segundos
y la desaturación de oxígeno tuvo umbral de ≥ 3%. El tipo de definición utilizada también podría
modificar la detección de los eventos respiratorios
asociados al sueño y los resultados.
A pesar de que las normativas vigentes reconocen un grado de concordancia elevado
entre
IAH e IDO (> 0.95)24, 40, 42, 43, los hallazgos de este
trabajo ponen en evidencia que la relación entre
estos indicadores disminuye progresivamente a
medida que se incrementa el IMC. Más aún, la
relación entre el IAH y el IDO podría contribuir
a mejorar la comprensión de la severidad del
SAHOS en pacientes con obesidad12. Nuevos
estudios son requeridos para determinar si este
fenómeno se relaciona con un efecto biológico
con implicancias pronósticas (mayor impacto de
la obesidad en los indicadores oximétricos que
en el IAH).
El rol de la edad sobre las anormalidades
respiratorias vinculadas al sueño se conoce ampliamente. Bwilise y col. sugirieron un modelo
heurístico con 2 formas de SAHOS, por una parte, aquel de naturaleza patológica que aparecería
en edades medias de la vida y que correspondería
a aquellos pacientes que son diagnosticados
habitualmente en las unidades de sueño; y por
otra parte, aquel que aparecería a partir de los
60 años de edad, con cierto solapamiento con el
anterior, y que sería causado de forma fisiológica por el propio envejecimiento y el incremento
en la colapsabilidad faríngea consiguiente13-46.
Nosotros encontramos un incremento del IAH
en ambos sexos en relación a la edad con una
meseta a partir de los 80 años, aunque este efecto
podría obedecer a la escasa muestra de individuos octogenarios. Sin embargo, el fenómeno
es claramente ostensible en mujeres donde el
impacto de la obesidad es menor.
Para concluir, el incremento del IAH estuvo
relacionado con la edad en las mujeres mientras
que en los hombres fue dependiente del IMC. La
concordancia entre IAH e IDO fue mayor con IMC < 30 y esta fue disminuyendo proporcionalmente
al incremento del IMC tanto en hombres como en
mujeres.
Estos hallazgos destacan el importante rol de
la oximetría en obesos y sugieren que la relación
entre los indicadores tradicionales podría contribuir a la comprensión de la severidad del SAHOS
en obesos.
Conflictos de interés: MB es docente de la Universidad Católica Argentina (UCA); recibió financiación para congresos de la compañía farmacéutica Teva; recibe financiación de la compañía AstraZeneca para realizar protocolos sobre asma y como disertante sobre asma y Epoc. TD recibe financiación de la compañía farmacéutica AstraZeneca para realizar protocolos sobre asma bronquial. EB recibe financiación (Grant) de Linde para realizar investigación acerca de SAHOS en embarazadas; recibió financiación para asistencia a congresos de las compañías farmacéuticas AstraZeneca y Dosa; participó como disertante en relación a la poligrafía respiratoria para la compañía Philips y recibió tecnología en comodato por las empresas Philips, ResMed, Air Liquide y Linde. La Unidad de Sueño del Hospital Británico usa tecnología Philips siendo “Reference Site” de Philips en la Argentina.
1. Swinburn BA, Sacks G, Hall KD et al. The global obesity pandemic: shaped by global drivers and local environments. Lancet 2011; 378(9793): 804-14.
2. Clinical guidelines on the identification, evaluation, and treatment of overweight and obesity in adults: executive summary. Expert Panel on the Identification, Evaluation, and Treatment of Overweight in Adults. Am J Clin Nutr 1998; 68: 899-17.
3. Aucott L, Poobalan A, Smith WCS et al. Effects of weight loss in overweight/obese individuals and long-term hypertension outcomes: a systematic review. Hypertension 2005; 45: 1035-41.
4. Aucott L, Poobalan A, Smith WCS et al. Weight loss in obese diabetic and non-diabetic individuals and long-term diabetes outcomes–a systematic review. Diabetes Obes Metab 2004; 6: 85-94.
5. Report of a WHO Consultation (WHO Technical Report Series 894). Obesity: preventing and managing the global epidemic. En: http://www.who.int/gho/ncd/risk_factors/bmi_text/en/index.html.
6. Ministerio de Salud. República Argentina. 2° Encuesta nacional de factores de riesgo 2009 para enfermedades no transmisibles. Rev Argent Salud Pública 2011; 2: 34-41.
7. Elgart J, Pfirter G, Gonzalez L et al. Obesity in Argentina: epidemiology, morbimortality and economic impact. Rev Argent Salud Pública 2010;1: 6-12.
8. Newman AB, Foster G, Givelber R, Nieto FJ, Redline S, Young T. Progression and regression of sleep-disordered breathing with changes in weight: the sleep heart health study. Arch Intern Med 2005; 165: 2408-13.
9. Schwartz A, Patil S, Laffan A, Polotsky V, Schneider H, Smith P. Obesity and Obstructive Sleep Apnea. Pathogenic Mechanisms and Therapeutic Approaches. Proc Am Thorac Soc 2008; 5: 185-92.
10. Serafini F, MacDowell A, Rosemurgy A, Strait T, Murr M. Clinical predictors of sleep apnea in patients undergoing bariatric surgery. Obes Surg 2001; 11: 28-31.
11. Ling I, James A, Hillman D. Interrelationships between Body Mass, Oxygen Desaturation, and Apnea-Hypopnea Indices in a Sleep Clinic Population. Sleep 2012; 35: 89-96.
12. Gabbay IE, Gabbay U, Lavie P. Obesity plays an independent worsening modifying effect on nocturnal hypoxia in obstructive sleep apnea. Sleep Med 2012;13(5): 524-8.
13. Martínez-García MA, Durán-Cantolla J, Montserrat JM. El síndrome de apneas-hipopneas durante el sueño en edades avanzadas. Arch Bronconeumol 2010; 46: 479-88.
14. Martínez-García MA, Amilibia J, Chiner E et al. Apnea del sueño en individuos de edad avanzada. Actividad asistencial (2002-2008) en España. Arch Bronconeumol 2010; 46: 502-7.
15. Jordan AS, Wellman A, Edwards JK et al. Respiratory control stability and upper airway collapsibility in men and women with obstructive sleep apnea. J Appl Physiol 2005; 99: 2020-2027.
16. O’Connor C, Thornley KS, Hanly PJ. Gender differences in the polysomnographic features of obstructive sleep apnea. Am J Respir Crit Care Med 2000; 161: 1465-1472.
17. Horner RL, Rivera MP, Kozar LF, Phillipson EA. The ventilatory response to arousal from sleep is not fully explained by differences in CO2 levels between sleep and wakefulness. J Physiol 2001; 534: 881-890.
18. Jordan AS, Eckert DJ, Catcheside PG, McEvoy RD. Ventilatory response to brief arousal from non-REM sleep is great in men than women. Am J Respir Crit Care Med 2003; 168: 1512-1519.
19. Lin CM, Davidson TM, Ancoli-Israel S. Gender Differences in Obstructive Sleep Apnea and Treatment Implications. Sleep Med Rev 2008; 12(6): 481-96.
20. Report of a WHO Consultation (WHO Technical Report Series 894). Obesity: preventing and managing the global epidemic. En: http://www.who.int/gho/ncd/risk_factors/bmi_text/en/index.html
21. Chiner E, Arriero JM, Signes-Costa J, Marco J, Fuentes I. Validation of the Spanish version of the Epworth Sleepiness Scale in patients with a sleep apnea síndrome. Arch Bronconeumol 1999; 35: 422-7.
22. Chung F , Yegneswaran B, Liao P et al. STOP questionnaire: a tool to screen patients for obstructive sleep apnea. Anesthesiology 2008; 108: 812-21.
23. Vana KD, Silva GE, Goldberg R. Predictive abilities of the STOP-Bang and Epworth Sleepiness Scale in identifying sleep clinic patients at high risk for obstructive sleep apnea. Res Nurs Health 2013; 36: 84-94.
24. Iber C, Ancoli-Israel S, Chesson AL Jr, Quan SF; for the American Academy of Sleep Medicine. The AASM manual for the scoring of sleep and associated events: rules, terminology and technical specifications. 1st ed. Westchester, IL: American Academy of Sleep Medicine 2007.
25. Malhotra A, White DP. Obstructive Sleep Apneas. Lancet 2002; 360: 237-45.
26. Isono S. Obesity and obstructive sleep apnoea: mechanisms for increased collapsibility of the passive pharyngeal airway. Respirology 2012; 17: 32-42.
27. Collop NA, Anderson WM, Boehlecke B et al. Clinical Guidelines for the Use of Unattended Portable Monitors in the Diagnosis of Obstructive Sleep Apnea in Adult Patients. Portable Monitoring Task Force of the American Academy of Sleep Medicine. Journal of Clinical Sleep Medicine 2007; 3: 737-47.
28. Borsini E, Maldonado L, Décima T et al. Estrategia de utilización domiciliaria de la poligrafía respiratoria con instalación por el propio paciente. Rev Am Med Resp 2013; 1: 4-11.
29. Grupo Español de Sueño. Documento consenso español sobre el síndrome de apneas-hipopneas del sueño. Arch Bronc 2005; 41 (4):7.
30. Nogueira F, Nigro C, Cambursano H, Borsini E, Silio J, Avila J. Practical guidelines for the diagnosis and treatment of obstructive sleep apnea syndrome. Medicina (B Aires) 2013; 73 (4): 349-62.
31. Fredheim JM, Roislien J and Hjelmesth J. Validation of a Portable Monitor for the Diagnosis of Obstructive Sleep Apnea in Morbidly Obese Patients. J Clin Sleep Med 2014; 10: 751-57.
32. Araghi MH, Jagielski A, Neira I et al. The complex associations among sleep quality, anxiety-depression, and quality of life in patients with extreme obesity. Sleep 2013; 36: 1859-65.
33. Vana KD, Silva GE, Goldberg R. Predictive abilities of STOP-Bang and Epworth Sleepines Scale in identififying sleep clinics patients at risk for obstructive sleep apnea. Re Nurs Health 2013; 36(1); 84-94.
34. Sil A, Barr G. Assessment of predictive ability of Epworth scoring in screening of patients with sleep apnoea. J Laringol Otol 2012; 126(4): 372-9.
35. Osman EEZ, Osborne J, Hill PD, Lee BW. The Epworth Sleepines Scale; can it be used for sleep apnoea screening among snorers? Clin Otolaryngol 1999; 24: 239-41.
36. Smith SS, Oei TP, Douglas JA, Brown I, Jorgensen G, Andrews J. Confirmatory factor analysis of the Epworth Sleepiness Scale (ESS) in patients with obstructive sleep apnoea. J Psychosom Res 2005; 58: 55-60.
37. Mathew R, Castriotta RJ. High hypopnea/apnea ratio (HAR) in extreme obesity. J Clin Sleep Med 2014; 10: 391-96.
38. Rabec C, de Lucas Ramos P, Veale D. Respiratory complications of obesity. Arch Bronconeumol 2011; 47: 252-61.
39. Recuerda SA, Gómez-Terreros FJ, Caballero P et al. Relationship between the upper airway and obstructive sleep apnea-hypopnea syndrome in morbidly obese women. Obes Surg 2007; 5: 689-97.
40. BaHammam AS. Prevalence, clinical characteristics, and predictors of obesity hypoventilation syndrome in a large sample of Saudi patients with obstructive sleep apnea. Saudi Med J 2015; 36 (2): 181-9.
41. Young T, Hutton R, Finn L, Badr S, Palta M. The gender bias in sleep apnea diagnosis. Are women missed because they have different symptoms? Arch Intern Med 1996;156 (21): 2445-51.
42. Guilleminault C, Black JE, Palombini L, Ohayon M. A clinical investigation of obstructive sleep apnea syndrome (OSAS) and upper airway resistance syndrome (UARS) patients. Sleep Med 2000; 1(1): 51-6.
43. Collop NA. Portable monitoring for the diagnosis of obstructive sleep apnea. Curr Opin Pulm Med 2008; 14: 525-29.
44. Berry RB, Budhiraja R, Gottlieb DJ, American Academy of Sleep Medicine et al. Rules for scoring respiratory events in sleep: update of the 2007 AASM Manual for the Scoring of Sleep and Associated Events. Deliberations of the Sleep Apnea Definitions Task Force of the American Academy of Sleep Medicine. J Clin Sleep Med 2012; 8: 597-19.
45. Redline S, Kapur VK, Sanders MH et al. Effects of varying approaches for identifying respiratory disturbances on sleep apnea assessment. Am J Respir Crit Care Med 2000; 161: 369-74.
46. Bliwise DL. Normal aging. En: Kryger MH, Roth T, Dement WC, editors. Principles and Practice of Sleep Medicine. 3rd ed. Philadelphia: Saunders, 2000, pp 26-42.