Autor : John R. Bach1, Lara Bravo Quiroga2
1Departamento de Medicina FĂsica y RehabilitaciĂłn; Departamento de Neurociencia, UMDNJ- New Yersey Medical School; Centro de Alternativas de Manejo Ventilatorio del Hospital Universitario, Newark, New Jersey, United States of America 2 Departamento de NeumologĂa, Hospital Universitario La Paz, Madrid, España
Correspondencia : John R. Bach, M. D. Department of Physical Medicine and Rehabilitation, University Hospital B-403,150 Bergen Street, Newark N.J. 07103; Tel.: 1- 973- 972 7195; fax: 1- 973- 972 5725 E-mail: bachjr@umdnj.edu
Resumen
El propósito de este artículo es describir el uso de técnicas de soporte respiratorio muscular no invasivo con el fin de prevenir la insuficiencia respiratoria y el fallo ventilatorio, permitiendo la extubación y decanulación de pacientes considerados “imposibles de destetar’’. La aplicación de presión en la vía aérea de forma no invasiva durante la inspiración puede proporcionar un soporte ventilatorio continuo en pacientes con poca o inexistente capacidad vital. Así mismo, podrá alcanzarse un pico flujo espiratorio efectivo en pacientes con una disfunción severa de los músculos espiratorios. En abril de 2010 un consenso clínico de 19 centros en 18 países describió 1623 pacientes neuromusculares con atrofia muscular espinal tipo 1, distrofia muscular de Duchenne (DMD) y esclerosis lateral amiotrófica que sobrevivieron utilizando soporte ventilatorio continuo sin necesidad de traqueotomía. De esta serie de pacientes, 76 (47%) precisaron ventilación no invasiva continua en un periodo de seguimiento de 15 años. De estos 76.22 (30.1%) de los enfermos fueron extubados y 35 (4.6%) decanulados en cuatro centros especializados. En estos centros se extuban rutinariamente pacientes con distrofia muscular de Duchenne considerados “imposibles de destetar”, de forma que ninguno de sus más de 250 enfermos ha requerido traqueotomía. Esta aproximación en el tratamiento se está abriendo camino en varios centros de España, México y América45.
Palabras clave: Respiración glosofaríngea; Tos asistida; Terapia respiratoria; Ventilación mecánica no invasiva; Insuflación-exsuflación mecánica
Abstract
Respiratory muscle aids to prevent respiratory failure and tracheotomy: Noninvasive mechanical ventilation and mechanically assisted coughing The purpose of this article is to describe the use of noninvasive inspiratory and expiratory muscle aids to prevent ventilatory insufficiency and failure, and to permit the extubation and tracheostomy tube decannulation in “unweanable” patients. Noninvasive airway pressure aids can provide a continuous support to respiratory ventilation for patients with little or no vital capacity and can provide effective cough flows in patients with severely dysfunctional expiratory muscles. In April 2010, a consensus of clinicians from 19 centers in 18 countries reported the experience of noninvasive ventilation in 1623 patients with spinal muscular atrophy type 1 (SMA1), Duchenne muscular dystrophy (DMD), and amyotrophic lateral sclerosis (ALS), who survived without tracheotomy. The survival was for more than 15 years in 76 patients. Among these 76 patients, 22 (30.1%) were extubated and 35 (4.6%) were decannulated in four specialized centers. In these centers, unweanable DMD patients are routinely extubated; none of over 250 such patients has undergone tracheotomy. This approach is now being introduced into different centers in Spain, Mexico and the United States.
Key words: Glossopharyngeal breathing; Assisted cough; Respiratory therapy; Noninvasive mechanical ventilation; Mechanical insufflation-exsufflation
Patofisiología
El fracaso respiratorio puede deberse bien a patologías primarias pulmonares o de las vías aéreas, en
cuyo caso se indicarán pruebas funcionales respiratorias y resultará beneficioso el tratamiento con
oxigenoterapia y broncodilatadores, o bien puede
deberse a la disfunción ventilatoria de los músculos respiratorios y sus complicaciones. El primer
caso se caracteriza por la presencia de hipoxia que
coexiste con normocapnia, y puede desembocar
en fallo respiratorio agudo tras una exacerbación.
El segundo caso, en cambio, se caracteriza por la
presencia de hipercapnia e hipoxia secundarias
a la hipoventilación e insuficiencia respiratoria
causadas por una tos inefectiva.
Podríamos definir el primero como insuficiencia
o fallo respiratorio y el segundo como insuficiencia
o fallo ventilatorio. Desafortunadamente, para médicos inexpertos resulta difícil diferenciarlos, por
lo que se refieren, evalúan y tratan ambos como
insuficiencia o fallo respiratorio. Esto puede conllevar una morbilidad y mortalidad innecesarias, sin
mencionar los costes y la pérdida de calidad de vida.
Los pacientes con hipercapnia sintomática se
benefician de la ventilación mecánica no invasiva
con presión positiva (VMNI) utilizada al menos durante parte del día, principalmente por la noche. La
debilidad progresiva de los músculos inspiratorios
produce inevitablemente la pérdida de la capacidad
para respirar espontáneamente sin el soporte de
un respirador. El aumento de secreciones bronquiales debido a una tos inefectiva puede solucionarse
utilizando técnicas de asistencia mecánica de la tos.
La insuficiencia o fallo ventilatorio puede deberse a varias causas. Puede ser únicamente nocturno
debido a la disfunción muscular del diafragma
que impide la ventilación en supino. Así mismo
puede deberse a la disfunción de todos los músculos inspiratorios. También puede derivarse de
un inadecuado control de la ventilación a nivel
central. La obesidad severa o la restricción de la
pared torácica constituyen otras posibles causas
de hipoventilación nocturna.
Numerosos pacientes con insuficiencia ventilatoria sobreviven años sin soporte ventilatorio a costa
de desarrollar ortopnea e hipercapnia progresivas
con sus síntomas y riesgos asociados, así como una
alcalosis metabólica compensatoria que produce
depresión del control central de la ventilación. La
alcalosis permite al sistema nervioso central acomo darse a la hipercapnia sin percibir síntomas de fallo
respiratorio agudo. Los pacientes hipercápnicos sin
VMNI, especialmente aquellos que reciben oxigenoterapia suplementaria, desarrollan hipercapnia
progresiva que puede derivar en coma hipercápnico
y parada respiratoria. Cuando los pacientes con hipercapnia sintomática son tratados correctamente
con VMNI, los gases arteriales se normalizan y los
síntomas y la alcalosis se resuelven a medida que el
riñón excreta el exceso de bicarbonato.
Debido a la necesidad que presentan estos pacientes de realizar inspiraciones más profundas
para mantener normal la presión parcial de dióxido
de carbono al desconectar la VMNI por la mañana,
la sensación de disnea puede aumentar el requerimiento de su uso durante el día. En ocasiones, finalmente, el paciente puede precisar VMNI continua.
Algunos enfermos con fallo ventilatorio muscular
y capacidad vital (CV) prácticamente inexistente
utilizan solamente soporte nocturno y se apoyan en
la respiración glosofaríngea para respirar durante
el día1.
Existen tres grupos musculares respiratorios:
los músculos inspiratorios, los espiratorios para
toser (predominantemente abdominales y de la
pared torácica superior) y la musculatura bulbar,
que es aquella inervada por sistemas procedentes
del bulbo en el tronco del encéfalo. Mientras que
la función de la musculatura inspiratoria y espiratoria puede suplirse incluso en pacientes con 0
mL de CV que utilizan la VMNI durante más de 50
años sin necesidad de traqueotomía2, no hay medidas eficaces no invasivas para asistir la función
de la musculatura bulbar. Por lo tanto, la única
indicación para la realización de una traqueotomía
en un paciente “imposible de destetar” sería la
disfunción de la glotis que causará la aspiración
de saliva lo que provocará un descenso mantenido
de la saturación de oxígeno por debajo del 95%3.
Afortunadamente, la única enfermedad neuromuscular en la que esto ocurre es la esclerosis lateral
amiotrófica bulbar avanzada después de la pérdida
completa de la capacidad para el habla y la deglución. Estos pacientes desarrollan esencialmente
una obstrucción de la vía aérea superior y requieren una traqueotomía para proteger la vía aérea.
¿Qué son las medidas de soporte respiratorio muscular?
Podríamos definir las medidas de soporte respiratorio muscular como el conjunto de técnicas y dispositivos que asisten la inspiración y expiración,
bien mediante la aplicación de manera mecánica o
manual de fuerzas sobre la superficie externa del
cuerpo, o bien mediante cambios intermitentes
sobre la vía aérea.
Los dispositivos que actúan sobre el cuerpo
incluyen los ventiladores de presión negativa externos o respiradores extracorporales, que crean
cambios de presión alrededor del tórax y abdomen.
Por otro lado, al aplicar una presión negativa sobre
la vía aérea en el momento de la espiración, se
consigue mejorar la capacidad de la tos. Así mismo,
la aplicación de una presión positiva sobre la vía
aérea durante la inspiración proporciona asistencia
inspiratoria. En cambio, la presión positiva continua (CPAP) no es capaz de administrar una asistencia de la función ventilatoria y no es útil para
pacientes con un fallo principalmente ventilatorio.
Evaluación de los pacientes
Normalmente, los pacientes con una reserva ventilatoria disminuida que conservan la capacidad
de caminar refieren disnea. Ocasionalmente,
pueden presentar cefalea matutina, fatiga, fragmentación del sueño e hipersomnolencia diurna4.
Sin embargo, en los enfermos en silla de ruedas,
los síntomas de insuficiencia ventilatoria pueden
ser mínimos excepto durante las infecciones respiratorias intercurrentes en las cuales pueden
estar presentes la ansiedad o el insomnio. Esto es
debido a que durante el sueño disminuye la frecuencia respiratoria, la sensibilidad de los centros
respiratorios a la concentración de CO2 es menor
y se produce una ausencia del reflejo tusígeno. Así mismo, pueden presentar taquipnea, respiración
paradójica, hipofonía, aleteo nasal, uso de la musculatura respiratoria accesoria, cianosis, rubor o
palidez y congestión o secreciones en la vía aérea.
La letargia y la confusión son signos inminentes
de coma hipercápnico.
Es muy importante la evaluación específica
de estos pacientes susceptibles de insuficiencia
ventilatoria. Su valoración requiere de cuatro dispositivos principales: un espirómetro, un medidor
de pico-flujo, un capnógrafo y un pulsioxímetro.
La CV se mide con el paciente en posición sentada
y en decúbito supino. La diferencia entre ambos
valores debe ser menor de un 7%. Dado que la
hipoventilación empeora durante el sueño, la posición en decúbito, más que la posición sentada, es un indicador importante y precoz de disfunción
ventilatoria. Cuando la diferencia es mayor del
20%, la ortopnea suele indicar la necesidad de
VMNI nocturna. En los usuarios de cinturones
toraco-abdominales debe realizarse la medición
de la CV con y sin ellos, ya que un buen ajuste del
cinturón puede incrementar la CV, mientras que
un mal ajuste puede disminuirla. La espirometría
también es útil para monitorizar el progreso con
la respiración glosofaríngea y con la técnica de
hiperinsuflación activa (“air stacking”).
La técnica de “air stacking” consiste en retener
el máximo volumen posible de aire aportado con un
ambú o con un ventilador volumétrico mediante un
cierre efectivo de la glotis. Este volumen máximo
se conoce como capacidad máxima de insuflación
(CMI). La técnica puede realizarse con interfases
nasales, oronasales o bucales (Figura 1).
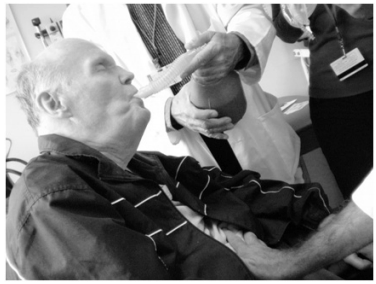
La respiración glosofaríngea consiste en impulsar el aire hacia los pulmones con los músculos de
la faringe y la lengua conteniendo el aire con la
glotis. La mayoría de los pacientes que realizan esta
maniobra pueden alcanzar volúmenes casi similares
a la CMI y algunos pueden incluso superarla5.
Es muy importante determinar, además de la
CV, el pico flujo máximo de tos, que puede medirse
utilizando un medidor de pico-flujo (Access Peak
Flow Meter, Healthscan Products Inc., Cedar
Grove, NJ). La falta de fuerza para toser es una
de las dificultades que nos encontramos en las
enfermedades neuromusculares.
La tos depende de la musculatura inspiratoria y
espiratoria así como de la función glótica, pero la tos
asistida depende únicamente de la función glótica. Un pico flujo asistido de 160 L/minuto se considera
el mínimo necesario para conseguir una tos efectiva5 y es el mejor indicador para una decanulación
exitosa, incluso sin considerar la función pulmonar
o CV. En los pacientes con CV menor de 1500 mL
podemos aumentar la eficacia de la tos con hiperinsuflaciones pasivas, o mediante “air stacking” con ambú o ventilador volumétrico. Se medirá el flujo máximo de tos asistida que consiste en
proporcionar una insuflación profunda mediante
un respirador o ambú, seguida de una compresión
abdominal y la apertura de la glotis de manera
simultánea7 (Figura 1).
Para los pacientes estables sin enfermedad
pulmonar intrínseca, la medición invasiva de los
gases arteriales es innecesaria. Además de ser
dolorosa, hasta el 25% puede hiperventilar como
resultado de la sensación de ansiedad o dolor con
la consiguiente alteración de los gases sanguíneos6.
La monitorización continua no invasiva, que incluyen la capnografía y pulsioximetría, proporciona
una información más útil, especialmente durante
el sueño.
Mientras que los pacientes claramente sintomáticos con disminución de los volúmenes
pulmonares requieren un ensayo con VMNI para
disminuir sus síntomas, si la sintomatología no es
clara o es cuestionable puede llevarse a cabo una
monitorización nocturna no invasiva de los gases
sanguíneos. Para ello utilizaremos el pulsioxímetro
y el capnógrafo, que mide el dióxido de carbono
espirado4. Estos estudios suelen realizarse en el
domicilio. Cuando la sintomatología es cuestionable y coexisten una CV disminuida, múltiples
desaturaciones nocturnas por debajo del 95% y una
PaCO2 nocturna elevada, también debería llevarse
a cabo un ensayo con VMNI nocturna. Generalmente, el tratamiento inapropiado con oxígeno
suplementario puede provocar coma hipercápnico6.
El fallo respiratorio agudo normalmente ocurre
cuando existe un pico flujo de tos y un manejo de
las secreciones bronquiales inadecuados. Si los pacientes presentan mala tolerancia a la VMNI y no
perciben mejoría con ella, se interrumpe indicando
una reevaluación en 3-6 meses.
En pacientes con síntomas secundarios a hipoventilación pero con una CV normal, con un patrón
de desaturación de la hemoglobina no claramente
establecido y que aparentemente no retienen dióxido de carbono, debe sospecharse una patología
del sueño e indicarse una polisomnografía9.
Los que presentan un síndrome de obesidad- hipoventilación, al igual que en las enfermedades
neuromusculares, son tratados con soporte ventilatorio nocturno e incluso continuo y no con CPAP. La
polisomnografía no estaría indicada para pacientes
neuromusculares con CV disminuida, ya que esta
interpreta cada apnea e hipoapnea como resultado
de eventos obstructivos o centrales pero no evalúa
la debilidad de los músculos inspiratorios. Es más,
el tratamiento de enfermos neuromusculares asintomáticos basado en anormalidades en la polisomnografía no prolonga ni mejora la calidad de vida.
Objetivos de intervención
Los objetivos de intervención consisten en mantener la distensibilidad o compliance toracopulmonar, promover el desarrollo normal de los
pulmones y la pared torácica en los niños, garantizar la ventilación alveolar las 24 horas del día y
aumentar el pico flujo de la tos.
Los objetivos a largo plazo son evitar los episodios de fallo respiratorio agudo, especialmente
durante las infecciones pulmonares intercurrentes,
las hospitalizaciones y prolongar la supervivencia
sin recurrir a la traqueotomía. Así mismo, los pacientes intubados o con traqueotomías “imposibles
de destetar” pueden ser extubados y decanulados
utilizando la VMNI y la tos asistida mecánicamente.
Estos objetivos se facilitan evaluando, entrenando y equipando a los enfermos ambulatoriamente
y en su domicilio.
Manejo a largo plazo
Objetivo número uno: mantener la distensibilidad, el desarrollo pulmonar y la movilidad de la pared torácica
La distensibilidad pulmonar está disminuida
ya que estos pacientes no pueden expandir los
pulmones hasta su CV teórica. A medida que
la CV disminuye, solo puede expandirse una
fracción del volumen pulmonar total. Al igual
que en las articulaciones de las extremidades,
la movilización periódica es necesaria para prevenir las contracturas de la pared torácica y la
restricción pulmonar10. Esto solo puede lograrse
proporcionando insuflaciones profundas mediante la técnica de “air stacking” o mediante VMNI
nocturna10. La proporción en la que la capacidad
máxima de insuflación excede a la CV (CMI-CV)
cuantifica objetivamente la función glótica y por lo tanto garantiza la integridad de la musculatura
bulbar, lo que se correlaciona con la capacidad de
adaptación a los soportes no invasivos sin necesidad de recurrir a la traqueotomía7.
Cuando la función de cierre de la glotis no está conservada y, por tanto, no se pueda realizar “airstacking” de forma activa, se harán insuflaciones
de forma pasiva utilizando un CoughAssistTM
(Philips-Respironics Internacional Inc., Murrysville, PA), de presión positiva intermitente con
presiones de 40 a 70 cmH2O, o con un ambú manteniendo la válvula espiratoria cerrada. El
máximo volumen de aire insuflado de forma pasiva puede definirse como capacidad de insuflación
pulmonar11.
Los objetivos primarios con la terapia de insuflación pulmonar son incrementar la CV y la CMI,
así como maximizar el pico flujo de tos (Figura
1), mantener o mejorar la compliance toracopulmonar, disminuir las atelectasias y adquirir
experiencia con la VMNI.
En 282 espirometrías evaluadas de pacientes
neuromusculares, los autores encontraron valores medios de CV, CMI y capacidad de insuflación
pulmonar de 1131 ± 744mL, 1712 ± 926mL y
2069 ± 867mL, respectivamente14. Los volúmenes
pulmonares conseguidos mediante hiperinsuflaciones también permiten incrementar el volumen
de la voz.
Cuando es posible realizar “air stacking”, se
facilita la adaptación a la VMNI. Si uno de estos
pacientes es intubado debido a fallo respiratorio
puede ser más fácilmente extubado directamente
a VMNI sin necesidad de realizar intentos de respiración espontánea. La extubación de pacientes
que no tienen experiencia con VMNI, sin intentos
de respiración espontánea exitosos y sin capacidad
para realizar air stacking, puede desembocar en un
fracaso de la ventilación con asincronías, asfixia y
en ocasiones la necesidad de reintubación.
Antes de que la CV de estos pacientes disminuya
por debajo del 70 al 80% del valor predicho se les
instruye para que realicen “air stacking” de 10 a 15
veces, al menos dos o tres veces al día, normalmente utilizando un ambú. Debido a la importancia
de esta técnica, la VMNI suele llevarse a cabo con
ventiladores volumétricos en vez de ventiladores
de presión en un modo asistido/controlado.
Los lactantes no pueden realizar la técnica de“air stacking” ni cooperar con la terapia de hiperinsuflación pasiva. Por ello, lactantes con atrofia
muscular espinal tipo 1 y 2, y con otras enferme dades neuromusculares en las que está presente
la respiración paradójica, requieren VMNI para
prevenir deformidades como el pectus excavatum, promover el desarrollo pulmonar y asistir la
función ventilatoria9. Además del soporte ventilatorio nocturno, se pueden realizar insuflaciones
profundas mediante un ambú a través de una
interfase oronasal sincronizando las insuflaciones
con la respiración. Los niños pueden cooperar con
la terapia de insuflaciones profundas a los 14-30
meses de edad.
Objetivo número dos: mantener normal la ventilación alveolar mediante la asistencia de los músculos inspiratorios
Aunque pueden conseguirse volúmenes corrientes adecuados mediante la aplicación de presión negativa sobre la superficie externa del tórax, los respiradores o bombas exteracorporales pueden inducir el desarrollo de apneas obstructivas, son menos efectivos que la VMNI y su eficacia disminuye con la edad y la pérdida de la compliance pulmonar13.

El respirador abdominal intermitente o “cinturón neumático” continúa siendo útil y se basa en el desplazamiento del contenido abdominal para ayudar a la ventilación. Consiste en un corsé o cinturón que se acopla a la superficie anterior del tórax y abdomen, y que contiene una bolsa inflable de goma (Figura 3). Mediante un ventilador de presión positiva se consigue el inflado intermitente de la bolsa y en consecuencia la elevación del dia fragma, lo que ayuda activamente a la espiración. La gravedad es necesaria para el descenso del diafragma, por ello el paciente deberá permanecer sentado con al menos una inclinación de 30º. Este modo de ventilación puede aumentar el volumen tidal desde 300mL hasta 1200mL. Normalmente aquellos que toleran menos de una hora la respiración espontánea prefieren este tipo de ventilación a la VMNI intermitente durante el día14.
Si el enfermo mantiene cierta capacidad inspiratoria o es capaz de realizar una respiración glosofaríngea, puede añadir volúmenes de aire de forma autónoma al aportado mecánicamente.
Ventilación no invasiva con presión positiva intermitente (VMNI)
La ventilación no invasiva con presión positiva intermitente puede utilizarse como soporte ventilatorio nocturno a través de interfases bucales, nasales u
oronasales. Las piezas bucales y mascarillas nasales
son circuitos abiertos que requieren la integridad
del sistema nervioso central (SNC) para prevenir
las fugas excesivas durante la noche2,12. La oxigenoterapia suplementaria y los fármacos depresores del
SNC pueden disminuir el efecto de la VMNI. Este
modo de ventilación puede ser utilizado tanto en un ámbito hospitalario como domiciliario.
Existen numerosas marcas comerciales de interfases nasales. Es recomendable probar varias y motivar al paciente para alternar su uso. Utilizando
mascarillas nasales que se ajustan correctamente y
evitando el uso de oxigenoterapia complementaria así como el uso de fármacos depresores del SNC,
se conseguirá reducir de manera importante el
número de fugas acontecidas durante la noche. Si
el número de fugas sigue siendo excesivo, hecho
que se manifestará por persistencia de la sintomatología, estas podrán evitarse mediante el uso de un
circuito cerrado que combina las olivas nasales con
una pieza que cubre la boca (“lipseal”) (Figura 3).
Este tipo de mascarillas proporciona el aire a través
de la boca y de la nariz durante el sueño al ejercer
una presión suave sobre la cara del paciente.
La VMNI a través de piezas bucales anguladas
de 15 mm es el método principal de soporte ventilatorio diurno. Algunos pacientes mantienen la
pieza o pipeta bucal entre sus dientes durante todo
día16. La mayoría, en cambio, la mantiene cerca de
su boca. Para ello, puede usarse una abrazadera de
metal conectada a la silla de ruedas, o bien puede
fijarse en los mandos (Figura 4). El volumen
tidal del ventilador normalmente se fija en 800 a
1500mL. La pieza bucal se sostiene con la boca y
a través de ella se obtienen los volúmenes pulmonares adecuados. Los pacientes pueden variar el
volumen que toman en cada ciclo respiratorio para
modificar la intensidad de la voz y el pico flujo de
la tos. Además, pueden realizar “air stacking”. Se
necesita cierto grado de movimiento del cuello y
que la función de los músculos orales esté conservada para mantener la pipeta y evitar las fugas.
Así mismo, el paladar blando debe moverse en dirección posterocaudal para sellar la nasofaringe. El
enfermo debe abrir la glotis y las cuerdas vocales,
y mantener abiertas la hipofaringe y la vía aérea.
Aquellos que han recibido ventilación a través de
una traqueotomía, ya que durante esta ventilación
las cuerdas vocales permanecen cerradas, pueden
requerir unos minutos para realizar de nuevo estos
movimientos reflejos2.

La VMNI a través de interfases nasales es la
forma más práctica para la ventilación nocturna.
También está indicada en lactantes y cuando no es
posible sostener la pipeta bucal debido a debilidad
de los músculos orales, a la inadecuada apertura
mandibular o a la insuficiente movilidad del cuello.
La VMNI nasal es una alternativa viable y preferible a la traqueostomía4. Los pacientes aprenden
a mantener sellados los labios o la orafaringe con
la ayuda del paladar blando y la lengua, lo que
previene así las fugas orales.
Una humidificación subóptima causará sequedad, irritación, vasodilatación y congestión de
la mucosa nasal, odinofagia y sequedad de boca. Mientras que con las interfases bucales se requiere
humidificación suplementaria, con las nasales no
suele ser necesaria17.
Uno de los efectos secundarios que acontece
con el uso de la VMNI es la distensión abdominal.
Normalmente desaparece con la movilización del
paciente por la mañana. Cuando es severa, puede
ser necesaria la colocación de una sonda rectal,
nasogástrica o la realización de una gastrostomía
para la eliminación del aire.
Entre los más de mil pacientes con soporte
ventilatorio de la serie citada18, incluso teniendo
en cuenta la realización durante largos periodos
de tiempo de insuflaciones pulmonares superiores
a los 60 mmH2O, solo se ha descrito un único caso
de neumotórax.
Aunque normalmente las secreciones bronquiales se consideran un factor limitante para la VMNI,
generalmente son el resultado de una aplicación
incorrecta o de la no utilización de las técnicas de
tos asistida mecánicamente.
Aparentemente no existen contraindicaciones
para el uso a largo plazo de la VMNI, excepto la
incapacidad de cooperación o la imposibilidad de
ajustar la mascarilla.
Objetivo número tres: asistencia de la función de los
músculos espiratorios para aumentar el pico-flujo de
la tos
La tos asistida manualmente consiste en realizar “air stacking” en pacientes con CV menor de 1500
mL seguido de una compresión abdominal simultánea a la apertura de la glotis, para así aumentar
la presión de la tos. Se obtuvieron picos de flujo
asistidos de 4.3 ± 1.7 L/seg en comparación con
picos de flujo no asistidos de 2.5 ± 2,0 L/seg7.
En 364 pacientes neuromusculares capaces de
realizar “air stacking” se obtuvieron valores de
capacidad vital media en posición sentada de 996.9
mL y una capacidad máxima de insuflación media
de 1647.6 mL. La media del pico flujo de tos fue de
2.3 L/seg, mientras que la media del pico flujo de
tos asistida fue de 3.9 L/seg. La diferencia entre
ambos valores nos indica la manera de conseguir
una tos efectiva para así prevenir las infecciones
respiratorias bajas y en consecuencia el fracaso
respiratorio agudo19.
La incapacidad para generar picos de flujo de tos
asistida de 160 L/m a pesar de una CV o capacidad
máxima de insuflación mayores de 1L indica la
presencia de obstrucción de la vía aérea superior.
Normalmente será causada por una disfunción
severa de la musculatura bulbar que deberá ser
evaluada mediante laringoscopia, corrigiendo
quirúrgicamente las lesiones reversibles.
La tos asistida mecánicamente (TAM) consiste en
utilizar un dispositivo de insuflación-exuflación, de
forma combinada, con una compresión abdominal
durante la espiración. Mediante este dispositivo se
aplica durante la inspiración una presión positiva en
la vía aérea de normalmente 40 cmH2O (insuflación
profunda). Seguidamente, esta presión positiva se
transforma en negativa (exuflación) de -40 cmH2O.
El cambio brusco de presión en un espacio corto de
tiempo genera un flujo de aire capaz de expulsar las
secreciones respiratorias. Si la exuflación se acompaña de una compresión abdominal, se incrementa
la efectividad de la maniobra.
Las presiones en torno a 40 cmH20 suelen ser
las más efectivas. La técnica puede realizarse a
través de interfases oronasales, piezas bucales,
tubos endotraqueales o cánulas de traqueostomía.
Cuando se realiza a través de esta última, debe
hacerse con el balón inflado.
El manejo del CoughAssistTM puede ser manual
o automático. El modo manual facilita la coordinación durante la inspiración y espiración con la
insuflación y la exuflación. Ahora bien, se necesitan más de dos manos para realizar la compresión
abdominal, sostener la interfase y realizar el ciclado manual. El manejo automático es más práctico
pero requiere de la cooperación del enfermo.
La TAM se realiza en sesiones de aproximadamente 5 ciclos seguidas de un corto periodo
de respiración espontánea o VMNI para evitar
la hiperventilación. Los tiempos de insuflación y
exuflación se ajustan para conseguir una máxima
expansión torácica y un vaciado pulmonar rápido.
En general se requieren de 2 a 4 segundos por cada
ciclo. Se continuará con los ciclos hasta el cese de
la expulsión de secreciones y que se logre un valor
de saturación de oxihemoglobina superior al 95%.
Durante las infecciones intercurrentes puede requerirse hasta cada 30 minutos.
La utilización del dispositivo de insuflación-exuflación a través de la vía aérea superior podría
ser efectiva en lactantes. Estos niños pueden acostumbrarse a su utilización, lo que evita el llanto
y el cierre de la glotis. En los lactantes también
pueden utilizarse las compresiones abdominales
coordinadas con la espiración. Entre los 2 años y
medio y los 5 años de edad la mayoría de los niños
cooperan adecuadamente.
La aspiración de secreciones realizada mediante sondas de aspiración a través de la vía aérea
superior o de tubos endotraqueales normalmente
no es efectiva en la retirada de las secreciones del
bronquio principal izquierdo hasta en el 90% de
las ocasiones20. La TAM, en cambio, proporciona
los mismos flujos espiratorios en ambos bronquios
principales sin el disconfort y el traumatismo sobre
la vía aérea que produce la aspiración traqueal.
Por ello, y por la mayor efectividad de la técnica,
los pacientes la prefieren21. Además suele hacer
innecesario el uso de la aspiración traqueal.
La CV, los flujos respiratorios y la saturación de
oxígeno mejoran con la eliminación de las secreciones respiratorias mediante el uso del dispositivo
de insuflación-exuflación22. Se ha observado un
aumento de la CV del 15 al 42% en 67 pacientes
con enfermedades pulmonares primarias después
de utilizar esta técnica y un incremento de la
CV del 55% en patología neuromuscular23. En
algunas series se ha observado una mejoría en los
valores de la CV del 15 al 400% (200 a 800mL) y
normalización de la saturación de oxígeno tras
su utilización durante los episodios infecciosos intercurrentes en pacientes neuromusculares con
soporte ventilatorio24.
De los tres grupos musculares mencionados previamente que se requieren para una tos efectiva,
el dispositivo de insuflación-exuflación solo puede
asistir la función de los músculos inspiratorios y
espiratorios. Por ello, cuando está presente una
disfunción de la musculatura bulbar como ocurre
en los enfermos con esclerosis lateral amiotrófica
avanzada, en los que se produce colapso de la vía
aérea y aspiración de saliva, el asistente de la tos
podrá evitar la traqueotomía a largo plazo.
Los pacientes que mantienen intacta la función
de la musculatura bulbar, como la mayoría con
tetraplejia traumática, habitualmente pueden
realizar “air stacking” consiguiendo volúmenes
de 3L o más, y excepto en aquellos que presentan
una escoliosis u obesidad severas, se pueden conseguir picos flujo de tos de 6 a 9 L/seg al combinar
las hiperinsuflaciones con compresiones abdominales. Estos flujos son suficientes para expulsar
las secreciones de la vía aérea y prevenir de este
modo las neumonías y el fallo respiratorio agudo
sin la necesidad de la tos asistida mecánicamente.
De hecho, los más beneficiados por la TAM tienen
una disfunción moderada de la musculatura bulbar
que limita los picos flujo de tos asistidos a menos
de 300 L/m. Excepto en los pacientes con esclerosis
lateral amiotrófica, esta disfunción moderada es
característica en la mayoría de las patologías neuromusculares, especialmente en la distrofia muscular
de Duchenne, en la que se obtiene un gran beneficio
con el uso del asistente de la tos19. Los pacientes con
debilidad de los músculos respiratorios, complicada
además con escoliosis o deformidades que dificultan
las compresiones abdominales, también se benefician del uso de la TAM.
Respiración glosofaríngea
La función muscular inspiratoria y de forma indirecta la espiratoria pueden asistirse con la respiración glosofaríngea1. Esta puede proporcionar a los pacientes con debilidad de la musculatura inspiratoria y CV inexistente la posibilidad de una ventilación alveolar normal cuando no utilizan soporte ventilatorio o en el caso de fallo del respirador1,25. Esta técnica implica el uso de la glotis. Mediante ella se “traga” o se impulsa el aire hacia los pulmones con los músculos de la faringe y la lengua. La glotis se cierra después de cada impul so. Una respiración normalmente consiste en 6 a 8 tragos de aire de 40 a 200mL cada uno (Figura 5). Durante el entrenamiento en esta técnica, su eficiencia puede monitorizarse con un espirómetro midiendo los mililitros de aire por cada impulso, los “tragos” por cada respiración y las respiraciones por minuto. Hay disponibles un manual de entrenamiento26 y numerosos vídeos27, uno de los mejores28 del año 1999.
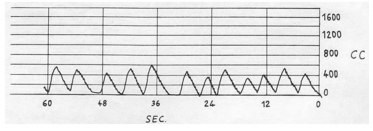
Aunque la debilidad muscular severa de la
musculatura orofaríngea puede limitar la utilidad
de la respiración glosofaríngea, en una serie29 de
13 sujetos con distrofia muscular de Duchenne
con soporte ventilatorio e inexistente respiración
espontánea, se describe la posibilidad de realizar
esta técnica.
Aproximadamente el 60% de los enfermos con
soporte ventilatorio sin autonomía para la respiración espontánea y una función de la musculatura
bulbar adecuada pueden utilizar la respiración
glosofaríngea y prescindir del soporte ventilatorio
durante periodos que pueden comprender desde
unos minutos a todo el día1,30. En cambio, tiene
escasa utilidad en presencia de una traqueotomía.
Su seguridad y versatilidad son razones adicionales
para evitar la traqueotomía.Ç
Los pacientes que presentan daño medular
espinal a niveles altos normalmente tienen una
función de la musculatura bulbar intacta, por ello
son los candidatos ideales para el entrenamiento
en la respiración glosofaríngea y para utilizar la
VMNI tras ser decanulados1,30 (Tabla 1).

* Niveles motores
**Una función muscular adecuada del cuello implica un control de la musculatura oral y del cuello suficiente para controlar la rotación, flexión y extensión y así mantener una pieza bucal en la VMNI; una función bulbar adecuada evita que la aspiración de saliva cause un descenso en la saturación de
oxígeno por debajo del 95%.
MCP diafragmático: marcapasos diafragmático; RAPI: Respirador abdominal de presión intermitente; VMNI oral: Presión positiva intermitente a través de una
pieza bucal; VMNI nasal: Presión positiva intermitente a través de una interfase nasal; VMT: Presión positiva intermitente a través de traqueotomía.
Monitorización pulsioximétrica
En los pacientes hipercápnicos con desaturaciones
debidas a hipoventilación alveolar crónica o en traqueotomizados que están siendo destetados de la
ventilación mecánica, la monitorización mediante
oximetría facilita la introducción de la VMNI.
Establecer una alarma a un nivel de 94% de
saturación ayuda al enfermo a mantener una saturación de oxígeno normal durante todo el día.
De este modo, cuando esta cae por debajo del 95%
realizará respiraciones más profundas19. Si no es
posible mantener una saturación mayor del 94%
mediante respiración espontánea durante el día,
se instaura la VMNI con una pieza bucal o una interfase nasal. Con el tiempo, se requiere aumentar
los periodos de la VMNI para mantener normal la
saturación de oxígeno. De esta manera, el control
central de la ventilación puede restaurarse.
La monitorización continua de oxígeno es
especialmente importante en el contexto de las
infecciones del tracto respiratorio. La tos de los
lactantes y niños que no se puede sentar es inefectiva para prevenir las neumonías y el fracaso
respiratorio agudo. Cuando se produce cualquier
caída de la saturación por debajo del 95% se utilizará la TAM. Esta caída está causada normalmente
por acúmulo de secreciones respiratorias en las
vías aéreas que si no son rápidamente aclaradas
pueden progresar en la aparición de atelectasias
y procesos neumónicos.
Los enfermos son entrenados en el uso de la
VMNI y la TAM para mantener normal la saturación de oxígeno, prevenir los procesos neumónicos,
el fracaso respiratorio agudo y las hospitalizaciones. Los adultos con procesos infecciosos infrecuentes necesitarán esta técnica únicamente cuando
presentan uno de estos episodios.
Soporte ventilatorio invasivo
Las técnicas no invasivas pueden estar contraindicadas en presencia de deterioro de la función cognitiva, alteraciones anatómicas que interfieran con la
colocación de las interfases, patologías pulmonares
que necesiten una FiO2 alta, abuso de sustancias o
convulsiones difícilmente controlables31. Las sondas nasogástricas pueden interferir con el ajuste
de una mascarilla nasal o una pieza bucal para la
VMNI, ya que dificultan el sellado de la nariz y el
cierre del paladar blando en la faringe.
Aunque la ventilación mecánica a través de
traqueotomía puede aumentar la supervivencia en
las enfermedades neuromusculares8, los resultados
en cuanto a mortalidad y morbilidad no son tan
favorables como con los soportes no invasivos8,33.
La traqueotomía estaría indicada en la esclerosis
lateral amiotrófica con afectación bulbar severa3 y raramente en la atrofia muscular espinal tipo
134. En los pacientes con distrofia muscular de
Duchenne, incluso en aquellos con dependencia
continua de la VMNI, si manejan adecuadamente
las técnicas de soporte ventilatorio puede disminuirse el número de hospitalizaciones y la necesidad de traqueotomía, y mejorar notablemente la
mortalidad y morbilidad de causa respiratoria19.
Resultados a largo plazo
Atrofia muscular espinal tipo 1
En una serie34 de pacientes con atrofia muscular
espinal tipo 1 se describieron 27 enfermos traqueotomizados y usuarios de ventilación invasiva. La
edad media fue de 78.2 (rango 65-179) meses. 25
de 27 (92.5%) perdieron la capacidad para la respiración autónoma inmediatamente después de la
traqueotomía. Ninguno de los 21 pacientes que no
habían desarrollado la capacidad de hablar antes
de la traqueotomía lo hicieron posteriormente.
Por otra parte, 72 pacientes con VMNI están
vivos actualmente con una edad media de 86.1
(rango 13-196) meses. Otros13 murieron a la edad de 52.3 (rango 13-111) meses. 67 de los 75 pacientes con atrofia muscular espinal tipo 1 y usuarios
de VMNI podían comunicarse verbalmente. 15
pacientes tienen actualmente más de 10 años y
6 más de 15, todos ellos sin traqueotomía a pesar
de depender de VMNI continua en la mayoría de
los casos34. Otros autores también han descrito la
utilización de VMNI continua en estos pacientes35 (Figuras 6,7).

Distrofia muscular de Duchenne En una serie reciente36, 101 pacientes con VMNI nocturna requirieron soporte continuo durante 7.4±6.1 años a los 30.1±6.1 años de edad. 56 sobreviven actualmente. 26 de los 101 requirieron VMNI continua y no precisaron de ninguna hospitalización. 8 con ventilación mecánica continua a través de traqueotomía fueron decanulados para instaurar VMNI. 31 pacientes intubados considerados “imposibles de destetar” fueron extubados intaurándose VMNI y TAM. 7 de los enfermos de la serie han sobrepasado la edad de 40 años, incluyendo 4 que han requerido VMNI continua desde los 28, 19, 21 y 24 años hasta los 41, 44, 48 y 47 años respectivamente35.También otros autores han descrito un aumento de la supervivencia de los pacientes con distrofia muscular de Duchenne mediante el uso de VMNI continua37.
Esclerosis lateral amiotrófica
De 176 pacientes con esclerosis lateral amiotrófica con soporte ventilatorio nocturno en la serie
citada38, 109 (42%) requirieron VMNI continua
aproximadamente 10 meses antes de que se produjera una caída en la saturación de oxígeno por
debajo del 95%. Esta estaba causada por disfunción de la musculatura bulbar con la consiguiente
aspiración de saliva.
En el 69° Congreso de la Sociedad Mexicana
Respiratoria y de Cirugía Torácica, 22 centros de
18 países diferentes presentaron los datos de 1623
pacientes con atrofia muscular espinal tipo 1, DMD
y esclerosis lateral amiotrófica con VMNI sin la
necesidad de traqueotomía.
Cuatro de estos centros extubaban rutinariamente enfermos considerados “imposibles de
destetar” de tal forma que tanto 250 pacientes
con DMD, como otros enfermos neuromusculares
dependientes de VMNI continua no necesitaron
traqueotomía.
Extubación de pacientes considerados “imposibles de destetar”
Se han descrito criterios específicos al realizarse
un nuevo protocolo para la extubación en pacientes
neuromusculares (Tabla 2). Una vez que se cumplen los criterios, deben retirarse las sondas oro
o nasogástricas para facilitar la VMNI nasal. La
extubación se realiza directamente y se instaura
la VMNI en un modo asistido/controlado con volúmenes en torno a 800-1500mL y frecuencia de 10-14 respiraciones por minuto, respirando aire
ambiente. La VMNI puede utilizarse a través de
interfases nasales, oronasales y piezas bucales.
Cuando los picos de flujo de tos asistida son mayores de 160 L/m la extubación será exitosa con el
uso adecuado de la VMNI y la TAM39.

En los pacientes capaces de mantener una pieza
bucal, esta debe permanecer accesible. El destete
lo realizarán ellos mismos espaciando la aplicación
de la presión positiva intermitente dependiendo
de su tolerancia.
Cuando no se puede utilizar la pieza bucal,
la VMNI se realizará a través de una mascarilla
nasal. Durante la ventilación nocturna se utilizan
interfases nasales u oronasales.
En los episodios de desaturación de oxígeno por
debajo del 95% deben tenerse en cuenta la presión
positiva inspiratoria (PPI), las fugas a través de la
interfase y las tubuladuras, la retención de CO2, los
parámetros ventilatorios y la aplicación de la TAM.
Los terapeutas, personal de enfermería y especialmente la familia y los cuidadores, aplican la
TAM hasta cada 30 minutos a través de interfases
oronasales. Los ciclos se mantienen hasta lograr
una saturación de oxígeno superior al 95% y la
desaparición de las secreciones respiratorias.
En 7 casos la ingesta oral después de la extubación se consideró insegura por lo que se realizó gastrostomía bajo anestesia local utilizando la
VMNI con ausencia de complicaciones.
En una serie de 157 pacientes considerados “imposibles de destetar” 25 estaban diagnosticados de
atrofia muscular espinal, 20 de DMD, 16 de esclerosis lateral amiotrófica, 51 de otras enfermedades
neuromusculares, 17 de daño medular espinal y 11
de poliomielitis. 83 de ellos, que habían rechazado
la traqueotomía, fueron trasladados desde otros
hospitales. No eran capaces de llevar a cabo intentos de respiración espontánea ni antes ni después
de la extubación. Una vez que la saturación de oxígeno se mantuvo por encima del 95% respirando
aire ambiente, los pacientes fueron extubados para
instaurar la VMNI y la TAM.
El éxito en la extubación se definió como la no
reintubación durante la hospitalización. Antes del
ingreso 96 (61%) pacientes no tenían experiencia
con la VMNI, 41(26%) utilizaban la ventilación
parte del día y 20 (13%) tenían una dependencia continua del ventilador. En el 95% de estos
enfermos (149) el primer intento de extubación
mediante este protocolo se realizó con éxito. En los
98 que presentaban picos de flujo de tos asistida≥ 160mL/m se logró realizar la extubación. En 6 de
los 8 pacientes en los que inicialmente se fracasó,
se consiguió en intentos posteriores. De modo que
solo en 2 pacientes con esclerosis lateral amiotrófica y que manejaban picos de flujo de 0L/m, se
realizó traqueotomía39.
Decanulación de pacientes “imposibles de destetar”
En 1996 se describió la decanulación en 50 pacientes neuromusculares considerados “imposibles de
destetar”5. Ya en años anteriores, en concreto en
1990 y 1991, se había descrito en enfermos con
lesión medular espinal alta en los que se instauró VMNI25,30. Los principios para la decanulación de
estos pacientes son esencialmente los mismos que
los explicados previamente para la extubación.
Aquellos dependientes de un respirador con la
función bulbar conservada, capaces de evitar la
aspiración de saliva causante de una disminución
en la saturación de oxígeno, pueden ser candidatos
para la decanulación e instauración de VMNI. Los
pacientes traqueotomizados sin capacidad para la
respiración espontánea sin respirador y con una
CV de 250 mL o mayor, toleraron adecuadamente
la VMNI tras la extubación.
En la mayoría de ellos se consiguió el destete a
la VMNI nocturna en las tres semanas posteriores
a la decanulación. Además también se facilitó el
habla y la deglución.
Todos los pacientes decanulados prefirieron la
VMNI a la ventilación invasiva a través de traqueotomía por su comodidad, capacidad para hablar y
deglutir, estética, confort y seguridad40.
Conclusión
En estos pacientes será mucho más útil realizar
una evaluación simple y específica de la función
de la musculatura respiratoria que una batería de pruebas funcionales enfocadas a las enfermedades
obstructivas e intrínsecas pulmonares. Así mismo,
la aplicación de presiones externas y en las vías aéreas para asistir la función de la musculatura inspiratoria y espiratoria será más efectiva que la terapia
con oxígeno suplementario y broncodilatadora, al
poder evitar los episodios de fallo respiratorio agudo.
Aquellos que presentan fallo respiratorio agudo
y precisan ser intubados sin poder realizar posteriormente intentos de respiración espontánea
podrán ser extubados en la mayoría de los casos
mediante la instauración de VMNI y TAM. De este
modo, siempre y cuando la función glótica se conserve lo suficiente como para evitar la aspiración
de secreciones, se podrá prescindir de la realización
de una traqueotomía.
Por tanto, el tratamiento de los pacientes diagnosticados de una enfermedad neuromuscular será distinto de aquellos que presentan una patología
pulmonar.
Conflicto de intereses: Esta revisión ha sido realizada
sin financiación externa.
Los autores no tienen conflictos de interés en relación con
la revisión.
1. Bach JR, Alba AS, Bodofsky E, et al. Glossopharyngeal breathing and noninvasive aids in the management of post-polio respiratory insufficiency. Birth Defects 1987; 23:99-113
2. Bach JR, Alba AS, Saporito LR. Intermittent positive pressure ventilation via the mouth as an alternative to tracheostomy for 257 ventilator users. Chest 1993; 103:174-182
3. Bach JR, Bianchi C, Aufiero E. Oximetry and indications for tracheotomy in amyotrophic lateral sclerosis. Chest 2004; 126:1502-07
4. Bach JR, Alba AS. Management of chronic alveolar hypoventilation by nasal ventilation. Chest 1990; 97:52-57
5. Bach JR, Saporito LR. Criteria for extubation and tracheostomy tube removal for patients with ventilatory failure. A different approach to weaning. Chest 1996;110:1566-1571
6. Currie DC, Munro C, Gaskell D, et al. Practice, problems and compliance with postural drainage: a survey of chronic sputum producers. Br J Dis Chest 1986; 80:249-253
7. Kang SW, Bach JR. Maximum insufflation capacity. Chest 2000; 118:61-65
8. 32. Bach JR, Rajaraman R, Ballanger F, et al. Neuromuscular ventilatory insufficiency: the effect of home mechanical ventilator use vs. oxygen therapy on pneumonia and hospitalization rates. Am J Phys Med Rehabil 1998; 77:8-19
9. Williams AJ, Yu G, Santiago S, Stein M. Screening for sleep apnea using pulse oximetry and a clinical score. Chest 1991; 100:631-635
10. Bach JR, Kang SW. Disorders of ventilation: weakness, stiffness, and mobilization. Chest 2000; 117:301-303
11. Bach JR, Mahajan K, Lipa B, Saporito L, Komaroff E. Lung insufflation capacity in neuromuscular disease. Am J Phys Med Rehabil 2008; 87:720-725
12. Bach JR, Baird JS, Plosky D, et al. Spinal muscular atrophy type 1: management and outcomes. Pediatr Pulmonol 2002; 34:16-22
13. Bach JR, Alba AS, Shin D. Management alternatives for post-polio respiratory insufficiency: assisted ventilation by nasal or oral-nasal interface. Am J Phys Med Rehabil 1989; 68:264-271
14. Bach JR, Alba AS. Intermittent abdominal pressure ventilator in a regimen of noninvasive ventilatory support. Chest 1991; 99:630-636
15. Bach JR, Robert D, Leger P, et al. Sleep fragmentation in kyphoscoliotic individuals with alveolar hypoventilation treated by nasal IPPV. Chest 1995; 107:1552-1558
16. Ishikawa Y. Manual for the care of patients using noninvasive ventilation. Japan Planning Center, Matsudo, Japan, 2005
17. Richards GN, Cistulli PA, Gunnar Ungar R, et al. Mouth leak with nasal continuous positive airway pressure increases nasal airway resistance. Am Respir Crit Care Med 1996; 154:182-186
18. Suri P, Burns SP, Bach JR. Pneumothorax associated with mechanical insufflation-exsufflation and related factors. Am J Phys Med Rehabil 2008; 87(11)951-955.
19. Gomez-Merino E, Bach JR. Duchenne muscular dystrophy: prolongation of life by noninvasive respiratory muscle aids. Am J Phys Med Rehabil 2002; 81:411-415
20. Fishburn MJ, Marino RJ, Ditunno JF Jr. Atelectasis and pneumonia in acute spinal cord injury. Arch Phys Med Rehabil 1990; 71:197-200
21. Garstang SV, Kirshblum SC, Wood KE. Patient preference for in-exsufflation for secretion management with spinal cord injury. J Spinal Cord Med 2000; 23:80-85
22. Bach JR, Smith WH, Michaels J, et al. Airway secretion clearance by mechanical exsufflation for post-poliomyelitis ventilator assisted individuals. Arch Phys Med Rehabil 1993; 74:170-177
23. Barach AL, Beck GJ. Exsufflation with negative pressure: physiologic and clinical studies in poliomyelitis, bronchial asthma, pulmonary emphysema and bronchiectasis. Arch Intern Med 1954; 93:825-841
24. Bach JR. Mechanical insufflation-exsufflation: comparison of peak expiratory flows with manually assisted and unassisted coughing techniques. Chest 1993; 104:1553-1562
25. Bach JR. New approaches in the rehabilitation of the traumatic high level quadriplegic. Am J Phys Med Rehabil 1991; 70:13-20
26. Dail C, Rodgers M, Guess V, et al. Glossopharyngeal breathing. Downey, CA: Rancho Los Amigos Department of Physical Therapy, 1979
27. Dail CW, Affeldt JE. Glossopharyngeal breathing [video]. Los Angeles: Department of Visual Education, College of Medical Evangelists, 1954
28. Webber B, Higgens J. Glossopharyngeal breathing: what, when and how? [video] Aslan Studios Ltd., Holbrook, Horsham, West Sussex, England, 1999
29. Bach JR, Bianchi C, Vidigal-Lopes M, et al. Lung inflation by glossopharyngeal breathing and “air stacking” in Duchenne muscular dystrophy. Am J Phys Med Rehabil 2007; 86:295-300
30. Bach JR, Alba AS. Noninvasive options for ventilatory support of the traumatic high level quadriplegic. Chest 1990; 98:613-619
31. Waldhorn RE, Herrick TW, Nguyen MC, et al. Long-term compliance with nasal continuous positive airway pressure therapy of obstructive sleep apnea. Chest 1990; 97:33-38
32. Bach JR. Conventional approaches to managing neuromuscular ventilatory failure. In: Bach JR, ed. Pulmonary rehabilitation: the obstructive and paralytic conditions. Philadelphia: Hanley & Belfus 1996: 285-301
33. Toussaint M, Steens M, Wasteels G, Soudon P. Diurnal ventilation via mouthpiece: survival in end-stage Duchenne patients. Eur Respir J 2006; 28:549-555
34. Bach JR, Gupta K, Reyna M, Hon A. Spinal muscular atrophy type 1: prolongation of survival by noninvasive respiratory aids. Pediatric Asthma Allergy & Immunology. 2009; 22:151-162
35. Schroth MK. Special considerations in the respiratory management of spinal muscular atrophy. Pediatrics 2009; 123:S245-S249.
36. Bach JR, Martinez D, Duchenne muscular dystrophy: prolongation of survival by noninvasive interventions. Respiratory Care (in press).
37. Kohler M, Clarenbach CF, Böni L, Brack T, Russi EW, Bloch KE. Quality of life, physical disability, and respiratory impairment in Duchenne muscular dystrophy. Am J Respir Crit Care Med 2005; 172:1032-1036
38. Gonçalves M, Bach JR, Ishikawa Y, DeVito EL, Prado F, Salinas P, Dominguez ME, Padrone EL, Vidigal-Lopes M, Guedes R, McKim D, Villanova M, Kang SW, Servera E, Soudon P, Simonds AK, Bachmann M, Baumberger M, Twok TK, Bloch K, Isquierdo J, Gross D, Saporito L, Weaver B, Hon A, Saulat B, Winck JC. Evolution of noninvasiv management of end-stage respiratory muscle failure in neuromuscular disease. (prepublication) available from J Bach bachjr@umdnj.edu.
39. Bach JR, Gonçalves MR, Hamdani I, Winck JC. Extubation of unweanable patients with neuromuscular weakness: a new management paradigm. Chest 2010; 137:1033-1039
40. Bach JR. A comparison of long-term ventilatory support alternatives from the perspective of the patient and care giver. Chest 1993; 104:1702-1706
41. Servera E, Perez D, Gomez-Merino E, Marin J, Polkey M. Respiratory care units for non-invasive mechanical ventila- tion in motor neurone disease. Thorax 2000;55(4):345–346. doi: 10.1136/thorax.55.4.345a.
42. Servera E, Sancho J, Zafra MJ, Catalá A, Vergara P, Marín J. Alternatives to endotracheal intubation for patients with neuromuscular diseases. Am J Phys Med Rehabil 2005;84(11):851-7.
43. Ferrer M, Esquinas A, Arancibia F, Bauer TT, Gonzalez G, Carrillo A, Rodriguez-Roisin R, Torres A. Noninvasive ventilation during persistent weaning failure: a randomized controlled trial. Am J Respir Crit Care Med. 2003;168(1):70-6.
44. Bach JR, Bianchi C, Vidigal-Lopes M, Turi S, Felisari G. Lung inflation by glossopharyngeal breathing and “air stacking” in Duchenne muscular dystrophy. Am J Phys Med Rehabil 2007;86(4):295-300.
45. Bach JR, Gonçalves MR, Hon AJ, Ishikawa Y, De Vito EL, Prado F, Dominguez ME. Changing trends in the management of end-stage respiratory muscle failure in neuromuscular disease: current recommendations of an international consensus. Am J Phys Med Rehabil 2013;(92)3:267-277.